Chlorid - Chloride
| |||
| Jména | |||
|---|---|---|---|
| Systematický název IUPAC Chlorid[1] | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 3587171 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| 14910 | |||
| KEGG | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| Cl− | |||
| Molární hmotnost | 35.45 g · mol−1 | ||
| Konjugovaná kyselina | Chlorovodík | ||
| Termochemie | |||
Std molární entropie (S | 153,36 J K.−1 mol−1[2] | ||
Std entalpie of formace (ΔFH⦵298) | -167 kJ · mol−1[2] | ||
| Související sloučeniny | |||
jiný anionty | Fluorid | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
The chlorid ion /ˈkl.raɪd/[3] je anion (záporně nabitý iont) Cl−. Vzniká, když živel chlór (A halogen ) získává elektron nebo když sloučenina jako chlorovodík je rozpuštěn ve vodě nebo jiných polárních rozpouštědlech. Chloridové soli, jako jsou chlorid sodný jsou často velmi rozpustné ve vodě.[4] Je to zásadní elektrolyt nachází se ve všech tělních tekutinách odpovědných za udržování acidobazické rovnováhy, přenosu nervové impulsy a regulaci tekutiny dovnitř a ven z buněk. Méně často slovo chlorid mohou také tvořit součást "běžného" názvu chemické sloučeniny ve kterém je jeden nebo více chloru atomy jsou kovalentně vázané. Například methylchlorid se standardním názvem chlormethan (viz knihy IUPAC) je organická sloučenina s kovalentní vazbou C-Cl, ve které chlor není anion.
Elektronické vlastnosti
Chloridový iont je mnohem větší než atom chloru, 167 respektive 99 pm. Ion je bezbarvý a diamagnetický. Ve vodném roztoku je ve většině případů vysoce rozpustný; avšak pro některé chloridové soli, jako je chlorid stříbrný, chlorid olovnatý a chlorid rtuťnatý, jsou mírně rozpustné ve vodě.[5] Ve vodném roztoku je chlorid vázán protickým koncem molekul vody.
Reakce chloridu
Chlorid lze oxidovat, ale ne redukovat. První oxidací, která se používá v chlor-alkalickém procesu, je přeměna na plynný chlor. Chlor může být dále oxidován na jiné oxidy a oxyanionty včetně chlornan (ClO−, aktivní složka v chloru bělidlo ), chlordioxid (ClO2), chlorát (ClO−
3), a chloristan (ClO−
4).
Z hlediska svých acidobazických vlastností je chlorid a velmi slabá základna jak je naznačeno zápornou hodnotou strK.A kyseliny chlorovodíkové. Chlorid může být protonován silné kyseliny, jako je kyselina sírová:
- NaCl + H2TAK4 → NaHSO4 + HCl
Soli iontových chloridů reagují s jinými solemi za účelem výměny aniontů. Přítomnost chloridu je často detekována tvorbou nerozpustného produktu chlorid stříbrný po ošetření iontem stříbra:
- Cl− + Ag+ → AgCl
Koncentraci chloridu v testu lze určit pomocí a chloridometr, který detekuje ionty stříbra, jakmile se touto reakcí vysráží veškerý chlorid v testu.
Chlorované stříbrné elektrody se běžně používají v ex vivo elektrofyziologie.[6]
Jiné oxyanionty
Chlor může předpokládat oxidační stavy z -1, +1, +3, +5 nebo +7. Několik neutrálních oxidy chloru jsou také známé.
| Stav oxidace chloru | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| název | chlorid | chlornan | chloritan | chlorát | chloristan |
| Vzorec | Cl− | ClO− | ClO− 2 | ClO− 3 | ClO− 4 |
| Struktura |  |  |  |
Výskyt v přírodě
V přírodě se chlorid vyskytuje především v mořské vodě, která obsahuje 1,94% chloridu. Menší množství, i když ve vyšších koncentracích, se vyskytují v některých vnitrozemských mořích a v podzemních solných vrtech, jako je Velké slané jezero, Utah a Mrtvé moře, Izrael.[7] Většina chloridových solí je rozpustných ve vodě, proto se minerály obsahující chloridy obvykle vyskytují pouze v suchu nebo hluboko v podzemí. Některé minerály obsahující chloridy zahrnují halit (chlorid sodný NaCl ), sylvite (chlorid draselný KCl ), bischofit (MgCl2∙ 6H2Ó), carnallite (KCl ∙ MgCl2∙ 6H2O) a kainit (KCl ∙ MgSO4 ∙ 3H2Ó). To je také nalezené v odpařovacích minerálech, jako je chlorapatit a sodalit.
Role v biologii
Chlorid má zásadní fyziologický význam, který zahrnuje regulaci osmotický tlak, elektrolytová rovnováha a acidobazická homeostáza. Chlorid je nejhojnější extracelulární látka anion a představuje přibližně jednu třetinu tonicity extracelulární tekutiny.[8][9]
Chlorid je zásadní elektrolyt, hrající klíčovou roli při udržování buňky homeostáza a vysílání akční potenciály v neuronech.[10] Může protékat chloridové kanály (včetně GABAA receptor) a je transportován KCC2 a NKCC2 transportéry.
Chlorid má obvykle (i když ne vždy) vyšší extracelulární koncentraci, což má za následek negativní reverzní potenciál (kolem -61 mV při 37 stupních Celsia v savčí buňce).[11] Charakteristické koncentrace chloridů v modelových organismech jsou: v obou E-coli a nadějné kvasnice jsou 10-200mM (závislé na médiu), v savčích buňkách 5 až 100 mM a v krevní plazmě 100 mM.[12]
Koncentrace chloridů v krvi se nazývá chlorid v séru a tuto koncentraci reguluje ledviny. Chloridový iont je strukturální složkou některých proteinů, např. Je přítomen v amyláza enzym. Pro tyto role je chlorid jednou z nezbytných dietní minerál (uvedeno podle názvu prvku chlór). Hladiny chloridu v séru jsou regulovány hlavně ledvinami prostřednictvím různých transportérů, které jsou přítomny podél nefronu.[13] Většina chloridu, který je filtrován glomeruly, je reabsorbována jak proximálním, tak distálním tubulem (hlavně proximálním tubulem) aktivním i pasivním transportem.[14]
Koroze

Přítomnost chloridů, např. v mořské vodě výrazně zhoršuje podmínky pro důlková koroze většiny kovů (včetně nerezových ocelí, hliníku a vysoce legovaných materiálů). Chloridem indukovaná koroze oceli v betonu vede k místnímu rozpadu ochranné formy oxidu v alkalickém betonu, takže dochází k následnému lokálnímu koroznímu napadení.[15]
Ohrožení životního prostředí
Zvýšené koncentrace chloridů mohou způsobit řadu ekologických účinků ve vodním i suchozemském prostředí. Může přispět k okyselení toků, mobilizovat radioaktivní půdní kovy iontovou výměnou, ovlivnit úmrtnost a reprodukci vodních rostlin a živočichů, podpořit invazi mořských organismů do dříve sladkovodních prostředí a narušit přirozené míchání jezer. Ukázalo se také, že sůl (chlorid sodný) mění složení mikrobiálních druhů v relativně nízkých koncentracích. Může také bránit procesu denitrifikace, mikrobiálnímu procesu nezbytnému pro odstranění dusičnanů a zachování kvality vody, a inhibovat nitrifikaci a dýchání organických látek.[16]
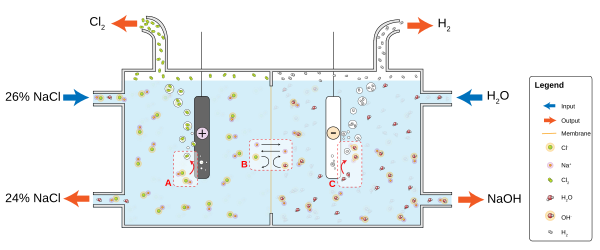
Výroba
The chlor-alkálie průmysl je významným spotřebitelem světového energetického rozpočtu. Tento proces přeměňuje chlorid sodný na chlor a hydroxid sodný, které se používají k výrobě mnoha dalších materiálů a chemikálií. Proces zahrnuje dvě paralelní reakce:
- 2 Cl− → Cl
2 + 2 E− - 2 H
2Ó + 2 e− → H2 + 2 OH−
Příklady a použití
Příkladem je kuchyňská sůl, která je chlorid sodný s chemický vzorec NaCl. v voda, disociuje na Na+ a Cl− ionty. Soli jako např chlorid vápenatý, chlorid hořečnatý, chlorid draselný mají různá použití od lékařských ošetření až po tvorbu cementu.[4]
Chlorid vápenatý (CaCl2) je sůl, která se prodává v peleta formulář pro odstranění vlhkosti z místností. Chlorid vápenatý se také používá pro údržbu nezpevněných komunikací a pro zpevnění základů vozovek pro novou výstavbu. Kromě toho je chlorid vápenatý široce používán jako a odmrazovač, protože je efektivní při snižování bod tání při aplikaci na led.[17]
Příklady kovalentně vázaných chloridů jsou chlorid fosforitý, chlorid fosforečný, a thionylchlorid, všechny tři reaktivní chlorace činidla které byly použity v a laboratoř.
Kvalita vody a její zpracování
Hlavní aplikací zahrnující chlorid je odsolování, což zahrnuje energeticky náročné odstraňování chloridových solí pitná voda. V ropný průmysl, chloridy jsou přísně sledovanou složkou bahenní systém. Zvýšení chloridů v bahenním systému může být známkou vrtání do vysokotlaké formace slané vody. Jeho nárůst může také naznačovat špatnou kvalitu cílového písku.[Citace je zapotřebí ]
Chlorid je také užitečným a spolehlivým chemickým indikátorem fekální kontaminace řeky / podzemní vody, protože chlorid je nereaktivní solut a je všudypřítomný pro splašky a pitnou vodu. Mnoho společností regulujících vodu po celém světě využívá chlorid ke kontrole úrovně kontaminace řek a zdrojů pitné vody.[18]
Jídlo
Chloridové soli, jako jsou chlorid sodný jsou zvyklí konzervovat jídlo a jako živiny nebo koření.
Viz také
- Halogenid (sloučeniny halogenů)
- Reabsorpce chloridu ledvinného
Reference
- ^ „Chloride ion - PubChem Public Chemical Database“. Projekt PubChem. USA: Národní centrum pro biotechnologické informace.
- ^ A b Zumdahl, Steven S. (2009). Chemické principy 6. vydání. Společnost Houghton Mifflin. p. A21. ISBN 0-618-94690-X.
- ^ Wells, John C. (2008), Slovník výslovnosti Longman (3. vyd.), Longman, str. 143, ISBN 9781405881180.
- ^ A b Green, John a Sadru Damji. "Kapitola 3." Chemie. Camberwell, Vic .: IBID, 2001. Tisk.
- ^ Zumdahl, Steven (2013). Chemické principy (7. vydání). Cengage Learning. p. 109. ISBN 978-1-285-13370-6.
- ^ Molleman, Areles (2003). „Patch Clamping: Úvodní průvodce elektrofyziologií Patch Clamp“. Wiley & Sons. ISBN 978-0-471-48685-5.
- ^ Greenwood, N. N. (1984). Chemie prvků (1. vyd.). Oxford [Oxfordshire]: Pergamon Press. ISBN 9780750628327.
- ^ Berend, Kenrick; van Hulsteijn, Leonard Hendrik; Gans, Rijk O.B. (Duben 2012). „Chlorid: Královna elektrolytů?“. European Journal of Internal Medicine. 23 (3): 203–211. doi:10.1016 / j.ejim.2011.11.013. PMID 22385875.
- ^ Rein, Joshua L .; Coca, Steven G. (1. března 2019). ""Nechápu žádnou úctu ": role chloridů při akutním poškození ledvin". American Journal of Physiology - Renal Physiology. 316 (3): F587 – F605. doi:10.1152 / ajprenal.00130.2018. ISSN 1931-857X. PMC 6459301.
- ^ Jentsch, Thomas J .; Stein, Valentin; Weinreich, Frank; Zdebik, Anselm A. (01.04.2002). "Molekulární struktura a fyziologická funkce chloridových kanálů". Fyziologické recenze. 82 (2): 503–568. doi:10.1152 / physrev.00029.2001. ISSN 0031-9333. PMID 11917096.
- ^ „Rovnovážné potenciály“. www.d.umn.edu.
- ^ Milo, Ron; Philips, Rob. „Buněčná biologie podle čísel: Jaké jsou koncentrace různých iontů v buňkách?“. book.bionumbers.org. Citováno 24. března 2017.
- ^ Nagami, Glenn T. (1. července 2016). „Hyperchloremie - proč a jak“. Nefrología (anglické vydání). 36 (4): 347–353. doi:10.1016 / j.nefro.2016.04.001. ISSN 2013-2514.
- ^ Shrimanker, Isha; Bhattarai, Sandeep (2020). "Elektrolyty". StatPearls. Publishing StatPearls.
- ^ Criado, M. "13 - Korozní chování vyztužené oceli zalité v alkalicky aktivované maltě". Příručka alkalicky aktivovaných cementů, malt a betonů. Woodhead Publishing. 333–372. ISBN 978-1-78242-276-1.
- ^ Kaushal, S. S. "Chloride". Encyclopedia of Inland Waters. Akademický tisk. 23–29. ISBN 978-0-12-370626-3.
- ^ "Společné soli". hyperfyzika.phy-astr.gsu.edu. Gruzínská státní univerzita.
- ^ "Chloridy". www.gopetsamerica.com. Archivovány od originál dne 18. srpna 2016. Citováno 14. dubna 2018.


