Petersonova olefinace - Peterson olefination
| Petersonova olefinace | |
|---|---|
| Pojmenoval podle | Donald John Peterson |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | petersonova olefinace |
| RSC ontologické ID | RXNO: 0000080 |
The Petersonova olefinace (nazývané také Petersonova reakce) je chemická reakce α-silylových karbanionů (1 ve schématu níže) s ketony (nebo aldehydy ) za vzniku β-hydroxysilanu (2), který vylučuje formování alkeny (3).[1]

Bylo publikováno několik recenzí.[2][3][4][5][6]
Reakční mechanismus
Jedním z atraktivních rysů Petersonovy olefinace je, že může být použita k přípravě buď cis- nebo trans-alkenů ze stejného p-hydroxysilanu. Zpracováním p-hydroxysilanu kyselinou se získá jeden alken, zatímco zpracováním stejného p-hydroxysilanu bází se získá alken opačné stereochemie.
Základní eliminace
Působení báze na β-hydroxysilan (1) vede ke vzájemné shodě syn eliminace (2) nebo (3) za vzniku požadovaného alkenu. Penta souřadnice křemičitan středně pokročilí (3) je postulován, ale dosud neexistuje žádný důkaz.[když? ]
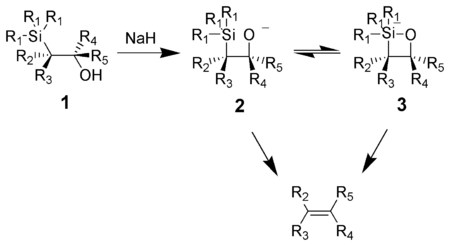
Draslík alkoxidy se rychle vylučují sodík alkoxidy obecně vyžadují zahřívání. Hořčík alkoxidy vylučují pouze v extrémních podmínkách. Pořadí reaktivity alkoxidů, K> Na >> Mg, odpovídá vyšší hustotě elektronů kyslík, proto zvyšuje alkoxidovou nukleofilitu.
Kyselinová eliminace
Léčba β-hydroxysilanem (1) s kyselinou vede k protonaci a an proti eliminace za vzniku požadovaného alkenu.

Alkylové substituenty
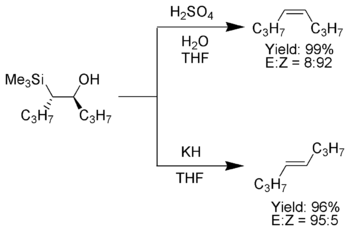
Když α-silyl karbanion obsahuje pouze alkyl, vodík nebo substituenty darující elektrony, stereochemický lze ovlivnit výsledek Petersonovy olefinace,[7] protože při nízké teplotě je eliminace pomalá a může být izolován meziprodukt β-hydroxysilan.
Jakmile jsou izolovány, diastereomerní p-hydroxysilany se oddělí. Jeden diastereomer se na kyselinu působí, zatímco na druhou se působí bází, čímž se materiál převede na alken požadovanou stereochemií.[4]
Substituenty odebírající elektrony
Když α-silylkarbanion obsahuje substituenty přitahující elektrony, Petersonova olefinace přímo tvoří alken. Meziprodukt β-hydroxysilan nelze izolovat, protože vylučuje in situ. V těchto případech byla předpokládána základní cesta eliminace.
Variace
Podmínky kyselé eliminace někdy nejsou proveditelné, protože kyselina také podporuje dvojnou vazbu izomerizace. Navíc eliminace pomocí sodík nebo hydrid draselný nemusí být proveditelné kvůli nekompatibilitě funkční skupiny. Chan et al. zjistili, že acylace meziproduktu silylkarbinolu kterýmkoli z nich acetylchlorid nebo thionylchlorid dává p-silyl ester které se samovolně vylučují při 25 ° C, čímž se získá požadovaný alken.[8] Corey a spolupracovníci vyvinuli metodu (někdy nazvanou Corey-Petersonova olefinace[9]) za použití silylovaného iminu za získání a, p-nenasyceného aldehydu z karbonylové sloučeniny v jednom kroku.[10] Příklad jeho použití při totální syntéze viz: Celková syntéza taxolu Kuwajima
Viz také
Reference
- ^ D. J. Peterson (1968). "Karbonylová olefinační reakce za použití silyl-substituovaných organokovových sloučenin". J. Org. Chem. 33 (2): 780–784. doi:10.1021 / jo01266a061.
- ^ Birkofer, L .; Stiehl, O. Horní. Curr. Chem. 1980, 88, 58. (Recenze)
- ^ Ager, D. J. Syntéza 1984, 384–398. (Posouzení)
- ^ A b Ager, D. J. Org. Reagovat. 1990, 38, 1. doi:10.1002 / 0471264180.nebo038.01
- ^ T. H. Chan (1977). „Alkenová syntéza prostřednictvím β-funkcionalizovaných organokřemičitých sloučenin“. Acc. Chem. Res. 10 (12): 442–448. doi:10.1021 / ar50120a003.
- ^ Nový vývoj v Petersonově olefinační reakci L. Frances van Staden, David Gravestock a David J. Ager Chem. Soc. Rev., 2002,31, 195-200 doi:10.1039 / A908402I
- ^ Barrett, A. G. M .; Flygare, J. A .; Hill, J. M .; Wallace, E. M. (1998). „Stereoselektivní alkenová syntéza přes 1-chlor-1 - [(dimethyl) fenylsilyl] alkany a α- (dimethyl) fenylsilyl ketony: 6-methyl-6-dodecen. Organické syntézy.; Kolektivní objem, 9, str. 580
- ^ T. H. Chan & E. Chang (1974). „Syntéza alkenů z karbonylových sloučenin a karbaniontů alfa na křemík. III. Úplná zpráva a syntéza pohlavního feromonu cikánského můry“. J. Org. Chem. 39 (22): 3264–3268. doi:10.1021 / jo00936a020. PMID 4473100.
- ^ X. Zeng; F. Zeng a E. Negishi (2004). „Efektivní a selektivní syntéza 6,7-dehydrostipiamidu prostřednictvím Zr-katalyzované asymetrické karboaluminace a Pd-katalyzované křížové vazby organozinců“. Org. Lett. 6 (19): 3245–3248. doi:10.1021 / ol048905v. PMID 15355023.
- ^ E. J. Corey; D. Enders a M. G. Bock (1976). „Jednoduchá a vysoce účinná cesta k α-β-nenasyceným aldehydům.“ Čtyřstěn dopisy. 17 (1): 7–10. doi:10.1016 / S0040-4039 (00) 71308-6.
