Imidogen - Imidogen - Wikipedia
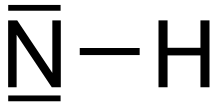 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC λ1-Azanyliden[1] | |||
| Ostatní jména Aminylen Azanylen hydridonitrogen | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
| 66 | |||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| HN | |||
| Molární hmotnost | 15.015 g · mol−1 | ||
| Konjugovaná kyselina | Nitreniový ion | ||
| Struktura | |||
| lineární | |||
| Termochemie | |||
Tepelná kapacita (C) | 21,19 J K.−1 mol−1 | ||
Std molární entropie (S | 181,22 kJ K.−1 mol−1 | ||
Std entalpie of formace (ΔFH⦵298) | 358,43 kJ mol−1 | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Imidogen je anorganická sloučenina s chemický vzorec NH.[2] Jako ostatní jednoduché radikály, je vysoce reaktivní a následně krátkodobý s výjimkou zředěného plynu. Jeho chování závisí na jeho multiplicita točení, tj. triplet versus singlet základní stav.
Výroba a vlastnosti
Imidogen může být generován elektrický výboj v atmosféře amoniak.[3]
Imidogen má velké rotační štěpení a slabou interakci spin-spin, proto bude méně pravděpodobné, že projde kolizí Zeeman přechody.[3] Imidogen základního stavu lze magneticky zachytit pomocí plnění vyrovnávacího plynu z molekulárního paprsku.[3]
První vzrušený stav (a1Δ) má dlouhou životnost jako jeho uvolnění do základního stavu (X3Σ−) je zakázáno otáčení.[4][5] Imidogen podléhá kolizi křížení mezi systémy.[6]
Reaktivita
Imidogen ignoruje atomy vodíku izoelektronický s karben (CH2) a atomy kyslíku (O) a vykazuje srovnatelnou reaktivitu.[4] První vzrušený stav lze zjistit pomocí laserem indukovaná fluorescence (ŽIVOT).[4] Metody LIF umožňují detekci vyčerpání, produkce a chemických produktů NH. Reaguje s oxid dusnatý (NE):
- NH + NO → N2 + OH
- NH + NO → N2O + H
První reakce je příznivější u a ΔH0 z −408±2 kJ / mol ve srovnání s ΔH0 z −147±2 kJ / mol pro druhou reakci.[7]
Nomenklatura
The triviální jméno nitren je preferovaný název IUPAC. Systematické názvy, λ1-azan a hydridonitrogen, platné IUPAC názvy jsou konstruovány podle substituční a doplňkové nomenklatury.
Ve vhodných kontextech lze na imidogen pohlížet jako na amoniak s odstraněnými dvěma atomy vodíku a jako takový, azyliden lze použít jako kontextově specifický systematický název podle substituční nomenklatury. Ve výchozím nastavení tento název neberie v úvahu radikalitu molekuly imidogenu. I když v ještě konkrétnějším kontextu může také pojmenovat neradikální stát, zatímco diradický stát je pojmenován azandiyl.
Astrochemie
Mezihvězdný NH byl identifikován v rozptýlených oblacích směrem k ζ Persei a HD 27778 z vysokého rozlišenísignál-šum spektra NH A3Π → X3Σ (0,0) absorpční pásmo blízko 3358 Å.[8] Teplota asi 30 K (-243 ° C) upřednostňovala účinnou produkci CN z NH v difuzním oblaku.[9][10][8]
Reakce související s astrochemií
Chemické reakce[11][12] Reakce Rychlostní konstanta Sazba / [H2]2 N + H− → NH + e− 1×10−9 3.5×10−18 NH2 + O → NH + OH 2.546×10−13 1.4×10−13 NH+
2 + e− → NH + H3.976×10−7 2.19×10−21 NH+
3 + e− → NH + H + H8.49×10−7 2.89×10−19 NH + N → N2 + H 4.98×10−11 4.36×10−16 NH + O → OH + N 1.16×10−11 1.54×10−14 NH + C+ → CN+ + H 7.8×10−10 4.9×10−19 NH + H3+ → NH+
2 + H21.3×10−9 3.18×10−19 NH + H+ → NH+ + H 2.1×10−9 4.05×10−20
V rozptýlených oblacích H− + N → NH + e− je hlavní formační mechanismus. V blízkosti chemické rovnováhy jsou důležitými mechanismy tvorby NH rekombinace NH+
2 a NH+
3 ionty s elektrony. V závislosti na radiačním poli v difuzním oblaku NH2 může také přispět.
NH je zničen v rozptýlených oblacích fotodisociace a fotoionizace. V hustých oblacích je NH zničen reakcemi s atomovým kyslíkem a dusíkem. Ó+ a N+ tvoří OH a NH v rozptýlených oblacích. NH se podílí na tvorbě N2, OH, H, CN+, CH, N, NH+
2, NH+ pro mezihvězdné médium.
NH byl popsán v difuzním mezihvězdném prostředí, ale ne v hustých molekulárních oblacích.[13] Účelem detekce NH je často získat lepší odhad rotačních konstant a vibračních hladin NH.[14] Je také nutné potvrdit teoretická data, která předpovídají výskyt N a NH ve hvězdách, které produkují N a NH a další hvězdy se zbytkovým stopovým množstvím N a NH.[15] Využití aktuálních hodnot pro rotační konstanty a vibrace NH i vibrací ACH a CH umožňují studovat množství uhlíku, dusíku a kyslíku, aniž by se uchýlili k syntéze celého spektra s atmosférou 3D modelu.[16]
Viz také
- Diimid (dimer)
Reference
- ^ Červená kniha IUPAC 2005
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ A b C Campbell, W. C .; Tsikata, E .; van Buuren, L .; Lu, H .; Doyle, J. M. (2007). "Magnetické zachycení a Zeemanova relaxace NH (X3Σ−)". Dopisy o fyzické kontrole. 98 (21): 213001. arXiv:fyzika / 0702071. doi:10.1103 / PhysRevLett.98.213001.
- ^ A b C Hack, W .; Rathmann, K. (1990). „Elementární reakce imidogenu (a1Δ) s oxidem uhelnatým “. Journal of Physical Chemistry. 94 (9): 3636–3639. doi:10.1021 / j100372a050.
- ^ Národní institut pro standardy a technologie[úplná citace nutná ]
- ^ Adams, J. S .; Pasternack, L. (1991). „Kolize vyvolaná kolizí v imidogenu (a1Δ) → imidogen (X3Σ−)". Journal of Physical Chemistry. 95 (8): 2975–2982. doi:10.1021 / j100161a009.
- ^ Patel-Misra, D .; Dagdigian, P. J. (1992). "Dynamika imidogenu (X3Σ−) + oxid dusnatý (X2Π) reakce: vnitřní rozdělení stavu hydroxylové skupiny (X2Π) produkt ". Journal of Physical Chemistry. 96 (8): 3232–3236. doi:10.1021 / j100187a011.
- ^ A b Meyer, David M .; Roth, Katherine C. (1. srpna 1991). "Objev mezihvězdného NH". Astrofyzikální deník. 376: L49 – L52. Bibcode:1991ApJ ... 376L..49M. doi:10.1086/186100.
- ^ Wagenblast, R .; Williams, D. A .; Millar, T. J .; Nejad, L. A. M. (1993). „O původu NH v rozptýlených mezihvězdných mracích“. Měsíční oznámení Královské astronomické společnosti. 260 (2): 420–424. Bibcode:1993MNRAS.260..420W. doi:10,1093 / mnras / 260,2,420.
- ^ Crutcher, R. M .; Watson, W. D. (1976). "Horní limit a význam molekuly NH v difuzních mezihvězdných mracích". Astrofyzikální deník. 209 (1): 778–781. Bibcode:1976ApJ ... 209..778C. doi:10.1086/154775.
- ^ Prasad, S. S .; Lovkyně, W. T. (1980). „Model pro chemii plynných fází v mezihvězdných mracích. I. Základní model, knihovna chemických reakcí a chemie mezi sloučeninami C, N a O“. Astrophysical Journal Supplement Series. 43: 1. Bibcode:1980ApJS ... 43 .... 1P. doi:10.1086/190665.
- ^ „Databáze UMIST pro astrochemii 2012 / astrochemistry.net“.
- ^ Cernicharo, José; Goicoechea, Javier R .; Caux, Emmanuel (2000). „Dálkově infračervená detekce C3 ve Střelci B2 a IRC +10216 ". Astrofyzikální deníkové dopisy. 534 (2): L199 – L202. Bibcode:2000ApJ ... 534L.199C. doi:10.1086/312668. hdl:10261/192089. ISSN 1538-4357.
- ^ Ram, R. S .; Bernath, P. F .; Hinkle, K.H. (1999). "Infračervená emisní spektroskopie NH: Porovnání kryogenního echelle spektrografu s Fourierovým transformačním spektrometrem". The Journal of Chemical Physics. 110 (12): 5557. Bibcode:1999JChPh.110.5557R. doi:10.1063/1.478453.
- ^ Grevesse, N .; Lambert, D. L .; Sauval, A. J .; Van Dishoeck, E. F .; Farmer, C. B .; Norton, R. H. (1990). "Identifikace linií slunečních vibrací a rotace NH a množství solárního dusíku". Astronomie a astrofyzika. 232 (1): 225. Bibcode:1990A & A ... 232..225G. ISSN 0004-6361.
- ^ Frebel, Anna; Collet, Remo; Eriksson, Kjell; Christlieb, Norbert; Aoki, Wako (2008). „HE 1327–2326, Nevyvolaná hvězda s [Fe / H] <–5,0. II. Nové 3D – 1D korigované množství z velmi velkého dalekohledu UVES spektra“. Astrofyzikální deník. 684 (1): 588–602. arXiv:0805.3341. Bibcode:2008ApJ ... 684..588F. doi:10.1086/590327. ISSN 0004-637X.