Horner – Wadsworth – Emmonsova reakce - Horner–Wadsworth–Emmons reaction
| Horner – Wadsworth – Emmonsova reakce | |
|---|---|
| Pojmenoval podle | Leopold Horner William S. Wadsworth William D. Emmons |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | wittig-hornerova reakce |
| RSC ontologické ID | RXNO: 0000056 |
The Reakce Horner – Wadsworth – Emmons (HWE) je chemická reakce použito v organická chemie stabilizovaný fosfonát karbanony s aldehydy (nebo ketony ) vyrábět převážně E-alkeny.[1]


V roce 1958 Leopold Horner zveřejnil upravený Wittigova reakce pomocí karbonátů stabilizovaných fosfonáty.[2][3] William S. Wadsworth a William D. Emmons dále definovala reakci.[4][5]
Na rozdíl od fosfoniumylidy použitý v Wittigova reakce, karbanionty stabilizované fosfonáty jsou více nukleofilní ale méně základní. Podobně mohou být alkylovány karbanionty stabilizované fosfonáty. Na rozdíl od fosfoniumylidů je vedlejší produkt dialkylfosfátové soli snadno odstraněn vodný extrakce.
Bylo publikováno několik recenzí.[6][7][8][9][10][11]
Reakční mechanismus
Horner – Wadsworth – Emmonsova reakce začíná deprotonace fosfonátu za vzniku fosfonátu karbanion 1. Nukleofilní přidání karbaniontu na aldehyd 2 (nebo keton) 3a nebo 3b je krok omezující rychlost.[12] Pokud R2 = H, pak meziprodukty 3a a 4a a meziprodukty 3b a 4b mohou vzájemně převádět.[13] Finále odstranění z oxafosfany 4a a 4b výnos (E) -alken 5 a (Z) -alken 6, přičemž vedlejším produktem je dialkyl-fosfát.

Poměr alkenu izomery 5 a 6 je závislá na stereochemický výsledek počátečního přidání karbaniontu a na schopnosti meziproduktů dosáhnout ekvilibrovat.
The skupina pro výběr elektronů (EWG) alfa k fosfonátu je nezbytný pro konečnou eliminaci. Při absenci skupiny přitahující elektrony je konečným produktem a-hydroxyfosfonát 3a a 3b.[14] Tyto a-hydroxyfosfonáty však lze transformovat na alkeny reakcí s diisopropylkarbodiimid.[15]
Stereoselektivita
Reakce Horner – Wadsworth – Emmons upřednostňuje vznik (E) -alkeny. Obecně platí, že čím více rovnováhy mezi meziprodukty, tím vyšší je selektivita pro (E) -alkenová tvorba.
Disubstituované alkeny
Thompson a Heathcock provedli systematické studium reakce methyl 2- (dimethylfosfono) acetátu s různými aldehydy.[16] I když byl každý účinek malý, měly kumulativní účinek umožňující upravit stereochemický výsledek bez úpravy struktury fosfonátu. Zjistili větší (E) -stereoselektivita za následujících podmínek:
- Zvýšení sterického objemu aldehydu
- Vyšší reakční teploty (23 ° C nad -78 ° C)
- Li > Na > K. soli
- Použití rozpouštědla DME přes THF
V samostatné studii bylo zjištěno, že objemné fosfonáty a objemné skupiny přitahující elektrony zvyšují selektivitu E-alkenu.
Trisubstituované alkeny
Při reakci a-rozvětvených fosfonátů s alifatickými aldehydy hraje zásadní roli sterický objem fosfonátových skupin a skupin přitahujících elektrony.[17]
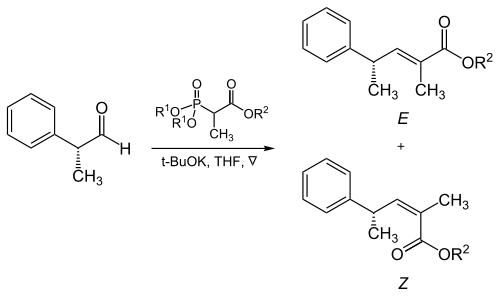
| R1 | R2 | Poměr alkenů (E: Z) |
|---|---|---|
| Methyl | Methyl | 5 : 95 |
| Methyl | Ethyl | 10 : 90 |
| Ethyl | Ethyl | 40 : 60 |
| Isopropyl | Ethyl | 90 : 10 |
| Isopropyl | Isopropyl | 95 : 5 |
Aromatický aldehydy produkují téměř výlučně (E) -alkeny. V případě (Z) -alkeny z aromatických aldehydů jsou potřebné, lze použít modifikaci Still – Gennari (viz níže).
Olefinace ketonů
Stereoselektivita reakce Horner – Wadsworth – Emmons z ketony je špatná až skromná.
Variace
Základní citlivé podklady
Protože mnoho podkladů není stabilních hydrid sodný, bylo vyvinuto několik postupů s použitím mírnějších základen. Masamune a Roush vyvinuli mírné podmínky za použití chlorid lithný a DBU.[18] Rathke to rozšířil na lithium nebo hořčík halogenidy s triethylamin.[19] Bylo zjištěno, že několik dalších bází je účinných.[20][21][22]
Stále úprava
W. Clark Still a C. Gennari vyvinuli podmínky, které dávají Z-alkeny s vynikající stereoselektivitou.[23] Použití fosfonátů se skupinami přitahujícími elektrony (trifluorethyl[24]) společně se silně disociačními podmínkami (KHMDS a 18-koruny-6 v THF ) lze dosáhnout téměř exkluzivní produkce Z-alkenu.
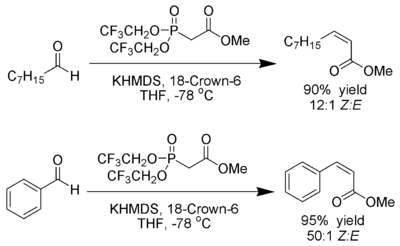
Ando navrhl, že použití elektronově deficitních fosfonátů urychluje eliminaci oxafosfethanových meziproduktů.[25]
Viz také
- Wittigova reakce
- Reakce Michaelis – Arbuzov
- Reakce Michaelis-Becker
- Petersonova reakce
- Tebbeho olefinace
Reference
- ^ Wadsworth, W. Org. Reagovat. 1977, 25, 73. doi:10.1002 / 0471264180.nebo025.02
- ^ Leopold Horner; Hoffmann, H. M. R .; Wippel, H. G. Ber. 1958, 91, 61–63.
- ^ Horner, L .; Hoffmann, H. M. R .; Wippel, H. G .; Klahre, G. Ber. 1959, 92, 2499–2505.
- ^ Wadsworth, W. S., Jr.; Emmons, W. D. J. Am. Chem. Soc. 1961, 83, 1733. (doi:10.1021 / ja01468a042 )
- ^ Wadsworth, W. S., Jr.; Emmons, W. D. Organické syntézy, Sb. Sv. 5, str. 547 (1973); Sv. 45, str. 44 (1965). (Článek )
- ^ Wadsworth, W. S., Jr. Org. Reagovat. 1977, 25, 73–253. (Posouzení)
- ^ Boutagy, J .; Thomas, R. Chem. Rev. 1974, 74, 87–99. (Posouzení, doi:10.1021 / cr60287a005 )
- ^ Kelly, S.E. Kompr. Org. Synth. 1991, 1, 729–817. (Posouzení)
- ^ B. E. Maryanoff; Reitz, A. B. Chem. Rev. 1989, 89, 863–927. (Posouzení, doi:10.1021 / cr00094a007 )
- ^ Bisceglia, J. A., Orelli, L. R. Curr. Org. Chem. 2012, 16, 2206–2230 (Recenze)
- ^ Bisceglia, J. A., Orelli, L. R. Curr. Org. Chem. 2015, 19, 744–775 (Recenze)
- ^ Larsen, R.O .; Aksnes, G. Síra fosforu 1983, 15, 218–219.
- ^ Lefèbvre, G .; Seyden-Penne, J. J. Chem Soc., Chem. Commun. 1970, 1308–09.
- ^ Corey, E. J.; Kwiatkowski, G. T. J. Am. Chem. Soc. 1966, 88, 5654–56. (doi:10.1021 / ja00975a057 )
- ^ Reichwein, J. F .; Pagenkopf, B. L. J. Am. Chem. Soc. 2003, 125, 1821–24. (doi:10.1021 / ja027658s )
- ^ Thompson, S.K .; Heathcock, C. H. J. Org. Chem. 1990, 55, 3386–88. (doi:10.1021 / jo00297a076 )
- ^ Nagaoka, H .; Kishi, Y. Čtyřstěn 1981, 37, 3873–3888.
- ^ Blanchette, M. A .; Choy, W .; Davis, J. T .; Essenfeld, A. P .; Masamune, S .; Roush, W. R .; Sakai, T. Čtyřstěn dopisy 1984, 25, 2183–2186.
- ^ Rathke, M. W .; Nowak, M. J. Org. Chem. 1985, 50, 2624–2626. (doi:10.1021 / jo00215a004 )
- ^ Paterson, I .; Yeung, K.-S .; Smaill, J. B. Synlett 1993, 774.
- ^ Simoni, D .; Rossi, M .; Rondanin, R .; Mazzali, A .; Baruchello, R .; Malagutti, C .; Roberti, M .; Invidiata, F. P. Org. Písmena 2000, 2, 3765–3768.
- ^ Blasdel, L. K .; Myers, A. G. Org. Písmena 2005, 7, 4281–4283.
- ^ Přesto W. C .; Gennari, C. Čtyřstěn dopisy 1983, 24, 4405–4408.
- ^ Patois, C .; Savignac, P .; About-Jaudet, E .; Collignon, N. Organické syntézy, Sb. Sv. 9, str. 88 (1998); Sv. 73, str. 152 (1996). (Článek )
- ^ Ando, K. J. Org. Chem. 1997, 62, 1934–1939. (doi:10.1021 / jo970057c )
