Akrylová kyselina - Acrylic acid
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Akrylová kyselina[2] | |
| Systematický název IUPAC Kyselina prop-2-enová | |
Ostatní jména
| |
| Identifikátory | |
3D model (JSmol ) | |
| 635743 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.001.071 |
| Číslo ES |
|
| 1817 | |
| KEGG | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3H4Ó2 | |
| Molární hmotnost | 72.063 g / mol |
| Vzhled | Čirá, bezbarvá kapalina |
| Zápach | Štiplavý[3] |
| Hustota | 1.051 g / ml |
| Bod tání | 14 ° C (57 ° F; 287 K) |
| Bod varu | 141 ° C (286 ° F; 414 K) |
| Mísitelný | |
| log P | 0.28[4] |
| Tlak páry | 3 mmHg[3] |
| Kyselost (strK.A) | 4,25 (H2Ó)[5] |
| Viskozita | 1.3 cP při 20 ° C (68 ° F) |
| Nebezpečí | |
| Bezpečnostní list | BL |
| Piktogramy GHS |     |
| Signální slovo GHS | Nebezpečí |
| H226, H302, H312, H314, H332, H400 | |
| P210, P233, P240, P241, P242, P243, P260, P261, P264, P270, P271, P273, P280, P301 + 312, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 312, P304 + 340, P305 + 351 + 338, P310, P312, P321, P322, P330 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | 68 ° C (154 ° F; 341 K) |
| 429 ° C (804 ° F; 702 K) | |
| Výbušné limity | 2.4–8.02%[3] |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | Žádný[3] |
REL (Doporučeno) | TWA 2 ppm (6 mg / m3) [kůže][3] |
IDLH (Okamžité nebezpečí) | N.D.[3] |
| Související sloučeniny | |
jiný anionty | akrylát |
Příbuzný karboxylové kyseliny | octová kyselina kyselina propionová kyselina mléčná Kyselina 3-hydroxypropionová kyselina mallonová kyselina máselná kyselina krotonová |
Související sloučeniny | allylalkohol propionaldehyd akrolein methylakrylát |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
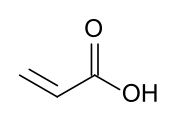
Akrylová kyselina (IUPAC: kyselina propenová) je organická sloučenina se vzorcem CH2= CHCOOH. Je to nejjednodušší nenasycené karboxylová kyselina, skládající se z a vinylová skupina připojeno přímo k a karboxylová kyselina konec. Tato bezbarvá kapalina má charakteristický štiplavý nebo koláčový zápach. to je mísitelný s voda, alkoholy, ethery, a chloroform. Ročně se vyprodukuje více než milion tun.[6]
Dějiny
Slovo „akryl“ vzniklo v roce 1843 pro chemický derivát akrolein, štiplavě vonící olej získaný z glycerol.
Výroba
Kyselinu akrylovou vyrábí společnost oxidace z propylen, což je vedlejší produkt výroby ethylen a benzín:
- 2 CH2= CHCH3 + 3 O.2 → 2 CH2= CHCO2H + 2 H2Ó
Historické metody
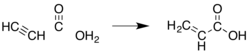
Protože kyselina akrylová a její estery jsou již dlouho komerčně ceněny, bylo vyvinuto mnoho dalších metod. Většina z nich byla opuštěna z ekonomických nebo ekologických důvodů. Časná metoda byla hydrokarboxylace acetylenu („Reppe chemie"):
Tato metoda vyžaduje niklkarbonyl, vysoké tlaky kysličník uhelnatý a acetylen, který je ve srovnání s propylenem relativně drahý.
Kyselinu akrylovou kdysi vyráběla společnost hydrolýza z akrylonitril, materiál odvozený od propen ammoxidací, ale od této cesty se upustilo, protože kogeneruje vedlejší produkty amoniaku, které je nutno zlikvidovat. Mezi další nyní opuštěné prekurzory kyseliny akrylové patří ethenon a ethylenkyanhydrin.[6]
Výzkum
Propan je podstatně levnější surovina než propylen, takže zkoumanou alternativou je jednostupňová selektivní oxidace propanu.[7]
Karboxylace ethylen na kyselinu akrylovou pod superkritický oxid uhličitý podmínka je termodynamicky možná, ale účinné katalyzátory nebyly vyvinuty.[8] Kyselina 3-hydroxypropionová (3HP), prekurzor kyseliny akrylové dehydratací, lze vyrobit z cukrů, ale postup není konkurenceschopný.[9][10]
Reakce a použití
Kyselina akrylová prochází typickým reakce karboxylové kyseliny. Když reagoval s alkohol, tvoří odpovídající ester. Estery a soli kyseliny akrylové jsou souhrnně označovány jako akryláty (nebo propenoáty). Nejběžnější alkylestery kyseliny akrylové jsou methyl, butyl, ethyl a 2-ethylhexylakrylát.
Kyselina akrylová a její estery se snadno kombinují (tvoří se kyselina polyakrylová ) nebo jiný monomery (např. akrylamidy, akrylonitril, vinyl sloučeniny, styren, a butadien ) reakcí na jejich dvojné vazbě a formováním homopolymery nebo kopolymery, které se používají při výrobě různých plasty, nátěry, lepidla, elastomery, stejně jako leštidla a barvy na podlahu.
Kyselina akrylová je sloučenina, která se používá v mnoha průmyslových odvětvích, jako je plena průmysl, úprava vody průmysl nebo textilní průmysl. V celosvětovém měřítku se předpokládá, že míra spotřeby kyseliny akrylové dosáhne do roku 2020 více než odhadovaných 8 000 kiloton. K tomuto nárůstu se očekává v důsledku použití tohoto produktu v nových aplikacích, včetně osobní péče produkty, čistící prostředky a výrobky používané pro dospělé inkontinence.[11]
Substituenty
Jako substituent lze kyselinu akrylovou najít jako acylová skupina nebo karboxyalkylová skupina, v závislosti na odstranění skupiny z molekuly.
Konkrétněji jde o:
- The akryloyl skupina, s odstraněním -OH z uhlíku-1.
- The 2-karboxyethenylová skupina, s odstraněním -H z uhlíku-3. Tato skupina substituentů se nachází v chlorofyl.
Bezpečnost
Kyselina akrylová silně dráždí a leptá pokožku a dýchací cesty. Kontakt s očima může mít za následek vážné a nevratné zranění. Nízká expozice způsobí minimální nebo žádné zdravotní účinky, zatímco vysoká expozice může mít za následek plicní otok. The LD50 je 340 mg / kg (potkan, orálně).
Kyselina akrylová je složkou tabákový kouř.[12]
Viz také
Reference
- ^ Index společnosti Merck, 11. vydání, 124.
- ^ ChemSpider uvádí „kyselinu akrylovou“ jako platný a odborně ověřený název IUPAC
- ^ A b C d E F NIOSH Kapesní průvodce chemickými nebezpečími. "#0013". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ „Acrylic acid_msds“.
- ^ Dippy, J. F. J .; Hughes, S. R. C .; Rozanski, A. (1959). "Disociační konstanty některých symetricky disubstituovaných jantarových kyselin". Journal of the Chemical Society: 2492–2498. doi:10.1039 / JR9590002492.
- ^ A b Ohara, Takashi; Sato, Takahisa; Šimizu, Noboru; Prescher, Günter; Schwind, Helmut; Weiberg, Otto; Marten, Klaus; Greim, Helmut (2003). "Kyselina akrylová a její deriváty". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a01_161.pub2.
- ^ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E .; Schlögl, Robert; Trunschke, Annette (2014). „Reakční síť při oxidaci propanu přes fázově čisté katalyzátory oxidu MoVTeNb M1“ (PDF). Journal of Catalysis. 311: 369–385. doi:10.1016 / j.jcat.2013.12.008. hdl:11858 / 00-001M-0000-0014-F434-5. Archivovány od originál (PDF) dne 2016-02-15. Citováno 2017-07-15.
- ^ Sakakura, Toshiyasu; Choi, Jun-Chul; Yasuda, Hiroyuki (13. června 2007). "Transformace oxidu uhličitého". Chemické recenze. 107 (6): 2365–2387. doi:10.1021 / cr068357u. PMID 17564481.
- ^ Sweet Deal: Dow and Partner Cook up Sugar-to-Acrylic Plan. Durabilityanddesign.com. Citováno 2012-05-24.
- ^ Better Bugs to Make Plastics, Technology Review, 20. září 2010, vyvoláno 9. ledna 2012. Technologyreview.com (2010-09-20). Citováno 2012-05-24.
- ^ „Trh s kyselinou akrylovou“. Citováno 2018-05-30.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). „Nebezpečné sloučeniny v tabákovém kouři“. International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10,3390 / ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.