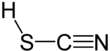Kyselina thiokyanová - Thiocyanic acid - Wikipedia
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Nitridosulfanidokarbon[3] | |||
Ostatní jména
| |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 3DMet | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.006.672 | ||
| Číslo ES |
| ||
| 25178 | |||
| KEGG | |||
| Pletivo | thiokyanová + kyselina | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| CHNS | |||
| Molární hmotnost | 59.09 g · mol−1 | ||
| Vzhled | bezbarvá, olejovitá kapalina | ||
| Zápach | pronikavý | ||
| Hustota | 2,04 g / cm3 | ||
| Bod tání | 5 ° C (41 ° F; 278 K) | ||
| Mísitelný | |||
| Rozpustnost | rozpustný v ethanol, diethylether | ||
| log P | 0.429 | ||
| Kyselost (strK.A) | 0.926 | ||
| Zásaditost (strK.b) | 13.071 | ||
| Nebezpečí | |||
Klasifikace EU (DSD) (zastaralý) | |||
| R-věty (zastaralý) | R20 / 21/22, R32, R52 / 53 | ||
| S-věty (zastaralý) | (S2), S13 | ||
| Související sloučeniny | |||
Související alkanenitrily | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Kyselina thiokyanová je chemická sloučenina se vzorcem HSCN, který existuje jako tautomer s kyselinou isothiokyanovou (HNCS).[4] Izoforma má tendenci dominovat, přičemž materiálem je asi 95% kyseliny isothiokyanové v parní fázi.[5]
 Tautomerismus mezi kyselinou thiokyanovou (vlevo) a kyselinou isothiokyanovou (vpravo)
Tautomerismus mezi kyselinou thiokyanovou (vlevo) a kyselinou isothiokyanovou (vpravo)
Je to slabá kyselina, hraničící se silnou, s pK.A 1,1 při 20 ° C a extrapolováno na nulovou iontovou sílu.[6]
Předpokládá se, že HSCN bude mít trojná vazba mezi uhlíkem a dusíkem. Bylo pozorováno spektroskopicky, ale nebylo izolováno jako čistá látka.[7]
The soli a estery thiokyanové kyseliny jsou známé jako thiokyanáty. Soli se skládají z thiokyanátového iontu (−SCN) a vhodný kationt kovu (např. thiokyanát draselný, KSCN). Estery kyseliny thiokyanové mají obecnou strukturu R – SCN.
Kyselina isothiokyanová, HNCS, je Lewisova kyselina, jejíž volná energie, entalpie a entropie se mění pro její asociaci 1: 1 s různými Lewisovými bázemi v roztoku tetrachlormethanu při 25 ° C.[8] Vlastnosti akceptoru HNCS jsou popsány v ECW model.
Reference
- ^ Index společnosti Merck, 11. vydání, 9257.
- ^ Richter, Victor von; Spielmann, Percy E., trans. (1922). Organická chemie nebo chemie uhlíkových sloučenin. sv. 1. Philadelphia, Pennsylvania, USA: P. Blakiston's Son & Co. str. 466.
- ^ „kyselina thiokyanová (CHEBI: 29200)“. Chemické entity biologického zájmu. USA: Evropský bioinformatický institut. 18. října 2009. Hlavní. Citováno 5. června 2012.
- ^ Holleman, A. F .; Wiberg, E. (2001). Anorganická chemie. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Beard, C. I .; Dailey, B. P. (1950). „Struktura a dipólový moment kyseliny izothiokyanové“ (PDF). The Journal of Chemical Physics. 18 (11): 1437. Bibcode:1950JChPh..18.1437B. doi:10.1063/1.1747507. hdl:1721.1/4934.
- ^ Martell, A.E .; Smith, R. M .; Motelaitis, R. J. (2001). Databáze NIST 46. Gaithersburg, MD: Národní institut pro standardy a technologie.
- ^ Wierzejewska, M .; Mielke, Z. (2001). "Fotolýza HNCS kyseliny isothiokyanové v nízkoteplotních matricích. Infračervená detekce HSCN a HSNC izomerů". Dopisy o chemické fyzice. 349 (3–4): 227–234. Bibcode:2001CPL ... 349..227W. doi:10.1016 / S0009-2614 (01) 01180-0.
- ^ . Barakat, T. M .; Nelson, J .; Nelson, S. M .; Pullin, A. D. E. (1969). „Spektra a vodíkové vazby charakteristik kyseliny thiokyanové. Část 4. - Sdružení se slabými akceptory protonů “. Trans. Faraday Soc., 1969,65, 41-51