Wackerův proces - Wacker process

The Wackerův proces nebo Hoechst-Wacker proces (pojmenovaný podle stejnojmenných chemických společností) odkazuje na oxidaci ethylen na acetaldehyd v přítomnosti chlorid palladnatý jako katalyzátor.[1] Tento chemická reakce byl jedním z prvních homogenní katalýza s organopalladium chemie aplikovaná v průmyslovém měřítku.[2]
Dějiny
Wackerovu reakci poprvé popsali Smidt et al.[3][4][5]
Vývoj chemického procesu, nyní známého jako Wackerův proces, začal v roce 1956 v Wacker Chemie.[6] V té době bylo vyrobeno mnoho průmyslových sloučenin acetylén, odvozený od karbid vápníku, drahá a ekologická technologie. Výstavba nové ropné rafinerie v roce 2006 Kolín nad Rýnem podle Esso blízko k webu Wacker v kombinaci s realizací ethylen by byla levnější surovina, přiměla společnost Wacker prozkoumat její potenciální využití. V rámci následujícího výzkumného úsilí proběhla reakce ethylenu a kyslíku palladium na uhlíku při hledání ethylenoxid neočekávaně poskytly důkazy o tvorbě acetaldehydu (jednoduše na základě čichu). Další výzkum této přeměny ethylenu na acetaldehyd vedl k patentu z roku 1957, který popisuje reakci v plynné fázi s použitím heterogenního katalyzátoru.[7] Mezitím Hoechst AG připojil se k závodu a po podání patentu přinutil Wackera k partnerství s názvem Aldehyd GmbH. Heterogenní proces nakonec selhal kvůli deaktivaci katalyzátoru a byl nahrazen homogenním systémem na bázi vody, pro který byla v roce 1958 funkční pilotní elektrárna. Problémy s agresivním řešením katalyzátoru byly vyřešeny přijetím titan (nově k dispozici pro průmyslové použití) jako stavební materiál pro reaktory a čerpadla. Výrobní závody byly uvedeny do provozu v roce 1960.
Reakční mechanismus
The mechanismus reakce pro průmyslový Wackerův proces (oxidace olefinů pomocí chloridu palladnatého) byla po několik desetiletí věnována významná pozornost. O aspektech mechanismu se stále diskutuje. Níže je popsána moderní formulace:

Počáteční stechiometrická reakce byla poprvé popsána Phillipsem.[9][10] Síťovou reakci lze také popsat takto:
- [PdCl4]2 − + C.2H4 + H2O → CH3CHO + Pd + 2 HCl + 2 Cl−
Po této přeměně následují reakce, které regenerují katalyzátor Pd (II):
- Pd + 2 CuCl2 + 2 Cl − → [PdCl4]2− + 2 CuCl
- 2 CuCl + ½ O2 + 2 HCl → 2 CuCl2 + H2Ó
Spotřebovává se pouze alken a kyslík. Bez chlorid měďnatý jako oxidační činidlo, Pd (0) kov (vzniklý z eliminace beta-hydridu Pd (II) v posledním kroku) by se vysráželo a reakce by se zastavila po jednom cyklu. Tato stechiometrická reakce byla objevena v roce 1894. Výsledek může oxidovat vzduch, čistý kyslík nebo řada dalších činidel CuCl -chloridová směs zpět na CuCl2, což umožňuje pokračování cyklu.
Historické mechanistické studie
Rané mechanistické studie ze 60. let objasnily několik klíčových bodů:[11][8]
- V této reakci nebyly pozorovány žádné účinky výměny H / D. Experimenty využívající C.2D4 ve vodě generovat CD3CDO a běží s C.2H4 v D.2O generovat CH3CHO. Tím pádem, keto-enol tautomerizace není možný mechanistický krok.
- Zanedbatelný kinetický izotopový efekt s plně deuterovanými reaktanty (k H/k D= 1,07). Odvozuje se tedy, že přenos hydridů není určující míru.
- Významný konkurenční izotopový účinek s C.2H2D2, (k H/k D= ~ 1,9), navrhuje, aby byl krok stanovení rychlosti před tvorbou acetaldehydu.
- Vysoké koncentrace chloridů a chlorid měďnatý upřednostňovat tvorbu nového produktu, chlorhydrin.
Mnoho mechanistických studií Wackerova procesu se zaměřilo na cestu k vytvoření vazby CO, O hydroxypalladace krok. Henry usoudil, že koordinovaný hydroxid napadá ethylenový ligand, vnitřní (syn-) dráhu.[12] Později stereochemické studie od Stilla a spolupracovníků[13][14][15] podporují anti-adiční dráhu, přičemž volný hydroxid napadá ethylenový ligand. Podmínky pro Stilleho experimenty se významně liší od podmínek průmyslových procesů. Další studie používající normální průmyslové Wackerovy podmínky (s výjimkou vysokých koncentrací chloridů a vysokých koncentrací chloridu měďnatých) také poskytly produkty, které odvodily nukleofilní útok jako antiadiční reakci.[16]
Kinetické studie byly prováděny na izotopově substituovaných allylalkoholech za standardních průmyslových podmínek (s nízkými koncentracemi chloridů), aby se prozkoumaly reakční mechanismy.[17][18] Tyto výsledky ukázaly, že nukleofilní útok je pomalý proces, zatímco navrhované mechanismy vysvětlující dřívější stereochemické studie předpokládaly, že nukleofilní útok je rychlý proces.
Následné stereochemické studie ukázaly, že se vyskytují obě cesty a jsou závislé na koncentracích chloridů.[19][20] Tyto studie jsou však také sporné, protože allylalkoholy mohou být citlivé na izomerační reakce a z těchto reakcí mohou vznikat různé stereoizomery, a nikoli ze standardního Wackerova procesu.
Stručně řečeno, zdá se, že experimentální důkazy podporují to, že k syn-adici dochází při nízkých koncentracích chloridů (<1 mol /L, podmínky průmyslového procesu), zatímco anti-adice se vyskytuje při vysokém obsahu chloridů (> 3mol /L ) reakční koncentrace, pravděpodobně kvůli chloridovým iontům, které saturují katalyzátor a inhibují mechanismus vnitřní koule. Přesná cesta a důvod tohoto přepínání cest však stále nejsou známy.
Dalším komplikováním mechanismu Wackerova procesu jsou otázky týkající se úlohy chloridu měďnatého. Většina teorií předpokládala, že měď nehraje roli v oxidačních mechanismech olefinů. Přesto experimenty Stangla a Jiry[21] zjištěno, že tvorba chlorhydrinu byla závislá na koncentracích chloridu měďnatého. Práce Hosokawy a spolupracovníků[22] poskytl krystalizovaný produkt obsahující chlorid měďnatý, což naznačuje, že může mít nevinnou roli v oxidaci olefinů. A konečně, studie ab initio od Comas-Vives, et al. [23] preferovanou cestou nebyla přítomnost žádného kokatalyzátoru mědi. Tato cesta byla později potvrzena experimenty Andersona a Sigmana bez mědi.[24] Byl zjištěn jiný zákon kinetické rychlosti bez závislosti na protonu za podmínek bez obsahu mědi, což naznačuje možnost, že i malé množství kokatalyzátorů mědi může mít na této chemii nevinnou roli. I když tyto práce komplikují obraz mechanismu Wackerova procesu, je třeba pravděpodobně odvodit, že tato a související chemie může být citlivá na reakční podmínky a ve hře může být několik různých reakčních cest.
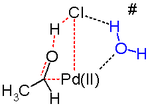
Dalším klíčovým krokem Wackerova procesu je migrace vodíku z kyslíku na chlorid a tvorba dvojné vazby C-O. Obecně se předpokládá, že tento krok probíhá prostřednictvím tzv Eliminace β-hydridu s cyklickým čtyřčlenným přechodový stav:
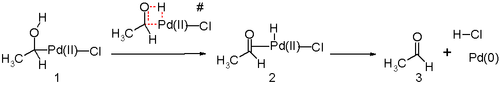
In silico studie[25][26][27] tvrdí, že přechodový stav pro tento reakční krok je nepříznivý a alternativa redukční eliminace mechanismus reakce je ve hře. Navrhovaným reakčním krokům pravděpodobně pomáhá molekula vody v roztoku působící jako katalyzátor.
Průmyslový proces
Pro výrobu acetaldehydu jsou komercializovány dvě cesty: jednostupňový proces a dvoustupňový.
Jednostupňový proces
Ethylen a kyslík jsou společně vedeny v reakční věži při teplotě asi 130 ° C a 400 kPa.[28] Katalyzátorem je vodný roztok PdCl2 a CuCl2. Acetaldehyd se čistí pomocí extrakční destilace následován frakční destilace. Extrakční destilací s vodou se odstraní zbytky světla, které mají nižší teploty varu než acetaldehyd (chlormethan, chlorethan, a oxid uhličitý ) nahoře, zatímco voda a vedlejší produkty s vyšší teplotou varu, jako např octová kyselina, krotonaldehyd nebo chlorované acetaldehydy, jsou odebírány společně s acetaldehydem na dně.[28]V důsledku korozívní Vzhledem k povaze katalyzátoru je reaktor obložen kyselinovzdorným keramický materiál a hadice je vyrobena z titan.
Dvoustupňový proces
Ve dvoustupňovém procesu, reakce a oxidace se provádějí samostatně v trubkových reaktorech. Na rozdíl od jednostupňového procesu lze místo kyslíku použít vzduch. Ethylen prochází reaktorem spolu s katalyzátorem při 105–110 ° C a 900–1000 kPa.[28] Roztok katalyzátoru obsahující acetaldehyd se oddělí blesková destilace. Katalyzátor se oxiduje v oxidačním reaktoru při 1000 kPa za použití vzduchu jako oxidačního média. Oxidovaný roztok katalyzátoru se oddělí a odešle zpět do reaktoru. Kyslík ze vzduchu je zcela spotřebován a odpadní vzduch cirkuluje jako inertní plyn. Směs acetaldehyd - vodní pára se předkoncentruje na 60–90% acetaldehyd pomocí reakční teplo a vypouštěná voda se vrací do bleskové věže pro udržení koncentrace katalyzátoru. Následuje dvoustupňová destilace surového acetaldehydu. V první fázi jsou nízkovroucí látky, jako např chlormethan, chlorethan a oxid uhličitý, jsou odděleny. Ve druhém stupni voda a vedlejší produkty s vyšší teplotou varu, jako jsou chlorované acetaldehydy a octová kyselina, se odstraní a acetaldehyd se získá v čisté formě nad hlavou.[28]Kvůli korozívní Povaha katalyzátoru je vybavena zařízením, které je s ním v kontaktu titan.
V jednostupňovém i dvoustupňovém procesu je výtěžek acetaldehydu asi 95%[28] a výrobní náklady jsou prakticky stejné. Výhoda použití zředěných plynů ve dvoustupňové metodě je vyvážena vyššími investičními náklady. Obě metody poskytují jako vedlejší produkty chlorované uhlovodíky, chlorované acetaldehydy a kyselinu octovou. Obecně je výběr metody řízen surovinovými a energetickými situacemi a dostupností kyslíku za rozumnou cenu. 100 dílů ethylenu obecně dává:
- 95 dílů acetaldehydu
- 1,9 dílu chlorovaných aldehydů
- 1,1 dílu nezměněného ethylenu
- 0,8 dílu oxidu uhličitého
- 0,7 dílu kyseliny octové
- 0,1 dílu chlormethanu
- 0,1 dílu ethylchloridu
- 0,3 dílu etanu, methanu, krotonaldehydu
a další vedlejší vedlejší produkty
Vývojový diagram ukazující vývojový diagram procesu pro jednostupňový Wackerův proces pro výrobu acetaldehydu.
Vývojový diagram ukazující vývojový diagram procesu pro dvoustupňový Wackerův proces výroby acetaldehydu.
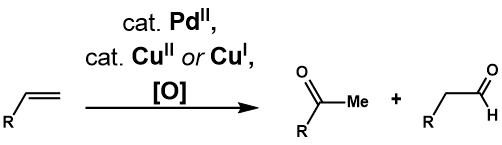
Tsuji-Wackerova oxidace
Příchod Wackerova procesu podnítil mnoho zkoumání užitečnosti a použitelnosti reakcí na složitější terminální olefiny. The Tsuji-Wackerova oxidace je přeměna takových olefinů na karbonylové sloučeniny katalyzovaná palladiem (II). Clement a Selwitz[29] jako první zjistili, že použití vodného DMF jako rozpouštědla umožnilo oxidaci 1-dodecenu na 2-dodekanon, což řešilo problém nerozpustnosti olefinů vyššího řádu ve vodě. Fahey[30] zaznamenali použití 3-methylsulfolanu místo DMF, protože rozpouštědlo zvýšilo výtěžek oxidace 3,3-dimethylbut-1-enu. Dva roky poté, Tsuji[31] aplikoval Selwitzovy podmínky pro selektivní oxidaci terminálních olefinů s více funkčními skupinami a prokázal jeho užitečnost při syntéze komplexních substrátů.[32] Další vývoj reakce vedl k tomu, že různé katalytické systémy řeší selektivitu reakce, stejně jako zavedení intermolekulární a intramolekulární oxidace s nevodnými nukleofily.
Regioselektivita
Doplněk Markovnikov
Tsuji-Wackerova oxidace oxiduje terminální olefin na odpovídající methylketon za podmínek Wackerova procesu. Téměř stejný jako u Wackerova procesu, navrhovaného katalytického cyklu[33](Obrázek 1) začíná na komplexace PdCl2 a dva chloridové anionty na PdCl4, který pak prochází následným výměna ligandu dvou chloridových ligandů pro vodu a alken za vzniku Pd (Cl2) (H2O) (alken) komplex. Molekula vody poté regioselektivně napadá olefin prostřednictvím mechanismu vnější koule v a Markovnikov způsobem, aby se vytvořil termodynamicky stabilnější Pd (Cl2) (OH) (- CH2Komplex -CHOH-R). Disociace chloridového ligandu ke komplexu tří souřadnic palladia podporuje Eliminace β-hydridu, potom následný 1,2-hydrid vložení generuje Pd (Cl2) (OH) (- CHOHR-CH3) komplexní. To prochází Eliminace β-hydridu k uvolnění ketonu a následně redukční eliminace produkuje HCl, vodu a palladium (0). Nakonec se palladium (0) reoxiduje na PdCl2 se dvěma ekvivalenty Cu (II) Cl2, což může být znovu oxidováno O2.
Oxidace koncových olefinů obecně poskytuje Markovnikov ketonový produkt, avšak v případech, kdy substrát upřednostňuje aldehyd (popsáno níže), lze k vynucení Markovnikovovy regioselektivity použít různé ligandy. Použití spartein jako ligand (obrázek 2, A)[34] upřednostňuje nukleopalladaci na terminálním uhlíku, aby se minimalizovala sterická interakce mezi komplexem palladia a substrátem. Palladiový katalyzátor ligovaný chinoxem se používá ke zvýhodnění tvorby ketonu, když substrát obsahuje směrovací skupinu (obrázek 2, B).[35] Když se takový substrát váže na Pd (Quinox) (OOtBu), je tento komplex koordinovaně nasycen, což brání navázání směrující skupiny, a vede k tvorbě produktu Markovnikov. Účinnost tohoto ligandu je také přičítána jeho elektronickým vlastnostem, kde se aniontový TBHP přednostně váže trans na oxazolinovou a olefinovou souřadnici trans na chinolin.[36]

Dodatek proti Markovnikovu
The anti-Markovnikov selektivity k aldehydu lze dosáhnout využitím přirozeného stereoelektronika podkladu.[37] Umístění řídící skupiny na homo-allylová (tj. obrázek 3, A)[38] a allylický pozice (tj. obrázek 3, B)[39] na koncový olefin upřednostňuje anti-Markovnikovův aldehydový produkt, což naznačuje, že v katalytickém cyklu cheláty do komplexu palladia tak, že voda útočí na anti-Markovnikovův uhlík a vytváří termodynamicky stabilnější palladocykl. Anti-Markovnikovova selektivita je také pozorována u styrenylových substrátů (tj. Obrázek 3, C),[40] pravděpodobně prostřednictvím η4komplex palladium-styren po vodě útočí na anti-Markovnikov. Další příklady substrátem kontrolované, anti-Markovnikovovy oxidace Tsuji-Wackera olefinů jsou uvedeny v recenzích Namboothiri,[41] Feringa,[37] a Muzart.[42]
Grubbs a spolupracovníci vydláždili cestu pro anti-Markovnikovovu oxidaci stereoelektronicky nezaujaté terminální olefiny pomocí systému palladium-dusitan (obrázek 2, D).[43] V jeho systému byl terminální olefin oxidován na aldehyd s vysokou selektivitou cestou regulace katalyzátoru. Mechanismus je předmětem šetření, nicméně důkazy[41] naznačuje, že prochází dusitany radikální přidává do koncového uhlíku, aby vytvořil termodynamicky stabilnější sekundární radikál. Grubbs rozšířil tuto metodiku na složitější, nezaujaté olefiny.[44][45]

Rozsah
Kyslíkové nukleofily
Intermolekulární oxidace olefinů s alkoholy jako nukleofil obvykle generovat Ketaly, kde jako oxidace olefinů katalyzované palladiem s karboxylovými kyselinami jako nukleofilní genreats vinylové nebo allylický karboxyláty. V případě dioly, jejich reakce s alkeny typicky generují ketály, zatímco reakce olefinů nesoucích skupiny přitahující elektrony mají tendenci se tvořit acetály.[46]
Palladiem katalyzovaná intermolekulární oxidace dienes s karboxylovými kyselinami a alkoholy jako dárci 1,4-přídavek produkty. V případě cyklohexadienu (obrázek 4, A) to Backvall zjistil stereochemický Bylo zjištěno, že výsledek produktu závisí na koncentraci LiCl.[47] Tato reakce probíhá tak, že se nejprve vytvoří komplex Pd (OAc) (benzochinon) (allyl) prostřednictvím antukleopalladace dienu s acetátem jako nukleofilem. Absence LiCl indukuje vnitřní sféra reduktivní eliminace, čímž se získá trans-acetátová stereochemie za vzniku trans-1,4-aduktu. Přítomnost LiCl vytěsňuje acetát s chloridem kvůli jeho vyšší vazebné afinitě, která nutí vnější acetátovou kouli proti palladiu, a poskytuje stereochemii cis-acetátu za vzniku cis-1,4-aduktu. Intramolekulární oxidační cyklizace: 2- (2-cyklohexenyl) fenol cyklizuje na odpovídající dihydro-benzofuran (obrázek 4, B);[48] Kyselina 1-cyklohexadien-octová v přítomnosti kyseliny octové cyklizuje na odpovídající lakton-acetátový 1,4 adukt (obrázek 4, C),[49] s cis a trans selektivita řízená přítomností LiCl.

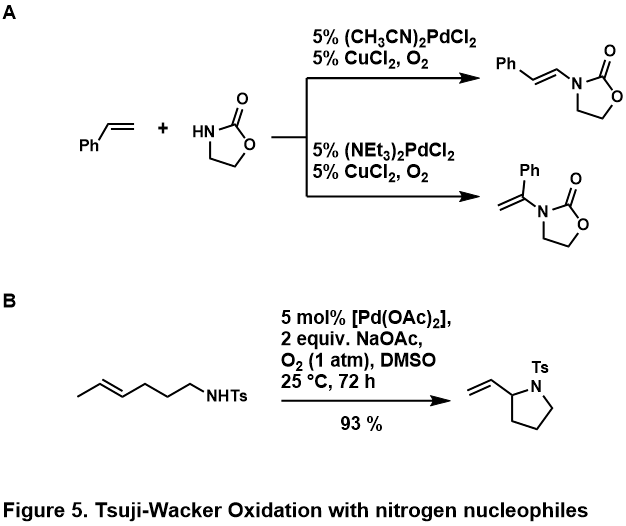
Dusíkaté nukleofily
Oxidační aminace olefinů se obvykle provádí s amidy nebo imides; aminy jsou považovány za protonoval kyselým médiem nebo příliš pevně svázat kovový střed, aby to umožnilo katalytické chemie.[46] Bylo zjištěno, že tyto dusíkaté nukleofily jsou kompetentní jak v intermolekulárních, tak v intramolekulárních reakcích, jsou uvedeny některé příklady (obrázek 5, A,[50] B[51])
Reference
- ^ Přeloženo částečně z de: Wacker-Verfahren.
- ^ Elschenbroich, C. „Organometallics“ (2006) Wiley-VCH: Weinheim. ISBN 978-3-527-29390-2
- ^ J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, R. Rüttinger a H. Kojer, Angew. Chem., 1959, 71, 176–182. doi:10,1002 / ange.19590710503
- ^ W. Hafner, R. Jira, J. Sedlmeier a J. Smidt, Chem. Ber., 1962, 95, 1575–1581.
- ^ J. Smidt, W. Hafner, R. Jira, R. Sieber, J. Sedlmeier a A. Sabel, Angew. Chem. Int. Vyd. Angl., 1962, 1, 80–88.
- ^ Acetaldehyd z ethylenu - retrospektiva při objevu Wackerova procesu Reinhard Jira Angew. Chem. Int. Vyd. 2009, 48, 9034–9037 doi:10.1002 / anie.200903992
- ^ J. Smidt, W. Hafner, J. Sedlmeier, R. Jira, R. Rottinger (Cons. F.elektrochem.Ind.), DE 1 049 845, 1959, Anm. 04.01.1957.
- ^ A b J. A. Keith, P. M. Henry (2009). „Mechanismus Wackerovy reakce: Příběh dvou hydroxypalladací“. Angew. Chem. Int. Vyd. 48 (48): 9038–9049. doi:10.1002 / anie.200902194. PMID 19834921.CS1 maint: používá parametr autoři (odkaz)
- ^ F. C. Phillips, Am. Chem. J., 1894, 16, 255–277.
- ^ F. C. Phillips, Z. Anorg. Chem., 1894, 6, 213–228.
- ^ Henry, Patrick M. In Handbook of Organopalladium Chemistry for Organic Synthesis; Negishi, E., vyd .; Wiley & Sons: New York, 2002; 2119. ISBN 0-471-31506-0
- ^ P. M. Henry, J. Am. Chem. Soc., 1964, 86, 3246–3250.
- ^ James, D.E., Stille, J.K. J. Organomet. Chem., 1976, 108, 401. doi:10.1021 / ja00423a028
- ^ Stille, J. K., Divakarumi, R. J., J. Organomet. Chem., 1979, 169, 239;
- ^ James, D.E., Hines, L.F., Stille, J.K. J. Am. Chem. Soc., 1976, 98, 1806 doi:10.1021 / ja00423a027
- ^ Bäckvall, J.E., Akermark, B., Ljunggren, S.O., J. Am. Chem. Soc., 1979, 101, 2411. doi:10.1021 / ja00503a029
- ^ Zaw, K., Lautens, M. a Henry P.M. Organometallics, 1985, 4, 1286–1296
- ^ Wan W.K., Zaw K. a Henry P.M. Organometallics, 1988, 7, 1677–1683
- ^ Francis, J.W., Henry, P.M. Organometallics, 1991, 10, 3498. doi:10.1021 / om00056a019
- ^ Francis, J.W., Henry, P.M. Organometallics, 1992, 11, 2832.doi:10.1021 / om00044a024
- ^ H. Stangl a R. Jira, Tetrahedron Lett., 1970, 11, 3589–3592
- ^ T. Hosokawa, T. Nomura, S.-I. Murahashi, J. Organomet. Chem., 1998, 551, 387–389
- ^ Comas-Vives, A., Stirling, A., Ujaque, G., Lledós, A., Chem. Eur. J., 2010, 16, 8738–8747.doi:10.1002 / chem.200903522
- ^ Anderson, B.J., Keith, J.A. a Sigman, M.S., J. Am. Chem. Soc., 2010, 132, 11872-11874
- ^ J. A. Keith, J. Oxgaard a W. A. Goddard, III J. Am. Chem. Soc., 2006, 128, 3132 – 3133; doi:10.1021 / ja0533139
- ^ H. E. Hosseini, S. A. Beyramabadi, A. Morsali a M. R. Housaindokht, J. Mol. Struct. (THEOCHEM), 2010, 941, 138–143
- ^ P. L. Theofanis a W. A. Goddard, III Organometallics, 2011, 30, 4941 – 4948; doi:10.1021 / om200542w
- ^ A b C d E Marc Eckert; Gerald Fleischmann; Reinhard Jira; Hermann M. Bolt; Klaus Golka. "Acetaldehyd". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a01_031.pub2.
- ^ Clement, William H .; Selwitz, Charles M. (leden 1964). „Vylepšené postupy pro převod vyšších α-olefinů na methylketony pomocí chloridu palladnatého“. The Journal of Organic Chemistry. 29 (1): 241–243. doi:10.1021 / jo01024a517. ISSN 0022-3263.
- ^ Fahey, Darryl R .; Zeuch, Ernest A. (listopad 1974). "Vodný sulfolan jako rozpouštědlo pro rychlou oxidaci vyšších a-olefinů na ketony za použití chloridu palladnatého". The Journal of Organic Chemistry. 39 (22): 3276–3277. doi:10.1021 / jo00936a023. ISSN 0022-3263.
- ^ Tsuji, Jiro; Shimizu, Isao; Yamamoto, Keiji (srpen 1976). "Pohodlná obecná syntetická metoda pro 1,4- a 1,5-diketony palladiem katalyzovanou oxidací a-allyl a a-3-butenylketonů". Čtyřstěn dopisy. 17 (34): 2975–2976. doi:10.1016 / s0040-4039 (01) 85504-0. ISSN 0040-4039.
- ^ Tsuji, Jiro (1984). „Syntetické aplikace oxidace olefinů na ketony katalyzovanou palladiem“. Syntéza. 1984 (5): 369–384. doi:10.1055 / s-1984-30848. ISSN 0039-7881.
- ^ Kurti, Laszlo; Czako, Barbara (2005). Strategické aplikace pojmenovaných reakcí v organické syntéze. 525 B Street, Suite 1900, San Diego, Kalifornie 92101-4495, USA: Elsevier Academic Press. p. 474. ISBN 978-0-12-429785-2.CS1 maint: umístění (odkaz)
- ^ Balija, Amy M .; Stowers, Kara J .; Schultz, Mitchell J .; Sigman, Matthew S. (březen 2006). „Pd (II) -Katalyzovaná přeměna styrenových derivátů na acetály: Dopad (-) - sparteinu na regioselektivitu“. Organické dopisy. 8 (6): 1121–1124. doi:10.1021 / ol053110p. ISSN 1523-7060. PMID 16524283.
- ^ Michel, Brian W .; Camelio, Andrew M .; Cornell, Candace N .; Sigman, Matthew S. (06.06.2009). „Obecný a efektivní katalyzátorový systém pro oxidaci typu Wacker využívající TBHP jako terminální oxidant: aplikace na klasicky náročné substráty“. Journal of the American Chemical Society. 131 (17): 6076–6077. doi:10.1021 / ja901212h. ISSN 0002-7863. PMC 2763354. PMID 19364100.
- ^ Michel, Brian W .; Steffens, Laura D .; Sigman, Matthew S. (červen 2011). „O mechanismu palladiem katalyzované terc-butylhydroperoxidem zprostředkované Wackerovy oxidace alkenů pomocí chinolin-2-oxazolinových ligandů“. Journal of the American Chemical Society. 133 (21): 8317–8325. doi:10.1021 / ja2017043. ISSN 0002-7863. PMC 3113657. PMID 21553838.
- ^ A b Dong, Jia Jia; Browne, Wesley R .; Feringa, Ben L. (03.11.2014). „Oxidace terminálu Alkenes katalyzovaná palladiem proti Markovnikovu“. Angewandte Chemie International Edition. 54 (3): 734–744. doi:10,1002 / anie.201404856. ISSN 1433-7851. PMID 25367376.
- ^ Miller, D. G .; Wayner, Danial D. M. (duben 1990). "Vylepšená metoda pro Wackerovu oxidaci cyklických a vnitřních olefinů". The Journal of Organic Chemistry. 55 (9): 2924–2927. doi:10.1021 / jo00296a067. ISSN 0022-3263.
- ^ Stragies, Roland; Blechert, Siegfried (říjen 2000). „Enantioselektivní syntéza tetraponerinů pomocí Pd- a Ru-katalyzovaných domino reakcí“. Journal of the American Chemical Society. 122 (40): 9584–9591. doi:10.1021 / ja001688i. ISSN 0002-7863.
- ^ Wright, Joseph A .; Gaunt, Matthew J .; Spencer, Jonathan B. (11.01.2006). „Nová anti-Markovnikovova regioselektivita v Wackerově reakci styrenů“. Chemistry - A European Journal. 12 (3): 949–955. doi:10.1002 / chem.200400644. ISSN 0947-6539. PMID 16144020.
- ^ A b Baiju, Thekke Veettil; Štěrk, Edmond; Doris, Eric; Namboothiri, Irishi N.N. (Září 2016). "Poslední vývoj v oxidaci Tsuji-Wacker". Čtyřstěn dopisy. 57 (36): 3993–4000. doi:10.1016 / j.tetlet.2016.07.081. ISSN 0040-4039.
- ^ Muzart, Jacques (srpen 2007). "Aldehydy z Pd katalyzované oxidace terminálních olefinů". Čtyřstěn. 63 (32): 7505–7521. doi:10.1016 / j.tet.2007.04.001. ISSN 0040-4020.
- ^ Wickens, Zachary K .; Morandi, Bill; Grubbs, Robert H. (2013-09-13). „Aldehydově selektivní oxidace Wackerova typu nestranných alkenů umožněná nitritovým kokatalyzátorem“ (PDF). Angewandte Chemie International Edition. 52 (43): 11257–11260. doi:10,1002 / anie.201306756. ISSN 1433-7851. PMID 24039135.
- ^ Wickens, Zachary K .; Skakuj, Kacper; Morandi, Bill; Grubbs, Robert H. (2014-01-13). „Oxidace Wackerova typu řízená katalyzátorem: snadný přístup k funkcionalizovaným aldehydům“ (PDF). Journal of the American Chemical Society. 136 (3): 890–893. doi:10.1021 / ja411749k. ISSN 0002-7863. PMID 24410719.
- ^ Kim, Kelly E .; Li, Jiaming; Grubbs, Robert H .; Stoltz, Brian M. (2016-09-30). „Katalytické anti-Markovnikovovy transformace bráněných terminálových alkenů umožněné aldehydovou selektivní oxidací typu Wacker“ (PDF). Journal of the American Chemical Society. 138 (40): 13179–13182. doi:10.1021 / jacs.6b08788. ISSN 0002-7863. PMID 27670712.
- ^ A b Hartwig, John F. (2010). Organotransition Metal Chemistry: From Bonding to Catalysis. USA: University Science Books. 717–734. ISBN 978-1-891389-53-5.
- ^ Baeckvall, Jan E .; Bystroem, Styrbjoern E .; Nordberg, Ruth E. (listopad 1984). „Stereo- a regioselektivní palladiem katalyzovaná 1,4-diacetoxylace 1,3-dienů“. The Journal of Organic Chemistry. 49 (24): 4619–4631. doi:10.1021 / jo00198a010. ISSN 0022-3263.
- ^ Hosokawa, Takahiro; Miyagi, Shyogo; Murahashi, Shunichi; Sonoda, Akio (červenec 1978). „Oxidační cyklizace 2-allylfenolů octanem paladnatým. Změny v distribuci produktu“. The Journal of Organic Chemistry. 43 (14): 2752–2757. doi:10.1021 / jo00408a004. ISSN 0022-3263.
- ^ Baeckvall, Jan E .; Granberg, Kenneth L .; Andersson, Pher G .; Gatti, Roberto; Gogoll, Adolf (září 1993). "Stereo řízené laktonizační reakce prostřednictvím palladiem katalyzovaného 1,4-přidání do konjugovaných dienů". The Journal of Organic Chemistry. 58 (20): 5445–5451. doi:10.1021 / jo00072a029. ISSN 0022-3263.
- ^ Timokhin, Vitaliy I .; Stahl, Shannon S. (prosinec 2005). „Brønsted Base-Modulated Regioselectivity in the Aerobic Oxidative Amination of Styrene Catalyzed by Palladium“. Journal of the American Chemical Society. 127 (50): 17888–17893. doi:10.1021 / ja0562806. ISSN 0002-7863. PMID 16351120.
- ^ Larock, Richard C .; Hightower, Timothy R .; Hasvold, Lisa A .; Peterson, Karl P. (leden 1996). „Cyklizace olefinických tosylamidů katalyzovaná palladiem (II)“. The Journal of Organic Chemistry. 61 (11): 3584–3585. doi:10.1021 / jo952088i. ISSN 0022-3263. PMID 11667199.


