Oktan - Octane
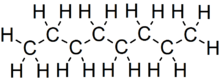 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Oktan[1] | |
| Identifikátory | |
3D model (JSmol ) | |
| 3DMet | |
| 1696875 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.003.539 |
| Číslo ES |
|
| 82412 | |
| KEGG | |
| Pletivo | oktan |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 1262 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C8H18 | |
| Molární hmotnost | 114.232 g · mol−1 |
| Vzhled | bezbarvá kapalina |
| Zápach | Jako benzín[2] |
| Hustota | 0,703 g cm−3 |
| Bod tání | -57,1 až -56,6 ° C; -70,9 až -69,8 ° F; 216,0 až 216,6 K. |
| Bod varu | 125,1 až 126,1 ° C; 257,1 až 258,9 ° F; 398,2 až 399,2 K. |
| 0,007 mg dm−3 (při 20 ° C) | |
| log P | 4.783 |
| Tlak páry | 1,47 kPa (při 20,0 ° C) |
| 29 nmol Pa−1 kg−1 | |
| Konjugovaná kyselina | Octonium |
| -96.63·10−6 cm3/ mol | |
Index lomu (nD) | 1.398 |
| Viskozita |
|
| Termochemie | |
Tepelná kapacita (C) | 255,68 J K.−1 mol−1 |
Std molární entropie (S | 361,20 J K.−1 mol−1 |
Std entalpie of formace (ΔFH⦵298) | −252,1– −248,5 kJ mol−1 |
Std entalpie of spalování (ΔCH⦵298) | −5,53– −5,33 MJ mol−1 |
| Nebezpečí | |
| Piktogramy GHS |     |
| Signální slovo GHS | Nebezpečí |
| H225, H304, H315, H336, H410 | |
| P210, P261, P273, P301 + 310, P331 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | 13,0 ° C (55,4 ° F; 286,1 K) |
| 220,0 ° C (428,0 ° F; 493,1 K) | |
| Výbušné limity | 0.96–6.5% |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LDhle (nejnižší publikováno ) | 428 mg / kg (myš, intravenózně)[4] |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | PEL (časově vážený průměr) 500 ppm (2350 mg / m3)[2] |
REL (Doporučeno) | PEL 75 ppm (350 mg / m3) C 385 ppm (1800 mg / m.)3) [15 minut][2] |
IDLH (Okamžité nebezpečí) | 1000 ppm[2] |
| Související sloučeniny | |
Související alkany | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
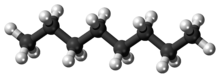
Oktan je uhlovodík a alkanu s chemický vzorec C8H18a kondenzovaný strukturní vzorec CH3(CH2)6CH3. Octane má mnoho strukturní izomery které se liší množstvím a umístěním větvení v uhlíkovém řetězci. Jeden z těchto izomerů, 2,2,4-trimethylpentan (běžně nazývaný iso-oktan) se používá jako jedna ze standardních hodnot v oktanové číslo měřítko.
Oktan je součástí benzín (benzín). Stejně jako u všech nízkomolekulárních uhlovodíků je i oktan nestálý a velmi hořlavý.
Použití výrazu v benzinu
„Oktan“ se hovorově používá jako krátká forma „oktanové číslo „, zejména ve výrazu„ vysoký oktan “.„ Oktanové hodnocení “je index schopnosti paliva odolávat klepání motoru při vysoké kompresi, která je charakteristická pro oktanové isomery s rozvětveným řetězcem, zejména isooktan.
Oktanové hodnocení bylo původně určeno smícháním paliv pouze s heptanem a 2,2,4-trimethylpentanem (vysoce rozvětveným oktanem) a přidělením anti-knock ratingů nule pro čistý heptan a 100 pro čistý 2,2,4-trimethylpentan. Antidetonační hodnocení této směsi by bylo stejné jako procento této směsi ve směsi. Různé izomery oktanu mohou přispívat k nižšímu nebo vyššímu oktanovému číslu. Například, n-oktan (přímý řetězec 8 atomů uhlíku bez větvení) má a -20 (negativní) Výzkumné oktanové hodnocení, zatímco čistý 2,2,4-trimethylpentan má hodnocení RON 100. Některá paliva mají oktanové číslo vyšší než 100, zejména paliva obsahující methanol nebo ethanol.
Metaforické použití
Octane se stal dobře známým v americké populární kultuře v polovině a na konci 60. let, kdy benzín společnosti se ve svých reklamách na benzín chlubily „vysokým oktanovým číslem“.
Složené adjektivum „vysoce oktanové“, což znamená silný nebo dynamický, je zaznamenáno v obrazném smyslu od roku 1944.[5] V polovině 90. let byla fráze běžně používána jako zesilovač a našel si místo v moderní anglické lidové mluvě.
Izomery
Oktan má 18 strukturních izomerů (24 včetně stereoizomery ):
- Oktan (n-oktan)
- 2-methylheptan
- 3-methylheptan (2 enantiomery )
- 4-methylheptan
- 3-ethylhexan
- 2,2-dimethylhexan
- 2,3-dimethylhexan (2 enantiomery)
- 2,4-dimethylhexan (2 enantiomery)
- 2,5-dimethylhexan
- 3,3-dimethylhexan
- 3,4-dimethylhexan (2 enantiomery + 1 meso sloučenina )
- 3-Ethyl-2-methylpentan
- 3-ethyl-3-methylpentan
- 2,2,3-trimethylpentan (2 enantiomery)
- 2,2,4-trimethylpentan (isooktan)
- 2,3,3-trimethylpentan
- 2,3,4-trimethylpentan
- 2,2,3,3-tetramethylbutan
Reference
- ^ „octane - Summary of Compound“. PubChem Compound. USA: Národní centrum pro biotechnologické informace. 16. září 2004. Identifikace a související záznamy. Citováno 6. ledna 2012.
- ^ A b C d NIOSH Kapesní průvodce chemickými nebezpečími. "#0470". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Dymond, J. H .; Oye, H. A. (1994). "Viskozita vybrané kapaliny n-Alkanehhhh s". Žurnál fyzikálních a chemických referenčních údajů. 23 (1): 41–53. doi:10.1063/1.555943. ISSN 0047-2689.
- ^ "Oktan". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Oxfordský anglický slovník.
externí odkazy
- Mezinárodní karta chemické bezpečnosti 0933
- NIOSH Kapesní průvodce chemickými nebezpečími. "#0470". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- Fytochemické a etnobotanické databáze Dr. Duke, Octane, http://www.ars-grin.gov/cgi-bin/duke/chemical.pl?OCTANE[trvalý mrtvý odkaz ]








