Bamford-Stevensova reakce - Bamford–Stevens reaction - Wikipedia
The Bamford-Stevensova reakce je chemická reakce přičemž léčba tosylhydrazony se silnou základnou dává alkeny.[1][2][3] Je pojmenován pro britského chemika William Randall Bamford a skotský chemik Thomas Stevens Stevens (1900–2000). Využití aprotická rozpouštědla dává převážně Z-alkeny, zatímco protické rozpouštědlo dává směs E- a Z-alkenů. Jako transformace vytvářející alkeny má Bamford-Stevensova reakce široké využití v syntetické metodologii a syntéze složitých molekul.

Zpracování tosylhydrazonů alkyl lithiovými činidly se nazývá Shapiro reakce.
Reakční mechanismus
Prvním krokem Bamford-Stevensovy reakce je tvorba diazo sloučeniny 3.[4]

V protických rozpouštědlech je to diazo sloučenina 3 se rozkládá na karbeniový ion 5.

V aprotických rozpouštědlech je to diazo sloučenina 3 rozkládá se na karben 7.

Směrovaná Bamford-Stevensova reakce
Bamford-Stevensova reakce se neukázala jako užitečná pro stereoselektivní generování alkenů prostřednictvím tepelný rozklad metalovaných tosylhydrazonů v důsledku nevybíravého 1,2-přeskupení karbenového centra, které poskytuje směs produktů. Nahrazením alkylové skupiny trimethylsilylovou (TMS) skupinou na N-aziridinyliminy lze zlepšit migraci konkrétního atomu vodíku. S křemík atom beta na H, a σC-Si → σ*C-H stereoelektronický efekt oslabuje vazbu C-H, což vede k jeho výlučné migraci a vede k téměř výlučné tvorbě allylsilanů namísto stejného množství allylsilanů a izomerních homoallylsilanů, analogicky ke směsi produktů pozorovaných v dialkylovém případě, nebo jiných produktů inzerce (tj. cyklopropanů). Vidět beta-křemíkový efekt.[5][6][7]
Syntéza 3-substituovaných indazolů z arynů a N-tosylhydrazonů
N-tosylhydrazony lze použít v různých syntetických postupech. Jejich použití s aryny bylo použito k přípravě 3-substituovaných indazolů dvěma navrhovanými cestami. Prvním krokem je deprotonace hydrazonu diazosloučenin pomocí CsF. V tomto okamžiku by se mohla konjugovaná báze buď rozložit za vzniku diazo sloučeniny a podstoupit [3 + 2] dipolární cykloadice s aryne dát produkt, nebo [3 + 2] anulace s arynem, který by také poskytl konečný produkt. Zatímco silné báze, jako jsou LiOtBu a Cs2CO3 jsou v této chemii často používány, byl použit CsF k usnadnění in situ tvorby arynů z o- (trimethylsilyl) aryltriflátů. CsF byl také považován za dostatečně bazický pro deprotonaci N-tosylhydrazonu.[8][9]
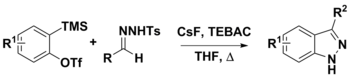
N-tosylhydrazony jako činidla pro křížové vazebné reakce
Barluenga a spolupracovníci vyvinuli první příklad použití N-tosylhydrazonů jako nukleofilní partnery v křížových vazebných reakcích. Typicky jsou nukleofilní činidla v vazebné reakce bývají z organokovový odrůda, jmenovitě organomagnesium, -zinek, -tin, -silikon a –boron. Zkombinováno s elektrofilní arylhalogenidy, lze použít N-tosylhydrazony k přípravě polysubstituovaných olefinů za podmínek katalyzovaných Pd bez použití často drahých a synteticky náročných organokovových činidel.
Rozsah reakce je široký; N-tosylhydrazony odvozené od aldehydů a ketonů jsou dobře tolerovány, což vede k di- i trisubstituovaným olefinům. Kromě toho jsou různé arylhalogenidy dobře tolerovány jako vazební partneři, včetně těch, které nesou jak skupiny přitahující elektrony, tak skupiny poskytující elektrony, stejně jako π-bohaté a π-deficitní aromatický heterocyklické sloučeniny. Při přípravě polysubstituovaných olefinů je důležitým prvkem stereochemie. Použití hydrazonů odvozených od lineárních aldehydů vedlo k výlučně trans olefinům, zatímco stereochemické výsledky trisubstituovaných olefinů byly závislé na velikosti substituentů.

Předpokládá se, že mechanismus této transformace probíhá podobným způsobem jako syntéza alkenů pomocí Bamford-Stevensovy reakce; rozklad N-tosylhydrazonů v přítomnosti báze za vzniku diazozloučenin, které pak uvolňují plynný dusík, za vzniku karbenu, který může být poté zastaven elektrofilem. V tomto případě začíná vazebná reakce s oxidační přísada arylhalogenidu na Pd0 katalyzátor, čímž se získá aryl PdII komplex. Reakce diazosloučeniny generované z hydrazonu s PdII komplex produkuje komplex Pd-karben. A migrační vložení arylové skupiny poskytuje alkyl Pd komplex, který podléhá syn eliminace beta-hydridu generovat trans aryl olefin a regenerovat Pd0 katalyzátor. Tato reakce byla také užitečná při přípravě konjugovaných enynů z N-tosylhydrazonů a terminálních alkynů za podobných Pd-katalyzovaných reakčních podmínek a podle stejného mechanismu.

Barluenga a spolupracovníci navíc prokázali jednosložkovou třísložkovou kopulační reakci aldehydů nebo ketonů, tosylhydrazidů a arylhalogenidů, ve kterých N-tosylhydrazon se tvoří in situ. Tento proces produkuje stereoselektivní olefiny v podobných výtěžcích ve srovnání s procesem, ve kterém byly provedeny NPoužívají se -tosylhydrazony.[10]
Barluenga a spolupracovníci také vyvinuli metodiku redukce nekovové vazby N-tosylhydrazonů s kyselinami boritými bez obsahu kovů. Reakce toleruje různé funkční skupiny na obou substrátech, včetně aromatických, heteroaromatických, alifatických, elektron-donujících a elektron-přitahujících substituentů, a probíhá s vysokými výtěžky v přítomnosti uhličitanu draselného. Předpokládá se, že reakce probíhá tvorbou diazo sloučeniny, která je generována z hydrazonové soli. Diazoová sloučenina by pak mohla reagovat s kyselinou boritou za vzniku kyseliny benzylborité přes meziprodukt boronátu. Alternativní cesta spočívá v tvorbě benzylboronové kyseliny prostřednictvím zwitteriontového meziproduktu, po níž následuje protodeborace benzylboronové kyseliny za bazických podmínek, čímž se získá konečný redukční produkt.

Tato metodika byla také rozšířena na heteroatomové nukleofily za účelem výroby etherů a thioetherů.[11][12]
Tandemový rhodiem katalyzovaný Bamford-Stevensův / tepelný alifatický Claisenův přesmyk
Stoltz vyvinul nový proces, ve kterém byla reakce Bamford-Stevens kombinována s Claisenův přesmyk k výrobě různých olefinových produktů. Tato transformace probíhá nejprve tepelným rozkladem N-aziridinylhydrazonů za vzniku diazo sloučeniny (1), následovaná rhodiem zprostředkovanou de-diazotací (2) a syn 1,2-hydridový posun (3). Tento substrát podléhá tepelné alifatice Claisenův přesmyk (4), čímž se získá produkt.[13][14]

Aplikace na celkovou syntézu
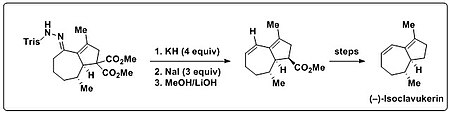
Trost a kol. využili Bamford-Stevensovu reakci v jejich celková syntéza (-) - isoclavukerinu zavést a dien skupina nacházející se v přírodním produktu. Nejprve byl podroben bicyklický trisylhydrazon Shapiro reakce podmínky (alkyllithia nebo LDA), které vedly pouze k necharakterizovatelným produktům rozkladu. Když byl tento bicyklický trisylhydrazon vystaven silné bázi (KH) a teplu, byl však vytvořen požadovaný dienový produkt. Navíc se ukázalo, že generace olefinů a následující dekarboxylace lze provést v jednom hrnci. Za tímto účelem byl přidán nadbytek NaI spolu se zvýšením teploty pro usnadnění Krapcho dekarboxylace.[15][16]
Reference
- ^ Bamford, W. R .; Stevens, T. S. (1952). "924. Rozklad toluen-p-sulfonylhydrazonů zásadou". Journal of the Chemical Society: 4735. doi:10.1039 / JR9520004735.
- ^ Shapiro, R. H. (březen 1976). "Alkenes from Tosylhydrazones". Organické reakce. 23. New York: Wiley. 405–507. ISBN 0-471-19624-X.
- ^ Adlington, R. M .; Barrett, A. G. M. (1983). "Nedávné aplikace Shapirovy reakce". Účty chemického výzkumu. 16 (2): 55. doi:10.1021 / ar00086a004.
- ^ Creary, X. (1986). "Pyrolýza solí tosylhydrazonu: fenyldiazomethany". Organické syntézy. 64: 207. doi:10.15227 / orgsyn.064.0207. (také v Collective Volume (1990) 7:438 (PDF))
- ^ Sarkar, T. (1992). „Křemíkem řízená Bamford-Stevensova reakce β-trimethylsilyl N-aziridinyliminů“. J. Chem. Soc. Chem. Commun. (17): 1184–1185. doi:10.1039 / C39920001184.
- ^ Lambert, J. (1990). "Interakce se silikonem s pozitivně nabitým uhlíkem". Čtyřstěn. 46 (8): 2677–2689. doi:10.1016 / s0040-4020 (01) 88362-9.
- ^ Jorgensen, W. (1985). "Velikost a původ účinku p-křemíku na ionty karbenia". J. Am. Chem. Soc. 107 (6): 1496–1500. doi:10.1021 / ja00292a008.
- ^ Feng, S. (2011). "Syntéza 3-substituovaných indazolů z arynů a N-tosylhydrazonů". Org. Lett. 13 (13): 3340–3343. doi:10,1021 / ol201086g. PMID 21630698.
- ^ Pellissier, H. (2002). "Využití arynů v organické syntéze". Čtyřstěn. 59 (6): 701–730. doi:10.1016 / s0040-4020 (02) 01563-6.
- ^ Baruenga, J. (2007). „N-tosylhydrazony jako činidla pro křížové vazebné reakce: cesta k polysubstituovaným olefinům“. Angew. Chem. Int. Vyd. 46 (29): 5587–5590. doi:10.1002 / anie.200701815. PMID 17577897.
- ^ Zhihui, S. (2012). „N-Tosylhydrazones: univerzální reagencie pro kovem katalyzované a bezkovové křížové vazebné reakce“. Chem. Soc. Rev. 41 (2): 560–572. doi:10.1039 / c1cs15127d. PMID 21785803.
- ^ Barluenga, J. (2009). „Redukční vazba vytvářející vazbu uhlík-uhlík bez uhlíku mezi kyselinami bornými a tosylhydrazony“. Nat. Chem. 1 (6): 494–499. Bibcode:2009NatCh ... 1..494B. doi:10,1038 / nchem. 328. PMID 21378917. S2CID 35892518.
- ^ Stoltz, B. (2002). „Nekarbonyl-stabilizované metalokarbenoidy v syntéze: vývoj tandemové sekvence Bamford-Stevens / Thermal Alphatic Claisenova přesmyku katalyzovaná rhodiem“ (PDF). J. Am. Chem. Soc. 124 (42): 12426–12427. doi:10.1021 / ja028020j. PMID 12381180.
- ^ Wood, J. (1999). „Vývoj Claisenova přesmyku iniciovaného karbenoidem rhodia pro enantioselektivní syntézu α-hydroxykarbonylových sloučenin“. J. Am. Chem. Soc. 121 (8): 1748–1749. doi:10.1021 / ja983294l.
- ^ Trost, B.M. (1996). „O diastereoselektivitě intramolekulárních cykloadic TMM katalyzovaných Pd. Asymetrická syntéza perhydroazulenu (-) - isoclavukerinu A“. J. Am. Chem. Soc. 118 (42): 10094–10105. doi:10.1021 / ja961561m.
- ^ Kurti, L .; Czako, B. (2005). Strategické aplikace pojmenovaných reakcí v organické syntéze. El Sevier. ISBN 978-0124297852.
