Julie olefinace - Julia olefination
| Julie olefinace | |
|---|---|
| Pojmenoval podle | Marc Julia |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | Julie-olefinace |
| RSC ontologické ID | RXNO: 0000117 |
The Julie olefinace (také známý jako Julia – Lythgoe olefinace) je chemická reakce použito v organická chemie z fenyl sulfony (1) s aldehydy (nebo ketony ) dát alkeny (olefiny) (3) po funkcionalizaci alkoholu a redukční eliminaci za použití amalgám sodný[1][2] nebo SmI2.[3] Reakce je pojmenována po francouzském chemikovi Marc Julia.
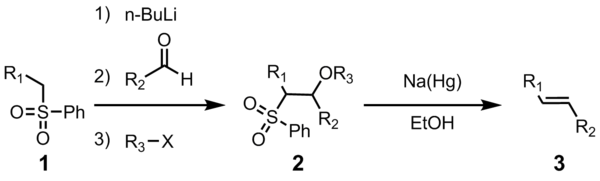
Užitečnost této pojivové olefinační reakce vyplývá z její všestrannosti, její široké tolerance funkční skupiny a mírných reakčních podmínek, za kterých reakce probíhá.
Všechny čtyři kroky lze provést v jedné reakční nádobě a použití R3X je volitelné. Čištění sulfonového meziproduktu 2 však vede k vyššímu výtěžku a čistotě. Nejčastěji R3 je acetyl nebo benzoyl, s anhydrid kyseliny octové nebo benzoylchlorid použitý při přípravě 2.
Dějiny
V roce 1973 uvedli Marc Julia a Jean-Marc Paris novou syntézu olefinů, při které byly β-acyloxysulfony redukčně eliminovány na odpovídající alkeny di-, tri- nebo tetrasubstituované.[4] Basil Lythgoe a Philip J. Kocienski prozkoumal rozsah a omezení reakce a dnes je tato olefinace formálně známá jako olefinace Julia-Lythgoe.[5] Reakce zahrnuje přidání sulfonyl-stabilizovaného karbaniontu k karbonylové sloučenině, následovanou eliminací za vzniku alkenu. V počátečních verzích reakcí byla eliminace provedena za redukčních podmínek. V poslední době byla vyvinuta upravená verze, která se tomuto kroku vyhne. První verze se někdy označuje jako olefinace Julia-Lythgoe, zatímco druhá se nazývá olefinace Julia-Kocienski. V redukční variantě je adukt obvykle acylován a poté zpracován redukčním činidlem, jako je například amalgám sodný[6][7] nebo SmI2.[8] Bylo publikováno několik recenzí těchto reakcí.[9][10]
Reakční mechanismus
Počáteční kroky jsou přímé. Fenylsulfon anion (2) reaguje s aldehydem za vzniku alkoxid (3). Alkoxid je funkcionalizován R3-X, čímž získáme stabilní meziprodukt (4). Přesný mechanismus redukce sodné soli amalgámu není znám, ale bylo prokázáno, že postupuje prostřednictvím vinylových radikálových druhů (5)[11]. Protonace vinylového radikálu poskytne požadovaný produkt (6).

Stereochemie alkenu (6) je nezávislá na stereochemii sulfonového meziproduktu 4. Předpokládá se, že radikální meziprodukty jsou schopné ekvilibrace, takže se nejčastěji vyrábí termodynamicky stabilnější trans-olefin. Tato transformace upřednostňuje formování E-alken.[12]
Variace
Upravená olefinace Julie

Upravená olefinace Julia, známá také jako olefinace Julia v jednom hrnci, je modifikací klasické olefinace Julia. Nahrazení fenylsulfonů heteroarylsulfony značně mění reakční cestu.[13] Nejpopulárnějším příkladem je benzothiazol sulfon.[14] Reakce benzothiazol sulfonu (1) s lithium diisopropylamid (LDA) poskytuje metalovaný benzothiazolylsulfon, který rychle reaguje s aldehydy (nebo ketony) za vzniku alkoxidového meziproduktu (2). Na rozdíl od fenylsulfonů je tento alkoxidový meziprodukt (2) reaktivnější a bude podléhat a Úsměv přesmyk[15] čímž se získá sulfinátová sůl (4). Sulfinátová sůl (4) bude spontánně odstraněna oxid siřičitý a lithium benzothiazolon (5) produkující požadovaný alken (6).

Jelikož benzothiazolová variace Julie olefinace nezahrnuje ekvilibrační meziprodukty, je stereochemický výsledek výsledkem stereochemie počátečního přidání karbonylu. Výsledkem je, že tato reakce často generuje směs alkenových stereoizomerů.
Olefinace Julia – Kocienski
| Olefinace Julia – Kocienski | |
|---|---|
| Pojmenoval podle | Marc Julia Philip Joseph Kocienski |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | modifikovaná-julia-kocienski-olefinace |
| RSC ontologické ID | RXNO: 0000304 |

Olefinace Julia-Kocienski, další zdokonalení upravené olefinace Julia, nabízí velmi dobré E-selektivita. V olefinaci Julia – Kocienski[16] the alkylační činidlo je tetrazol. Vyrábí se stejným mechanismem jako výše uvedený benzothiazol sulfon. Výška E-selektivita olefinace Julia – Kocienski je výsledkem kineticky kontrolované diastereoselektivní adice metalovaných 1-fenyl-1 H-tetrazol-5-yl (PT) sulfonů na nekonjugované aldehydy. Tak se získají anti-p-alkoxysulfony, které se stereospecificky rozkládají na E-alkeny.[17] V jedné adaptaci[18] s t-butyltetrazoylmethylsulfon reakční podmínky jsou buď bis (trimethylsilyl) amid sodný při -70 ° C v tetrahydrofuran nebo uhličitan česný při +70 ° C. Tato reakce je pojmenována po Philipu J. Kocienskim pro jeho modifikaci olefinace Julia.

Syntetické aplikace
Reakce Julia nebo modifikovaná Julia olefinace je výkonná a všestranná syntetická transformace, široce využívaná při konstrukci složitých přírodních produktů s vynikající kontrolou geometrické izomerie.
Pterostilben
Pterostilben je stilbenoid chemicky příbuzný resveratrolu. Patří do skupiny fytoalexinů, látek produkovaných rostlinami v boji proti infekcím.[19] Pterostilben je přirozeně se vyskytující dimethyletherový analog resveratrolu. Předpokládá se, že sloučenina také má antidiabetikum vlastnosti, ale zatím bylo v této otázce studováno velmi málo.
Ve srovnání s Wittig Wittig-Horner, Perkin nebo reakce katalyzované přechodným kovem k syntéze pterostilebenu, nabízí olefinace Julia jednoduchou, ekonomickou alternativní metodu pro přípravu pterostilbenu.[20][21]
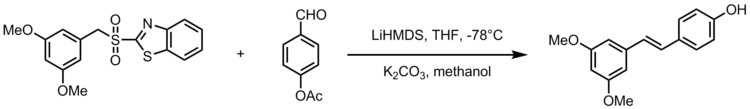
Resveratrol
Jedna adaptace Julia-Kocienského olefinace poskytuje syntézu stilbenoid resveratrol, přírodní sloučenina nacházející se v běžných potravinách, jako jsou hrozny, vína a ořechy. Resveratrol je biologicky důležitý stilbenoid, o kterém se tvrdí, že má mnoho zdravotních výhod. Olefinace Julia-Kocienski slouží jako silná reakce při syntéze analogů resveratrolu s 3,5-bis (trifluormethyl) fenylsulfony. Následující schéma zobrazuje obecné schéma syntézy analogů resveratrolu, kde R2 je arylová skupina.[22]

(-) - Callystatin A
Při asymetrické totální syntéze (-) - kallystatinu A pomocí Amos Smith, k připojení dvou byly použity dvě oddělené olefinace Julia E-alkenové skupiny.[23] (-) - kallystatin A je členem rodiny leptomycinových antibiotik. Následující schéma zobrazuje olefinaci Julia-Kocienski použitou k dosažení prekurzoru přírodního produktu, jak je naznačeno použitím PT-sulfonu.

Viz také
- Horner – Wadsworth – Emmonsova reakce
- Johnson – Corey – Chaykovského reakce
- Petersonova olefinace
- Wittigova reakce
Reference
- ^ Julia, M .; Paris, J.-M. Tetrahedron Lett. 1973, 14, 4833–4836. (doi:10.1016 / S0040-4039 (01) 87348-2 )
- ^ Kocienski, P. J .; Lythgoe, B .; Ruston, S. J. Chem. Soc., Perkin Trans. 1 1978, 829.
- ^ Keck, G. E .; Savin, K. A .; Weglarz, M. A. J. Org. Chem. 1995, 60, 3194–3204. (doi:10.1021 / jo00115a041 )
- ^ Kocienski, P. J. Fosfor a síra 1985, 24, 97–127. (Posouzení)
- ^ Kelly, S.E. Komplexní organická syntéza 1991, 1, 792–806. (Posouzení) (doi:10.1016 / B978-0-08-052349-1.00020-2 )
- ^ Blakemore, P. R. J. Chem. Soc., Perkin Trans. 1 2002, 2563–2585. (doi:10.1039 / b208078h )
- ^ Baudin, J. B .; Hareau, G .; Julia, S. A .; Ruel, O. Tetrahedron Lett. 1991, 32, 1175. (doi:10.1016 / S0040-4039 (00) 92037-9 )
- ^ Příměří, W. E .; Kreider, E. M .; Značka, W. W. Org. Reagovat. 1970, 18, 99. (Recenze)
- ^ Paul R. Blakemore, William J. Cole, Philip J. Kocieński, Andrew Morley Synlett 1998, 26–28. (doi:10.1055 / s-1998-1570 )
- ^ Christophe Aïssa J. Org. Chem. 2006, 71, 360–63. (doi:10.1021 / jo051693a )
- ^ Zajc, B., & Kumar, R. (2010). Syntéza fluoroolefinů pomocí Julia-Kocienskiho olefinace. Syntéza, 2010(11), 1822–1836.(doi:10.1055 / s-0029-1218789 )
- ^ Langcake, P .; Pryce, R. J. (1977). "Nová třída fytoalexinů z vinné révy". Experientia 33 (2): 151–2. (doi:10.1007 / BF02124034 ) PMID 844529.
- ^ Moro, A. V .; Cardoso, F. S. P .; Correia, C. R. D. Heckova arylace styrenů s arenediazoniovými solemi: krátká, účinná a stereoselektivní syntéza resveratrolu, DMU-212 a analogů. Tetrahedron Lett. 2008, 49(39), 5668–5671.
- ^ Prabhakar Peddikotla, Amar G. Chittiboyina, Ikhlas A. Khan, (2014) ChemInform Abstrakt: Syntéza Pterostilbene od Julie Olefination. ChemInform 45, doi:10,1002 / brada.201408101.
- ^ Alonso DA, Fuensanta M, Nájera C, Varea M. J. Org. Chem. 2005; 70:6404–6416. PMID 16050703.
- ^ A. B. Smith, III a B. M. Brandt. Celková syntéza (-) - kallystatinu A. Org. Lett. 2001, 3, 1685-1688.
- ^ Robiette, R .; Pospíšil, J. O původu selektivity E / Z v modifikované olefinaci Julia: důležitost eliminačního kroku; Eur. J. Org. Chem. 2013, 836-840.
