Molekula - Molecule


A molekula je elektricky neutrální skupina dvou nebo více atomy drží pohromadě chemické vazby.[4][5][6][7][8] Molekuly se odlišují od ionty jejich nedostatkem elektrická nabíječka.
v kvantová fyzika, organická chemie, a biochemie, rozlišení od iontů je zrušeno a molekula se často používá, když se odkazuje na polyatomové ionty.
V kinetická teorie plynů, termín molekula se často používá pro jakékoli plynné částice bez ohledu na jeho složení. To porušuje definici, kterou molekula obsahuje dva nebo více atomy, protože vzácné plyny jsou jednotlivé atomy.[9]
Molekula může být homonukleární, to znamená, že se skládá z atomů jednoho chemický prvek, stejně jako u dvou atomů v kyslík molekula (O.2); nebo může být heteronukleární, a chemická sloučenina složený z více než jednoho prvku, jako u voda (dva atomy vodíku a jeden atom kyslíku; H2Ó).
Atomy a komplexy spojené nekovalentní interakce, jako Vodíkové vazby nebo iontové vazby, se obvykle nepovažují za jednotlivé molekuly.[10]
Molekuly jako složky hmoty jsou běžné. Tvoří také většinu oceánů a atmosféry. Většina organický látky jsou molekuly. Látkami života jsou molekuly, např. bílkoviny, aminokyseliny, z nichž jsou vyrobeny, nukleové kyseliny (DNA a RNA), cukry, sacharidy, tuky a vitamíny. Nutriční minerály obvykle nejsou molekuly, např. síran železitý.
Většina známých pevných látek na Zemi však není vyrobena z molekul. Patří sem všechny minerály, které tvoří podstatu Země, půdu, špínu, písek, jíl, oblázky, skály, balvany, skalní podloží, roztavený interiér a jádro Země. Všechny tyto obsahují mnoho chemických vazeb, ale jsou ne vyrobený z identifikovatelných molekul.
Nelze definovat žádnou typickou molekulu soli ani pro kovalentní krystaly, i když jsou často složeny z opakování jednotkové buňky které sahají buď do a letadlo, např. grafen; nebo trojrozměrně např. diamant, křemen, chlorid sodný. Téma opakované jednotkové buněčné struktury platí také pro většinu kovů, které jsou kondenzovanými fázemi kovové lepení. Pevné kovy tedy nejsou vyrobeny z molekul.
v brýle, což jsou pevné látky, které existují ve sklovitém neuspořádaném stavu, jsou atomy drženy pohromadě chemickými vazbami bez přítomnosti definovatelné molekuly ani s pravidelností opakující se jednotkové buněčné struktury, která charakterizuje soli, kovalentní krystaly a kovy.
Molekulární věda
Věda molekul se nazývá molekulární chemie nebo molekulární fyzika, podle toho, zda se zaměřujeme na chemii nebo fyziku. Molekulární chemie se zabývá zákony upravujícími interakci mezi molekulami, která vede k tvorbě a rozbití chemické vazby, zatímco molekulární fyzika se zabývá zákony upravujícími jejich strukturu a vlastnosti. V praxi je však tento rozdíl nejasný. V molekulárních vědách se molekula skládá ze stabilního systému (vázaný stav ) složený ze dvou nebo více atomy. Polyatomové ionty mohou být někdy užitečně považovány za elektricky nabité molekuly. Termín nestabilní molekula se používá pro velmi reaktivní druhy, tj. krátkodobá shromáždění (rezonance ) elektronů a jádra, jako radikály, molekulární ionty, Rydbergovy molekuly, přechodové stavy, van der Waalsovy komplexy nebo systémy srážejících se atomů jako v Kondenzát Bose – Einstein.
Historie a etymologie
Podle Merriam-Webster a Online slovník etymologie, slovo „molekula“ pochází z latinský "krtci "nebo malá jednotka hmotnosti.
- Molekula (1794) - „extrémně nepatrná částice“, z francouzštiny molekula (1678), z Nová latina molecula, zdrobnělina latiny krtci "hmotnost, bariéra". Nejasný význam zpočátku; móda pro slovo (používaná až do konce 18. století pouze v latinské podobě) lze vysledovat až k filozofii Descartes.[11][12]
Definice molekuly se vyvinula se zvyšující se znalostí struktury molekul. Dřívější definice byly méně přesné a definovaly molekuly jako nejmenší částice čistého chemické substance které si stále zachovávají své složení a chemické vlastnosti.[13] Tato definice se často rozpadá, protože mnoho látek v běžné praxi, jako např skály, soli, a kovy, jsou složeny z velkých krystalických sítí chemicky vázané atomy nebo ionty, ale nejsou vyrobeny z diskrétních molekul.
Lepení
Molekuly jsou drženy pohromadě oběma kovalentní vazba nebo iontová vazba. Několik typů nekovových prvků existuje v prostředí pouze jako molekula. Například vodík existuje pouze jako molekula vodíku. Molekula sloučeniny je složena ze dvou nebo více prvků.[14]
Kovalentní
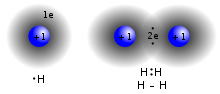
Kovalentní vazba je a chemická vazba to zahrnuje sdílení elektronové páry mezi atomy. Tyto elektronové páry se nazývají sdílené páry nebo lepení párůa je označována stabilní rovnováha atraktivních a odpudivých sil mezi atomy, když sdílejí elektrony kovalentní vazba.[15]
Iontový
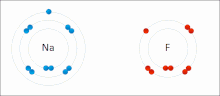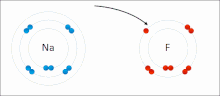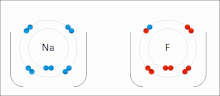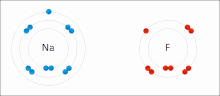
Iontové vazby jsou typem chemická vazba který zahrnuje elektrostatický přitažlivost mezi opačně nabitými ionty, a je primární interakcí vyskytující se v iontové sloučeniny. Ionty jsou atomy, které ztratily jeden nebo více elektrony (nazývané kationty ) a atomy, které získaly jeden nebo více elektronů (tzv anionty ).[16] Tento přenos elektronů se nazývá elektroventence na rozdíl od kovalence. V nejjednodušším případě je kation kov atom a anion je a nekovový atom, ale tyto ionty mohou mít složitější povahu, např. molekulární ionty jako NH4+ nebo tak42−.
Molekulární velikost
Většina molekul je příliš malá na to, aby je bylo možné vidět pouhým okem, i když molekul mnoha polymery může dosáhnout makroskopické velikosti, včetně biopolymery jako DNA. Molekuly běžně používané jako stavební kameny pro organickou syntézu mají rozměr několika angstromy (Å) na několik desítek Å neboli zhruba miliardtinu metru. Jednotlivé molekuly obvykle nelze pozorovat světlo (jak je uvedeno výše), ale malé molekuly a dokonce i obrysy jednotlivých atomů lze za určitých okolností vysledovat pomocí mikroskop atomové síly. Některé z největších molekul jsou makromolekuly nebo supermolekuly.
Nejmenší molekula je křemelina vodík (H2), s délkou vazby 0,74 Å.[17]
Efektivní poloměr molekuly je velikost, kterou molekula zobrazuje v roztoku.[18][19]The tabulka permselektivity pro různé látky obsahuje příklady.
Molekulární vzorce
Typy chemických vzorců
The chemický vzorec pro molekulu používá jeden řádek chemický prvek symboly, čísla a někdy i další symboly, například závorky, pomlčky, závorky a Plus (+) a mínus (-) znaky. Ty jsou omezeny na jednu typografickou řadu symbolů, která může zahrnovat dolní a horní indexy.
Sloučenina empirický vzorec je velmi jednoduchý typ chemického vzorce.[20] Je to nejjednodušší celé číslo poměr z chemické prvky které to tvoří.[21] Například voda se vždy skládá z poměru 2: 1 vodík na kyslík atomy a ethanol (ethylalkohol) se vždy skládá z uhlík, vodík, a kyslík v poměru 2: 6: 1. To však neurčuje jednoznačně druh molekuly - dimethylether má stejné poměry jako například ethanol. Molekuly se stejnými atomy jsou volána různá uspořádání izomery. Také například sacharidy mají stejný poměr (uhlík: vodík: kyslík = 1: 2: 1) (a tedy stejný empirický vzorec), ale odlišný celkový počet atomů v molekule.
The molekulární vzorec odráží přesný počet atomů, které tvoří molekulu, a tak charakterizuje různé molekuly. Různé izomery však mohou mít stejné atomové složení, přičemž se jedná o různé molekuly.
Empirický vzorec je často stejný jako molekulární vzorec, ale ne vždy. Například molekula acetylén má molekulární vzorec C2H2, ale nejjednodušší celočíselný poměr prvků je CH.
The molekulová hmotnost lze vypočítat z chemický vzorec a je vyjádřen konvenčně atomové hmotnostní jednotky rovnající se 1/12 hmotnosti neutrálního uhlíku-12 (12C izotop ) atom. Pro pevné látky v síti, termín vzorec jednotka se používá v stechiometrický výpočty.
Strukturní vzorec
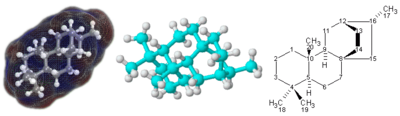
Pro molekuly se složitou trojrozměrnou strukturou, zejména s atomy vázanými na čtyři různé substituenty, jednoduchý molekulární vzorec nebo dokonce semistrukturální chemický vzorec nemusí stačit k úplnému určení molekuly. V tomto případě grafický typ vzorce zvaný a strukturní vzorec může být potřeba. Strukturní vzorce mohou být zase reprezentovány jednorozměrným chemickým názvem, ale takovým chemická nomenklatura vyžaduje mnoho slov a výrazů, které nejsou součástí chemických vzorců.
Molekulární geometrie
Molekuly byly opraveny rovnováha geometrie - délky a úhly vazeb - o nichž neustále kmitají prostřednictvím vibračních a rotačních pohybů. Čistá látka se skládá z molekul se stejnou průměrnou geometrickou strukturou. Chemický vzorec a struktura molekuly jsou dva důležité faktory, které určují její vlastnosti, zejména její reaktivita. Izomery sdílejí chemický vzorec, ale obvykle mají velmi odlišné vlastnosti, protože mají různé struktury. Stereoizomery, určitý typ izomeru, může mít velmi podobné fyzikálně-chemické vlastnosti a zároveň odlišné biochemické činnosti.
Molekulární spektroskopie
Molekulární spektroskopie se zabývá odpovědí (spektrum ) molekul interagujících se známými snímacími signály energie (nebo frekvence, podle Planckův vzorec ). Molekuly kvantovaly energetické hladiny, které lze analyzovat detekcí energetické výměny molekuly absorbance nebo emise.[24]Spektroskopie obecně neodkazuje difrakce studie, kde částice jako neutrony, elektrony nebo vysoká energie Rentgenové záření interagují s pravidelným uspořádáním molekul (jako v krystalu).
Mikrovlnná spektroskopie běžně měří změny v rotaci molekul a lze je použít k identifikaci molekul ve vesmíru. Infračervená spektroskopie měří vibrace molekul, včetně protahování, ohýbání nebo kroucení. Běžně se používá k identifikaci druhů vazeb nebo funkční skupiny v molekulách. Změny v uspořádání elektronů poskytují absorpční nebo emisní čáry v ultrafialovém, viditelném nebo blízko infračerveného světlo a výsledkem je barva. Spektroskopie nukleární rezonance měří prostředí konkrétních jader v molekule a lze ji použít k charakterizaci počtu atomů v různých pozicích v molekule.
Teoretické aspekty
Studium molekul metodou molekulární fyzika a teoretická chemie je do značné míry založen na kvantová mechanika a je nezbytný pro pochopení chemická vazba. Nejjednodušší z molekul je iont molekuly vodíku, H2+a nejjednodušší ze všech chemických vazeb je jedno-elektronová vazba. H2+ se skládá ze dvou kladně nabitých protony a jeden záporně nabitý elektron, což znamená, že Schrödingerova rovnice protože systém lze vyřešit snadněji kvůli nedostatku odpuzování elektronů elektrony. S vývojem rychlých digitálních počítačů se stala možná přibližná řešení pro složitější molekuly a jsou jedním z hlavních aspektů výpočetní chemie.
Když se snažíme přesně definovat, zda uspořádání atomů je dostatečně stabilní být považován za molekulu, IUPAC naznačuje, že "musí odpovídat depresi na povrch potenciální energie to je dostatečně hluboké, aby omezilo alespoň jeden vibrační stav “.[4] Tato definice nezávisí na povaze interakce mezi atomy, ale pouze na síle interakce. Ve skutečnosti zahrnuje slabě vázané druhy, které by tradičně nebyly považovány za molekuly, jako například hélium dimer, On2, který má jednu vibrační vázaný stav[25] a je tak volně vázán, že je pravděpodobné, že bude pozorován pouze při velmi nízkých teplotách.
Zda uspořádání atomů je či není dostatečně stabilní považovat za molekulu je neodmyslitelně provozní definice. Filozoficky tedy molekula není základní entitou (na rozdíl například od elementární částice ); koncept molekuly je spíše chemickým způsobem, jak učinit užitečné prohlášení o síle interakcí v atomovém měřítku ve světě, které pozorujeme.
Viz také
- Atom
- Chemická polarita
- Kovalentní vazba
- Diatomická molekula
- Seznam sloučenin
- Seznam mezihvězdných a okolních molekul
- Molekulární biologie
- Software pro molekulární design
- Molekulární inženýrství
- Molekulární geometrie
- Molekulární Hamiltonian
- Molekulární ion
- Molekulární modelování
- Molekulární promiskuita
- Molekulární orbitální
- Nekovalentní vazba
- Periodické systémy malých molekul
- Malá molekula
- Srovnání softwaru pro modelování molekulární mechaniky
- Van der Waalsova molekula
- Celosvětová molekulární matice
Reference
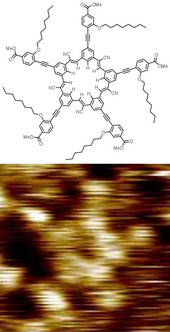
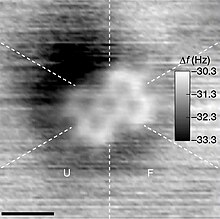
- ^ Iwata, Kota; Yamazaki, Shiro; Mutombo, Pingo; Hapala, Prokop; Ondráček, Martin; Jelínek, Pavel; Sugimoto, Yoshiaki (2015). "Chemická struktura zobrazování jedné molekuly mikroskopem atomové síly při pokojové teplotě". Příroda komunikace. 6: 7766. Bibcode:2015NatCo ... 6.7766I. doi:10.1038 / ncomms8766. PMC 4518281. PMID 26178193.
- ^ Dinca, L.E .; De Marchi, F .; MacLeod, J.M .; Lipton-Duffin, J .; Gatti, R .; Ma, D .; Perepichka, D.F.; Rosei, F. (2015). „Pentacen na Ni (111): Molekulární náplň při pokojové teplotě a teplotně aktivovaná přeměna na grafen“. Nanoměřítko. 7 (7): 3263–9. Bibcode:2015Nanos ... 7.3263D. doi:10.1039 / C4NR07057G. PMID 25619890.
- ^ Hapala, Prokop; Švec, Martin; Stetsovych, Oleksandr; Van Der Heijden, Nadine J .; Ondráček, Martin; Van Der Lit, Joost; Mutombo, Pingo; Swart, Ingmar; Jelínek, Pavel (2016). „Mapování elektrostatického silového pole jednotlivých molekul ze snímků skenovací sondy s vysokým rozlišením“. Příroda komunikace. 7: 11560. Bibcode:2016NatCo ... 711560H. doi:10.1038 / ncomms11560. PMC 4894979. PMID 27230940.
- ^ A b IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “Molekula ". doi:10.1351 / zlatá kniha.M04002
- ^ Ebbin, Darrell D. (1990). Obecná chemie (3. vyd.). Boston: Houghton Mifflin Co. ISBN 978-0-395-43302-7.
- ^ Brown, T.L .; Kenneth C. Kemp; Theodore L. Brown; Harold Eugene LeMay; Bruce Edward Bursten (2003). Chemie - ústřední věda (9. vydání). New Jersey: Prentice Hall. ISBN 978-0-13-066997-1.
- ^ Chang, Raymond (1998). Chemie (6. vydání). New York: McGraw Hill. ISBN 978-0-07-115221-1.
- ^ Zumdahl, Steven S. (1997). Chemie (4. vydání). Boston: Houghton Mifflin. ISBN 978-0-669-41794-4.
- ^ Chandra, Sulekh (2005). Komplexní anorganická chemie. Vydavatelé New Age. ISBN 978-81-224-1512-4.
- ^ "Molekula". Encyklopedie Britannica. 22. ledna 2016. Citováno 23. února 2016.
- ^ Harper, Douglas. "molekula". Online slovník etymologie. Citováno 22. února 2016.
- ^ "molekula". Merriam-Webster. Citováno 22. února 2016.
- ^ Definice molekuly Archivováno 13. října 2014 v Wayback Machine (Frostburgská státní univerzita )
- ^ Hutchinsonova nezkrácená encyklopedie s atlasem a meteorologickým průvodcem. Oxford, Anglie. OCLC 696918830.
- ^ Campbell, Neil A .; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston: Pearson Prentice Hall. ISBN 978-0-13-250882-7. Citováno 5. února 2012.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Campbell, Flake C. (2008). Prvky metalurgie a strojírenských slitin. ASM International. ISBN 978-1-61503-058-3.
- ^ Roger L. DeKock; Harry B. Gray; Harry B. Gray (1989). Chemická struktura a vazba. University Science Books. p. 199. ISBN 978-0-935702-61-3.
- ^ Chang RL; Deen WM; Robertson CR; Brenner BM (1975). „Permselektivita glomerulární kapilární stěny: III. Omezený transport polyanionů“. Kidney Int. 8 (4): 212–218. doi:10.1038 / ki.1975.104. PMID 1202253.
- ^ Chang RL; Ueki IF; Troy JL; Deen WM; Robertson CR; Brenner BM (1975). „Permselektivita stěny glomerulární kapiláry na makromolekuly. II. Experimentální studie na krysách s použitím neutrálního dextranu“. Biophys. J. 15 (9): 887–906. Bibcode:1975BpJ .... 15..887C. doi:10.1016 / S0006-3495 (75) 85863-2. PMC 1334749. PMID 1182263.
- ^ Wink, Donald J .; Fetzer-Gislason, Sharon; McNicholas, Sheila (2003). Praxe chemie. Macmillana. ISBN 978-0-7167-4871-7.
- ^ "ChemTeam: Empirický vzorec". www.chemteam.info. Citováno 16. dubna 2017.
- ^ Hirsch, Brandon E .; Lee, Semin; Qiao, Bo; Chen, Chun-Hsing; McDonald, Kevin P .; Tait, Steven L .; Flood, Amar H. (2014). „Anionty indukovaná dimerizace pětinásobných symetrických cyanostarů ve 3D krystalických pevných látkách a 2D samostatně sestavených krystalech“. Chemická komunikace. 50 (69): 9827–30. doi:10.1039 / C4CC03725A. PMID 25080328.
- ^ Zoldan, V. C .; Faccio, R; Pasa, A.A. (2015). "Charakter typu N a p jednotlivých molekul diod". Vědecké zprávy. 5: 8350. Bibcode:2015NatSR ... 5E8350Z. doi:10.1038 / srep08350. PMC 4322354. PMID 25666850.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “Spektroskopie ". doi:10.1351 / goldbook.S05848
- ^ Anderson JB (květen 2004). „Komentář k„ Přesnému kvantovému výpočtu Monte Carla mezimolekulárního potenciálu helium-helium “[J. Chem. Phys. 115, 4546 (2001)]“ “. J Chem Phys. 120 (20): 9886–7. Bibcode:2004JChPh.120.9886A. doi:10.1063/1.1704638. PMID 15268005.