Buckminsterfullerene - Buckminsterfullerene
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC (C60-Jáh) [5,6] fulleren | |||
| Ostatní jména Buckyballs; Fulleren-C60; [60] fulleren | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 5901022 | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.156.884 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C60 | |||
| Molární hmotnost | 720.660 g · mol−1 | ||
| Vzhled | Tmavé jehlicovité krystaly | ||
| Hustota | 1,65 g / cm3 | ||
| nerozpustný ve vodě | |||
| Tlak páry | 0,4-0,5 Pa (T ≈ 800 K); 14 Pa (T ≈ 900 K) [1] | ||
| Struktura | |||
| Obličej centrovaný cF1924 | |||
| Fm3m, č. 225 | |||
A = 1,4154 nm | |||
| Nebezpečí | |||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Varování | ||
| H315, H319, H335 | |||
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
| Část série článků o |
| Nanomateriály |
|---|
 |
| Uhlíkové nanotrubice |
| Fullereny |
| jiný nanočástice |
| Nanostrukturované materiály |
|
Buckminsterfullerene je typ fulleren se vzorcem C.60. Má strukturu taveného prstence podobnou kleci (zkrácený dvacetistěn ), který se podobá a fotbalový míč, vyrobeno z dvaceti šestiúhelníky a dvanáct pětiúhelníky. Každý uhlík atom má tři vazby. Je to černá pevná látka, která se rozpouští v uhlovodíkových rozpouštědlech za vzniku fialového roztoku. Sloučenina prošla intenzivním studiem, ačkoli bylo nalezeno jen málo aplikací v reálném světě.
Výskyt
Buckminsterfullerene je nejběžnější přirozeně se vyskytující fulleren. Najdete jej v malém množství v saze.[2][3] Molekula také byla detekován v hlubokém vesmíru.[4] V dubnu 2019 vědci ve spolupráci s Hubbleův vesmírný dalekohled uvádí potvrzenou detekci velkých a složitých ionizovaných molekul buckminsterfullerenu (C.60) v mezihvězdné střední prostory mezi hvězdy.[5][6]
Dějiny

Teoretické předpovědi molekul buckyball se objevily koncem šedesátých a začátku sedmdesátých let,[7][8][9] ale tyto zprávy zůstaly do značné míry bez povšimnutí. Buckminsterfullerene byl poprvé vytvořen v roce 1984 Ericem Rohlfingem, Donaldem Coxem a Andrewem Kaldorem[10][11] pomocí laseru k odpařování uhlíku v nadzvukovém paprsku helia. V roce 1985 byla jejich práce opakována Harold Kroto, James R. Heath Sean O'Brien, Robert Curl, a Richard Smalley na Rice University, který poznal strukturu C.60 jako buckminsterfullerene.[12] Kroto, Curl a Smalley byli oceněni v roce 1996 Nobelova cena za chemii za jejich role při objevu buckminsterfullerenu a příbuzné třídy molekul, fullereny.
Souběžně, ale nesouvisí s prací Kroto-Smalleye, astrofyzici pracovali se spektroskopem na studiu infračervených emisí obrovských červených uhlíkových hvězd.[13][14][15] Smalley a tým dokázali pomocí techniky laserové vaporizace vytvořit uhlíkové klastry, které by mohly potenciálně emitovat infračervené záření na stejné vlnové délce, jakou vyzařovala červená uhlíková hvězda.[13][16] Inspiraci proto dostal Smalley a tým k použití laserové techniky na grafitu ke generování fullerenů.
C60 objevili v roce 1985 Robert Curl, Harold Kroto a Richard Smalley. Použitím laser vypařování z grafit našli C.n shluky (kde n> 20 a sudé), z nichž nejběžnější byly C60 a C.70. Jako povrch, ze kterého se pomocí laserového paprsku odpařoval uhlík, se použil pevný rotující grafitový disk, který vytvářel horkou plazmu, která pak prošla proudem plynného helia o vysoké hustotě.[17] Uhlík druh byly následně ochlazeny a ionizovány, což mělo za následek tvorbu shluků. Klastry se pohybovaly v molekulárních hmotnostech, ale Kroto a Smalley našli převahu v C60 shluk, který lze dále vylepšit tím, že necháme plazmu reagovat déle. Také zjistili, že C60 molekula vytvořila strukturu podobnou kleci, pravidelnou zkrácený dvacetistěn.[13][17]
Za tento objev byli Curl, Kroto a Smalley oceněni v roce 1996 Nobelova cena za chemii.[7]
Experimentální důkazy, silný vrchol na 720 atomové hmotnostní jednotky, naznačil, že se tvoří molekula uhlíku se 60 atomy uhlíku, ale neposkytl žádné strukturální informace. Výzkumná skupina dospěla po experimentech s reaktivitou k závěru, že nejpravděpodobnější strukturou byla sféroidní molekula. Myšlenka byla rychle racionalizována jako základ icosahedral symetrie uzavřená konstrukce klece. Kroto zmínil geodetické kupolovité struktury významného futuristy a vynálezce Buckminster Fuller jako vlivy při pojmenování této konkrétní látky jako buckminsterfullerene.[7]
V roce 1989 fyzici Wolfgang Krätschmer, Konstantinos Fostiropoulos, a Donald R. Huffman pozorovány neobvyklé optické absorpce v tenkých vrstvách uhlíkového prachu (sazí). Saze byly generovány obloukem mezi dvěma grafity elektrody v heliové atmosféře, kde se elektrodový materiál odpařuje a kondenzuje za tvorby sazí v kalicí atmosféře. IR spektra sazí mimo jiné vykazovala čtyři diskrétní pásma v těsné shodě s těmi, která byla navržena pro C60.[18][19]
Další práce na charakterizaci a ověření molekulární struktury navázala ve stejném roce (1990) na jejich tenkovrstvé experimenty a podrobně popisovala také extrakci odpařitelného a benzen rozpustný materiál ze sazí generovaných obloukem. Tento výpis měl TEM a rentgen krystalická analýza shodná s poli sférického C60 molekuly, přibližně 1,0 nm průměr van der Waals[20] stejně jako očekávaná molekulová hmotnost 720 u pro C60 (a 840 u pro C.70) v jejich hmotnostní spektra.[21] Metoda byla jednoduchá a efektivní při přípravě materiálu v gramových množstvích za den (1990), což podpořilo fullerenový výzkum a dodnes se používá pro komerční výrobu fullerenů.
Objev praktických cest do C60 vedlo k prozkoumání nové oblasti chemie zahrnující studium fullerenů.
Etymologie
Objevitelé alotropu pojmenovali nově nalezenou molekulu Buckminster Fuller, kteří navrhli mnoho geodetická kupole struktury, které vypadají podobně jako C.60 a kteří zemřeli v předchozím roce v roce 1983 před objevem v roce 1984. To je však mírně zavádějící, protože Fullerovy geodetické dómy jsou konstruovány pouze dalším rozdělením šestiúhelníků nebo pětiúhelníků na trojúhelníky, které se pak deformují pohybem vrcholů radiálně směrem ven, aby se vešly na povrch koule.[22] Geometricky vzato je buckminsterfullerene přirozeně se vyskytujícím příkladem a Goldbergův mnohostěn. Obyčejný, zkrácený název pro buckminsterfullerene je „buckyballs“.[23]
Syntéza

Saze se vyrábějí laserovou ablací grafitu nebo pyrolýza z aromatické uhlovodíky. Fullereny se ze sazí extrahují organickými rozpouštědly za použití a Soxhletův extraktor.[24] Tímto krokem se získá roztok obsahující až 75% C60, stejně jako další fullereny. Tyto frakce se oddělí za použití chromatografie.[25] Obecně se fullereny rozpustí v uhlovodíku nebo halogenovaném uhlovodíku a oddělí se pomocí kolon z oxidu hlinitého.[26]
Struktura
Buckminsterfullerene je zkrácený dvacetistěn s 60 vrcholy a 32 ploch (20 šestiúhelníků a 12 pětiúhelníků, kde žádný pětiúhelník nesdílí vrchol) s atomem uhlíku na vrcholech každého polygonu a vazbou podél každého okraje polygonu. The průměr van der Waals a C
60 molekula je asi 1,01nanometry (nm). Průměr jádra k jádru a C
60 molekula je asi 0,71 nm. The C
60 molekula má dvě délky vazby. Lze považovat kruhové vazby 6: 6 (mezi dvěma šestiúhelníky) "dvojné vazby "a jsou kratší než vazby 6: 5 (mezi šestiúhelníkem a pětiúhelníkem). Jeho průměrná délka vazby je 0,14 nm. Každý atom uhlíku ve struktuře je vázán kovalentně se 3 dalšími.[27]

Vlastnosti
Buckminsterfullerene je největší pozorovaný objekt dualita vln-částic; teoreticky každý objekt vykazuje toto chování.[28]
Sloučenina je stabilní,[29] vydrží vysoké teploty a vysoké tlaky.
C
60 prochází šesti reverzibilními redukcemi s jedním elektronem na C6−
60, ale oxidace je nevratný. První redukce vyžaduje ≈1,0PROTI (Fc /Fc+
), což ukazuje, že C60 je středně účinný akceptor elektronů. C
60 má tendenci vyhnout se dvojitým vazbám v pětiúhelníkových prstencích, které tvoří elektron delokalizace špatný a má za následek C
60 nebýt “superaromatické ". C.60 chová se velmi podobně jako nedostatek elektronů alken a snadno reaguje s druhy bohatými na elektrony.[20]
Atom uhlíku v C
60 molekula může být substituována atomem dusíku nebo boru za vzniku a C
59N nebo C.59B, resp.[30]
| Na střed | Vrchol | Okraj 5–6 | Okraj 6–6 | Tvář Šestiúhelník | Tvář Pentagon |
|---|---|---|---|---|---|
| obraz |  |  |  |  |  |
| Projektivní symetrie | [2] | [2] | [2] | [6] | [10] |
Řešení

| Solventní | Rozpustnost (g / l) |
|---|---|
| 1-chlornaftalen | 51 |
| 1-methylnaftalen | 33 |
| 1,2-dichlorbenzen | 24 |
| 1,2,4-trimethylbenzen | 18 |
| tetrahydronaftalen | 16 |
| sirouhlík | 8 |
| 1,2,3-tribrompropan | 8 |
| xylen | 5 |
| bromoform | 5 |
| kumen | 4 |
| toluen | 3 |
| benzen | 1.5 |
| chlorid uhličitý | 0.447 |
| chloroform | 0.25 |
| n-hexan | 0.046 |
| cyklohexan | 0.035 |
| tetrahydrofuran | 0.006 |
| acetonitril | 0.004 |
| methanolu | 0.00004 |
| voda | 1.3 × 10−11 |
| pentan | 0.004 |
| oktan | 0.025 |
| isooktan | 0.026 |
| dekan | 0.070 |
| dodekan | 0.091 |
| tetradekan | 0.126 |
| dioxan | 0.0041 |
| mesitylen | 0.997 |
| dichlormethan | 0.254 |
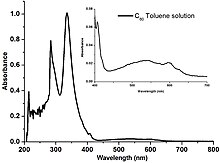
60 roztok, vykazující sníženou absorpci modrého (~ 450 nm) a červeného (~ 700 nm) světla, což vede k fialové barvě.
Fullereny jsou těžce rozpustné v aromatických látkách rozpouštědla jako toluen a sirouhlík, ale nerozpustný ve vodě. Řešení čistého C.60 mají tmavě fialovou barvu, která po odpaření zanechává hnědý zbytek. Důvodem této změny barvy je relativně úzká energetická šířka pásma molekulárních úrovní odpovědných za absorpci zeleného světla jednotlivým C60 molekuly. Jednotlivé molekuly tedy přenášejí určité modré a červené světlo, což vede k fialové barvě. Po vysušení vede intermolekulární interakce k překrytí a rozšíření energetických pásem, čímž se eliminuje propustnost modrého světla a způsobí se změna fialové až hnědé barvy.[34]
C
60 krystalizuje s některými rozpouštědly v mřížce („solváty“). Například krystalizace C60 v benzen Roztok poskytuje triclinické krystaly vzorce C60· 4C6H6. Stejně jako ostatní solváty, i tento snadno uvolňuje benzen za vzniku obvyklého fcc C60. Krystaly C o velikosti milimetru60 a C
70 lze pěstovat z roztoku jak pro solváty, tak pro čisté fullereny.[35][36]
Pevný


60 Krystalická struktura
V pevné buckminsterfullerene, C60 molekuly přijímají fcc (kubický střed ) motiv. Začínají se otáčet asi při -20 ° C. Tato změna je spojena s fázovým přechodem prvního řádu na strukturu fcc a malým, ale náhlým zvýšením mřížkové konstanty z 1,411 na 1,4154 nm.[37]
C
60 pevná látka je měkká jako grafit, ale při komprimaci na méně než 70% svého objemu se transformuje na a superhard druh diamant (vidět agregovaný diamantový nanorod ). C
60 filmy a roztoky mají silné nelineární optické vlastnosti; zejména jejich optická absorpce se zvyšuje s intenzitou světla (saturovatelná absorpce).
C
60 tvoří nahnědlou pevnou látku s prahem optické absorpce při ≈1,6 eV.[38] Je to n -typ polovodič s nízkou aktivační energií 0,1–0,3 eV; tato vodivost se připisuje vnitřním vadám nebo vadám souvisejícím s kyslíkem.[39] Fcc C.60 obsahuje mezery na svých oktaedrických a čtyřstěnných místech, které jsou dostatečně velké (0,6 resp. 0,2 nm), aby pojaly atomy nečistot. Když jsou alkalické kovy dopovaný do těchto prázdnot, C60 převádí z polovodiče na vodič nebo dokonce supravodič.[37][40]
Chemické reakce a vlastnosti
Hydrogenace
C60 vykazuje malý stupeň aromatického charakteru, ale stále odráží lokalizované znaky dvojných a jednoduchých vazeb C – C. Proto C.60 může podstoupit přidání s vodíkem za vzniku polyhydrofullerenů. C60 také prochází Snížení břízy. Například C60 reaguje s lithiem v kapalném amoniaku a poté tert-butanol za vzniku směsi polyhydrofullerenů, jako je C60H18, C.60H32, C.60H36, s C.60H32 být dominujícím produktem. Tato směs polyhydrofullerenů může být znovu oxidována 2,3-dichlor-5,6-dikyano-l, 4-benzochinon dát C.60 znovu.
Existuje metoda selektivní hydrogenace. Reakce C.60 s 9,9 ', 10,10'-dihydroanthracenem za stejných podmínek, v závislosti na době reakce, dává C60H32 a C.60H18 respektive a selektivně.[41]
C60 lze hydrogenovat,[42] což naznačuje, že modifikovaný buckminsterfulleren zvaný organokovové buckyballs (OBB) by se mohl stát prostředkem pro „vysokou hustotu, pokojovou teplotu, tlak okolí skladování vodíku ". Tyto OBB jsou vytvořeny vazbou atomů a přechodový kov (TM) do C.60 nebo C.48B12 a poté na tento atom TM navázat mnoho atomů vodíku a rovnoměrně je rozptýlit po celém vnitřku organokovové buckyball. Studie zjistila, že teoretické množství H2 které lze získat z OBB na okolní tlak přístupy 9hm.%, hmotnostní zlomek, který byl označen jako optimální pro vodíkové palivo Americké ministerstvo energetiky.
Halogenace
Přidání fluor, chlór, a bróm vyskytuje se pro C.60.
Atomy fluoru jsou dostatečně malé na přidání 1,2, zatímco Cl2 a Br2 přidat ke vzdáleným atomům C kvůli sterické faktory. Například v C60Br8 a C.60Br24, atomy Br jsou navzájem v polohách 1,3- nebo 1,4-.
Za různých podmínek obrovské množství halogenovaných derivátů C60 mohou být vyrobeny, některé s mimořádnou selektivitou na jeden nebo dva izomery nad ostatními možnými.
Přidání fluoru a chloru obvykle vede ke zploštění C60 kostra do molekuly ve tvaru bubnu.[41]
Přidání atomů kyslíku
Řešení C.60 lze okysličit na epoxid C60O. Ozonace C.60 v 1,2-xylenu při 257 K poskytuje meziprodukt ozonid C60Ó3, které lze rozložit na 2 formy C.60O. Rozklad C.60Ó3 při 296 K dává epoxid, ale fotolýza dává produkt, ve kterém atom O přemostí 5,6-hranu.[41]

Cykloadice
The Diels-Alderova reakce se běžně používá k funkcionalizaci C60. Reakce C.60 s vhodným substituovaným dienem poskytuje odpovídající adukt.
Diels-Alderova reakce mezi C.60 a 3,6-diaryl-l, 2,4,5-tetraziny poskytuje C62. C.62 má strukturu, ve které je čtyřčlenný kruh obklopen čtyřmi šestičlennými kruhy.

C.60 molekuly lze také spojit pomocí [2 + 2] cykloadice, čímž se získá sloučenina ve tvaru činky C.120. Spojky je dosaženo vysokorychlostním vibračním frézováním C60 s katalytickým množstvím KCN. Reakce je reverzibilní jako C120 disociuje zpět na dva C.60 molekuly při zahřátí na 450 K (177 ° C; 350 ° F). Za vysokého tlaku a teploty se opakovala [2 + 2] cykloadice mezi C60 vede k polymerizovaným fullerenovým řetězcům a sítím. Tyto polymery zůstávají stabilní při okolním tlaku a teplotě, jakmile se vytvoří, a mají pozoruhodně zajímavé elektronické a magnetické vlastnosti, jako jsou feromagnetický nad pokojovou teplotu.[41]
Reakce volných radikálů
Reakce C.60 s volné radikály snadno nastat. Když C.60 je smíchán s disulfidovým RSSR, radikálem C.60SR • se vytváří spontánně po ozáření směsi.
Stabilita radikálních druhů C60Y• záleží do značné míry na sterické faktory z Y. Kdy tert-butylhalogenid se fotolyzuje a nechá reagovat s C60, vzniká reverzibilní meziklecová vazba C – C:[41]

Cyklopropanace (Bingelova reakce)
Cyklopropanace ( Bingelova reakce ) je další běžná metoda pro funkcionalizaci C.60. Cyklopropanace C.60 většinou se vyskytuje na křižovatce 2 šestiúhelníků kvůli sterickým faktorům.
První cyklopropanace byla provedena zpracováním p-bromomalonátu s C60 v přítomnosti základny. K cyklopropanaci také snadno dochází diazomethany. Například difenyldiazomethan snadno reaguje s C.60 čímž se získá sloučenina C61Ph2.[41] Fenyl-C61methylester kyseliny máselné derivát připravený cyklopropanací byl studován pro použití v organické solární články.
Redoxní reakce - C.60 anionty a kationty
C60 anionty
The LUMO v C.60 je trojnásobně zdegenerovaný, s HOMO –LUMO separace relativně malá. Tato malá mezera naznačuje, že snížení C60 by mělo nastat při mírných potenciálech vedoucích k fulleridovým aniontům, [C.60]n− (n = 1–6). Potenciál středního bodu redukce 1-elektronu buckminsterfullerenu a jeho aniontů je uveden v následující tabulce:
| Redukční potenciál C.60 při 213 K. | |
|---|---|
| Poloviční reakce | E° (V) |
| C60 + e− ⇌ C− 60 | −0.169 |
| C− 60 + e− ⇌ C2− 60 | −0.599 |
| C2− 60 + e− ⇌ C3− 60 | −1.129 |
| C3− 60 + e− ⇌ C4− 60 | −1.579 |
| C4− 60 + e− ⇌ C5− 60 | −2.069 |
| C5− 60 + e− ⇌ C6− 60 | −2.479 |
C60 tvoří různé komplexy přenosu náboje, například s tetrakis (dimethylamino) ethylen:
- C60 + C.2(NMe2)4 → [C.2(NMe2)4]+[C60]−
Tato sůl vykazuje feromagnetismus při 16 K.
C60 kationty
C60 obtížně oxiduje. Při použití byly pozorovány tři reverzibilní oxidační procesy cyklická voltametrie s ultra suchým methylenchlorid a podpůrný elektrolyt s extrémně vysokou oxidační odolností a nízkou nukleofilitou, jako je [nBu4N] [AsF6].[41]
| Redukční potenciály C60 oxidace při nízkých teplotách | |
|---|---|
| Poloviční reakce | E° (V) |
| C60 ⇌ C+ 60 | +1.27 |
| C+ 60 ⇌ C2+ 60 | +1.71 |
| C2+ 60 ⇌ C3+ 60 | +2.14 |
Kovové komplexy
C60 tvoří komplexy podobné běžnějším alkenům. Byly hlášeny komplexy molybden, wolfram, Platina, palladium, iridium, a titan. Druhy pentacarbonyl jsou produkovány fotochemické reakce.
- M (CO)6 + C.60 → M (η2-C60) (CO)5 + CO (M = Mo, W)
V případě platinového komplexu je labilní ethylenový ligand odstupující skupinou v tepelné reakci:
- Pt (η2-C2H4) (PPh3)2 + C.60 → Pt (η2-C60) (PPh3)2 + C.2H4
Titanocen komplexy byly také hlášeny:
- (η5-Str )2Ti (η2- (CH3)3SiC≡CSi (CH3)3) + C.60 → (η5-Cp)2Ti (η2-C60) + (CH3)3SiC≡CSi (CH3)3
Koordinačně nenasycené prekurzory, jako např Vaskův komplex, pro adukty s C.60:
- trans-Ir (CO) Cl (PPh3)2 + C.60 → Ir (CO) Cl (η2-C60) (PPh3)2
Jeden takový iridiový komplex, [Ir (η2-C60) (CO) Cl (Ph2CH2C6H4OCH2Ph)2] byl připraven tam, kde kovové centrum promítá dvě elektrony bohaté „paže“, které objímají C.60 host.[43]
Endohedrální fullereny
Atomy kovů nebo určité malé molekuly, jako je H2 a vzácný plyn může být zapouzdřen uvnitř C60 klec. Tyto endohedrální fullereny se obvykle syntetizují dopováním atomů kovů v obloukovém reaktoru nebo odpařováním laserem. Tyto metody poskytují nízké výtěžky endohedrálních fullerenů a lepší metoda zahrnuje otevření klece, zabalení atomů nebo molekul a uzavření otvoru pomocí určitých organické reakce. Tato metoda je však stále nezralá a tímto způsobem bylo syntetizováno pouze několik druhů.[44]
Endohedrální fullereny vykazují odlišné a zajímavé chemické vlastnosti, které se mohou zcela lišit od zapouzdřeného atomu nebo molekuly i samotného fullerenu. Bylo prokázáno, že zapouzdřené atomy provádějí uvnitř C kruhové pohyby60 klec a po jejím pohybu následovalo použití NMR spektroskopie.[43]
Aplikace
V lékařské oblasti jsou to prvky jako hélium (které lze detekovat v malém množství) lze použít jako chemické stopovací látky v impregnovaných buckyballs.
Ve vodě rozpustné deriváty C.60 Bylo zjištěno, že inhibují tři izoformy syntáza oxidu dusnatého, s mírně odlišnými potencemi.[45]
Optické absorpční vlastnosti C.60 odpovídat slunečnímu spektru způsobem, který naznačuje, že C60filmy na bázi by mohly být užitečné pro fotovoltaické aplikace. Kvůli jeho vysoké elektronická afinita [46] je to jeden z nejběžnějších akceptory elektronů používá se v solárních článcích na bázi dárce / akceptoru. Účinnost převodu až 5,7% byla hlášena v C.60–Polymerové články.[47]
Bezpečnost
Řešení C.60 rozpuštěné v olivovém oleji jsou považovány za netoxické pro hlodavce.[48]Novější studie zjistila, že C60 se hromadí v těle, a proto má potenciál vyvolat škodlivé účinky na zdraví po expozici.[49]
Reference
- ^ Piacente; Gigli; Scardala; Giustini; Ferro (1995). "Tlak páry C60 Buckminsterfullerene ". J. Phys. Chem. 99 (38): 14052–14057. doi:10.1021 / j100038a041.
- ^ Howard, Jack B .; McKinnon, J. Thomas; Makarovskij, Jakov; Lafleur, Arthur L .; Johnson, M. Elaine (1991). „Fullerenes C.60 a C.70 v plamenech". Příroda. 352 (6331): 139–41. Bibcode:1991Natur.352..139H. doi:10.1038 / 352139a0. PMID 2067575. S2CID 37159968.
- ^ Howard, J; Lafleur, A; Makarovsky, Y; Mitra, S; Papež, C; Yadav, T (1992). "Syntéza fullerenů při spalování". Uhlík. 30 (8): 1183–1201. doi:10.1016 / 0008-6223 (92) 90061-Z.
- ^ Zaměstnanci (22. února 2012). „Drobné vesmírné molekuly„ fotbalového míče “by se mohly rovnat 10 000 Mount Everestům“. ProfoundSpace.org. Citováno 23. února 2012.
- ^ Starr, Michelle (29. dubna 2019). „Hubbleův vesmírný dalekohled právě našel solidní důkazy o mezihvězdných koulích“. ScienceAlert.com. Citováno 29. dubna 2019.
- ^ Cordiner, M. A.; et al. (22. dubna 2019). "Potvrzení Interstellar C60 + pomocí Hubblova kosmického dalekohledu". The Astrophysical Journal Letters. 875 (2): L28. arXiv:1904.08821. Bibcode:2019ApJ ... 875L..28C. doi:10.3847 / 2041-8213 / ab14e5. S2CID 121292704.
- ^ A b C Katz, 363
- ^ Osawa, E. (1970). Kagaku (Kyoto) (v japonštině). 25: 854
- ^ Jones, David E. H. (1966). "Duté molekuly". Nový vědec (32): 245.
- ^ Smalley, Richard (07.12.1996) Objevování Fullerenů. Nobelova přednáška. p. 97. nobelprize.org
- ^ Rohlfing, Eric A; Cox, D. M; Kaldor, A (1984). "Výroba a charakterizace nadzvukových uhlíkových shlukových paprsků". Journal of Chemical Physics. 81 (7): 3322. Bibcode:1984JChPh..81.3322R. doi:10.1063/1.447994.
- ^ Kroto, H. W .; Heath, J. R .; O'Brien, S. C .; Curl, R. F .; Smalley, R. E. (1985). "C60: Buckminsterfullerene ". Příroda. 318 (6042): 162–163. Bibcode:1985 Natur.318..162K. doi:10.1038 / 318162a0. S2CID 4314237.
- ^ A b C Dresselhaus, M. S .; Dresselhaus, G .; Eklund, P. C. (1996). Věda o fullerenech a uhlíkových nanotrubičkách. San Diego, CA: Academic Press. ISBN 978-012-221820-0.
- ^ Herbig, E. (1975). „Difúzní mezihvězdné pásy. IV - oblast 4400-6850 A“. Astrophys. J. 196: 129. Bibcode:1975ApJ ... 196..129H. doi:10.1086/153400.
- ^ Leger, A .; d'Hendecourt, L .; Verstraete, L .; Schmidt, W. (1988). "Pozoruhodní kandidáti na nosič rozptýlených mezihvězdných pásem: C60+ a další polyedrické ionty uhlíku ". Astron. Astrophys. 203 (1): 145. Bibcode:1988A & A ... 203..145L.
- ^ Dietz, T. G .; Duncan, M. A .; Powers, D. E .; Smalley, R. E. (1981). "Laserová výroba nadzvukových kovových svazků paprsků". J. Chem. Phys. 74 (11): 6511. Bibcode:1981JChPh..74,6511D. doi:10.1063/1.440991.
- ^ A b Kroto, H. W .; Health, J. R .; O'Brien, S. C .; Curl, R. F .; Smalley, R. E. (1985). "C60: Buckminsterfullerene ". Příroda. 318 (6042): 162–163. Bibcode:1985 Natur.318..162K. doi:10.1038 / 318162a0. S2CID 4314237.
- ^ Sborník z konference „Dusty Objects in the Universe“, strana 89–93, "Vyhledejte UV a IR spektra C60 v laboratorně vyrobeném uhlíkovém prachu "
- ^ Krätschmer, W. (1990). „Infračervená a ultrafialová absorpční spektra laboratorně vyrobeného uhlíkového prachu: důkazy o přítomnosti C60 molekula". Dopisy o chemické fyzice. 170 (2–3): 167–170. Bibcode:1990CPL ... 170..167K. doi:10.1016/0009-2614(90)87109-5.
- ^ A b Buckminsterfullerene, C.60. University of Bristol. Chm.bris.ac.uk (1996-10-13). Citováno 2011-12-25.
- ^ Krätschmer, W .; Lamb, Lowell D .; Fostiropoulos, K .; Huffman, Donald R. (1990). "Solid C60: Nová forma uhlíku". Příroda. 347 (6291): 354–358. Bibcode:1990 Natur.347..354K. doi:10.1038 / 347354a0. S2CID 4359360.
- ^ „Co je to geodetická kupole?“. R. Buckminster Fuller Collection: architekt, teoretik systémů, designér a vynálezce. Stanfordská Univerzita. Citováno 10. června 2019.
- ^ AZo Journal of Materials Online. AZoM.com. „Buckminsterfullerene.“ 2006. Citováno 4. ledna 2011.
- ^ Girolami, G. S .; Rauchfuss, T. B .; Angelici, R. J. (1999). Syntéza a Teknique v anorganické chemii. Mill Valley, CA: University Science Books. ISBN 978-0935702484.
- ^ Katz, 369–370
- ^ Shriver; Atkins (2010). Anorganická chemie (Páté vydání). New York: W. H. Freeman. p. 356. ISBN 978-0-19-923617-6.
- ^ Katz, 364
- ^ Arndt, Markus; Nairz, Olaf; Vos-Andreae, Julian; Keller, Claudia; Van Der Zouw, Gerbrand; Zeilinger, Anton (1999). „Dualita vln-částic C60". Příroda. 401 (6754): 680–2. Bibcode:1999 Natur.401..680A. doi:10.1038/44348. PMID 18494170. S2CID 4424892.
- ^ A. Karton; B. Chan; K. Raghavachari & L. Radom (2013). "Hodnocení tepla při tvorbě koronnulenu a C60 pomocí teoretických postupů na vysoké úrovni “. Journal of Physical Chemistry A. 117 (8): 1834–1842. Bibcode:2013JPCA..117.1834K. doi:10.1021 / jp312585r. PMID 23343032.
- ^ Katz, 374
- ^ Beck, Mihály T .; Mándi, Géza (1997). "Rozpustnost C.60". Fullereny, nanotrubice a uhlíkové nanostruktury. 5 (2): 291–310. doi:10.1080/15363839708011993.
- ^ Bezmel'nitsyn, V.N .; Eletskii, A.V .; Okun ', M.V. (1998). "Fullereny v řešeních". Fyzika-Uspekhi. 41 (11): 1091–1114. Bibcode:1998PhyU ... 41.1091B. doi:10.1070 / PU1998v041n11ABEH000502.
- ^ Ruoff, R. S .; Tse, Doris S .; Malhotra, Ripudaman; Lorents, Donald C. (1993). "Rozpustnost fullerenu (C.60) v různých rozpouštědlech “. Journal of Physical Chemistry. 97 (13): 3379–3383. doi:10.1021 / j100115a049.
- ^ M. S. Dresselhaus; G. Dresselhaus; P. C. Eklund (20. února 1996). Věda o fullerenech a uhlíkových nanotrubičkách. Akademický tisk. 437–. ISBN 978-0-12-221820-0. Citováno 26. prosince 2011.
- ^ Talyzin, A.V. (1997). "Fázový přechod C60- C.60* 4C6H6 v kapalném benzenu ". Journal of Physical Chemistry B. 101 (47): 9679–9681. doi:10.1021 / jp9720303.
- ^ Talyzin, A.V .; Engström, I. (1998). „C70 v benzenových, hexanových a toluenových řešeních“. Journal of Physical Chemistry B. 102 (34): 6477–6481. doi:10.1021 / jp9815255.
- ^ A b Katz, 372
- ^ Katz, 361
- ^ Katz, 379
- ^ Katz, 381
- ^ A b C d E F G Catherine E. Housecroft; Alan G. Sharpe (2008). „Kapitola 14: Prvky skupiny 14“. Anorganická chemie (3. vyd.). Pearson. ISBN 978-0-13-175553-6.
- ^ Zhao, Yufeng; Kim, Yong-Hyun; Dillon, A. C .; Heben, M. J .; Zhang, S. B. (22. dubna 2005). „Skladování vodíku v nových organokovových koulích“ (PDF). Dopisy o fyzické kontrole. 94 (15): 155504. Bibcode:2005PhRvL..94o5504Z. doi:10.1103 / PhysRevLett.94.155504. PMID 15904160. Archivovány od originál (PDF) dne 25. září 2012. Citováno 24. září 2012.
- ^ A b Jonathan W. Steed & Jerry L. Atwood (2009). Supramolekulární chemie (2. vyd.). Wiley. ISBN 978-0-470-51233-3.
- ^ Rodríguez-Fortea, Antonio; Balch, Alan L .; Poblet, Josep M. (2011). „Endohedral metallofullerenes: a unique host – guest association“. Chem. Soc. Rev. 40 (7): 3551–3563. doi:10.1039 / C0CS00225A. PMID 21505658.
- ^ Papoiu, Alexandru D. P. (2004). Inhibice syntázy oxidu dusnatého ve vodě rozpustnými deriváty C.60 (Disertační práce). Rutgersova univerzita.
- ^ Ryuichi, Mitsumoto (1998). "Elektronové struktury a chemické vazby fluorovaných fullerenů studovány". J. Phys. Chem. A. 102 (3): 552–560. Bibcode:1998JPCA..102..552M. doi:10.1021 / jp972863t.
- ^ Katz, 385 a násl.
- ^ Baati, Tarek; Moussa, Fathi (červen 2012). „Prodloužení života potkanů opakovaným orálním podáváním [60] fullerenu“. Biomateriály. 33 (19): 4936–4946. doi:10.1016 / j.biomaterials.2012.03.036. PMID 22498298.
- ^ Dispozice fullerenu C60 u potkanů po intratracheálním nebo intravenózním podání. Xenobiotica září 2019
Bibliografie
- Katz, E. A. (2006). „Fullerenové tenké filmy jako fotovoltaický materiál“. V Sōga, Tetsuo (ed.). Nanostrukturované materiály pro přeměnu sluneční energie. Elsevier. str. 361–443. ISBN 978-0-444-52844-5.
Další čtení
- Kroto, H. W .; Heath, J. R .; O'Brien, S. C .; Curl, R. F .; Smalley, R. E. (listopad 1985). "C60: Buckminsterfullerene ". Příroda. 318 (14): 162–163. Bibcode:1985 Natur.318..162K. doi:10.1038 / 318162a0. S2CID 4314237. - popisující původní objev C.60
- Hebgen, Peter; Goel, Anish; Howard, Jack B .; Rainey, Lenore C .; Vander Sande, John B. (2000). „Fullereny a nanostruktury v difúzních plamenech“ (PDF). Sborník spalovacího ústavu. 28: 1397–1404. CiteSeerX 10.1.1.574.8368. doi:10.1016 / S0082-0784 (00) 80355-0. - zpráva popisující syntézu C.60 s výzkumem spalování publikovaným v roce 2000 na 28. mezinárodním sympoziu o spalování
externí odkazy
- Historie C.60objev provedený chemickým oddělením na Bristolské univerzitě
- Stručný přehled buckminsterfullerene popsaný University of Wisconsin-Madison
- Zpráva Ming Kai College podrobně popisující vlastnosti buckminsterfullerene
- Papír Donalda R. Huffmana a Wolfganga Krätschmera týkající se syntézy C.60 v Příroda publikováno v roce 1990
- Důkladný popis C.60 Národní laboratoř Oak Ridge
- Článek o buckminsterfullerene na Connexions Science Encyclopaedia
- Rozsáhlé statistické údaje shromážděné University of Sussex o numerických kvantitativních vlastnostech buckminsterfullerenu
- Webový portál věnovaný buckminsterfullerene, jehož autorem a podporovatelem je University of Bristol
- Další webový portál věnovaný buckminsterfullerenu, jehož autorem je a podporováno katedrou chemie na univerzitě v Bristolu
- Stručný článek zcela věnovaný C.60 a jeho objev, struktura, výroba, vlastnosti a aplikace
- Celý článek Americké chemické společnosti o buckminsterfullerenu
- Buckminsterfullerene na Periodická tabulka videí (University of Nottingham)




