Metylformát - Methyl formate - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Metylformát | |||
| Systematický název IUPAC Methylmethanoát | |||
| Ostatní jména R-611 | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.003.166 | ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C2H4Ó2 | |||
| Molární hmotnost | 60.052 g · mol−1 | ||
| Vzhled | Bezbarvá kapalina | ||
| Zápach | příjemný[1] | ||
| Hustota | 0,98 g / cm3 | ||
| Bod tání | −100 ° C (−148 ° F; 173 K) | ||
| Bod varu | 32 ° C (90 ° F; 305 K) | ||
| 30% (20 ° C)[1] | |||
| Tlak páry | 634 hPa (476 mmHg) (20 ° C)[1] | ||
| -32.0·10−6 cm3/ mol | |||
| Nebezpečí | |||
| Bezpečnostní list | Oxford MSDS | ||
Klasifikace EU (DSD) (zastaralý) | Vysoce hořlavý (F +); Škodlivý (Xn) | ||
| Bod vzplanutí | -19 ° C; -2 ° F; 254 K. [1] | ||
| Výbušné limity | 4.5%-23%[1] | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
LD50 (střední dávka ) | 1622 mg / kg (orálně, králík)[2] | ||
LChle (nejnižší publikováno ) | 50 000 ppm (morče, 20 min)[2] | ||
| NIOSH (Limity expozice USA pro zdraví): | |||
PEL (Dovolený) | PEL 100 ppm (250 mg / m3)[1] | ||
REL (Doporučeno) | PEL 100 ppm (250 mg / m3) ST 150 ppm (375 mg / m.)3)[1] | ||
IDLH (Okamžité nebezpečí) | 4500 ppm[1] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
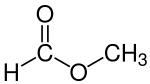
Metylformát, také zvaný methyl methanoát, je methyl ester z kyselina mravenčí. Nejjednodušší příklad esteru, je to bezbarvá kapalina s éterickým zápachem, vysoká tlak páry a nízko povrchové napětí. Je předchůdcem mnoha dalších sloučenin komerčního zájmu.[3]
Výroba
V laboratoři může methylformiát vyrábět kondenzační reakce z methanolu a kyselina mravenčí, jak následuje:
- HCOOH + CH3OH → HCO2CH3 + H2Ó
Průmyslový methylformiát se však obvykle vyrábí kombinací methanolu a kysličník uhelnatý (karbonylace ) v přítomnosti silné báze, jako je methoxid sodný:[3]

Tento proces komerčně praktikovaný společností BASF mimo jiné poskytuje 96% selektivitu vůči methylformiátu. The katalyzátor protože tento proces je citlivý na vodu, která může být přítomna v kysličník uhelnatý surovina, z níž se běžně získává syntetický plyn. Velmi suchý kysličník uhelnatý je proto zásadní.[4]
Použití
Methylformiát se používá především k výrobě formamid, dimethylformamid, a kyselina mravenčí. Tyto sloučeniny jsou prekurzory nebo stavebními kameny mnoha užitečných derivátů.
Kvůli jeho vysoké tlak páry, používá se k rychleschnoucím povrchům a jako nadouvadlo pro některé aplikace z polyuretanové pěny a jako náhrada za CFC, HCFC, a HFC. Methylformát má nulu potenciál poškozování ozonové vrstvy a nula potenciál globálního oteplování[Citace je zapotřebí ]. Používá se také jako insekticid.
Historické použití methylformiátu, které mu někdy přináší pozornost, bylo v chlazení. Před zavedením méně toxických chladiv byl methydrát mravenčanů používán jako alternativa k oxidu siřičitému v domácích chladničkách, jako jsou některé modely slavného GE Monitor Top.
Reference
- ^ A b C d E F G h Kapesní průvodce chemickými riziky NIOSH. "#0417". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b "Methylformát". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b Werner Reutemann a Heinz Kieczka "Kyselina mravenčí" ve Španělsku Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a12_013
- ^ W. Couteau, J. Ramioulle, americký patent US4216339