Chalkogenid vodíku - Hydrogen chalcogenide

Chalkogenidy vodíku (taky chalkogen hydridy nebo chalcidy vodíku) jsou binární sloučeniny vodíku s chalkogen atomy (prvky skupiny 16: kyslík, síra, selen, telur, a polonium ). Voda, první chemická sloučenina v této sérii obsahuje jeden atom kyslíku a dva vodík atomů a je nejběžnější sloučeninou na povrchu Země.[1]
Dihydrogenchalkogenidy
Nejdůležitější řada, včetně vody, má chemický vzorec H2X, kde X představuje jakýkoli chalkogen. Jsou tedy triatomický. Berou na sebe ohnutá struktura a jako takové jsou polární molekuly. Voda je základní složkou život na Země dnes,[2] pokrývající 70,9% povrchu planety. Ostatní vodíkové chalkogenidy jsou obvykle extrémně toxické a mají silné nepříjemné vůně, obvykle připomínající hnijící vejce nebo zeleninu. Sirovodík je běžným produktem rozkladu v kyslík -chudé prostředí a jako takové je jedna chemická látka odpovědná za vůni nadýmání. Je to také a sopečný plyn. Navzdory své toxicitě Lidské tělo záměrně vyrábí v dostatečně malých dávkách pro použití jako signální molekula.
Voda může rozpustit ostatní vodíkové chalkogenidy (alespoň ty až po telurid vodíku), tvořící se kyselé řešení známá jako hydrochalkogenové kyseliny. I když se jedná o slabší kyseliny než halogenovodíkové kyseliny, sledují podobný trend zvyšování síly kyselin s těžšími chalkogeny a také se tvoří podobným způsobem (přeměňují vodu na hydronium iont H3Ó+ a rozpuštěná látka do XH− ion). Není známo, zda hydrid polonia vytváří ve vodě kyselý roztok jako jeho lehčí homology, nebo se chová spíše jako hydrid kovu (viz také astatid vodíku ).
| Sloučenina | Tak jako vodný roztok | Chemický vzorec | Geometrie | strK.A | Modelka |
|---|---|---|---|---|---|
| oxid vodíku kyslíkový hydrid voda (oxidan) | voda | H2Ó | 13.995 |  | |
| sirovodík hydrid síry (sulfan) | kyselinu sírovou | H2S |  | 7.0 |  |
| selenid vodíku hydrid seleničitý (selane) | kyselina hydroselenová | H2Se |  | 3.89 |  |
| telurid vodíku teluriumhydrid (tellane) | kyselina hydrotellurová | H2Te |  | 2.6 |  |
| polonid vodíku hydrid polonia (polane) | kyselina hydropolonová | H2Po | ? |  | |
| livermorid vodíku livermorium hydrid (livermoran) | kyselina hydrolivermorová | H2Lv | ? |
Některé vlastnosti vodíkových chalkogenidů následují:[3]
| Vlastnictví | H2Ó | H2S | H2Se | H2Te | H2Po |
|---|---|---|---|---|---|
| Bod tání (° C) | 0.0 | −85.6 | −65.7 | −51 | −35.3 |
| Bod varu (° C) | 100.0 | −60.3 | −41.3 | −4 | 36.1 |
| −285.9 | +20.1 | +73.0 | +99.6 | ? | |
| Úhel spojení (H – X – H) (plyn) | 104.45° | 92.1° | 91° | 90° | 90,9 ° (předpokládané)[4] |
| Disociační konstanta (HX−, K.1) | 1.8 × 10−16 | 1.3 × 10−7 | 1.3 × 10−4 | 2.3 × 10−3 | ? |
| Disociační konstanta (X2−, K.2) | 0 | 7.1 × 10−15 | 1 × 10−11 | 1.6 × 10−11 | ? |
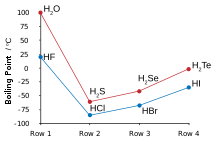
Mnoho anomálních vlastností vody ve srovnání se zbytkem vodíkových chalkogenidů lze připsat významným vodíkové vazby mezi atomy vodíku a kyslíku. Některé z těchto vlastností jsou vysoké teploty tání a teploty varu (je to kapalina při pokojové teplotě), stejně jako vysoké dielektrická konstanta a pozorovatelná iontová disociace. Vodíková vazba ve vodě také vede k velkým hodnotám tepla a entropie odpařování, povrchového napětí a viskozity.[5]
Ostatní vodíkové chalkogenidy jsou vysoce toxické, zapáchající plyny. Sírovodík se v přírodě vyskytuje běžně a jeho vlastnosti ve srovnání s vodou odhalují nedostatek jakýchkoli významných vodíkových vazeb.[6] Jelikož jsou oba na STP plyny, může být vodík jednoduše spalován v přítomnosti kyslíku za vzniku vody ve vysoké míře exotermické reakce; takový test může být použit v chemii pro začátečníky k testování plynů produkovaných reakcí, protože vodík bude hořet popem. Voda, sirovodík a selenid vodíku mohou být vyrobeny zahříváním jejich základních prvků nad 350 ° C, ale telurid vodíku a hydrid polonia nejsou touto metodou dosažitelné kvůli jejich tepelné nestabilitě; telurid vodíku se rozkládá ve vlhkosti, na světle a při teplotách nad 0 ° C. Hydrid polonia je nestabilní a kvůli intenzivní radioaktivitě polonia (vedoucí kradiolýza při tvorbě) lze zpracováním zředěného získat pouze stopová množství kyselina chlorovodíková s pozinkovaným povrchem hořčík fólie. Jeho vlastnosti jsou poněkud odlišné od zbytku vodíkových chalkogenidů, protože polonium je kov, zatímco ostatní chalkogeny nejsou, a proto je tato sloučenina mezi běžným vodíkovým chalkogenidem nebo halogenovodík jako chlorovodík a podobné hydridy kovů stannane. Stejně jako voda, první ze skupiny, je hydrid polonia také kapalinou při pokojové teplotě. Na rozdíl od vody jsou však silné mezimolekulární přitažlivosti, které způsobují vyšší teplotu varu van der Waalsovy interakce, účinek velkých elektronových mraků polonia.[3]
Dihydrogendichalkogenidy
Dihydrogendichalkogenidy mají chemický vzorec H2X2a jsou obecně méně stabilní než monochalkogenidy, obvykle se rozkládající na monochalkogenid a zapojený chalkogen.
Nejdůležitější z nich je peroxid vodíku, H2Ó2, bledě modrá, téměř bezbarvá kapalina, která má nižší těkavost než voda a vyšší hustotu a viskozitu. Je to důležité chemicky, protože může být buď oxidováno nebo redukováno v roztocích s jakýmkoli pH, může snadno tvořit komplexy peroxometalu a komplexy peroxokyseliny, stejně jako podstoupit mnoho reakcí protonová kyselina / báze. Ve své méně koncentrované formě má peroxid vodíku několik hlavních použití v domácnosti, například jako dezinfekční prostředek nebo pro bělení vlasů; mnohem koncentrovanější řešení jsou mnohem nebezpečnější.
| Sloučenina | Chemický vzorec | Délka vazby | Modelka |
|---|---|---|---|
(dioxidan) |  |  | |
(disulfan) |  | ||
(diselane) |  | ||
(ditellane) |  |
Některé vlastnosti hydrogendichalkogenidů následují:
| Vlastnictví | H2Ó2 | H2S2 | H2Se2 | H2Te2 |
|---|---|---|---|---|
| Bod tání (° C) | -0.43 | −89.6 | ? | ? |
| Bod varu (° C) | 150.2 (rozkládá se) | 70.7 | ? | ? |
Alternativní strukturní izomer výpočtů byly zkoumány dichalkogenidy, ve kterých jsou oba atomy vodíku navázány na stejný atom chalkogenu, který je také navázán na druhý atom chalkogenu. Tyto H2X+-X– struktury jsou ylidy. Tato izomerní forma peroxidu vodíku, kyslíková voda, nebyl syntetizován experimentálně. Analogický izomer sirovodíku, thiosulfoxid, byl zjištěn uživatelem hmotnostní spektrometrie experimenty.[9]
Je možné, aby dva různé atomy chalkogenu sdílely dichalkogenid, jako v thioperoxid vodíku (H2TAK); zahrnují více známé sloučeniny podobného popisu kyselina sírová (H2TAK4).
Vyšší dihydrogenchalkogenidy
Všechny vodíkové chalkogenidy s přímým řetězcem následují vzorec H2Xn.
Vyšší polyoxidy vodíku než H2Ó2 nejsou stabilní.[10] Trioxidan, se třemi atomy kyslíku, je přechodný nestabilní meziprodukt v několika reakcích. Další dva ze série s kyslíkem oxid uhličitý a oxid vodíku Byly také syntetizovány a bylo zjištěno, že jsou vysoce reaktivní. Výpočetně byl zkoumán alternativní strukturní izomer trioxidanu, ve kterém jsou dva atomy vodíku připojeny k centrálnímu kyslíku řetězce s třemi kyslíky spíše než k jednomu na každém konci.[11]
Za H2S a H2S2, mnoho vyšší polysulfany H2Sn (n = 3–8) jsou známé jako stabilní sloučeniny.[12] Mají nerozvětvené sirné řetězce, což odráží sklon síry ke katenizaci. Počínaje H2S2, všechny známé polysulfany jsou kapaliny při teplotě místnosti. H2S2 je bezbarvý, zatímco ostatní polysulfany jsou žluté; barva bude bohatší n se zvyšuje, stejně jako hustota, viskozita a bod varu. Tabulka fyzikálních vlastností je uvedena níže.[13]
| Sloučenina | Hustota při 20 ° C (g • cm−3) | Tlak páry (mmHg) | Extrapolovaná teplota varu (° C) |
|---|---|---|---|
| H2S | 1,363 (g • dm−3) | 1740 (kPa, 21 ° C) | -60 |
| H2S2 | 1.334 | 87.7 | 70 |
| H2S3 | 1.491 | 1.4 | 170 |
| H2S4 | 1.582 | 0.035 | 240 |
| H2S5 | 1.644 | 0.0012 | 285 |
| H2S6 | 1.688 | ? | ? |
| H2S7 | 1.721 | ? | ? |
| H2S8 | 1.747 | ? | ? |
Mohou však být snadno oxidovány a všechny jsou tepelně nestabilní, snadno disproporcionální vůči síře a sirovodíku, což je reakce, při které alkálie působí jako katalyzátor:[13]
- H2Sn → H2S + n − 1/8 S8
Reagují také s siřičitan a kyanid k výrobě thiosíran a thiokyanát resp.[13]
Výpočetně byl zkoumán alternativní strukturní izomer trisulfidu, ve kterém jsou dva atomy vodíku připojeny k centrální síře třísírového řetězce spíše než k jednomu na každém konci.[11] Kyselina thiosíranová, rozvětvený izomer tetrasulfidu, ve kterém je čtvrtá síra vázána na centrální síru lineární dihydrogen trisulfidové struktury ((HS)2S+–S–), byl také prozkoumán výpočetně.[14] Kyselina thiosíranová, ve kterém dva atomy síry odbočující z centrální části lineární dihydrogen trisulfidové struktury byly studovány také výpočetně.[15]
Mohou existovat vyšší hydridy polonia.[16]
Další sloučeniny vodíku a chalkogenu

Některé monohydrogenchalkogenidové sloučeniny existují a jiné byly studovány teoreticky. Tak jako radikální sloučeniny, jsou docela nestabilní. Dva nejjednodušší jsou hydroxyl (HO) a hydroperoxyl (HO2). Sloučenina ozonid vodíku (HO3) je také známo,[17] spolu s některými jeho alkalický kov ozonid soli jsou (různé MO3).[18] Příslušný analog síry pro hydroxylovou skupinu je sulfanyl (HS) a HS2 pro hydroperoxyl.


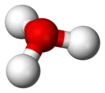
Jeden nebo oba atomy protia ve vodě mohou být substituovány izotop deuterium, čímž se získá polotěžká voda a těžká voda, přičemž druhá je jednou z nejznámějších sloučenin deuteria. Vzhledem k vysokému rozdílu v hustotě mezi deuteriem a běžným protium těžká voda vykazuje mnoho anomálních vlastností. Radioizotop tritium může také tvořit tritiovaná voda stejným způsobem. Dalším pozoruhodným chalkogenidem deuteria je disulfid deuteria. Telurid deuteria (D2Te) má o něco vyšší tepelnou stabilitu než telurid protium a experimentálně se používá pro metody chemické depozice tenkých filmů na bázi teluridu.[19]
Vodík sdílí mnoho vlastností s halogeny; může dojít k nahrazení vodíku halogeny halogenid chalkogenu sloučeniny jako difluorid kyslíku a oxid chloričitý, vedle těch, které mohou být nemožné s vodíkem, jako je chlordioxid.
Vodíkové ionty
Jedním z nejznámějších iontů vodíku a chalkogenidu je hydroxid ion a související hydroxy funkční skupina. První je přítomen v alkalický kov, alkalická zemina, a vzácná země hydroxidy, vytvořené reakcí příslušného kovu s vodou. Hydroxyskupina se běžně objevuje v organické chemii, například uvnitř alkoholy. Související bisulfid / sulfhydrylová skupina se objeví v hydrosulfidové soli a thioly, resp.
The hydronium (H3Ó+) ion je přítomen ve vodných kyselých roztocích, včetně samotných hydrochalkogenních kyselin, jakož i čistá voda vedle hydroxidu.
Reference
- ^ "CIA - světový přehled věcí". Ústřední zpravodajská služba. Citováno 18. srpna 2016.
- ^ „O mezinárodním desetiletí pro akci„ Voda pro život “2005–2015“.
- ^ A b Greenwood a Earnshaw, str. 766–7
- ^ Sumathi, K .; Balasubramanian, K. (1990). „Elektronické stavy a povrchy potenciální energie H2Te, H2Po a jejich kladné ionty “. Journal of Chemical Physics. 92 (11): 6604–6619. Bibcode:1990JChPh..92,6604S. doi:10.1063/1.458298.
- ^ Greenwood a Earnshaw, str. 623
- ^ Greenwood a Earnshaw, str. 682
- ^ Goldbach, Andreas; Saboungi, Marie-Louise; Johnson, J. A .; Cook, Andrew R .; Meisel, Dan (2000). „Oxidace vodných roztoků polyselenidů. Studie mechanistické pulzní radiolýzy“. J. Phys. Chem. A. 104 (17): 4011–4016. Bibcode:2000JPCA..104,4011G. doi:10.1021 / jp994361g.
- ^ Hop, Cornelis E. C. A .; Medina, Marco A. (1994). „H2Te2 Je stabilní v plynné fázi “. Journal of the American Chemical Society. 1994 (116): 3163–4. doi:10.1021 / ja00086a072.
- ^ Gerbaux, Pascal; Salpin, Jean-Yves; Bouchoux, Guy; Flammang, Robert (2000). "Thiosulfoxidy (X2S = S) a disulfany (XSSX): první pozorování organických thiosulfoxidů ". International Journal of Mass Spectrometry. 195/196: 239–249. Bibcode:2000 IJMSp. 195..239G. doi:10.1016 / S1387-3806 (99) 00227-4.
- ^ Greenwood a Earnshaw, str. 633–8
- ^ A b Dobado, J. A .; Martínez-García, Henar; Molina, José; Sundberg, Markku R. (1999). „Chemická vazba v hypervalentních molekulách revidována. 2. Aplikace atomů v teorii molekul na Y2XZ a Y2XZ2 (Y = H, F, CH3; X = O, S, Se; Z = O, S) Sloučeniny ". J. Am. Chem. Soc. 121 (13): 3156–3164. doi:10.1021 / ja9828206.
- ^ R. Steudel "Anorganické polysulfany H2S2 s n> 1 "v Elementární síře a sloučeninách bohatých na síru II (Topics in Current Chemistry) 2003, svazek 231, str. 99-125. doi:10.1007 / b13182
- ^ A b C Greenwood a Earnshaw, str. 683
- ^ Laitinen, Risto S .; Pakkanen, Tapani A .; Steudel, Ralf (1987). „Ab initio studie hypervalentních hydridů síry jako modelových meziproduktů v interkonverzních reakcích sloučenin obsahujících vazby síra-síra“. J. Am. Chem. Soc. 109 (3): 710–714. doi:10.1021 / ja00237a012.
- ^ Nishimoto, Akiko; Zhang, Daisy Y. (2003). „Hypervalence v síře? Ab initio a DFT studie struktur thiosíranu a souvisejících sirných oxyaniontů “. Síra písmena. 26 (5/6): 171–180. doi:10.1080/02786110310001622767.
- ^ Liu, Yunxian; Duan, Defang; Tian, Fubo; Li, Da; Sha, Xiaojing; Zhao, Zhonglong; Zhang, Huadi; Wu, Gang; Yu, Hongyu; Liu, Bingbing; Cui, Tian (2015). "Fázový diagram a supravodivost hydridů polonia pod vysokým tlakem". arXiv:1503.08587 [cond-mat. supr-con ].
- ^ Cacace, F .; de Petris, G .; Pepi, F .; Troiani, A. (1999). "Experimentální detekce oxidu vodíku". Věda. 285 (5424): 81–82.
- ^ Wiberg 2001, s. 497
- ^ Xiao, M. & Gaffney, T. R. Tellurium (Te) Prekurzory pro výrobu paměťových materiálů s fázovou změnou. (Google Patents, 2013) (https://www.google.ch/patents/US20130129603 )
Bibliografie
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.








