Hydrid hořečnatý - Magnesium hydride
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Hydrid hořečnatý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.028.824 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
| |
| |
| Vlastnosti | |
| MgH2 | |
| Molární hmotnost | 26,3209 g / mol |
| Vzhled | bílé krystaly |
| Hustota | 1,45 g / cm3 |
| Bod tání | 327 ° C (621 ° F; 600 K) se rozkládá |
| rozkládá se | |
| Rozpustnost | nerozpustný v éter |
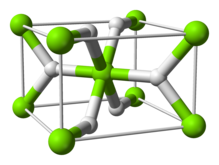
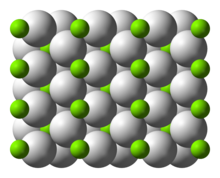
| Struktura | |
| čtyřúhelníkový | |
| Termochemie | |
Tepelná kapacita (C) | 35,4 J / mol K. |
Std molární entropie (S | 31,1 J / mol K. |
Std entalpie of formace (ΔFH⦵298) | -75,2 kJ / mol |
Gibbsova volná energie (ΔFG˚) | -35,9 kJ / mol |
| Nebezpečí | |
| Hlavní nebezpečí | samozápalný[1] |
| Související sloučeniny | |
jiný kationty | Hydrid berylnatý Hydrid vápenatý Hydrid strontnatý Hydrid barnatý |
| Monohydrid hořečnatý Mg4H6 | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hydrid hořečnatý je chemická sloučenina s molekulárním vzorcem MgH2. Obsahuje 7,66% hmotnostních vodíku a bylo studováno jako potenciální médium pro ukládání vodíku.[2]
Příprava
V roce 1951 byla poprvé popsána příprava z prvků zahrnující přímou hydrogenaci kovu Mg při vysokém tlaku a teplotě (200 atmosfér, 500 ° C) s MgI2 katalyzátor:[3]
- Mg + H2 → MgH2
Produkce nižší teploty z Mg a H2 s použitím nanokrystalického Mg vyrobeného v kulové mlýny byl vyšetřován.[4] Mezi další přípravky patří:
- hydrogenace antracen hořečnatý za mírných podmínek:[5]
- Mg (antracen) + H2 → MgH2
- reakce diethylmagnesium s lithiumaluminiumhydrid[6]
- produkt komplexovaného MgH2 např. MgH2.THF reakcí fenylsilan a dibutylmagnesium v etheru nebo uhlovodíkových rozpouštědlech v přítomnosti THF nebo TMEDA jako ligand.[1]
Struktura a lepení
Teplota místnosti tvoří α-MgH2 má rutil struktura.[7] Existují nejméně čtyři vysokotlaké formy: γ-MgH2 s α-PbO2 struktura,[8] kubický β-MgH2 s vesmírnou skupinou Pa-3,[9] ortorombický HP1 s Pbc21 vesmírná skupina a ortorombická HP2 s vesmírnou skupinou Pnma.[10] Navíc nestechiometrický MgH(2-δ) byla charakterizována, ale zdá se, že existuje pouze pro velmi malé částice[11]
(objemový MgH2 je v podstatě stechiometrický, protože dokáže pojmout pouze velmi nízké koncentrace volných pracovních míst[12]).
Vazba ve formě rutilu je někdy popisována jako spíše kovalentní v přírodě než čistě iontová;[13] stanovení hustoty náboje synchrotronovou rentgenovou difrakcí ukazuje, že atom hořčíku je plně ionizovaný a sférického tvaru a hydridový iont je podlouhlý.[14]Molekulární formy hydridu hořečnatého, MgH, MgH2, Mg2H, Mg2H2, Mg2H3a Mg2H4 molekuly identifikované podle jejich vibračních spekter byly nalezeny ve vzorcích izolovaných na matrici pod 10 K, vytvořených po laserové ablaci hořčíku v přítomnosti vodíku.[15] The Mg2H4 molekula má přemostěnou strukturu analogickou s dimerní hydrid hlinitý Al2H6.[15]
Reakce
MgH2 snadno reaguje s vodou za vzniku plynného vodíku:
- MgH2 + 2 H2O → 2 H2 + Mg (OH)2
Při 287 ° C se rozkládá za vzniku H2 při tlaku 1 bar,[16] požadovaná vysoká teplota je považována za omezení při použití MgH2 jako reverzibilní médium pro skladování vodíku:[17]
- MgH2 → Mg + H2
Potenciální využití pro skladování vodíku
Jeho potenciál jako reverzibilního „skladovacího“ média pro vodík vedl k zájmu o zlepšení kinetiky hydrogenační a dehydrogenační reakce.[17][18] Toho lze částečně dosáhnout pomocí doping nebo zmenšením velikosti částic pomocí kulové frézování.[19][20][21] Alternativním přístupem, který je předmětem šetření, je výroba čerpatelné suspenze MgH2 který je bezpečný pro manipulaci a uvolňuje H2 reakcí s vodou s přepracováním Mg (OH)2 do MgH2.[1] Řada amerických patentů (US9123925B2, US8651268B2, US8651270B2, US9732906B2) a mezinárodních patentů byla udělena pro dobíjecí nízkotlaký a nízkoteplotní systém skladování vodíku využívající nanostrukturovaný hydrid hořečnatý pro absorpci vodíku s vysokou hustotou a laserem aktivovanou desorpci. Praktický systém využívá ošetřené polymerní substráty ve formě disku nebo pásky pro použití při dlouhodobém skladování, přepravě a stabilizaci mřížky. Systém má jedinečnou výhodu ve schopnosti pasivně zachytávat vodík z průmyslových komínů a zařízení na zpracování odpadu, než se může spojit za vzniku skleníkových plynů.
Reference
- ^ A b Michalczyk, Michael J (1992). "Syntéza hydridu hořečnatého reakcí fenylsilanu a dibutylmagnesium". Organometallics. 11 (6): 2307–2309. doi:10.1021 / om00042a055.
- ^ Bogdanovic, Borislav (1985). "Katalytická syntéza organolithných a organohořečnatých sloučenin a hydridů lithia a hořčíku - aplikace v organické syntéze a skladování vodíku". Angewandte Chemie International Edition v angličtině. 24 (4): 262–273. doi:10,1002 / anie.198502621.
- ^ Egon Wiberg, Heinz Goeltzer, Richard Bauer (1951). „Synthese von Magnesiumhydrid aus den Elementen (Syntéza hořečnatého hydridu z prvků)“ (PDF). Zeitschrift für Naturforschung B. 6b: 394.CS1 maint: používá parametr autoři (odkaz)
- ^ Zaluska, A; Zaluski, L; Ström – Olsen, J.O (1999). "Nanokrystalický hořčík pro skladování vodíku". Journal of Alloys and Compounds. 288 (1–2): 217–225. doi:10.1016 / S0925-8388 (99) 00073-0.
- ^ Bogdanovi ?, Borislav; Liao, Shih-Tsien; Schwickardi, Manfred; Sikorsky, Peter; Spliethoff, Bernd (1980). "Katalytická syntéza hydridu hořečnatého za mírných podmínek". Angewandte Chemie International Edition v angličtině. 19 (10): 818. doi:10.1002 / anie.198008181.
- ^ Barbaras, Glenn D; Dillard, Clyde; Finholt, A.E .; Wartik, Thomas; Wilzbach, K.E; Schlesinger, H. I (1951). „Příprava hydridů zinku, kadmia, berylia, hořčíku a lithia pomocí lithiumaluminiumhydridu1“. Journal of the American Chemical Society. 73 (10): 4585. doi:10.1021 / ja01154a025.
- ^ Zachariasen, W. H; Holley, C.E .; Stamper, J.F (1963). „Neutronová difrakční studie deuteridu hořečnatého“. Acta Crystallographica. 16 (5): 352. doi:10.1107 / S0365110X63000967.
- ^ Bortz, M; Bertheville, B; Böttger, G; Yvon, K (1999). "Struktura vysokotlaké fáze γ-MgH2 pomocí neutronové práškové difrakce". Journal of Alloys and Compounds. 287 (1–2): L4 – L6. doi:10.1016 / S0925-8388 (99) 00028-6.
- ^ Vajeeston, P; Ravindran, P; Hauback, B. C; Fjellvåg, H; Kjekshus, A; Furuseth, S; Hanfland, M (2006). "Strukturální stabilita a tlakem indukované fázové přechody vMgH2". Fyzický přehled B. 73 (22): 224102. Bibcode:2006PhRvB..73v4102V. doi:10.1103 / PhysRevB.73.224102.
- ^ Moriwaki, Toru; Akahama, Yuichi; Kawamura, Haruki; Nakano, satoshi; Takemura, Kenichi (2006). „Strukturní fázový přechod vysokotlakých látek MgH2at rutilového typu“. Journal of the Physical Society of Japan. 75 (7): 074603. Bibcode:2006JPSJ ... 75g4603M. doi:10.1143 / JPSJ.75.074603.
- ^ Schimmel, H. Gijs; Huot, Jacques; Chapon, Laurent C; Tichelaar, Frans D; Mulder, Fokko M (2005). "Cyklus vodíku niobu a vanadu katalyzovaného nanostrukturovaného hořčíku". Journal of the American Chemical Society. 127 (41): 14348–54. doi:10.1021 / ja051508a. PMID 16218629.
- ^ Grau-Crespo, R .; K. C. Smith; T. S. Fisher; N. H. de Leeuw; U. V. Waghmare (2009). „Termodynamika volných míst vodíku v MgH2 z výpočtů prvního principu a velkánonické statistické mechaniky “. Fyzický přehled B. 80 (17): 174117. arXiv:0910.4331. Bibcode:2009PhRvB..80q4117G. doi:10.1103 / PhysRevB.80.174117.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A .; Bochmann, Manfred (1999), Pokročilá anorganická chemie (6. vydání), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Noritake, T; Towata, S; Aoki, M; Seno, Y; Hirose, Y; Nishibori, E; Takata, M; Sakata, M (2003). "Měření hustoty náboje v MgH2 pomocí synchrotronové rentgenové difrakce". Journal of Alloys and Compounds. 356-357: 84–86. doi:10.1016 / S0925-8388 (03) 00104-X.
- ^ A b Wang, Xuefeng; Andrews, Lester (2004). "Infračervené spektrum molekul hydridu hořečnatého, komplexů a pevného dihydridu hořečnatého". The Journal of Physical Chemistry A. 108 (52): 11511. Bibcode:2004JPCA..10811511W. doi:10.1021 / jp046410h.
- ^ McAuliffe, T. R. (1980). Vodík a energie (ilustrované vydání). Springer. str. 65. ISBN 978-1-349-02635-7. Výňatek ze strany 65
- ^ A b Schlapbach, Louis; Züttel, Andreas (2001). „Materiály pro skladování vodíku pro mobilní aplikace“ (PDF). Příroda. 414 (6861): 353–8. Bibcode:2001 Natur.414..353S. doi:10.1038/35104634. PMID 11713542.
- ^ J Huot Vodík v kovech (2002) in New Trends in Intercalation Compounds for Energy Storage, Christian Julien, J. P. Pereira-Ramos, A. Momchilov, Springer, ISBN 1-4020-0594-6
- ^ Sakintuna, B .; F. Lamaridarkrim; M. Hirscher (2007). „Kovové hydridové materiály pro skladování pevného vodíku: recenze“. International Journal of Hydrogen Energy. 32 (9): 1121–1140. doi:10.1016 / j.ijhydene.2006.11.022.
- ^ Smith, Kyle; Fisher, Timothy; Waghmare, Umesh; Grau-Crespo, Ricardo (2010). "Dopant-volné místo vazebné účinky v Li-dopovaný hydrid hořečnatý". Fyzický přehled B. 82 (13): 134109. arXiv:1009.4806. Bibcode:2010PhRvB..82m4109S. doi:10.1103 / PhysRevB.82.134109. ISSN 1098-0121.
- ^ Liang, G .; Huot, J .; Boily, S .; Van Neste, A .; Schulz, R. (1999). „Katalytický účinek přechodných kovů na sorpci vodíku v nanokrystalických kulových mletých systémech MgH2 – Tm (Tm = Ti, V, Mn, Fe a Ni)“. Journal of Alloys and Compounds. 292 (1–2): 247–252. doi:10.1016 / S0925-8388 (99) 00442-9. ISSN 0925-8388.
