Amino radikál - Amino radical
| |||
| Jména | |||
|---|---|---|---|
| Systematický název IUPAC | |||
| Ostatní jména Amidogen; Aminylový radikál; Azanyl radikál | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Vlastnosti | |||
| NH 2• | |||
| Molární hmotnost | 16,0226 g mol−1 | ||
| Termochemie | |||
Std molární entropie (S | 194,71 J K.−1 mol−1 | ||
Std entalpie of formace (ΔFH⦵298) | 190,37 kJ mol−1 | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
The amino radikální, •
NH
2, také známý jako aminylový radikál nebo azanylová skupina, je neutrální forma amidový ion (NH−
2). Aminyl je vysoce reaktivní a následně krátkodobý jako většina radikálů; tvoří však důležitou součást chemie dusíku. V dostatečně vysoké koncentraci se aminové radikály dimerizují a tvoří se hydrazin. Zatímco NH2 jako funkční skupina je běžné v Příroda, tvořící součást mnoha sloučenin (např fenethylaminy ), radikál nelze izolovat ve volné formě.[2]
Syntéza
Reakce 1: Tvorba amino radikálu z amoniaku
Amino radikály lze vyrobit reakcí OH radikálu s amoniakem v ozářených vodných roztocích. Tato reakce je formulována jako reakce na odběr vodíku.[3]
- NH3 + • OH → • NH2 + H2Ó
Rychlostní konstanta (k1) pro tuto reakci byl stanoven na 1,0 × 108 M−1 s−1, zatímco paralelní reakce OH s NH+
4 bylo zjištěno, že je mnohem pomalejší. Tato rychlost byla znovu stanovena použitím dvou kompetitivních metod pulzní radiolýzy s benzoátovými a thiokyanátovými ionty při pH 11,4. Hodnota k1 = (9 + 1) × 107 M−1 s−1 byl získán z obou systémů. V kyselém roztoku odpovídá odpovídající • OH s NH+
4 je příliš pomalý na to, aby byl pozorovatelný pulzní radiolýzou.
Reakce 2: Tvorba amino radikálu z hydroxylaminu
Amino radikál může být také produkován reakcí např−(aq) s NH2ACH. Několik studií také využilo redoxní systém TiIII—NH2OH pro produkci amino radikálů pomocí elektronové paramagnetické rezonanční (ESR) spektroskopie a polarografie.[3]
- TiIII + NH2OH → TiIV + • NH2 + OH−
Reakce 3: Tvorba amino radikálu z amoniumyl
Snížení hydroxylaminu e−(aq) bylo také navrženo pro produkci amino radikálu v následující reakci.[3]
- •NH+
3 NH • NH2 + H+
Očekává se, že reaktivita amino radikálu v této reakci bude záviset na pH a měla by se vyskytovat v oblasti pH 3–7.
Vlastnosti
Elektronické stavy
Amino radikál má dva charakteristické elektronické stavy:
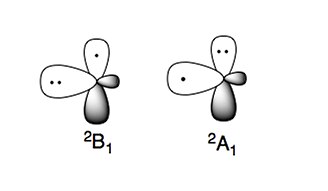
Stabilnější elektronický stav je 2B1, kde je nepárový elektron v p-orbitál kolmý k rovině molekuly (radikál typu π). Vysokoenergetický elektronický stav, 2A1, má dva elektrony v p-orbitál a nepárový elektron ve sp2 orbitální (radikál typu σ).[4][5]
Sloučeniny zaměřené na dusík, jako jsou aminy, jsou nukleofilní v přírodě. Tento znak je také patrný v amino radikálech, které lze považovat za nukleofilní druhy.[4][5]
Spektrální vlastnosti
Amino radikál vykazuje pouze velmi nízkou optickou absorpci ve viditelné oblasti (λmax 530 nm, emax 81 mil−1 s−1), zatímco jeho absorpce v UV (<260 nm) je podobná absorpci v OH. Z tohoto důvodu je nepraktické určit rychlost reakce amino radikálu s organickými sloučeninami sledováním rozpadu amino radikálu.
Reaktivita
Obecně jsou amino radikály vysoce reaktivní a krátkodobé; to však není případ reakce s některými organickými molekulami. Byly hlášeny relativní reaktivity amino radikálu s několika organickými sloučeninami, ale absolutní rychlostní konstanty pro tyto reakce zůstávají neznámé. V reakci 1 se předpokládalo, že amino radikál může případně reagovat s NH3 rychleji než OH a může oxidovat NH+
4 produkovat amino radikál v kyselých roztocích, protože radikály jsou silnější oxidanty než OH. Aby se to otestovalo, byly použity sulfátové a fosfátové radikální anionty. Bylo zjištěno, že anionty síranových a fosfátových radikálů reagují s NH pomaleji3 než aminoskupina a reagují s amoniakem abstrakcí vodíku a ne oxidací elektronového přenosu.[3]
Když amino radikál reaguje s benzoát ionty, rychlostní konstanta je velmi nízká a pozoruje se pouze slabá absorpce v UV spektru, což naznačuje, že amino radikály nereagují rychle s benzenem. Fenol Na druhé straně bylo zjištěno, že reaguje rychleji s amino radikálem. V experimentech při pH 11,3 a 12 s použitím 1,5 M NH3 a různé koncentrace fenolu mezi 4 a 10 mM byla pozorována tvorba absorpce fenoxylových radikálů s rychlostní konstantou (3 + 0,4) × 106 M−1 s−1. Tato reakce může produkovat fenoxylové radikály dvěma možnými mechanismy:[3]
- Přidání do kruhu s následnou eliminací NH3nebo
- Oxidace přímým přenosem elektronů

I když je známo, že amino radikál je slabě reaktivní, vzniká rekombinační proces dvou amino radikálů hydrazin se jeví jako jeden z nejrychlejších. Výsledkem je, že často soutěží s jinými NH2 reakce.
- NH2 + NH2 → N2H4
Při nízkých tlacích je tato reakce nejrychlejší, a proto je hlavním režimem NH2 zmizení.[6]
Viz také
Reference
- ^ A b „aminyl (CHEBI: 29318)“. Chemické entity biologického zájmu (ChEBI). UK: Evropský bioinformatický institut. Názvy IUPAC.
- ^ die.net. "Amidogen". Archivovány od originál 21. února 2013. Citováno 16. května 2012.
- ^ A b C d E F Neta, P .; Maruthamuthu, P .; Carton, P. M .; Fessenden, R. W. (1978). "Tvorba a reaktivita amino radikálu". The Journal of Physical Chemistry. 82 (17): 1875–1878. doi:10.1021 / j100506a004. ISSN 0022-3654.
- ^ A b "Amino Radical". Webová kniha NIST Chemistry. Národní vědecký a technologický institut. 2017. Citováno 15. června 2018.
- ^ A b Koenig, T .; Hoobler, J. A .; Klopfenstein, C.E .; Hedden, G .; Sunderman, F .; Russell, B. R. (1974). "Elektronické konfigurace amidových radikálů". Journal of the American Chemical Society. 96 (14): 4573–4577. doi:10.1021 / ja00821a036. ISSN 0002-7863.
- ^ Khe, P. V .; Soulignac, J. C .; Lesclaux, R. (1977). "Závislost tlakové a teplotní konstanty rychlostní rekombinace amin radikálů". The Journal of Physical Chemistry. 81 (3): 210–214. doi:10.1021 / j100518a006.
Další čtení
- Davies, P (2008). "Detekce amino radikálu NH2 laserovou magnetickou rezonanční spektroskopií". The Journal of Chemical Physics. 62 (9): 3739. doi:10.1063/1.430970.
- Buttner, T (2005). "Stabilní aminylový radikál s komplexem kovů". Věda. 307 (5707): 235–8. Bibcode:2005Sci ... 307..235B. doi:10.1126 / science.1106070. PMID 15653498.
- John, Seely (1977). "Teplotní a tlaková závislost rychlostní konstanty pro reakci HO2 + NO". The Journal of Physical Chemistry. 81 (10): 210–214. doi:10.1021 / jp952553f.
- Koenig, Hoobler (1974). "Elektronické konfigurace amino radikálů". Journal of the American Chemical Society. 96 (14): 4573–4577. doi:10.1021 / ja00821a036.



