Benzonitril - Benzonitrile - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Benzonitril | |||
| Systematický název IUPAC Benzenkarbonitril | |||
| Ostatní jména | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 3DMet | |||
| 506893 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.002.596 | ||
| Číslo ES |
| ||
| 2653 | |||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 2224 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C 6H 5(CN) | |||
| Molární hmotnost | 103,12 g / mol | ||
| Hustota | 1,0 g / ml | ||
| Bod tání | -13 ° C (9 ° F; 260 K) | ||
| Bod varu | 188 až 191 ° C (370 až 376 ° F; 461 až 464 K) | ||
| <0,5 g / 100 ml (22 ° C) | |||
| -65.19·10−6 cm3/ mol | |||
Index lomu (nD) | 1.5280 | ||
| Nebezpečí | |||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Varování | ||
| H302, H312 | |||
| P264, P270, P280, P301 + 312, P302 + 352, P312, P322, P330, P363, P501 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 75 ° C (167 ° F; 348 K) | ||
| 550 ° C (1022 ° F; 823 K) | |||
| Výbušné limity | 1.4–7.2% | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
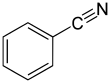
Benzonitril je chemická sloučenina se vzorcem C
6H
5(CN), zkráceně Ph CN. Tento aromatický organická sloučenina je bezbarvá kapalina se sladkou hořkou mandlovou vůní. Používá se hlavně jako předzvěst pryskyřice benzoguanamin.
Výroba
Připravuje jej amoxidace z toluen, to je jeho reakce s amoniak a kyslík (nebo vzduch) při 400 až 450 ° C (752 až 842 ° F).[1]
- C
6H
5CH
3 + 3/2 Ó
2 + NH
3 → C
6H
5(CN) + 3 H
2Ó
V laboratoři jej lze připravit dehydratací benzamid nebo Rosenmund – von Braunova reakce použitím kyanid měďný nebo NaCN /DMSO a brombenzen.
Aplikace
Laboratorní použití
Benzonitril je užitečné rozpouštědlo a všestranný předchůdce mnoha derivátů. Reaguje s aminy za získání N-substituovaných benzamidů po hydrolýze.[2] Je předchůdcem difenylketiminu Ph
2C = NH (teplota varu 151 ° C, 8 mm Hg) reakcí s fenylmagnesiumbromid následován methanolýza.[3]
Benzonitrilové formy koordinační komplexy s přechodnými kovy, které jsou jak rozpustné v organických rozpouštědlech, tak pohodlně labilní. Jedním z příkladů je PdCl
2(PhCN)
2. Benzonitrilové ligandy jsou snadno vytěsňovány silnějšími ligandy, což z benzonitrilových komplexů činí užitečné syntetické meziprodukty.[4]
Dějiny
Benzonitril byl hlášen uživatelem Hermann Fehling v roce 1844. Našel sloučeninu jako produkt z tepelné dehydratace benzoan amonný. Jeho strukturu odvodil z již známé analogické reakce mravenčan amonný čímž se získá formonitril. Také vytvořil jméno benzonitril, které dalo jméno celé skupině nitrily.[5]
V roce 2018 byl údajně benzonitril detekován v EU mezihvězdné médium.[6]
Reference
- ^ Maki, Takao; Takeda, Kazuo (červen 2000). "Kyselina benzoová a deriváty". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a03_555. ISBN 3527306730.
- ^ Cooper, F. C .; Partridge, M. W. (1963). "N-fenylbenzamidin". Organické syntézy.; Kolektivní objem, 4, str. 769
- ^ Pickard, P.L .; Tolbert, T. L. (1973). "Difenyl Ketimin". Organické syntézy.; Kolektivní objem, 5, str. 520
- ^ Anderson, Gordon K .; Lin, Minren (1990). "Bis (benzonitril) dichlorové komplexy palladia a platiny". Reagencie pro přechodový kovový komplex a organokovové syntézy. Anorganické syntézy. 28. John Wiley & Sons. str. 60–63. doi:10.1002 / 9780470132593.ch13. ISBN 978-0-470-13259-3.
- ^ Fehling, Hermann (1844). „Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme“ (PDF). Annalen der Chemie und Pharmacie. 49 (1): 91–97. doi:10,1002 / jlac.18440490106.
- ^ McGuire, Brett A .; et al. (Leden 2018). „Detekce aromatické molekuly benzonitrilu (c − C
6H
5CN) v mezihvězdném médiu “. Věda. 359 (6372): 202–205. arXiv:1801.04228. Bibcode:2018Sci ... 359..202M. doi:10.1126 / science.aao4890. PMID 29326270.