Pnictogen hydrid - Pnictogen hydride - Wikipedia
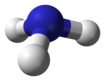


Pnictogen hydridy nebo vodíkové pnictidy jsou binární sloučeniny vodíku s pnictogen atomy (prvky skupiny 15: dusík, fosfor, arsen, antimon, a vizmut ) kovalentně vázán k vodík.
Pnictogen trihydridy
Nejjednodušší řada má chemický vzorec XH3 (méně často H3X), přičemž X představuje některý z pnictogenů. Berou na sebe pyramidová struktura (na rozdíl od trigonální planární uspořádání hydridy skupiny 13 ), a proto jsou polární. Tyto pnictogen trihydridy jsou obecně stále více nestabilní a jedovaté s těžšími prvky.
Jako jednoduché halogenovodíky a chalkogenidy, pnictogen hydridy jsou voda -rozpustný.[pochybný ] Na rozdíl od jiných hydridů, jako jsou sirovodík a fluorovodík, které tvoří kyselé vodné roztoky, amoniak rozpouští se ve vodě hydroxid amonný což je základní (vytvořením a hydroxid ion na rozdíl od hydronium ). Fosfin je také rozpustný ve vodě. Arsine a stibine jsou méně, a není známo, zda vizmutin je.
| Složené názvy | Chemický vzorec | Geometrie | Model vyplňující prostor |
|---|---|---|---|
| hydrid dusíku amoniak (azan) | NH3 |  |  |
| hydrid fosforitý fosfin (fosfan) | PH3 | 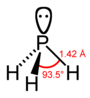 |  |
| arsen hydrid arsine (arsane) | Popel3 |  |  |
| antimon hydrid stibine (stibane) | SbH3 |  |  |
| hydrid bismutitý vizmutin (vizmutan) | BiH3 |  |  |
Některé vlastnosti pnictogen trihydridů následují:[1]
| Vlastnictví | NH3 | PH3 | Popel3 | SbH3 | BiH3 |
|---|---|---|---|---|---|
| Bod tání (° C) | −77.8 | −133.5 | −116.3 | −88 | ? |
| Bod varu (° C) | −34.5 | −87.5 | −62.4 | −18.4 | 16,8 (extrapolováno) |
| Hustota kapaliny (g / cm3) | 0,683 (-34 ° C) | 0,746 (-90 ° C) | 1,640 (-64 ° C) | 2,204 (-18 ° C) | ? |
| ΔH° F/ kJ mol−1 | −46.1 | −9.6 (?) | +66.4 | +145.1 | +277.8 |
| Vzdálenost (X – H) / pm | 101.7 | 141.9 | 151.9 | 170.7 | 177.59 |
| Úhel H – X – H | 107.8° | 93.6° | 91.8° | 91.3° | 90.48° |
Tyto plyny nemají žádný zápach v čisté formě, místo toho ho získávají při kontaktu se vzduchem. Amoniak má nechvalně známý, intenzivní zápach připomínající moč a / nebo Ryba, obvykle výsledkem rozkladu močovina. Fosfin voní jako ryba nebo česnek a stibin jako shnilá vejce, podobně jako sirovodík a selenid.
Dipnictogen tetrahydridy
| Složené názvy | Chemický vzorec | Geometrie | Model vyplňující prostor |
|---|---|---|---|
| dinitrogenhydrid hydrazin (diazan) | N2H4 |  |  |
| difosfor hydrid difosfin (difosfan ) | P2H4 | 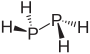 |  |
| diacid hydrid[1] průjm (průjmová ) | Tak jako2H4 |  |  |
Vlastnosti
Všechny nasycené atomy vodíku s přímým řetězcem se řídí vzorcem XnHn + 2.


Amoniak se průmyslově vyrábí v největším měřítku ze všech sloučenin. Jako voda, vodíkové vazby vede k vysoké teplotě tání a bodu varu ve srovnání s jinými hydridy pnictogenu, i když při tavení se ztrácí 26%, dalších 7% při zahřívání kapaliny k varu a zbývajících 67% při varu. Dalšími účinky vodíkové vazby jsou vysoká dielektrická konstanta a nízké hodnoty hustoty, viskozity a elektrické vodivosti. Stejně jako voda je to vynikající a často používané ionizační rozpouštědlo.[2] Více než dvacet dalších hydridů dusík jsou známé, nejdůležitější bytosti hydrazin (N2H4) a azid vodíku (HN3). Hydrazin má fyzikální vlastnosti, které jsou pozoruhodně podobné vlastnostem vody: jeho teploty tání a varu jsou 2,0 ° C a 113,5 ° C, hustota pevné látky při -5 ° C je 1,146 g / cm3, zatímco kapalina při 25 ° C je 1,00 g / cm3.[3] The azany jsou série, které zahrnují amoniak, hydrazin a triazan.
Fosfin, toxický, bezbarvý plyn, je nejstabilnějším hydridem fosforu a je prvním z homologního polyfosfanu řady P s přímým řetězcemnHn+2 (n = 1–9), které jsou stále tepelně nestabilnější n zvyšuje. Další cyklické a kondenzované polyfosfanové řady jsou známé z P.nHn hornínHn−18, v roce 1997 v množství 85 známých fosfanů. Nerozpustný ve vodě, ale rozpustný v organických kapalinách (stejně jako sirouhlík a kyselina trichloroctová ), fosfin je silné redukční činidlo.[4]
Arsin, stibin a bismuthin jsou vysoce toxické, tepelně nestabilní a bezbarvé plyny. U fosfinu, arsinu, stibinu nebo bismutinu se nenachází znatelná vodíková vazba a není zde patrná tendence disociovat jako amoniak na MH+
4 a MH−
2 (M = P, As, Sb, Bi). Hydrogeny pnictogenu jsou ve skupině hustší a délky vazeb M – H se zvětšují, zatímco úhel vazeb H – M – H se mírně zmenšuje. Standardní entalpie formace odrážejí zvyšující se tepelnou nestabilitu sestupující do skupiny. Arsine se rozkládá na arsen a vodík při 250–300 ° C, stibin až antimon a vodík při teplotě místnosti a bismuthin až vizmut a vodík nad -45 ° C. Arsin a stibin se velmi snadno oxidují na oxid arsenitý nebo antimonitý a vodu; podobná reakce se stane s síra nebo selen. Reakce s kovy při zvýšené teplotě vede k arsenidům a antimonidům. Je známo několik nižších hydridů, například As2H4, ale jsou ještě nestabilnější a jejich vlastnosti nejsou známy.[1]
Imidogen, radikál složený z jednoho atomu vodíku a jednoho atomu dusíku (NH), lze klasifikovat jako pnictogen hydrid.
Viz také
Reference
Bibliografie
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.







