Vinylalkohol - Vinyl alcohol - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Ethenol | |||
| Ostatní jména Hydroxyethen Hydroxyethylen | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.008.350 | ||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C2H4Ó | |||
| Molární hmotnost | 44,053 g / mol | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Vinylalkohol, také zvaný ethenol (Název IUPAC), je nejjednodušší enol. S vzorec CH2CHÓ H, je to labilní sloučenina, která se převádí na acetaldehyd. Není to předchůdce polyvinylalkohol.
Syntéza
Vinylalkohol může být tvořen pyrolytikem odstranění vody z ethylenglykol při teplotě 900 ° C a nízkém tlaku.[1]
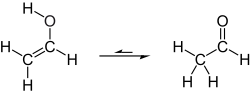
Tautomerizace vinylalkoholu na acetaldehyd
Za normálních podmínek se vinylalkohol převádí (tautomerizuje ) na acetaldehyd:
Při teplotě místnosti se přidá acetaldehyd (H3CC (O) H) je stabilnější než vinylalkohol (H2C = CHOH) o 42,7 kJ / mol:[2]
- H2C = CHOH → H3CC (O) H ΔH298, g = -42,7 kJ / mol

Nekatalyzovaný keto – enol tautomerismus migrací 1,3-vodíku je zakázán Woodward – Hoffmann vládne a proto má vysokou aktivační bariéru a není významnou cestou při teplotě místnosti nebo v její blízkosti. Avšak i stopové množství kyselin nebo zásad (včetně vody) může katalyzovat reakci. I při přísných opatřeních k minimalizaci náhodné vlhkosti nebo zdrojů protonů lze vinylalkohol skladovat pouze několik minut až hodin, než se izomerizuje na acetaldehyd. (Kyselina uhličitá je dalším příkladem látky, která je kineticky stabilní, když je přísně čistá, ale rychle se rozkládá v důsledku katalýzy stopovou vlhkostí.)
Tautomerizace může být také katalyzována fotochemickým procesem. Tato zjištění naznačují, že keto – enolová tautomerizace je životaschopnou cestou za atmosférických a stratosférických podmínek, která je důležitá pro roli vinylalkoholu při výrobě organických kyselin v atmosféře.[4][5]
Vinylalkohol lze stabilizovat kontrolou koncentrace vody v systému a využitím kinetické příznivosti alkoholu deuterium - vyrobeno kinetický izotopový efekt (kH+/kD+ = 4.75, kH2Ó/kD2Ó = 12). Stabilizace deuteria může být dosažena hydrolýzou a keten prekurzor v přítomnosti mírného stechiometrického přebytku těžká voda (D.2Ó). Studie ukazují, že tautomerizační proces je významně inhibován při okolních teplotách ( kt ≈ 10−6 M / s) a poločas rozpadu enolické formy lze snadno zvýšit na t1/2 = 42 minut pro kinetiku hydrolýzy prvního řádu.[6]
Vztah k polyvinylalkoholu
Kvůli nestabilitě vinylalkoholu, termoplast polyvinylalkohol (PVA nebo PVOH) se vyrábí nepřímo polymerací vinylacetát následován hydrolýza z ester vazby (Ac = acetyl; HOAc = kyselina octová):
- n CH2= CHOAc → (CH2−CHOAc)n
- (CH2−CHOAc)n + n H2O → (CH2-CHOH)n + n HOAc
Jako ligand
Několik kovové komplexy je známo, že obsahují vinylalkohol jako a ligand. Jedním příkladem je Pt (acac) (η2-C2H3OH) Cl.[7]
Výskyt v mezihvězdném médiu
Vinyl alkohol byl zjištěn v molekulární mrak Střelec B.[8] Jeho stabilita v (zředěném) mezihvězdné médium ukazuje, že k jeho tautomerizaci nedochází unimolekulárně.
Viz také
Reference
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart. Organická chemie, 2. vydání, str. 456-57. Oxford University Press, 2012. ISBN 978-0-19-927029-3.
- ^ R.D. Johnson III. "CCCBDB NIST Standardní referenční databáze". Citováno 2014-08-30.
- ^ J. A. Keith, P. M. Henry (2009). „Mechanismus Wackerovy reakce: Příběh dvou hydroxypalladací“. Angew. Chem. Int. Vyd. 48: 9038–9049. doi:10.1002 / anie.200902194. PMID 19834921.CS1 maint: používá parametr autoři (odkaz)
- ^ Heazlewood, B. R .; Maccarone, A. T .; Andrews, D. U .; Osborn, D. L .; Harding, L. B .; Klippenstein, S. J .; Jordan, M. J. T .; Kable, S. H. „Téměř prahová výměna H / D na CD3Fotodisociace CHO. "Nat. Chem. 2011, 3, 443−448. doi:10.1038 / nchem.1052
- ^ Andrews D. U., Heazlewood B. R., Maccarone A. T., Conroy T., Payne R. J., Jordan M. J. T., Kable S. H. (2012). „Foto-tautomerizace acetaldehydu na vinylalkohol: potenciální cesta k kyselinám troposféry“. Věda. 337: 1203–1206. doi:10.1126 / science.1220712. PMID 22903524.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Cederstav, Anna K .; Novak, Bruce M. (1994). „Vyšetřování chemie termodynamicky nestabilních druhů. Přímá polymerace vinylalkoholu, enolový tautomer acetaldehydu“. Journal of the American Chemical Society. 100 (9): 4073–4074. doi:10.1021 / ja00088a051.
- ^ Cotton F. A., Francis J. N., Frenz B. A., Tsutsui M. (1973). "Struktura dihapto (vinylalkoholového) komplexu platiny (II)". Journal of the American Chemical Society. 95: 2483–6. doi:10.1021 / ja00789a011.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ „Vědci připíjejí na objev vinylalkoholu v mezihvězdném prostoru“. Národní radioastronomická observatoř. 2001-10-01. Citováno 2006-12-20.