Farmakodynamika estradiolu - Pharmacodynamics of estradiol
The farmakologie z estradiol, an estrogen léky a přirozeně se vyskytující steroidní hormon, týká se jeho farmakodynamika, farmakokinetika a různé způsoby podání.[1][2][3]
Estradiol je a přirozeně se vyskytující a bioidentický estrogen nebo an agonista z estrogenový receptor, biologický cíl z estrogeny jako endogenní estradiol.[1] Estradiol má díky své estrogenní aktivitě antigonadotropní účinky a může bránit plodnost a potlačit pohlavní hormon Výroba u žen i mužů.[4][5] Estradiol se liší od nebioidentických estrogenů konjugované estrogeny a ethinylestradiol různými způsoby s důsledky pro snášenlivost a bezpečnost.[1]
Estradiol lze užívat pusou, držen pod jazykem, jako gel nebo náplast to je aplikován na kůži, dovnitř vagíny tím, že injekce do svalu nebo Tlustý, nebo prostřednictvím použití implantát, který je umístěn do tuku, mimo jiné trasy.[1]
Mechanismus účinku
Estradiol je estrogen, nebo agonista z jaderný estrogenové receptory (ER), estrogenový receptor alfa (ERα) a estrogenový receptor beta (ERβ).[1][2][6] V jedné studii se ES50 hodnota estradiolu pro lidský ERa byla 50 pM (0,05 nM) a pro lidský ERp byla 200 pM (0,2 nM).[2][7] Estradiol je také agonistou membránové estrogenové receptory (mER), včetně Estrogenový receptor spojený s G proteinem (GPER) (3–6 nM),[8] Gqspojený membránový estrogenový receptor (Gq-mER), ER-X, a ERx.[9][10] Je to mnohem víc silný jako estrogen než jiné přírodní a bioidentický estrogeny jako estron a estriol.[1] Dána subkutánní injekce u myší je estradiol asi 10krát účinnější než estron a asi 100krát účinnější než estriol.[11] Kromě toho velká část estrogenní účinnosti estronu in vivo je ve skutečnosti důsledkem přeměny na estradiol.[1]
Estradiol má málo k ne afinita pro ostatní receptory steroidních hormonů, včetně androgen, progesteron, glukokortikoid, a mineralokortikoidové receptory.[12][13][14] Má slabou afinitu k androgennímu receptoru, asi 8% relativní vazebná afinita testosteronu podle jedné studie,[15] a vykazuje agonistickou aktivitu na tomto receptoru.[16] Estrogeny však cirkulují v pikomolární (10−12 M), zatímco androgeny cirkulují v nanomolární (10−9 M) až mikromolární (10−6 M) rozsah,[17][18] a v souladu s tím je estradiol aktivní jako estrogen v cílových tkáních v přibližně 1 000krát nižších koncentracích než testosteron.[19] Navíc, zatímco estradiol vykazoval aktivaci androgenního receptoru in vitro při velmi vysokých koncentracích byla jeho účinnost jako agonisty androgenového receptoru tak nízká, že nebylo možné vypočítat ES50 hodnota aktivity.[16] Je tedy nepravděpodobné, že slabá aktivita estradiolu na androgenním receptoru bude mít při normálních fyziologických koncentracích biologický význam.[15][16]
Afinity estradiolu k ER jsou vysoké (kolem 0,1 nM) a v relativně nízkém množství je asi 10 000 až 20 000 ER cytoplazma za buňka v cílových tkáních estrogenu.[20] Estradiol zůstává vázán na ER asi 24 hodin, což je déle než u jiných estrogenů, jako je estriol (6 hodin).[1] Prodloužená doba vazby na ER (např. 9 až 12 hodin po endometria účinky), stejně jako u estradiolu, je nezbytný pro plnou estrogenní odpověď v různých tkáních.[1] ER downregulate s expozicí estradiolu a v souladu s tím výraz ER je závislá na koncentraci estradiolu.[21][22] Konstantní hladiny estradiolu mohou vést k downregulaci ER a relativně sníženým reakcím na estradiol, i když to nebylo klinicky hodnoceno.[21] Jakmile se naváží na estradiol, jsou ER ubikvitinovaný a degradován podle proteazomy, což je hlavní mechanismus downregulace ER.[22] Nenavázaný ERα má intracelulární poločas až 5 dní, ale to se zkracuje na 3–4 hodin jednou vázáno na a ligand jako je estradiol.[23][22] Deprivace estrogenu může snadno zvýšit citlivost na estrogeny, jako je estradiol, 10 000krát nebo více, což prokazuje hlubokou kapacitu ER pro upregulaci a downregulaci.[24] Toto zvýšení citlivosti je zprostředkováno 100násobným zvýšením ER, jakož i dalšími mechanismy, jako jsou změny v koaktivátor citlivost a stupeň fosforylace z transaktivační faktory.[24] Gestageny jako progesteron a androgeny jako testosteron downregulujte ER v určitých tkáních, jako je endometrium a prsa, mezi ostatními.[25][1][26]
Estradiol je a steroid a a lipofilní sloučenina.[1][27] Díky tomu snadno vstoupí buňky přes jednoduché pasivní difúze skrz lipidová dvojvrstva z buněčná membrána.[27] To je v rozporu s hydrofilní estrogenové konjugáty jako estron sulfát a estradiol glukuronid, které vyžadují aktivní transport přes konkrétní membránové transportní proteiny vstoupit do buněk.[28][29][30] ER jsou jaderné receptory které jsou většinou přítomny v buněčné jádro.[27] Na vazba estradiolu na ER, receptor dimerizuje (kombinuje) s jiným ER vázaným na estradiol.[1][27] Tyto ER dimery může být ERα – ERα nebo ERβ – ERβ homodimery nebo ERα – ERβ heterodimery.[1] Jakmile je v dimerizovaném stavu, je ER – ER vázán na estradiol komplex váže se na short prvky reakce na estrogen (ERE) (z minima nukleotidová sekvence 5'-GGTCANNNTGACC-3 ', kde N je jakýkoli nukleotid) v promotér oblasti reagující na estrogen geny na chromozomy, zase modulující jejich výraz.[1][27][31] Některé prominentní příklady genů obsahujících ERE, a tedy estrogenem modulovaných genů u lidí, zahrnují geny kódující proteiny oxytocin, c-fos, c-myc, a transformující růstový faktor alfa (TGFα).[32]
| Ligand | Ostatní jména | Relativní vazebné afinity (RBA,%)A | Absolutní vazebné afinity (K.i, nM)A | Akce | ||
|---|---|---|---|---|---|---|
| ERα | ERβ | ERα | ERβ | |||
| Estradiol | E2; 17p-estradiol | 100 | 100 | 0.115 (0.04–0.24) | 0.15 (0.10–2.08) | Estrogen |
| Estrone | E1; 17-Ketoestradiol | 16.39 (0.7–60) | 6.5 (1.36–52) | 0.445 (0.3–1.01) | 1.75 (0.35–9.24) | Estrogen |
| Estriol | E3; 16a-OH-17p-E2 | 12.65 (4.03–56) | 26 (14.0–44.6) | 0.45 (0.35–1.4) | 0.7 (0.63–0.7) | Estrogen |
| Estetrol | E4; 15a, 16a-Di-OH-17p-E2 | 4.0 | 3.0 | 4.9 | 19 | Estrogen |
| Alfatradiol | 17α-estradiol | 20.5 (7–80.1) | 8.195 (2–42) | 0.2–0.52 | 0.43–1.2 | Metabolit |
| 16-Epiestriol | 16p-hydroxy-17p-estradiol | 7.795 (4.94–63) | 50 | ? | ? | Metabolit |
| 17-Epiestriol | 16α-hydroxy-17a-estradiol | 55.45 (29–103) | 79–80 | ? | ? | Metabolit |
| 16,17-epiestriol | 16p-Hydroxy-17a-estradiol | 1.0 | 13 | ? | ? | Metabolit |
| 2-hydroxyestradiol | 2-OH-E2 | 22 (7–81) | 11–35 | 2.5 | 1.3 | Metabolit |
| 2-methoxyestradiol | 2-MeO-E2 | 0.0027–2.0 | 1.0 | ? | ? | Metabolit |
| 4-hydroxyestradiol | 4-OH-E2 | 13 (8–70) | 7–56 | 1.0 | 1.9 | Metabolit |
| 4-methoxyestradiol | 4-MeO-E2 | 2.0 | 1.0 | ? | ? | Metabolit |
| 2-hydroxyestron | 2-OH-E1 | 2.0–4.0 | 0.2–0.4 | ? | ? | Metabolit |
| 2-methoxyestron | 2-MeO-E1 | <0.001–<1 | <1 | ? | ? | Metabolit |
| 4-hydroxyestron | 4-OH-E1 | 1.0–2.0 | 1.0 | ? | ? | Metabolit |
| 4-methoxyestron | 4-MeO-E1 | <1 | <1 | ? | ? | Metabolit |
| 16α-hydroxyestron | 16a-OH-El; 17-Ketoestriol | 2.0–6.5 | 35 | ? | ? | Metabolit |
| 2-hydroxyestriol | 2-OH-E3 | 2.0 | 1.0 | ? | ? | Metabolit |
| 4-methoxyestriol | 4-MeO-E3 | 1.0 | 1.0 | ? | ? | Metabolit |
| Estradiol sulfát | E2S; Estradiol 3-sulfát | <1 | <1 | ? | ? | Metabolit |
| Estradiol disulfát | Estradiol 3,17p-disulfát | 0.0004 | ? | ? | ? | Metabolit |
| Estradiol 3-glukuronid | E2-3G | 0.0079 | ? | ? | ? | Metabolit |
| Estradiol 17β-glukuronid | E2-17G | 0.0015 | ? | ? | ? | Metabolit |
| Estradiol 3-gluc. 17p-sulfát | E2-3G-17S | 0.0001 | ? | ? | ? | Metabolit |
| Estrone sulfát | E1S; Estrone 3-sulfát | <1 | <1 | >10 | >10 | Metabolit |
| Estradiol benzoát | EB; Estradiol 3-benzoát | 10 | ? | ? | ? | Estrogen |
| Estradiol 17β-benzoát | E2-17B | 11.3 | 32.6 | ? | ? | Estrogen |
| Estrone methylether | Estron 3-methylether | 0.145 | ? | ? | ? | Estrogen |
| ent-Estradiol | 1-estradiol | 1.31–12.34 | 9.44–80.07 | ? | ? | Estrogen |
| Equilin | 7-dehydroestron | 13 (4.0–28.9) | 13.0–49 | 0.79 | 0.36 | Estrogen |
| Ekvilenin | 6,8-didehydroestron | 2.0–15 | 7.0–20 | 0.64 | 0.62 | Estrogen |
| 17p-dihydroekvilin | 7-dehydro-17p-estradiol | 7.9–113 | 7.9–108 | 0.09 | 0.17 | Estrogen |
| 17α-dihydroekvilin | 7-dehydro-17a-estradiol | 18.6 (18–41) | 14–32 | 0.24 | 0.57 | Estrogen |
| 17p-dihydroekvilenin | 6,8-didehydro-17p-estradiol | 35–68 | 90–100 | 0.15 | 0.20 | Estrogen |
| 17α-dihydroekvilenin | 6,8-didehydro-17a-estradiol | 20 | 49 | 0.50 | 0.37 | Estrogen |
| Δ8-Estradiol | 8,9-dehydro-17p-estradiol | 68 | 72 | 0.15 | 0.25 | Estrogen |
| Δ8-Estrone | 8,9-dehydroestron | 19 | 32 | 0.52 | 0.57 | Estrogen |
| Ethinylestradiol | EE; 17α-Ethynyl-17β-E2 | 120.9 (68.8–480) | 44.4 (2.0–144) | 0.02–0.05 | 0.29–0.81 | Estrogen |
| Mestranol | EE 3-methylether | ? | 2.5 | ? | ? | Estrogen |
| Moxestrol | RU-2858; Llp-methoxy-EE | 35–43 | 5–20 | 0.5 | 2.6 | Estrogen |
| Methylestradiol | 17a-methyl-17p-estradiol | 70 | 44 | ? | ? | Estrogen |
| Diethylstilbestrol | DES; Stilbestrol | 129.5 (89.1–468) | 219.63 (61.2–295) | 0.04 | 0.05 | Estrogen |
| Hexestrol | Dihydrodiethylstilbestrol | 153.6 (31–302) | 60–234 | 0.06 | 0.06 | Estrogen |
| Dienestrol | Dehydrostilbestrol | 37 (20.4–223) | 56–404 | 0.05 | 0.03 | Estrogen |
| Benzestrol (B2) | – | 114 | ? | ? | ? | Estrogen |
| Chlorotrianisen | TACE | 1.74 | ? | 15.30 | ? | Estrogen |
| Trifenyletylen | TPE | 0.074 | ? | ? | ? | Estrogen |
| Trifenylbromethylen | TPBE | 2.69 | ? | ? | ? | Estrogen |
| Tamoxifen | ICI-46 474 | 3 (0.1–47) | 3.33 (0.28–6) | 3.4–9.69 | 2.5 | SERM |
| Afimoxifen | 4-hydroxytamoxifen; 4-OHT | 100.1 (1.7–257) | 10 (0.98–339) | 2.3 (0.1–3.61) | 0.04–4.8 | SERM |
| Toremifen | 4-chlorotamoxifen; 4-CT | ? | ? | 7.14–20.3 | 15.4 | SERM |
| Klomifen | MRL-41 | 25 (19.2–37.2) | 12 | 0.9 | 1.2 | SERM |
| Cyklofenil | F-6066; Sexovid | 151–152 | 243 | ? | ? | SERM |
| Nafoxidin | U-11 000A | 30.9–44 | 16 | 0.3 | 0.8 | SERM |
| Raloxifen | – | 41.2 (7.8–69) | 5.34 (0.54–16) | 0.188–0.52 | 20.2 | SERM |
| Arzoxifen | LY-353 381 | ? | ? | 0.179 | ? | SERM |
| Lasofoxifen | CP-336 156 | 10.2–166 | 19.0 | 0.229 | ? | SERM |
| Ormeloxifen | Centchroman | ? | ? | 0.313 | ? | SERM |
| Levormeloxifen | 6720-CDRI; NNC-460 020 | 1.55 | 1.88 | ? | ? | SERM |
| Ospemifen | Deaminohydroxytoremifen | 2.63 | 1.22 | ? | ? | SERM |
| Bazedoxifen | – | ? | ? | 0.053 | ? | SERM |
| Etacstil | GW-5638 | 4.30 | 11.5 | ? | ? | SERM |
| ICI-164 384 | – | 63.5 (3.70–97.7) | 166 | 0.2 | 0.08 | Antiestrogen |
| Fulvestrant | ICI-182 780 | 43.5 (9.4–325) | 21.65 (2.05–40.5) | 0.42 | 1.3 | Antiestrogen |
| Propylpyrazoletriol | PPT | 49 (10.0–89.1) | 0.12 | 0.40 | 92.8 | Agonista ERα |
| 16α-LE2 | 16α-lakton-17p-estradiol | 14.6–57 | 0.089 | 0.27 | 131 | Agonista ERα |
| 16α-Iodo-E2 | 16a-jod-17p-estradiol | 30.2 | 2.30 | ? | ? | Agonista ERα |
| Methylpiperidinopyrazol | MPP | 11 | 0.05 | ? | ? | Antagonista ERα |
| Diarylpropionitril | DPN | 0.12–0.25 | 6.6–18 | 32.4 | 1.7 | Agonista ERp |
| 8β-VE2 | 8p-Vinyl-17p-estradiol | 0.35 | 22.0–83 | 12.9 | 0.50 | Agonista ERp |
| Prinaberel | ERB-041; WAY-202 041 | 0.27 | 67–72 | ? | ? | Agonista ERp |
| ERB-196 | WAY-202,196 | ? | 180 | ? | ? | Agonista ERp |
| Erteberel | SERBA-1; 500 500 LY | ? | ? | 2.68 | 0.19 | Agonista ERp |
| SERBA-2 | – | ? | ? | 14.5 | 1.54 | Agonista ERp |
| Coumestrol | – | 9.225 (0.0117–94) | 64.125 (0.41–185) | 0.14–80.0 | 0.07–27.0 | Xenoestrogen |
| Genistein | – | 0.445 (0.0012–16) | 33.42 (0.86–87) | 2.6–126 | 0.3–12.8 | Xenoestrogen |
| Equol | – | 0.2–0.287 | 0.85 (0.10–2.85) | ? | ? | Xenoestrogen |
| Daidzein | – | 0.07 (0.0018–9.3) | 0.7865 (0.04–17.1) | 2.0 | 85.3 | Xenoestrogen |
| Biochanin A | – | 0.04 (0.022–0.15) | 0.6225 (0.010–1.2) | 174 | 8.9 | Xenoestrogen |
| Kaempferol | – | 0.07 (0.029–0.10) | 2.2 (0.002–3.00) | ? | ? | Xenoestrogen |
| Naringenin | – | 0.0054 (<0.001–0.01) | 0.15 (0.11–0.33) | ? | ? | Xenoestrogen |
| 8-Prenylnaringenin | 8-PN | 4.4 | ? | ? | ? | Xenoestrogen |
| Quercetin | – | <0.001–0.01 | 0.002–0.040 | ? | ? | Xenoestrogen |
| Ipriflavon | – | <0.01 | <0.01 | ? | ? | Xenoestrogen |
| Miroestrol | – | 0.39 | ? | ? | ? | Xenoestrogen |
| Deoxymiroestrol | – | 2.0 | ? | ? | ? | Xenoestrogen |
| β-sitosterol | – | <0.001–0.0875 | <0.001–0.016 | ? | ? | Xenoestrogen |
| Resveratrol | – | <0.001–0.0032 | ? | ? | ? | Xenoestrogen |
| a-Zearalenol | – | 48 (13–52.5) | ? | ? | ? | Xenoestrogen |
| p-zearalenol | – | 0.6 (0.032–13) | ? | ? | ? | Xenoestrogen |
| Zeranol | a-Zearalanol | 48–111 | ? | ? | ? | Xenoestrogen |
| Taleranol | p-Zearalanol | 16 (13–17.8) | 14 | 0.8 | 0.9 | Xenoestrogen |
| Zearalenon | ZEN | 7.68 (2.04–28) | 9.45 (2.43–31.5) | ? | ? | Xenoestrogen |
| Zearalanon | ZAN | 0.51 | ? | ? | ? | Xenoestrogen |
| Bisfenol A | BPA | 0.0315 (0.008–1.0) | 0.135 (0.002–4.23) | 195 | 35 | Xenoestrogen |
| Endosulfan | EDS | <0.001–<0.01 | <0.01 | ? | ? | Xenoestrogen |
| Kepone | Chlordekon | 0.0069–0.2 | ? | ? | ? | Xenoestrogen |
| o, p '-DDT | – | 0.0073–0.4 | ? | ? | ? | Xenoestrogen |
| p, p '-DDT | – | 0.03 | ? | ? | ? | Xenoestrogen |
| Methoxychlor | p, p '-Dimethoxy-DDT | 0.01 (<0.001–0.02) | 0.01–0.13 | ? | ? | Xenoestrogen |
| HPTE | Hydroxychlor; p, p '-OH-DDT | 1.2–1.7 | ? | ? | ? | Xenoestrogen |
| Testosteron | T; 4-Androstenolone | <0.0001–<0.01 | <0.002–0.040 | >5000 | >5000 | Androgen |
| Dihydrotestosteron | DHT; 5α-Androstanolone | 0.01 (<0.001–0.05) | 0.0059–0.17 | 221–>5000 | 73–1688 | Androgen |
| Nandrolon | 19-nortestosteron; 19-NT | 0.01 | 0.23 | 765 | 53 | Androgen |
| Dehydroepiandrosteron | DHEA; Prasterone | 0.038 (<0.001–0.04) | 0.019–0.07 | 245–1053 | 163–515 | Androgen |
| 5-Androstendiol | A5; Androstendiol | 6 | 17 | 3.6 | 0.9 | Androgen |
| 4-Androstendiol | – | 0.5 | 0.6 | 23 | 19 | Androgen |
| 4-Androstendion | A4; Androstendion | <0.01 | <0.01 | >10000 | >10000 | Androgen |
| 3α-Androstandiol | 3α-Adiol | 0.07 | 0.3 | 260 | 48 | Androgen |
| 3β-Androstandiol | 3β-Adiol | 3 | 7 | 6 | 2 | Androgen |
| Androstandion | 5α-Androstandion | <0.01 | <0.01 | >10000 | >10000 | Androgen |
| Etiocholanedion | 5β-Androstandion | <0.01 | <0.01 | >10000 | >10000 | Androgen |
| Methyltestosteron | 17α-methyltestosteron | <0.0001 | ? | ? | ? | Androgen |
| Ethinyl-3α-androstandiol | 17a-Ethynyl-3a-adiol | 4.0 | <0.07 | ? | ? | Estrogen |
| Ethinyl-3β-androstandiol | 17a-Ethynyl-3p-adiol | 50 | 5.6 | ? | ? | Estrogen |
| Progesteron | P4; 4-Pregnendion | <0.001–0.6 | <0.001–0.010 | ? | ? | Progestogen |
| Norethisteron | SÍŤ; 17α-Ethynyl-19-NT | 0.085 (0.0015–<0.1) | 0.1 (0.01–0.3) | 152 | 1084 | Progestogen |
| Norethynodrel | 5 (10) -Norethisteron | 0.5 (0.3–0.7) | <0.1–0.22 | 14 | 53 | Progestogen |
| Tibolon | 7α-Methylnorethynodrel | 0.5 (0.45–2.0) | 0.2–0.076 | ? | ? | Progestogen |
| Δ4-Tibolon | 7α-methylnorethisteron | 0.069–<0.1 | 0.027–<0.1 | ? | ? | Progestogen |
| 3α-hydroxytibolon | – | 2.5 (1.06–5.0) | 0.6–0.8 | ? | ? | Progestogen |
| 3β-hydroxytibolon | – | 1.6 (0.75–1.9) | 0.070–0.1 | ? | ? | Progestogen |
| Poznámky pod čarou: A = (1) Vazebná afinita hodnoty mají formát „medián (rozsah)“ (# (# - #)), „rozsah“ (# - #) nebo „hodnota“ (#) v závislosti na dostupných hodnotách. Úplné sady hodnot v rozmezí najdete v kódu Wiki. (2) Vazebné afinity byly stanoveny pomocí studií vytěsnění u různých typů in-vitro systémy s označeno estradiol a člověk ERα a ERβ proteiny (s výjimkou hodnot ERp od Kuiper et al. (1997), které jsou krysí ERp). Zdroje: Viz stránka šablony. | ||||||
| Estrogen | Relativní vazebné afinity (%) | ||||||
|---|---|---|---|---|---|---|---|
| ER | AR | PR | GR | PAN | SHBG | CBG | |
| Estradiol | 100 | 7.9 | 2.6 | 0.6 | 0.13 | 8.7–12 | <0.1 |
| Estradiol benzoát | ? | ? | ? | ? | ? | <0.1–0.16 | <0.1 |
| Estradiol valerát | 2 | ? | ? | ? | ? | ? | ? |
| Estrone | 11–35 | <1 | <1 | <1 | <1 | 2.7 | <0.1 |
| Estrone sulfát | 2 | 2 | ? | ? | ? | ? | ? |
| Estriol | 10–15 | <1 | <1 | <1 | <1 | <0.1 | <0.1 |
| Equilin | 40 | ? | ? | ? | ? | ? | 0 |
| Alfatradiol | 15 | <1 | <1 | <1 | <1 | ? | ? |
| Epiestriol | 20 | <1 | <1 | <1 | <1 | ? | ? |
| Ethinylestradiol | 100–112 | 1–3 | 15–25 | 1–3 | <1 | 0.18 | <0.1 |
| Mestranol | 1 | ? | ? | ? | ? | <0.1 | <0.1 |
| Methylestradiol | 67 | 1–3 | 3–25 | 1–3 | <1 | ? | ? |
| Moxestrol | 12 | <0.1 | 0.8 | 3.2 | <0.1 | <0.2 | <0.1 |
| Diethylstilbestrol | ? | ? | ? | ? | ? | <0.1 | <0.1 |
| Poznámky: Odkaz ligandy (100%) byly progesteron pro PR, testosteron pro AR, estradiol pro ER, dexamethason pro GR, aldosteron pro PAN, dihydrotestosteron pro SHBG, a kortizol pro CBG. Zdroje: Viz šablona. | |||||||
| Estrogen | Ostatní jména | RBA (%)A | REP (%)b | |||
|---|---|---|---|---|---|---|
| ER | ERα | ERβ | ||||
| Estradiol | E2 | 100 | 100 | 100 | ||
| Estradiol 3-sulfát | E2S; E2-3S | ? | 0.02 | 0.04 | ||
| Estradiol 3-glukuronid | E2-3G | ? | 0.02 | 0.09 | ||
| Estradiol 17β-glukuronid | E2-17G | ? | 0.002 | 0.0002 | ||
| Estradiol benzoát | EB; Estradiol 3-benzoát | 10 | 1.1 | 0.52 | ||
| Estradiol 17β-acetát | E2-17A | 31–45 | 24 | ? | ||
| Estradiol diacetát | EDA; Estradiol 3,17p-diacetát | ? | 0.79 | ? | ||
| Estradiol propionát | EP; Estradiol 17β-propionát | 19–26 | 2.6 | ? | ||
| Estradiol valerát | EV; Estradiol 17β-valerát | 2–11 | 0.04–21 | ? | ||
| Estradiol cypionát | EC; Estradiol 17β-cypionát | ?C | 4.0 | ? | ||
| Estradiol palmitát | Estradiol 17β-palmitát | 0 | ? | ? | ||
| Estradiolstearát | Estradiol 17β-stearát | 0 | ? | ? | ||
| Estrone | E1; 17-Ketoestradiol | 11 | 5.3–38 | 14 | ||
| Estrone sulfát | E1S; Estrone 3-sulfát | 2 | 0.004 | 0.002 | ||
| Estron glukuronid | E1G; Estrone 3-glukuronid | ? | <0.001 | 0.0006 | ||
| Ethinylestradiol | EE; 17α-Ethynylestradiol | 100 | 17–150 | 129 | ||
| Mestranol | EE 3-methylether | 1 | 1.3–8.2 | 0.16 | ||
| Quinestrol | EE 3-cyklopentylether | ? | 0.37 | ? | ||
| Poznámky pod čarou: A = Relativní vazebné afinity (RBA) byly stanoveny pomocí in-vitro posunutí označeno estradiol z estrogenové receptory (ER) obecně z hlodavec děložní cytosol. Estrogen estery jsou variabilně hydrolyzovaný v těchto systémech na estrogeny (kratší délka esterového řetězce -> větší rychlost hydrolýzy) a ER RBA esterů silně klesá, když je zabráněno hydrolýze. b = Relativní estrogenní potence (REP) byly vypočteny z poloviční maximální účinné koncentrace (ES50), které byly stanoveny prostřednictvím in-vitro β ‐ galaktosidáza (β-gal) a zelený fluorescenční protein (GFP) Výroba testy v droždí vyjadřující člověka ERα a lidské ERβ. Oba savčí buňky a kvasinky mají schopnost hydrolyzovat estrogenové estery. C = Spřízněnost estradiol cypionát pro ER jsou podobné těm z estradiol valerát a estradiol benzoát (postava ). Zdroje: Viz stránka šablony. | ||||||
| Estrogen | ER RBA (%) | Hmotnost dělohy (%) | Uterotrofie | LH úrovně (%) | SHBG RBA (%) |
|---|---|---|---|---|---|
| Řízení | – | 100 | – | 100 | – |
| Estradiol | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| Estrone | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| Estriol | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| Estetrol | 0.5 ± 0.2 | ? | Neaktivní | ? | 1 |
| 17α-estradiol | 4.2 ± 0.8 | ? | ? | ? | ? |
| 2-hydroxyestradiol | 24 ± 7 | 285 ± 8 | +b | 31–61 | 28 |
| 2-methoxyestradiol | 0.05 ± 0.04 | 101 | Neaktivní | ? | 130 |
| 4-hydroxyestradiol | 45 ± 12 | ? | ? | ? | ? |
| 4-methoxyestradiol | 1.3 ± 0.2 | 260 | ++ | ? | 9 |
| 4-fluorestradiolA | 180 ± 43 | ? | +++ | ? | ? |
| 2-hydroxyestron | 1.9 ± 0.8 | 130 ± 9 | Neaktivní | 110–142 | 8 |
| 2-methoxyestron | 0.01 ± 0.00 | 103 ± 7 | Neaktivní | 95–100 | 120 |
| 4-hydroxyestron | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-methoxyestron | 0.13 ± 0.04 | 338 | ++ | 65–92 | 12 |
| 16α-hydroxyestron | 2.8 ± 1.0 | 552 ± 42 | +++ | 7–24 | <0.5 |
| 2-hydroxyestriol | 0.9 ± 0.3 | 302 | +b | ? | ? |
| 2-methoxyestriol | 0.01 ± 0.00 | ? | Neaktivní | ? | 4 |
| Poznámky: Hodnoty jsou průměr ± SD nebo rozsah. ER RBA = Relativní vazebná afinita na estrogenové receptory krysy děložní cytosol. Hmotnost dělohy = procento změny hmotnosti dělohy za mokra ovariektomizováno krysy po 72 hodinách s kontinuálním podáváním 1 μg / hodinu přes subkutánně implantován osmotické pumpy. LH úrovně = Luteinizační hormon hladiny ve srovnání s výchozí hodnotou krys po ovariektomii po 24 až 72 hodinách kontinuálního podávání subkutánním implantátem. Poznámky pod čarou: A = Syntetický (tj. ne endogenní ). b = Atypický uterotrofní účinek, který náhorní plošiny do 48 hodin (uterotrofie estradiolu pokračuje lineárně až do 72 hodin). Zdroje: Viz šablona. | |||||
Účinky na tělo a mozek
ER jsou široce exprimovány v celém těle, včetně v prsa, děloha, pochva, prostaty, Tlustý, kůže, kost, játra, hypofýza, hypotalamus a jinde po celém světě mozek.[33] Prostřednictvím aktivace ER (stejně jako MER) má estradiol mnoho účinků, včetně následujících:
- Podporuje růst, funkci a údržbu prsou, dělohy a pochvy během puberty a poté[33][34]
- Zprostředkovává ukládání podkožní tuk v ženský vzor, zejména v prsou, boky, hýždě, a stehna[35]
- Udržuje zdraví, celistvost, vzhled a hydrataci pokožky a zpomaluje rychlost stárnutí pokožky[36]
- Produkuje růstový spurt a uzávěr epifýzy u obou pohlaví během puberty zprostředkovává rozšíření boků u žen během puberty a udržuje kostní minerální hustota u obou pohlaví po celý život[37][38]
- Moduluje syntéza jaterních proteinů, jako je výroba globulin vázající pohlavní hormony (SHBG) a mnoho dalších bílkoviny s následnými účinky na kardiovaskulární systém a různé další systémy[3]
- Exertuje negativní zpětná vazba na osa hypotalamus – hypofýza – gonadální (Osa HPG) potlačením sekrece gonadotropinů FSH a LH z hypofýzy, čímž inhibuje gonadal pohlavní hormon produkce i ovulace a plodnost[39][3][40]
- Reguluje vazomotorický systém a tělesná teplota přes hypotalamus, čímž zabrání návalům horka[41][42]
- Moduluje funkci mozku s účinky na nálada, citovost, a sexualita, stejně jako poznání a Paměť[43]
- Ovlivňuje riziko a / nebo progresi hormonálně citlivých rakovin, včetně rakoviny prsu, rakoviny prostaty a rakoviny endometria[44][3]
Bylo také zjištěno, že estrogen zvyšuje vylučování z oxytocin a zvýšit výraz jeho receptor, oxytocinový receptor, v mozek.[18] U žen byla shledána dostatečná jedna dávka estradiolu ke zvýšení koncentrací oxytocinu v oběhu.[45]
| Sloučenina | Dávka pro konkrétní použití (obvykle mg)[A] | ||||||
|---|---|---|---|---|---|---|---|
| ETD[b] | EPD[b] | MSD[b] | MSD[C] | OID[C] | TSD[C] | ||
| Estradiol (nemikronový) | 30 | ≥120–300 | 120 | 6 | - | - | |
| Estradiol (mikronizovaný) | 6–12 | 60–80 | 14–42 | 1–2 | >5 | >8 | |
| Estradiol valerát | 6–12 | 60–80 | 14–42 | 1–2 | - | >8 | |
| Estradiol benzoát | - | 60–140 | - | - | - | - | |
| Estriol | ≥20 | 120–150[d] | 28–126 | 1–6 | >5 | - | |
| Estriol sukcinát | - | 140–150[d] | 28–126 | 2–6 | - | - | |
| Estrone sulfát | 12 | 60 | 42 | 2 | - | - | |
| Konjugované estrogeny | 5–12 | 60–80 | 8.4–25 | 0.625–1.25 | >3.75 | 7.5 | |
| Ethinylestradiol | 200 μg | 1–2 | 280 μg | 20–40 μg | 100 μg | 100 μg | |
| Mestranol | 300 μg | 1.5–3.0 | 300–600 μg | 25–30 μg | > 80 μg | - | |
| Quinestrol | 300 μg | 2–4 | 500 μg | 25–50 μg | - | - | |
| Methylestradiol | - | 2 | - | - | - | - | |
| Diethylstilbestrol | 2.5 | 20–30 | 11 | 0.5–2.0 | >5 | 3 | |
| DES dipropionát | - | 15–30 | - | - | - | - | |
| Dienestrol | 5 | 30–40 | 42 | 0.5–4.0 | - | - | |
| Dienestrol diacetát | 3–5 | 30–60 | - | - | - | - | |
| Hexestrol | - | 70–110 | - | - | - | - | |
| Chlorotrianisen | - | >100 | - | - | >48 | - | |
| Methallenestril | - | 400 | - | - | - | - | |
| Estrogen | HF | VE | UCa | FSH | LH | HDL -C | SHBG | CBG | AGT | Játra |
|---|---|---|---|---|---|---|---|---|---|---|
| Estradiol | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
| Estrone | ? | ? | ? | 0.3 | 0.3 | ? | ? | ? | ? | ? |
| Estriol | 0.3 | 0.3 | 0.1 | 0.3 | 0.3 | 0.2 | ? | ? | ? | 0.67 |
| Estrone sulfát | ? | 0.9 | 0.9 | 0.8–0.9 | 0.9 | 0.5 | 0.9 | 0.5–0.7 | 1.4–1.5 | 0.56–1.7 |
| Konjugované estrogeny | 1.2 | 1.5 | 2.0 | 1.1–1.3 | 1.0 | 1.5 | 3.0–3.2 | 1.3–1.5 | 5.0 | 1.3–4.5 |
| Equilin sulfát | ? | ? | 1.0 | ? | ? | 6.0 | 7.5 | 6.0 | 7.5 | ? |
| Ethinylestradiol | 120 | 150 | 400 | 60–150 | 100 | 400 | 500–600 | 500–600 | 350 | 2.9–5.0 |
| Diethylstilbestrol | ? | ? | ? | 2.9–3.4 | ? | ? | 26–28 | 25–37 | 20 | 5.7–7.5 |
Zdroje a poznámky pod čarou Poznámky: Hodnoty jsou poměry s estradiolem jako standardem (tj. 1,0). Zkratky: HF = Klinická úleva od návaly horka. VE = Zvýšeno proliferace z vaginální epitel. UCa = Pokles UCa. FSH = Potlačení FSH úrovně. LH = Potlačení LH úrovně. HDL-C, SHBG, CBG, a AGT = Zvýšení sérových hladin těchto látek jaterní bílkoviny. Játra = Poměr jaterních estrogenních účinků k obecným / systémovým estrogenním účinkům (návaly horka /gonadotropiny ). Zdroje: Viz šablona. | ||||||||||
| Estrogen | Formulář | Dávka (mg) | Doba trvání dávky (mg) | ||
|---|---|---|---|---|---|
| EPD | CICD | ||||
| Estradiol | Vod. soln. | ? | – | <1 d | |
| Solný olej | 40–60 | – | 1–2 ≈ 1–2 d | ||
| Vod. susp. | ? | 3.5 | 0,5–2 ≈ 2–7 d; 3,5 ≈> 5 d | ||
| Microsph. | ? | – | 1 ≈ 30 d | ||
| Estradiol benzoát | Solný olej | 25–35 | – | 1,66 ≈ 2–3 dny; 5 ≈ 3–6 d | |
| Vod. susp. | 20 | – | 10 ≈ 16–21 d | ||
| Emulze | ? | – | 10 ≈ 14–21 d | ||
| Estradiol dipropionát | Solný olej | 25–30 | – | 5 ≈ 5–8 d | |
| Estradiol valerát | Solný olej | 20–30 | 5 | 5 ≈ 7–8 d; 10 ≈ 10–14 d; 40 ≈ 14–21 d; 100 ≈ 21–28 d | |
| Estradiol benz. butyrát | Solný olej | ? | 10 | 10 ≈ 21 d | |
| Estradiol cypionát | Solný olej | 20–30 | – | 5 ≈ 11–14 d | |
| Vod. susp. | ? | 5 | 5 ≈ 14–24 d | ||
| Estradiol enanthate | Solný olej | ? | 5–10 | 10 ≈ 20–30 d | |
| Estradiol dienanthát | Solný olej | ? | – | 7,5 ≈> 40 d | |
| Estradiol undecylát | Solný olej | ? | – | 10–20 ≈ 40–60 d; 25–50 ≈ 60–120 d | |
| Polyestradiol fosfát | Vod. soln. | 40–60 | – | 40 ≈ 30 d; 80 ≈ 60 d; 160 ≈ 120 d | |
| Estrone | Solný olej | ? | – | 1–2 ≈ 2–3 d | |
| Vod. susp. | ? | – | 0,1–2 ≈ 2–7 dní | ||
| Estriol | Solný olej | ? | – | 1–2 ≈ 1–4 d | |
| Polyestriol fosfát | Vod. soln. | ? | – | 50 ≈ 30 d; 80 ≈ 60 d | |
Poznámky a zdroje Poznámky: Všechno vodné suspenze jsou z mikrokrystalický velikost částic. Estradiol výroba během menstruační cyklus je 30–640 µg / d (6,4–8,6 mg celkem za měsíc nebo cyklus). The vaginální epitel zrání dávka estradiol benzoát nebo estradiol valerát bylo hlášeno jako 5 až 7 mg / týden. Efektivní dávka inhibující ovulaci z estradiol undecylát je 20–30 mg / měsíc. Zdroje: Viz šablona. | |||||
Účinky na hladiny pohlavních hormonů
Antigonadotropní účinky
Estrogeny jsou silné antigonadotropiny při dostatečně vysokých koncentracích.[40][65][66][4][5] Vynaložením negativní zpětná vazba na osa hypotalamus – hypofýza – gonadální (Osa HPG), jsou schopni potlačit vylučování z gonadotropiny, LH a FSH, a tím inhibují produkci pohlavních hormonů gonád a hladiny cirkulujících pohlavních hormonů stejně jako plodnost (ovulace u žen a spermatogeneze u mužů).[40][65][66] Klinické studie zjistily, že u mužů s nimi léčených mohou estrogeny maximálně potlačit hladinu testosteronu přibližně o 95% nebo dobře do rozmezí kastrát / žena (<50 ng / dL).[4][5] To odpovídá snížení hladiny testosteronu dosaženého orchiektomie a analog hormonu uvolňujícího gonadotropin (Analog GnRH), což odpovídá úplnému zastavení produkce testosteronu gonád.[67][68] Kromě toho je větší, než je dosaženo u vysokých dávek progestogenů, jako je cyproteronacetát a gestonoron kaproát, který může maximálně potlačit hladinu testosteronu u mužů přibližně o 75%.[69][70][71][72][73]
Inhibice ovulace monoterapie estradiolem u žen byla studována a prokázána pro perorální estradiol, transdermální náplasti estradiolu, subkutánní estradiolové implantáty a intramuskulární estradiol undecylát injekce.[74][75][76][77][78][62] Studie inhibice ovulace u žen zjistila, že perorální nemikronizovaný estradiol byl 55% účinný při 1 mg / den, 61% účinný při 2 mg / den a 88% účinný při 5 mg / den.[62][63]
Potlačení hladiny testosteronu estradiolem v rozmezí kastrát / žena (<50 ng / dl) u mužů vyžaduje relativně vysoké hladiny estradiolu a je spojováno s cirkulujícími hladinami 200 až 300 pg / ml a vyšší.[79][5] Přestože rozsah kastrátů u mužů byl definován jako koncentrace testosteronu nižší než 50 ng / dl, průměrné hladiny testosteronu s chirurgickou kastrací jsou ve skutečnosti asi 15 ng / dl.[80] K dosažení takových hladin testosteronu při léčbě estradiolem byly nutné vyšší koncentrace estradiolu asi 500 pg / ml, aby se dosáhlo požadovaného maximálního potlačení produkce testosteronu.[4] Injikované estradiolestery jako polyestradiol fosfát, estradiol valerát, a estradiol undecylát, stejně jako vysoké dávky estradiolových transdermálních náplastí, se používají jako forma vysoká dávka estrogenu terapie k potlačení hladiny testosteronu do rozmezí kastrátů u mužů s rakovinou prostaty.[3][81][82][83][5][71] Vysoké dávky estradiolu v různých formách a způsobech se také používají k potlačení hladiny testosteronu u transgender žen.[84][85][86] Potlačení hladiny testosteronu estradiolem u mužů je rychlé.[87] Jedna intramuskulární injekce 2 mg vodného estradiolu potlačila hladinu testosteronu u mladých mužů z výchozí hodnoty 760 ng / dl na 295 ng / dl (snížení o 60%) po 24 hodinách a na maximum 123 ng / dl (snížení o 85%) po 36 hodin.[87]
Nižší dávky a koncentrace estradiolu mohou také významně potlačit sekreci gonadotropinů a hladinu testosteronu u mužů a transgender žen.[88][89] Retrospektivní studie perorální monoterapie estradiolem u transgender žen zjistila, že dávky 1 až 8 mg / den zvýšily průměrné hladiny estradiolu na přibližně 50 až 150 pg / ml a potlačily průměrné hladiny testosteronu na přibližně 10 až 120 ng / dL.[57] Byla však vysoká interindividuální variabilita dosažených hladin estradiolu a testosteronu a hladiny testosteronu byly u mnoha nedostatečně potlačeny dokonce i při dávce 8 mg / den.[57] V jiné studii byla dávka 1 mg / den perorálně podávaného mikronizovaného estradiolu u zdravých starších mužů, která zvýšila hladiny estradiolu v oběhu relativně vysoké 6krát (na 159 pg / ml), hladiny estronu 15krát (na 386 Bylo zjištěno, že hladiny SHBG o 17% potlačují celkovou hladinu testosteronu o 27% (na 436 ng / dl) a hladiny volného testosteronu o 34% (na 11,8 ng / dl).[88][89] Farmakodynamická studie potlačení testosteronu polyestradiolfosfátem u mužů s rakovinou prostaty zjistila, že hladiny estradiolu asi 135 pg / ml (500 pmol / l) sníží hladinu testosteronu o 50% (ze 430 ng / dL na 215 ng / dL), zatímco hladiny estradiolu asi 410 až 545 pg / ml (1 500–2 000 pmol / l) by snížily hladinu testosteronu až do rozmezí kastrátů na asi 6 až 12 ng / dL (0,2–0,4 nmol / l).[90]
Ústní konjugované estrogeny bylo zjištěno, že v dávce 7,5 mg / den potlačuje celkovou hladinu testosteronu u mužů ve stejném rozsahu jako 3 mg / den perorálně diethylstilbestrol, což je minimální dávka diethylstilbestrolu potřebná k důslednému potlačení celkové hladiny testosteronu do rozmezí kastrátů (<50 ng / dL).[56] Ekvivalentní dávka v případě perorálního estradiolu nebyla popsána. Na základě výsledků jedné studie se však zdá, že je vyšší než 8 mg / den.[57] Kromě toho je známo, že orální estradiol má podobnou nebo mírně nižší antigonadotropní účinnost než orální konjugované estrogeny; potence perorálních konjugovaných estrogenů, pokud jde o potlačení hladin LH a FSH, je 1,0 a 1,1–1,3 ve srovnání s perorálním estradiolem.[1][48]
Kromě jejich antigonadotropních účinků se zdá, že vysoké koncentrace estrogenů mají toxické účinky na testy, a při dlouhodobé (> 3 roky) terapii, může případně trvale snížit schopnost varlat produkovat testosteron.[91][92][93][94][95][96][97][98] Může se také jednat o dlouhodobé potlačení funkce hypofýzy, přetrvávající i po vysazení estrogenu.[98] Při krátkodobější terapii bylo hlášeno, že morfologie varlat se vrátí k normálu během 18 až 24 měsíců.[99]
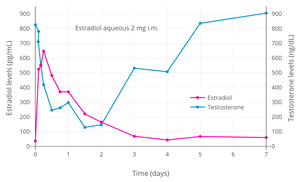
- Antigonadotropní účinky estradiolu

Hladiny testosteronu ve vztahu k hladinám estradiolu (a odpovídajícím dávkám estradiolu) během léčby samotným estradiolem nebo v kombinaci s antiandrogenem u transgender žen.[57] Přerušovaná fialová čára je horní mez pro rozmezí žen / kastrátů (~ 50 ng / dL) a přerušovaná šedá čára představuje hladinu testosteronu ve srovnávací skupině pooperačních transgender žen (21,7 pg / ml).[57]

Hladiny estradiolu a testosteronu v průběhu 12 týdnů po jedné intramuskulární injekci 320 mg polyestradiol fosfát u mužů s rakovinou prostaty.[79]

Hladiny estradiolu a testosteronu s polyestradiolfosfátem 160, 240 nebo 320 mg jednou za 4 týdny intramuskulární injekcí u mužů s rakovinou prostaty.[100]

Hladiny estradiolu, testosteronu a prolaktinu se 100 mg estradiolu undecylátu za měsíc intramuskulární injekcí u mužů s rakovinou prostaty.[103]
Progonadotropní účinky
Obecně jsou estrogeny antigonadotropní a inhibují sekreci gonadotropinu.[104][105] U žen však na konci studie dochází k prudkému zvýšení hladin estradiolu na přibližně 200 až 500 pg / ml folikulární fáze (uprostřed cyklu) během normálu menstruační cyklus a paradoxně spouští nárůst sekrece LH a FSH.[104][106][105] K tomu dochází, když koncentrace estradiolu dosáhnou úrovně přibližně 250 až 300 pg / ml.[107] Během nárůstu v polovině cyklu se hladiny LH zvyšují 3 až 12krát a hladiny FSH se zvyšují 2 až 4krát.[108][109][110] Náraz trvá přibližně 24 až 36 hodin a spouští se ovulace, prasknutí dominantní ovariální folikul a vydání vejce z vaječník do vejcovod.[104] Bylo také zjištěno, že tento účinek přepětí gonadotropinu zprostředkovaný estrogenem se vyskytuje exogenní estrogen, včetně transgenderových žen na hormonální terapii a předhormonální terapii transsexuálové akutně vystaven vysoké dávce estrogenu, ale nevyskytuje se u mužů, transgenderových žen před hormonální terapií nebo transgenderových mužů na hormonální terapii, což naznačuje hormonálně založený rozdíl pohlaví.[111] Progestogeny mají antiestrogenní účinky na progonadotropní účinky estrogenů[112] a dostatečné množství progesteronu (odpovídá hladinám vyšším než 2 ng / ml) nebo progestin brání nárůstu hladin gonadotropinu u žen v polovině cyklu estradiolem.[113][114] Takto progestiny zabraňují ovulaci a částečně zprostředkovávají jejich antikoncepční účinky u žen.[114]
Účinky na hladinu androgenů nadledvin
Kromě svých antigonadotropních účinků mohou estrogeny ve vysokých koncentracích významně snížit produkci androgenu nadledviny.[3][115][116] Studie zjistila, že léčba vysokou dávkou ethinylestradiolu (100 µg / den) omezila oběh adrenální androgen u transgender žen 27 až 48%.[3][115][116] Další studie zjistila podobné účinky u mužů s rakovinou prostaty, s hladinami adrenálních androgenů dehydroepiandrosteron (DHEA), dehydroepiandrosteron sulfát (DHEA-S) a androstendion (A4) vše významně klesá více při léčbě vysokými dávkami estrogenu (perorální ethinylestradiol plus intramuskulární polyestradiol fosfát) než u orchiektomie (o 33–39%, respektive 10–26%).[117]
Studie však zjistila, že k těmto účinkům došlo u vysokých dávek perorálních a syntetických estrogenů, jako je ethinylestradiol a estramustin fosfát ale ne u parenterálního estrogenpolyestradiolfosfátu, což naznačuje, že pokles hladin androgenů v nadledvinkách je sekundární k změnám v syntéze jaterních proteinů, spíše než kvůli přímému kůra nadledvin, a že k těmto změnám dojde pouze v kontextu silného vlivu na játra.[92][118] Kortizol hladiny v ostatních skupinách (např. orchiektomie, terapie agonisty GnRH a parenterální léčba estrogeny) v této studii zůstaly nezměněny, ale zvýšily se o 300 až 400% ve skupinách užívajících perorální a syntetické estrogeny, pravděpodobně sekundárně ke zvýšení jaterních globulin vázající kortikosteroidy (CBG) produkce a kompenzační upregulace nadledvin kortikosteroidy syntéza.[118]
Změny hladin slabých androgenů nadledvin jsou relevantní, protože tyto androgeny slouží jako cirkulující rezervoár prekurzory které se transformují v tkáních na silné androgeny, jako je testosteron a dihydrotestosteron a na estrogeny.[119][120][121][122]
Účinky na syntézu jaterních bílkovin
Estradiol a další estrogeny modulují syntéza jaterních proteinů prostřednictvím aktivace jaterní ER.[1] Estradiol zvyšuje produkci a rozšířením cirkulujících hladin globulin vázající pohlavní hormony (SHBG), globulin vázající kortikosteroidy (CBG), angiotensinogen (AGT), protein těhotenské zóny (PZP), koagulační faktory a mnoho dalších jaterní proteiny.[1] Estradiol naopak snižuje syntézu jater a v širším smyslu cirkulující hladiny růstový faktor podobný inzulínu 1 (IGF-1).[1] Účinky estradiolu na syntézu jaterních bílkovin jsou zmírněny způsob podání, s ústní podání které mají 4- nebo 5krát silnější účinky na syntézu jaterních bílkovin než dávky od transdermální cesta s ekvivalentní obecnou / systémovou estrogenní účinností.[1] Vliv estradiolu na syntézu jaterních bílkovin má v těle různé účinky s dopady na biologická dostupnost androgenů a kardiovaskulární Systém.[1]
Vliv 2 mg / den perorálně podávaného estradiolu na hladiny jaterních proteinů, jako jsou SHBG, CBG a AGT, je mnohem nižší než u perorálních 10 μg / den ethinylestradiol.[123][68] Vaginální mikronizovaný estradiol v dávce 0,25 mg / den zvýšil hladinu SHBG asi o 10% po 2 týdnech léčby u žen.[124][125] Antikoncepční pilulky obsahující estradiol Bylo zjištěno, že, které obsahují 1 až 3 mg / den estradiolu nebo estradiolvalerátu, zvyšují hladiny SHBG 1,5krát.[126][127] Bylo zjištěno, že jak perorální estradiolvalerát v dávce 6 mg / den, tak intrasmuskulární estradiolvalerát v dávce 10 mg každých 10 dní zvyšují hladiny SHBG 2,5 až 3krát transgender ženy.[128][129][130] Pro srovnání, kombinované antikoncepční pilulky Bylo zjištěno, že obsahující ethinylestradiol a progestin s minimální androgenní nebo antiandrogenní aktivitou zvyšují hladiny SHBG přibližně 3 až 4krát.[131] Vysoká dávka polyestradiol fosfát podle intramuskulární injekce bylo zjištěno, že zvyšuje hladiny SHBG asi 1,5krát.[4][68]
Estradiol valerát v olejovém roztoku intramuskulární injekcí byl studován při léčbě rakoviny prostaty.[132][133][134][135] Ačkoli má parenterální estradiol ve srovnání s perorálním estradiolem a nebioidentickými estrogeny snížené účinky na syntézu jaterních bílkovin a rozšířenou koagulaci a kardiovaskulární riziko, což je vlastnost, kterou lze přičíst absenci nepřiměřených účinků na játra, dostatečné dávky parenterálního estradiolu mohou nicméně vést k vysokým koncentrace estradiolu v játrech a mohou se zvyšovat koagulace a kardiovaskulární riziko podobně.[132][133][135] Bylo zjištěno, že estradiol valerát v dávce 10 až 40 mg intramuskulární injekcí jednou za 2 týdny u mužů s rakovinou prostaty zvyšuje markery koagulace a plazminogen aktivace systému, například úrovně komplex trombin – antitrombin a kvantitativní D-dimery.[132][133][135] Podávání denní profylaktické léčby antikoagulace ve formě nízkomolekulární heparin byl schopen úspěšně vrátit tyto markery hemostázy na výchozí hodnotu.[132][135] Dávky estradiolvalerátu 10 až 40 mg intramuskulární injekcí byly také použity omezit krvácení u žen s krvácení kvůli nefunkční děložní krvácení, i když je to primárně způsobeno stimulací růst dělohy.[51]:318[136]:60
| Proteiny, Všeobecné | Koagulační faktory | ||
|---|---|---|---|
| Sloučenina | Účinek | Sloučenina | Účinek |
| α1-Antitrypsin | + | Antitrombin III | − |
| Albumin | − | C-reaktivní protein | + |
| Alkalická fosfatáza | + | Koagulační faktor II | + |
| Angiotensinogen | + | Koagulační faktor VII | + |
| Bilirubin | + | Koagulační faktor VIII | + |
| Ceruloplasmin | + | Koagulační faktor IX | + |
| Globulin vázající kortikosteroidy (transkortin) | + | Koagulační faktor X | + |
| χ-glutamyl transpeptidáza | + | Koagulační faktor XII | + |
| Růstový hormon | + | Fibrinogen | + |
| Protein vázající růstový hormon | + | Plasminogen | + |
| Inzulinu podobný růstový faktor 1 | − | Protein C. | + |
| Haptoglobin | − | Protrombinový čas | − |
| Leucyl aminopeptidáza | + | Lipidy | |
| α2-Mikroglobulin | + | Sloučenina | Účinek |
| Orosomucoid (α1-kyselinový glykoprotein) | − | Apolipoprotein A | + |
| Protein v těhotenské zóně | + | Lipoprotein s vysokou hustotou | + |
| Protein vázající retinol | + | Lipoprotein s nízkou hustotou | − |
| Globulin vázající pohlavní hormony | + | Lecitin | + |
| Globulin vázající tyroxin | + | Celkový obsah lipidů | + |
| Transferrin | + | Triglyceridy | + |
| Klíč: + = Zvýšeno. - = Sníženo. Zdroje: Viz šablona. | |||
Další efekty
Bylo hlášeno, že estrogeny downregulují androgenní receptor výraz v tuková tkáň, a může tak inhibovat účinky androgenů na distribuce tuku.[137][138][139]
Rozdíly od jiných estrogenů


Estradiol má orálně relativně nízkou hladinu biologická dostupnost asi 5%.[1] Kromě toho existuje značné interindividuální variabilita v hladinách estradiolu dosažených perorálním estradiolem.[1] Na rozdíl od estradiolu syntetický estrogen ethinylestradiol má asi 45% orální biologickou dostupnost, přibližně 80- až 200krát vyšší systémovou orální estrogenní účinnost, zhruba 500- až 1 500krát vyšší jaterní dosažena orální estrogenní účinnost a menší interindividuální variabilita v hladinách cirkulujícího estrogenu.[68][1][141][142][143][144][145] Perorální dávka ethinylestradiolu, která je přibližně 100krát nižší než dávka estradiolu, je obdobná maximální koncentrace cirkulujícího estrogenu (např. 50 pg / ml ethinylestradiolu s jednou dávkou 20 μg ethinylestradiolu ve srovnání s 40 pg / ml estradiolu s jednou dávkou 2 mg mikronizovaného estradiolu nebo estradiolvalerátu).[1] Tyto rozdíly jsou způsobeny zavedením ethynylová skupina v poloze C17α v ethinylestradiolu (také známém jako 17α-ethynylestradiol), což vede k sterická překážka a výrazně snižuje metabolismus prvního průchodu ethinylestradiolu ve srovnání s estradiolem při perorálním podání.[1] Estradiol a ethinylestradiol mají podobné spřízněnosti pro a účinnost jako agonisté ER,[1][2] a systémová estrogenní účinnost estradiolu a ethinylestradiolu je podobná, pokud jsou podávány intravenózní trasa.[146]
Syntetické estrogeny, jako je ethinylestradiol a diethylstilbestrol a přirozené, ale odvozené od zvířat konjugované estrogeny mít nepřiměřené účinky na syntéza jaterních proteinů vzhledem k jejich účinkům v jiných tkáních ve srovnání s estradiolem.[1] V dávkách orálním způsobem se srovnatelnou systémovou estrogenní účinností mají konjugované estrogeny přibližně 1,3 až 4,5násobek hepatotropní účinnost (tj. účinnost při modulaci syntéza jaterních proteinů ) estradiolu, ethinylestradiol má přibližně 2,9 až 5,0násobek hepatotropní účinnosti estradiolu a diethylstilbestrol vykazuje přibližně 5,7 až 7,5násobek hepatotropní účinnosti estradiolu (vše měřeno pomocí malého výběru estrogenem modulovaných jaterních proteinů, které zahrnovaly HDL cholesterol, SHBG, CBG, a angiotensinogen ).[1] Vyšší hepatotropní účinnost těchto estrogenů ve srovnání s estradiolem souvisí s náchylností k jaternímu metabolismu.[1] Zatímco estradiol je metabolizován a tím rychle inaktivován po vstupu do jater, jiné estrogeny, jako je ethinylestradiol a diethylstilbestrol, jsou rezistentní na metabolismus v játrech a přetrvávají v játrech po delší dobu.[1] To se odráží v biologických poločasech těchto estrogenů; poločas estradiolu v krvi je přibližně 1 až 2 hodiny, zatímco poločasy ethinylestradiolu a diethylstilbestrolu jsou přibližně 20 hodin, respektive 24 hodin.[147][148][145] V souladu se svým dlouhým poločasem prochází ethinylestradiol játry mnohokrát před jeho eliminací.[149] Protože lidé nejsou přizpůsobeno účinně metabolizovat konjugované estrogeny (které jsou koňský (koňské) estrogeny) a syntetické estrogeny, jako je ethinylestradiol a diethylstilbestrol, tyto estrogeny nejsou řádně inaktivovány v játrech, což vede k výrazně nepřiměřeným jaterním estrogenním účinkům.[1]
Kromě rozdílů v hepatotropní účinnosti mezi estradiolem a jinými estrogeny existují rozdíly v hepatotropní účinnosti mezi různými způsoby podávání estradiolu.[1] Díky prvnímu průchodu játry vede perorální estradiol k nepřiměřeným a nefyziologickým hladinám estradiolu v játrech, které jsou 4 až 5krát vyšší než v oběhu.[150][1] Naopak parenterální cesty estradiolu, jako je transdermální, vaginální a injekční, obcházejí první průchod játry a produkují hladiny estradiolu v oběhu a játrech, které jsou srovnatelné.[150][1] Jako příklad sníženého jaterního účinku parenterálního estradiolu ve srovnání s perorálním estradiolem studie zjistila, že 1 mg / den perorální estradiol významně zvýšil hladiny SHBG o 45%, zatímco 50 μg / den transdermální estradiol zvýšil hladiny SHBG nevýznamně pouze o 12 % (přičemž tyto dávky jsou zhruba ekvivalentní v systémové estrogenní účinnosti).[151][152][153] Jako takové nejenžebioidentický estrogeny, jako je ethinylestradiol a konjugované estrogeny, mají podstatně větší účinnost v játrech než perorální estradiol, orální estradiol má podstatně větší účinnost v játrech než parenterální estradiol.[1] To znamená, že hepatotropní účinky perorálních nebioidentických estrogenů, jako je ethinylestradiol, jsou obrovské ve srovnání s parenterálním estradiolem (viz graf výše / vpravo), který má na rozdíl od těchto estrogenů velmi slabé nebo dokonce žádné účinky na syntézu jaterních proteinů terapeutické dávky.[1][79][68][3] Zatímco intramuskulární polyestradiol-fosfát s vysokou dávkou 320 mg / měsíc zvýšil hladiny SHBG na 166% u mužů s rakovinou prostaty, kombinace intramuskulárního polyestradiol-fosfátu s dávkou 80 mg / měsíc a vysoká dávka orálního ethinylestradiolu v dávce 150 µg / den zvýšila hladinu SHBG na 617% , téměř 8násobný rozdíl ve zvýšení a téměř 4násobný rozdíl v absolutních hladinách mezi dvěma režimy léčby.[4][79][154]
Účinky estrogenů na syntézu jaterních bílkovin, například na syntéza z koagulační faktory, lipoproteiny, a triglyceridy, může způsobit zvýšené riziko tromboembolický a kardiovaskulární komplikace, které mohou vést ke zvýšení úmrtnost.[68] Riziko tromboembolických a kardiovaskulárních komplikací je významně zvýšeno u postmenopauzálních žen užívajících perorální konjugované estrogeny jako součást menopauzální hormonální terapie.[1][155][156] Orální estradiol i orální esterifikované estrogeny Bylo zjištěno, že mají významně nižší riziko tromboembolických a kardiovaskulárních komplikací než orální konjugované estrogeny, a zdá se, že transdermální estradiol taková rizika vůbec nemá.[1][157][155][156] V minulosti široce používané perorální syntetické estrogeny, jako je ethinylestradiol a diethylstilbestrol, se již nepoužívají v menopauzální hormonální terapii kvůli jejich vysokému riziku tromboembolických a kardiovaskulárních komplikací.[158] Studie zjistily výrazně zvýšené 5leté riziko kardiovaskulární úmrtnosti o 14 až 26% u mužů léčených vysokými dávkami perorálních syntetických estrogenů, jako je ethinylestradiol a diethylstilbestrol na rakovinu prostaty.[68] U diethylstilbestrolu je až 35% výskyt kardiovaskulární toxicity a až 15% výskyt žilní tromboembolismus.[159] V malé studii porovnávající intramuskulární polyestradiol-fosfát s vysokou dávkou 320 mg / měsíc oproti kombinaci polyestradiol-fosfátu s dávkou 80 mg / měsíc s vysokými dávkami 150 µg / den perorálně podávaného ethinylestradiolu pro rakovinu prostaty byl 25% výskyt kardiovaskulárních komplikací v průběhu roku ve skupině, která byla také léčena ethinylestradiolem, zatímco ve skupině obsahující pouze polyestradiol-fosfát nebyly žádné kardiovaskulární komplikace.[79] V souladu s tím jiná studie nezjistila žádnou změnu hladin koagulační faktor VII, protein zvláště důležitý v kardiovaskulárních vedlejších účincích estrogenů, s 240 mg / měsíc intramuskulárního polyestradiol fosfátu.[160] Navzdory výrazně sníženému dopadu parenterálního estradiolu na játra ve srovnání s jinými estrogeny však mohou vysoké dávky parenterálního estradiolu, které produkují vysoké hladiny cirkulujícího estradiolu, stále vést k důležitým a nežádoucím změnám v syntéze jaterních bílkovin jako u jiných estrogenů.[40] Bylo zjištěno, že vysoká dávka polyestradiolfosfátu 320 mg / měsíc vede k významně zvýšené kardiovaskulární morbiditě (kvůli nefatální ischemické srdeční příhody a srdeční dekompenzace ) u mužů s rakovinou prostaty ve dvou velkých studiích, ačkoli kardiovaskulární úmrtnost nebyla výrazně zvýšena.[40][161]
Kromě jater vykazuje ethinylestradiol nepřiměřené estrogenní účinky na děloha.[1][43][162] To je způsobeno jeho neschopností být inaktivován dělohou 17β-hydroxysteroid dehydrogenáza (17p-HSD).[1][43][162] Vzhledem k nepřiměřeným účinkům na dělohu je ethinylestradiol spojen s významně nižším výskytem vaginální krvácení a špinění než je estradiol, zejména v kombinaci s progestogeny (které indukují expresi 17β-HSD a tudíž metabolismus estradiolu v děloze),[1] a je důležitým faktorem, který přispívá k tomu, proč byl etinylestradiol, mimo jiné, a navzdory horšímu bezpečnostnímu profilu, široce používán v perorálních kontraceptivách místo estradiolu.[127][126] Ačkoli má ethinylestradiol zvýšené účinky na dělohu ve srovnání s estradiolem, není podobně spojen se zvýšením rizika hyperplazie endometria a rakovina endometria při použití v kombinaci s progestogenem, ale místo toho s významným poklesem.[1][163]
Viz také
Reference
- ^ A b C d E F G h i j k l m n Ó str q r s t u proti w X y z aa ab ac inzerát ae af ag ah ai aj ak al dopoledne an ao ap Kuhl H (2005). „Farmakologie estrogenů a progestogenů: vliv různých cest podání“ (PDF). Klimakterický. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ A b C d Michael Oettel; Ekkehard Schillinger (6. prosince 2012). Estrogeny a antiestrogeny I: Fyziologie a mechanismy působení estrogenů a antiestrogenů. Springer Science & Business Media. 121, 226, 235–237. ISBN 978-3-642-58616-3.
- ^ A b C d E F G h Michael Oettel; Ekkehard Schillinger (6. prosince 2012). Estrogeny a antiestrogeny II: Farmakologie a klinické použití estrogenů a antiestrogenů. Springer Science & Business Media. str. 163–178, 235–237, 252–253, 261–276, 538–543. ISBN 978-3-642-60107-1.
- ^ A b C d E F G Stege R, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A (1988). "Terapie polyestradiolfosfátem v jedné léčbě rakoviny prostaty". Dopoledne. J. Clin. Oncol. 11 Suppl 2: S101–3. doi:10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ A b C d E F Ockrim JL, Lalani EN, Laniado ME, Carter SS, Abel PD (2003). „Transdermální léčba estradiolem u pokročilého karcinomu prostaty - dopředu do minulosti?“. J. Urol. 169 (5): 1735–7. doi:10.1097 / 01.ju.0000061024.75334,40. PMID 12686820.
- ^ Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P, Nicolas JC, Cavaillès V, Balaguer P (2006). "Hodnocení selektivity ligandu pomocí reportérových buněčných linií stabilně exprimujících estrogenový receptor alfa nebo beta". Biochem. Pharmacol. 71 (10): 1459–69. doi:10.1016 / j.bcp.2006.02.002. PMID 16554039.
- ^ Barkhem T, Carlsson B, Nilsson Y, Enmark E, Gustafsson J, Nilsson S (červenec 1998). „Diferenciální odpověď estrogenového receptoru alfa a estrogenového receptoru beta na parciální agonisty / antagonisty estrogenu“. Mol. Pharmacol. 54 (1): 105–12. doi:10,1124 / mol. 54.1.105. PMID 9658195.
- ^ Prossnitz ER, Arterburn JB (červenec 2015). „International Union of Basic and Clinical Pharmacology. XCVII. G Protein-Coupled Estrogen Receptor and its Pharmacologic Modulators“. Pharmacol. Rev. 67 (3): 505–40. doi:10.1124 / pr.114.009712. PMC 4485017. PMID 26023144.
- ^ Soltysik K, Czekaj P (duben 2013). „Membránové estrogenové receptory - je to alternativní způsob působení estrogenu?“. J. Physiol. Pharmacol. 64 (2): 129–42. PMID 23756388.
- ^ Prossnitz ER, Barton M (květen 2014). „Estrogenová biologie: Nové poznatky o funkci GPER a klinických příležitostech“. Mol. Buňka. Endokrinol. 389 (1–2): 71–83. doi:10.1016 / j.mce.2014.02.002. PMC 4040308. PMID 24530924.
- ^ A. Labhart (6. prosince 2012). Klinická endokrinologie: teorie a praxe. Springer Science & Business Media. 548, 551. ISBN 978-3-642-96158-8.
- ^ Ojasoo T, Raynaud JP (listopad 1978). „Unikátní kongenery steroidů pro studium receptorů“. Cancer Res. 38 (11 Pt 2): 4186–98. PMID 359134.
- ^ Ojasoo T, Delettré J, Mornon JP, Turpin-VanDycke C, Raynaud JP (1987). "Směrem k mapování progesteronových a androgenních receptorů". J. Steroid Biochem. 27 (1–3): 255–69. doi:10.1016/0022-4731(87)90317-7. PMID 3695484.
- ^ Raynaud JP, Bouton MM, Moguilewsky M, Ojasoo T, Philibert D, Beck G, Labrie F, Mornon JP (leden 1980). "Steroidní hormonální receptory a farmakologie". J. Steroid Biochem. 12: 143–57. doi:10.1016/0022-4731(80)90264-2. PMID 7421203.
- ^ A b Raynaud, J.P .; Ojasoo, T .; Bouton, M. M.; Philibert, D. (1979). Drogový design. 169–214. doi:10.1016 / B978-0-12-060308-4.50010-X. ISBN 9780120603084.
- ^ A b C Blankvoort BM, de Groene EM, van Meeteren-Kreikamp AP, Witkamp RF, Rodenburg RJ, Aarts JM (listopad 2001). „Vývoj testu na androgenní reportérový gen (AR-LUX) využívající lidskou buněčnou linii s endogenně regulovaným androgenním receptorem“. Anální. Biochem. 298 (1): 93–102. doi:10.1006 / abio.2001.5352. PMID 11673900.
- ^ Eberhard Nieschlag; Hermann M. Behre; Susan Nieschlag (26. července 2012). Testosteron: Akce, nedostatek, substituce. Cambridge University Press. str. 495–. ISBN 978-1-107-01290-5.
- ^ A b Goldstein I, Meston CM, Davis S, Traish A (17. listopadu 2005). Sexuální funkce a dysfunkce žen: studium, diagnostika a léčba. CRC Press. str. 205–540. ISBN 978-1-84214-263-9.
- ^ Robert Marcus; David W. Dempster; Jane A. Cauley; David Feldman (13. června 2013). Osteoporóza. Akademický tisk. str. 1117–. ISBN 978-0-12-398252-0.
Celkově muži vydělávají 20krát více androgenů než ženy; podíl androgenu přeměněného na E2 je u žen 200krát vyšší; a E2 je 1000krát účinnější než androgeny (na molární bázi) v cílových tkáních [28]. Hladiny cirkulujícího estrogenu se tedy měří v pikogramech a hladiny testosteronu se měří v nanogramech.
- ^ Thomas, John A .; Keenan, Edward J. (1986). Principy endokrinní farmakologie. str. 135–165. doi:10.1007/978-1-4684-5036-1_7. ISBN 978-0-306-42143-3.
Cytoplazmatické estrogenové receptory charakteristicky vykazují vysokou afinitu k estradiolu-17J3 s rovnovážnou disociační konstantou 0,1 nM. Počet těchto míst v cílových tkáních je obecně nízký, přibližně 10 000 - 20 000 míst na buňku.
- ^ A b Wibowo E, Schellhammer P, Wassersug RJ (leden 2011). „Role estrogenu v normální mužské funkci: klinické důsledky pro pacienty s rakovinou prostaty na androgenní deprivační terapii“. J. Urol. 185 (1): 17–23. doi:10.1016 / j.juro.2010.08.094. PMID 21074215.
V buněčné kultuře37 a hlodavcích gonadektomovaných48 může přidání E vyvolat autoregulaci ER. Toto zjištění naznačuje, že exprese ER závisí na hladině E v séru a udržení účinné buněčné odpovědi na regulaci E2 ER je zásadní. Dlouhodobé podávání E2 v konstantní dávce nemusí být pro pacienty s PCa maximálně účinné. V důsledku kontinuální expozice mohou být ER sníženy, což snižuje jejich účinnost. Proto může být výhodné spíše cyklické než kontinuální podávání E.
- ^ A b C Nawaz Z, Lonard DM, Dennis AP, Smith CL, O'Malley BW (březen 1999). „Degradace receptoru lidského estrogenu závislá na proteazomu“. Proc. Natl. Acad. Sci. USA. 96 (5): 1858–62. Bibcode:1999PNAS ... 96.1858N. doi:10.1073 / pnas.96.5.1858. PMC 26701. PMID 10051559.
- ^ Miller, Colette (říjen 2015). „Stručný přehled struktury a funkce estrogenového receptoru alfa (BCMB8010 Enzyme Project)“. doi:10,13140 / RG.2.1.4082.5044.
ERα je relativně stabilní v buňce s poločasem až 5 dnů, avšak jakmile se naváže na ligand, tato doba se zkrátí na 3-4 hodiny.
Citovat deník vyžaduje| deník =(Pomoc) - ^ A b Kloosterboer, Helenius; Schoonen, Willem; Verheul, Herman (2008). Rakovina prsu. str. 343–366. doi:10.3109/9781420058734-19. ISBN 978-1-4200-5872-7.
Například deprivace steroidů může mít zásadní vliv na stimulaci růstu pomocí E2. Citlivost na estrogen lze snadno zvýšit o čtyři logaritmické jednotky nebo více (Masamura et al., 1995; Chan et al., 2002) (obr. 1). Tento účinek lze vysvětlit alespoň částečně stokrát vyšší úrovní ER (Zajchowski et al., 1993), ale citlivost koaktivátoru i stupeň fosforylace transaktivačních faktorů (TAF-1 a / nebo TAF-2) mohou být také zásadní.
- ^ Mauvais-Jarvis P, Kuttenn F, Gompel A (1986). "Antiestrogenní účinek progesteronu v prsní tkáni". Breast Cancer Res. Zacházet. 8 (3): 179–88. doi:10.1007 / BF01807330. PMID 3297211. S2CID 17511105.
- ^ Zhou J, Ng S, Adesanya-Famuiya O, Anderson K, Bondy CA (září 2000). „Testosteron inhibuje estrogenem indukovanou proliferaci epitelu mléčné žlázy a potlačuje expresi estrogenových receptorů“. FASEB J. 14 (12): 1725–30. doi:10.1096 / fj.99-0863com. PMID 10973921. S2CID 17172449.
- ^ A b C d E Weigel, Nancy L .; Smith, Carolyn L. (2016). "Účinek estrogenu a progesteronu". Endokrinologie: dospělí a dětští. str. 2207–2215.e3. doi:10.1016 / B978-0-323-18907-1.00127-X. ISBN 9780323189071.
- ^ Purohit A, Woo LW, Potter BV (červenec 2011). „Steroid sulfatáza: klíčový hráč v syntéze a metabolismu estrogenu“ (PDF). Mol. Buňka. Endokrinol. 340 (2): 154–60. doi:10.1016 / j.mce.2011.06.012. PMID 21693170. S2CID 14296237.
- ^ Africander D, Storbeck KH (květen 2018). „Metabolismus steroidů u rakoviny prsu: Kde jsme a co nám chybí?“. Mol. Buňka. Endokrinol. 466: 86–97. doi:10.1016 / j.mce.2017.05.016. PMID 28527781. S2CID 4547808.
- ^ Mueller JW, Gilligan LC, Idkowiak J, Arlt W, Foster PA (říjen 2015). „Regulace steroidní akce sulfatací a desulfatací“. Endocr. Rev. 36 (5): 526–63. doi:10.1210 / er.2015-1036. PMC 4591525. PMID 26213785.
- ^ Klinge CM (červenec 2001). „Interakce estrogenového receptoru s prvky reakce na estrogen“. Nucleic Acids Res. 29 (14): 2905–19. doi:10.1093 / nar / 29.14.2905. PMC 55815. PMID 11452016.
- ^ Christian Behl (22. června 2001). Estrogen - záhadná droga pro mozek?: Neuroprotektivní aktivity ženského pohlavního hormonu. Springer Science & Business Media. str. 41–. ISBN 978-3-211-83539-5.
- ^ A b Fritz F. Parl (2000). Estrogeny, estrogenový receptor a rakovina prsu. IOS Press. 4, 111. ISBN 978-0-9673355-4-4.
- ^ Jennifer E. Dietrich (18. června 2014). Ženská puberta: Komplexní průvodce pro lékaře. Springer. str. 53–. ISBN 978-1-4939-0912-4.
- ^ Randy Thornhill; Steven W. Gangestad (25. září 2008). Evoluční biologie lidské ženské sexuality. Oxford University Press. str. 145–. ISBN 978-0-19-988770-5.
- ^ Raine-Fenning NJ, poslanec Brincat, Muscat-Baron Y (2003). "Stárnutí kůže a menopauza: důsledky pro léčbu". Am J Clin Dermatol. 4 (6): 371–8. doi:10.2165/00128071-200304060-00001. PMID 12762829. S2CID 20392538.
- ^ Chris Hayward (31. července 2003). Genderové rozdíly v pubertě. Cambridge University Press. str. 22–. ISBN 978-0-521-00165-6.
- ^ Shlomo Melmed; Kenneth S. Polonsky; P. Reed Larsen; Henry M. Kronenberg (11. listopadu 2015). Williamsova učebnice endokrinologie. Elsevier Health Sciences. str. 1105–. ISBN 978-0-323-34157-8.
- ^ Richard E. Jones; Kristin H. Lopez (28. září 2013). Reprodukční biologie člověka. Akademický tisk. str. 19–. ISBN 978-0-12-382185-0.
- ^ A b C d E Waun Ki Hong; James F. Holland (2010). Holland-Frei Cancer Medicine 8. PMPH-USA. str. 753–. ISBN 978-1-60795-014-1.
- ^ Ethel Sloane (2002). Biology of Women. Cengage Learning. str. 496–. ISBN 978-0-7668-1142-3.
- ^ Tekoa L. King; Mary C. Brucker (25 October 2010). Farmakologie pro zdraví žen. Jones & Bartlett Learning. pp. 1022–. ISBN 978-0-7637-5329-0.
- ^ A b C Rogerio A. Lobo (5. června 2007). Léčba postmenopauzální ženy: základní a klinické aspekty. Akademický tisk. str. 177, 217–226, 770–771. ISBN 978-0-08-055309-2.
- ^ David Warshawsky; Joseph R. Landolph Jr. (31 October 2005). Molecular Carcinogenesis and the Molecular Biology of Human Cancer. CRC Press. 457–. ISBN 978-0-203-50343-0.
- ^ Acevedo-Rodriguez A, Mani SK, Handa RJ (2015). "Oxytocin and Estrogen Receptor β in the Brain: An Overview". Hranice v endokrinologii. 6: 160. doi:10.3389/fendo.2015.00160. PMC 4606117. PMID 26528239.
- ^ Lauritzen C (září 1990). "Klinické použití estrogenů a progestogenů". Maturitas. 12 (3): 199–214. doi:10.1016 / 0378-5122 (90) 90004-P. PMID 2215269.
- ^ Lauritzen C (červen 1977). „[Estrogen thearpy in praxe. 3. Estrogenové přípravky a kombinované přípravky]“ [Estrogenová terapie v praxi. 3. Estrogenové přípravky a kombinované přípravky]. Fortschritte Der Medizin (v němčině). 95 (21): 1388–92. PMID 559617.
- ^ A b Wolf AS, Schneider HP (12. března 2013). Östrogene in Diagnostik und Therapie. Springer-Verlag. str. 78–. ISBN 978-3-642-75101-1. Cite error: The named reference "WolfSchneider2013" was defined multiple times with different content (see the stránka nápovědy).
- ^ Göretzlehner G, Lauritzen C, Römer T, Rossmanith W (1. ledna 2012). Praktische Hormontherapie in der Gynäkologie. Walter de Gruyter. str. 44–. ISBN 978-3-11-024568-4.
- ^ Knörr K, Beller FK, Lauritzen C (17. dubna 2013). Lehrbuch der Gynäkologie. Springer-Verlag. 212–213. ISBN 978-3-662-00942-0.
- ^ A b Horský J, Presl J (1981). "Hormonální léčba poruch menstruačního cyklu". In Horsky J, Presl J (eds.). Funkce vaječníků a její poruchy: diagnostika a terapie. Springer Science & Business Media. 309–332. doi:10.1007/978-94-009-8195-9_11. ISBN 978-94-009-8195-9. Cite error: The named reference "HorskyPresl1981" was defined multiple times with different content (see the stránka nápovědy).
- ^ Pschyrembel W (1968). Praktische Gynäkologie: für Studierende und Ärzte. Walter de Gruyter. str. 598–599. ISBN 978-3-11-150424-7.
- ^ Lauritzen CH (leden 1976). "Ženský klimakterický syndrom: význam, problémy, léčba". Acta Obstetricia Et Gynecologica Scandinavica. Doplněk. 51: 47–61. doi:10.3109/00016347509156433. PMID 779393.
- ^ Lauritzen C (1975). „Ženský klimakterický syndrom: význam, problémy, léčba“. Acta Obstetricia et Gynecologica Scandinavica. 54 (s51): 48–61. doi:10.3109/00016347509156433. ISSN 0001-6349.
- ^ Kopera H (1991). „Hormone der Gonaden“. Hormonelle Therapie für die Frau. Kliniktaschenbücher. str. 59–124. doi:10.1007/978-3-642-95670-6_6. ISBN 978-3-540-54554-5. ISSN 0172-777X.
- ^ A b Scott WW, Menon M, Walsh PC (duben 1980). "Hormonální léčba rakoviny prostaty". Rakovina. 45 Suppl 7: 1929–1936. doi:10.1002 / cncr.1980.45.s7.1929. PMID 29603164. Cite error: The named reference "pmid29603164" was defined multiple times with different content (see the stránka nápovědy).
- ^ A b C d E F Leinung MC, Feustel PJ, Joseph J (2018). „Hormonální léčba transgenderových žen perorálním estradiolem“. Transsexuální zdraví. 3 (1): 74–81. doi:10.1089 / trgh.2017.0035. PMC 5944393. PMID 29756046. Cite error: The named reference "pmid29756046" was defined multiple times with different content (see the stránka nápovědy).
- ^ Ryden AB (1950). „Přírodní a syntetické estrogenní látky; jejich relativní účinnost při orálním podání“. Acta Endocrinologica. 4 (2): 121–39. doi:10.1530 / acta.0.0040121. PMID 15432047.
- ^ Ryden AB (1951). „Účinnost přírodních a syntetických estrogenních látek u žen“. Acta Endocrinologica. 8 (2): 175–91. doi:10.1530 / acta.0.0080175. PMID 14902290.
- ^ Kottmeier HL (1947). „Ueber blutungen in der menopause: Speziell der klinischen bedeutung eines endometriums mit zeichen hormononaler beeinflussung: Část I“. Acta Obstetricia et Gynecologica Scandinavica. 27 (s6): 1–121. doi:10.3109/00016344709154486. ISSN 0001-6349.
Není pochyb o tom, že přeměna endometria injekcemi syntetických i nativních estrogenových hormonálních přípravků uspěje, ale názor, zda mohou nativní orálně podávané přípravky vyvolat proliferaci sliznice, se u různých autorů mění. PEDERSEN-BJERGAARD (1939) dokázal, že 90% folikulinu absorbovaného v krvi vena portae je inaktivováno v játrech. Ani firmám KAUFMANN (1933, 1935), RAUSCHER (1939, 1942) ani HERRNBERGER (1941) se nepodařilo pomocí velkých dávek perorálně podávaných přípravků estronu nebo estradiolu uvést do kastrace endometrium. Další výsledky uvádějí NEUSTAEDTER (1939), LAUTERWEIN (1940) a FERIN (1941); podařilo se jim přeměnit atrofické kastrační endometrium na jednoznačnou proliferační sliznici pomocí 120–300 estradiolu nebo 380 estronu.
- ^ Rietbrock N, Staib AH, Loew D (11. března 2013). Klinische Pharmakologie: Arzneitherapie. Springer-Verlag. str. 426–. ISBN 978-3-642-57636-2.
- ^ A b C Martinez-Manautou J, Rudel HW (1966). "Antiovulační aktivita několika syntetických a přírodních estrogenů". V Robert Benjamin Greenblatt (ed.). Ovulace: Stimulace, potlačení a detekce. Lippincott. str. 243–253. Cite error: The named reference "Greenblatt1966" was defined multiple times with different content (see the stránka nápovědy).
- ^ A b Herr F, Revesz C, Manson AJ, Jewell JB (1970). "Biologické vlastnosti estrogen sulfátů". Chemické a biologické aspekty konjugace se steroidy. 368–408. doi:10.1007/978-3-642-49793-3_8. ISBN 978-3-642-49506-9. Chyba citace: Pojmenovaný odkaz „HerrRevesz1970“ byl definován několikrát s různým obsahem (viz stránka nápovědy).
- ^ Duncan CJ, Kistner RW, Mansell H (říjen 1956). "Potlačení ovulace trip-anisylchlorethylenem (TACE)". porodnictví a gynekologie. 8 (4): 399–407. PMID 13370006.
- ^ A b Scherr DS, Pitts WR (2003). „Nesteroidní účinky diethylstilbestrolu: důvody pro terapii deprivace androgenů bez deprese estrogenu při léčbě rakoviny prostaty“. J. Urol. 170 (5): 1703–8. doi:10.1097 / 01.ju.0000077558.48257.3d. PMID 14532759.
- ^ A b Coss, Christopher C.; Jones, Amanda; Parke, Deanna N.; Narayanan, Ramesh; Barrett, Christina M.; Kearbey, Jeffrey D.; Veverka, Karen A.; Miller, Duane D.; Morton, Ronald A.; Steiner, Mitchell S.; Dalton, James T. (2012). "Preclinical Characterization of a Novel Diphenyl Benzamide Selective ERα Agonist for Hormone Therapy in Prostate Cancer". Endokrinologie. 153 (3): 1070–1081. doi:10.1210/en.2011-1608. ISSN 0013-7227. PMID 22294742.
- ^ Novara G, Galfano A, Secco S, Ficarra V, Artibani W (2009). "Impact of surgical and medical castration on serum testosterone level in prostate cancer patients". Urol. Int. 82 (3): 249–55. doi:10.1159/000209352. PMID 19440008. S2CID 24771328.
- ^ A b C d E F G h i von Schoultz B, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A, Stege R (1989). "Estrogenová terapie a funkce jater - metabolické účinky orálního a parenterálního podání". Prostata. 14 (4): 389–95. doi:10.1002 / pros.2990140410. PMID 2664738. S2CID 21510744.
- ^ Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA (25 August 2011). Campbell-Walsh Urology: Expert Consult Premium Edition: Enhanced Online Features and Print, 4-Volume Set. Elsevier Health Sciences. pp. 2938–. ISBN 978-1-4160-6911-9.
- ^ Knuth UA, Hano R, Nieschlag E (1984). "Effect of flutamide or cyproterone acetate on pituitary and testicular hormones in normal men". J. Clin. Endokrinol. Metab. 59 (5): 963–9. doi:10.1210/jcem-59-5-963. PMID 6237116.
- ^ A b Jacobi GH, Altwein JE, Kurth KH, Basting R, Hohenfellner R (1980). „Léčba pokročilého karcinomu prostaty parenterálním cyproteron-acetátem: randomizovaná studie fáze III“. Br J Urol. 52 (3): 208–15. doi:10.1111/j.1464-410x.1980.tb02961.x. PMID 7000222.
- ^ Sander S, Nissen-Meyer R, Aakvaag A (1978). "On gestagen treatment of advanced prostatic carcinoma". Scand. J. Urol. Nephrol. 12 (2): 119–21. doi:10.3109/00365597809179977. PMID 694436.
- ^ Kjeld JM, Puah CM, Kaufman B, Loizou S, Vlotides J, Gwee HM, Kahn F, Sood R, Joplin GF (1979). "Effects of norgestrel and ethinyloestradiol ingestion on serum levels of sex hormones and gonadotrophins in men". Clin. Endokrinol. (Oxf). 11 (5): 497–504. doi:10.1111/j.1365-2265.1979.tb03102.x. PMID 519881. S2CID 5836155.
- ^ Watson NR, Studd JW, Riddle AF, Savvas M (October 1988). "Suppression of ovulation by transdermal oestradiol patches". BMJ. 297 (6653): 900–1. doi:10.1136/bmj.297.6653.900. PMC 1834440. PMID 3140971.
- ^ Sitruk-Ware R (June 1995). "Transdermal application of steroid hormones for contraception". J. Steroid Biochem. Mol. Biol. 53 (1–6): 247–51. doi:10.1016/0960-0760(95)00055-5. PMID 7626463. S2CID 30461300.
- ^ Studd, J. (2012). "Treatment of premenstrual disorders by suppression of ovulation by transdermal estrogens". Menopauza mezinárodní. 18 (2): 65–67. doi:10.1258/mi.2012.012015. ISSN 1754-0453. PMID 22611224. S2CID 8914354.
- ^ Toppozada M (June 1977). "The clinical use of monthly injectable contraceptive preparations". Obstet Gynecol Surv. 32 (6): 335–47. doi:10.1097/00006254-197706000-00001. PMID 865726.
- ^ el-Mahgoub S, Karim M (February 1972). "Depot estrogen as a monthly contraceptive in nulliparous women with mild uterine hypoplasia". Dopoledne. J. Obstet. Gynecol. 112 (4): 575–6. doi:10.1016/0002-9378(72)90319-5. PMID 5008627.
- ^ A b C d E Stege R, Gunnarsson PO, Johansson CJ, Olsson P, Pousette A, Carlström K (May 1996). "Pharmacokinetics and testosterone suppression of a single dose of polyestradiol phosphate (Estradurin) in prostatic cancer patients". Prostata. 28 (5): 307–10. doi:10.1002/(SICI)1097-0045(199605)28:5<307::AID-PROS6>3.0.CO;2-8. PMID 8610057.
- ^ Gokhan Ozyigit; Ugur Selek (1 August 2017). Principles and Practice of Urooncology: Radiotherapy, Surgery and Systemic Therapy. Springer. pp. 334–. ISBN 978-3-319-56114-1.
The castrate level was defined as testosterone being less than 50 ng/dL (1.7 nmol/L), many years ago. However contemporary laboratory testing methods showed that the mean value after surgical castration is 15 ng/dL [1]. Thus, recently the level is defined as being less than 20 ng/dL (1 nmol/L).
- ^ Lycette JL, Bland LB, Garzotto M, Beer TM (2006). „Parenterální estrogeny pro rakovinu prostaty: může nová cesta podání překonat starou toxicitu?“. Clin Genitourin Cancer. 5 (3): 198–205. doi:10.3816 / CGC.2006.n.037. PMID 17239273.
- ^ Altwein, J. (1983). "Controversial Aspects of Hormone Manipulation in Prostatic Carcinoma". Cancer of the Prostate and Kidney. pp. 305–316. doi:10.1007/978-1-4684-4349-3_38. ISBN 978-1-4684-4351-6.
- ^ Ockrim JL; Lalani el-N; Kakkar AK; Abel PD (August 2005). "Transdermal estradiol therapy for prostate cancer reduces thrombophilic activation and protects against thromboembolism". J. Urol. 174 (2): 527–33, discussion 532–3. doi:10.1097/01.ju.0000165567.99142.1f. PMID 16006886.
- ^ Moore E, Wisniewski A, Dobs A (2003). "Endocrine treatment of transsexual people: a review of treatment regimens, outcomes, and adverse effects". J. Clin. Endokrinol. Metab. 88 (8): 3467–73. doi:10.1210/jc.2002-021967. PMID 12915619.
- ^ Tangpricha V, den Heijer M (2017). „Estrogenová a antiandrogenní léčba transgender žen“. Lancet Diabetes Endocrinol. 5 (4): 291–300. doi:10.1016 / S2213-8587 (16) 30319-9. PMC 5366074. PMID 27916515.
- ^ Deutsch MB, Bhakri V, Kubíček K (2015). „Účinky hormonální léčby mezi pohlavími na transsexuální ženy a muže“. Obstet Gynecol. 125 (3): 605–10. doi:10.1097 / AOG.0000000000000692. PMC 4442681. PMID 25730222.
- ^ A b C d Jones TM, Fang VS, Landau RL, Rosenfield R (December 1978). "Direct inhibition of Leydig cell function by estradiol". J. Clin. Endokrinol. Metab. 47 (6): 1368–73. doi:10.1210/jcem-47-6-1368. PMID 122429.
- ^ A b Taxel P, Kennedy D, Fall P, Willard A, Shoukri K, Clive J, Raisz LG (2000). "The effect of short-term treatment with micronized estradiol on bone turnover and gonadotrophins in older men". Endocr. Res. 26 (3): 381–98. doi:10.3109/07435800009066175. PMID 11019903. S2CID 45695901.
- ^ A b Dukes, M.N.G. (2002). Pohlavní hormony a příbuzné sloučeniny, včetně hormonální antikoncepce. Nežádoucí účinky léků ročně. 25. 478–502. doi:10.1016 / S0378-6080 (02) 80047-2. ISBN 9780444506740. ISSN 0378-6080.
- ^ Johansson CJ, Gunnarsson PO (červen 2000). „Farmakodynamický model potlačení testosteronu po intramuskulární depotní estrogenové léčbě u rakoviny prostaty“. Prostata. 44 (1): 26–30. doi:10.1002 / 1097-0045 (20000615) 44: 1 <26 :: AID-PROS4> 3.0.CO; 2-P. PMID 10861754.
- ^ Salam MA (2003). Principy a praxe urologie: Komplexní text. Universal-Publishers. str. 684–. ISBN 978-1-58112-412-5.
Estrogeny působí primárně prostřednictvím negativní zpětné vazby na úrovni hypotalamus-hypofýza, aby snížily sekreci LH a syntézu androgenů ve varlatech. [...] Je zajímavé, že pokud je léčba estrogeny přerušena po 3 letech. nepřerušované expozice může testosteron v séru zůstat na kastračních úrovních po dobu dalších 3 let. Předpokládá se, že toto prodloužené potlačení je výsledkem přímého účinku estrogenů na Leydigovy buňky.
- ^ A b Cox RL, Crawford ED (prosinec 1995). "Estrogeny při léčbě rakoviny prostaty". J. Urol. 154 (6): 1991–8. doi:10.1016 / S0022-5347 (01) 66670-9. PMID 7500443.
- ^ Tomić R, Bergman B (říjen 1987). "Hormonální účinky ukončení léčby estrogenem pro karcinom prostaty". J. Urol. 138 (4): 801–3. doi:10.1016 / S0022-5347 (17) 43379-9. PMID 3116281.
- ^ Tomić R, Bergman B, Damber JE (únor 1983). "Testikulární endokrinní funkce po ukončení léčby estrogeny u pacientů s karcinomem prostaty". Br J Urol. 55 (1): 42–7. doi:10.1111 / j.1464-410X.1983.tb07077.x. PMID 6402048.
- ^ Daehlin L, Tomić R, Damber JE (1988). „Depresivní uvolňování testosteronu z testikulární tkáně in vitro po ukončení léčby estrogeny u pacientů s karcinomem prostaty“. Scand. J. Urol. Nephrol. 22 (1): 11–3. doi:10.1080/00365599.1988.11690376. PMID 3387906.
- ^ Tomić R, Damber JE, Bergman B (1988). „Endokrinní účinky stažení estrogenu u dlouhodobě léčených pacientů s adenokarcinomem prostaty“. Eur. Urol. 14 (1): 6–8. doi:10.1159/000472886. PMID 3342807.
- ^ Wortsman J, Hamidinia A, Winters SJ (červen 1989). „Hypogonadismus po dlouhodobé léčbě diethylstilbestrolem“. Dopoledne. J. Med. Sci. 297 (6): 365–8. doi:10.1097/00000441-198906000-00006. PMID 2500019. S2CID 22686874.
- ^ A b Tomić R (říjen 1987). "Funkce hypofýzy po orchiektomii u pacientů s nebo bez dřívější léčby estrogenem pro karcinom prostaty". J. Endocrinol. Investovat. 10 (5): 479–82. doi:10.1007 / BF03348174. PMID 3123547. S2CID 25897203.
- ^ Janet Brotherton (1976). Farmakologie pohlavních hormonů. Akademický tisk. p. 341. ISBN 978-0-12-137250-7.
- ^ Stege R, Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A (1988). "Terapie polyestradiolfosfátem v jedné léčbě rakoviny prostaty". Dopoledne. J. Clin. Oncol. 11 Suppl 2: S101–3. doi:10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ Langley RE, Godsland IF, Kynaston H, Clarke NW, Rosen SD, Morgan RC, Pollock P, Kockelbergh R, Lalani EN, Dearnaley D, Parmar M, Abel PD (srpen 2008). „Časná hormonální data z multicentrické studie fáze II používající transdermální estrogenové náplasti jako hormonální léčbu první linie u pacientů s lokálně pokročilým nebo metastatickým karcinomem prostaty“. BJU Int. 102 (4): 442–5. doi:10.1111 / j.1464-410X.2008.07583.x. PMC 2564109. PMID 18422771.
Dostupné informace naznačují, že u přípravků dodávajících estradiol 100 μg / den transdermálně (včetně náplastí Progynova [TS forte] použitých v původní pilotní studii [5]) [...]
- ^ Ockrim J, Lalani E, Abel P (říjen 2006). „Therapy Insight: parenterální léčba estrogeny pro rakovinu prostaty - nový úsvit staré terapie“. Nat Clin Pract Oncol. 3 (10): 552–63. doi:10.1038 / ncponc0602. PMID 17019433. S2CID 6847203.
- ^ Jacobi, G.H .; Altwein, J. E. (1979). „Bromokriptin als Palliativtherapie beim fortgeschrittenen Prostatakarzinom: Experimentelles und klinisches Profil eines Medikamentes“ [Bromokriptin jako paliativní terapie u pokročilého karcinomu prostaty: Experimentální a klinický profil Drugjournal = Urologia Internationalis]. Urologia Internationalis. 34 (4): 266–290. doi:10.1159/000280272. PMID 89747.
- ^ A b C McDowell, Julie (2010). Encyklopedie systémů lidského těla. ABC-CLIO. 201–. ISBN 978-0-313-39175-0.
- ^ A b Herbison AE (červen 1998). "Multimodální vliv estrogenu na neurony hormonu uvolňujícího gonadotropin". Endocr. Rev. 19 (3): 302–30. doi:10.1210 / edrv.19.3.0332. PMID 9626556.
Pro větší část ovariálního cyklu pomáhá estrogen omezovat sekreci LH prostřednictvím akce označované jako akce „negativní zpětné vazby“. Ukázalo se, že k tomu dochází částečně prostřednictvím inhibice sekrece GnRH u několika druhů (7, 11–13), ale zahrnuje to také silné působení estrogenu na hypofýzové gonadotropy (3, 4, 14). Estrogen také vykazuje vliv „pozitivní zpětné vazby“ na neurony GnRH a gonadotropiny hypofýzy, aby generoval preovulační nárůst LH.
- ^ Jerome Frank Strauss; Robert L. Barbieri (1. ledna 2009). Yen and Jaffe's Reprodukční endokrinologie: fyziologie, patofyziologie a klinické řízení. Elsevier Health Sciences. str. 807–. ISBN 978-1-4160-4907-4.
- ^ Grunwald, K .; Rabe, T .; Runnebaum, B. (1997). "Fyziologie menstruačního cyklu". Manuál asistované reprodukce. s. 22–77. doi:10.1007/978-3-662-00763-1_3. ISBN 978-3-662-00765-5.
- ^ Anand Kumar; Mona Sharma (24. července 2017). Základy lidské andrologie: Učebnice. Springer. str. 395–. ISBN 978-981-10-3695-8.
- ^ Miranda A. Farage; Howard I.Maibach (27. března 2017). The Vulva: Physiology and Clinical Management, Second Edition. CRC Press. str. 139–. ISBN 978-1-4987-5245-9.
- ^ Rogerio A. Lobo; David M Gershenson; Gretchen M Lentz; Fidel A Valea (22. června 2016). Komplexní e-kniha o gynekologii. Elsevier Health Sciences. 97–. ISBN 978-0-323-43003-6.
- ^ Linda Garnets; Douglas Kimmel (6. května 2003). Psychologické pohledy na lesbické, homosexuální a bisexuální zkušenosti. Columbia University Press. str. 62–. ISBN 978-0-231-50494-2.
- ^ Römmler A, Baumgarten S, Schwartz U, Hammerstein J (červen 1982). "Antiestrogenní účinky antikoncepčních progestinů na dynamiku uvolňování gonadotropinu". Antikoncepce. 25 (6): 619–27. doi:10.1016/0010-7824(82)90063-4. PMID 6214371.
- ^ Leon Speroff; Marc A. Fritz (2005). Klinická gynekologická endokrinologie a neplodnost. Lippincott Williams & Wilkins. 211–. ISBN 978-0-7817-4795-0.
- ^ A b Stefan Offermanns; W. Rosenthal (14. srpna 2008). Encyclopedia of Molecular Pharmacology. Springer Science & Business Media. 388–. ISBN 978-3-540-38916-3.
- ^ A b Andrew N. Margioris; George P. Chrousos (20. dubna 2001). Poruchy nadledvin. Springer Science & Business Media. str. 84–. ISBN 978-1-59259-101-5.
- ^ A b Polderman KH, Gooren LJ, van der Veen EA (říjen 1995). "Účinky gonadálních androgenů a estrogenů na hladinu androgenů v nadledvinách". Clin. Endokrinol. (Oxf). 43 (4): 415–21. doi:10.1111 / j.1365-2265.1995.tb02611.x. PMID 7586614. S2CID 6815423.
- ^ Stege R, Eriksson A, Henriksson P, Carlström K (srpen 1987). „Orchidektomie nebo léčba estrogeny u rakoviny prostaty: účinky na sérové hladiny adrenálních androgenů a souvisejících steroidů“. Int. J. Androl. 10 (4): 581–7. doi:10.1111 / j.1365-2605.1987.tb00357.x. PMID 2958420.
- ^ A b Pousette A, Carlström K, Stege R (1989). "Androgeny během různých způsobů endokrinní léčby rakoviny prostaty". Urol. Res. 17 (2): 95–8. doi:10.1007 / BF00262027. PMID 2734983. S2CID 25309877.
- ^ Labrie F, Martel C, Bélanger A, Pelletier G (duben 2017). „Androgeny u žen se podle intrakrinologie v zásadě vyrábějí z DHEA v každé periferní tkáni.“ J. Steroid Biochem. Mol. Biol. 168: 9–18. doi:10.1016 / j.jsbmb.2016.12.007. PMID 28153489. S2CID 2620899.
- ^ Chang KH, Ercole CE, Sharifi N (září 2014). „Androgenní metabolismus u rakoviny prostaty: od molekulárních mechanismů po klinické důsledky“. Br. J. Cancer. 111 (7): 1249–54. doi:10.1038 / bjc.2014.268. PMC 4183835. PMID 24867689.
- ^ Labrie F, Bélanger A, Pelletier G, Martel C, Archer DF, Utian WH (červen 2017). "Věda o intrakrinologii u postmenopauzálních žen". Menopauza. 24 (6): 702–712. doi:10.1097 / GME.0000000000000808. PMID 28098598. S2CID 3794402.
- ^ Warner M, Gustafsson JA (leden 2015). "DHEA - předchůdce ligandů ERβ". J. Steroid Biochem. Mol. Biol. 145: 245–7. doi:10.1016 / j.jsbmb.2014.08.003. PMID 25125389. S2CID 26043868.
- ^ Mashchak CA, Lobo RA, Dozono-Takano R, Eggena P, Nakamura RM, Brenner PF, Mishell DR (listopad 1982). "Srovnání farmakodynamických vlastností různých estrogenových formulací". Dopoledne. J. Obstet. Gynecol. 144 (5): 511–8. doi:10.1016/0002-9378(82)90218-6. PMID 6291391.
- ^ L'Hermite M (září 1990). "Rizika estrogenů a progestogenů". Maturitas. 12 (3): 215–46. doi:10.1016 / 0378-5122 (90) 90005-q. PMID 2170823.
- ^ Carlström K, Pschera H, Lunell NO (prosinec 1988). „Sérové hladiny estrogenů, progesteronu, folikuly stimulujícího hormonu a globulinu vázajícího pohlavní hormony při současném vaginálním podání 17 beta-estradiolu a progesteronu v období před a po menopauze.“ Maturitas. 10 (4): 307–16. doi:10.1016/0378-5122(88)90066-7. PMID 3147360.
- ^ A b Sitruk-Ware R, Nath A (červen 2011). "Metabolické účinky antikoncepčních steroidů". Rev Endocr Metab Disord. 12 (2): 63–75. doi:10.1007 / s11154-011-9182-4. PMID 21538049. S2CID 23760705.
- ^ A b Fruzzetti F, Trémollieres F, Bitzer J (květen 2012). „Přehled vývoje kombinovaných perorálních kontraceptiv obsahujících estradiol: zaměření na estradiol valerát / dienogest“. Gynecol. Endokrinol. 28 (5): 400–8. doi:10.3109/09513590.2012.662547. PMC 3399636. PMID 22468839.
- ^ Mueller A, Dittrich R, Binder H, Kuehnel W, Maltaris T, Hoffmann I, Beckmann MW (červenec 2005). „Léčba vysokými dávkami estrogenu zvyšuje hustotu kostních minerálů u transsexuálů muž-žena, kterým je podáván agonista hormonu uvolňujícího gonadotropin bez přítomnosti testosteronu.“ Eur. J. Endocrinol. 153 (1): 107–13. doi:10.1530 / eje.1.01943. PMID 15994752.
- ^ Mueller A, Binder H, Cupisti S, Hoffmann I, Beckmann MW, Dittrich R (březen 2006). „Účinky dlouhodobé léčby na mužský endokrinní systém agonisty a estrogeny uvolňujícími gonadotropin u transsexuálů muž-žena“. Horm. Metab. Res. 38 (3): 183–7. doi:10.1055 / s-2006-925198. PMID 16673210.
- ^ Mueller A, Zollver H, Kronawitter D, Oppelt PG, Claassen T, Hoffmann I, Beckmann MW, Dittrich R (únor 2011). „Složení těla a kostní minerální hustota u transsexuálů mezi muži a ženami během hormonální terapie mezi pohlavími s použitím agonisty hormonu uvolňujícího gonadotropin“. Exp. Clin. Endokrinol. Cukrovka. 119 (2): 95–100. doi:10.1055 / s-0030-1255074. PMID 20625973.
- ^ Odlind V, Milsom I, Persson I, Victor A (červen 2002). „Mohou změny globulinu vázajícího pohlavní hormony předpovědět riziko venózního tromboembolismu u kombinovaných perorálních antikoncepčních pilulek?“. Acta Obstet Gynecol Scand. 81 (6): 482–90. doi:10.1034 / j.1600-0412.2002.810603.x. PMID 12047300. S2CID 26054257.
- ^ A b C d Kohli, M .; Alikhan, M. A .; Spencer, H. J .; Carter, G. (2004). „Fáze I studie intramuskulárního estradiolvalerátu (I / M-E) u hormonálně refrakterního karcinomu prostaty“. Journal of Clinical Oncology. 22 (14_suppl): 4726. doi:10.1200 / jco.2004.22.90140.4726. ISSN 0732-183X.
- ^ A b C Kuhli M, McClellan J (2001). „Parenterální léčba estrogeny u pokročilého karcinomu prostaty: retrospektivní analýza intramuskulárního estradiolvalerátu u„ hormonálně refrakterního „onemocnění prostaty“. Proc Am Soc Clin Oncol. 20: 2407a. ISSN 0736-7589.
- ^ Ryan CJ, Small EJ (prosinec 2003). „Úloha sekundární hormonální terapie při léčbě rekurentního karcinomu prostaty“. Urologie. 62 Suppl 1: 87–94. doi:10.1016 / j.urology.2003.10.002. PMID 14747046.
Použití parenterálního estradiol [valerátu] u pacientů s progresivním onemocněním po sekundární hormonální terapii vedlo v pilotní studii k poklesu PSA u 5 z 5 pacientů bez metastatického onemocnění. Ve stejné studii byl také podáván parenterální estradiol v kombinaci s chemoterapií
- ^ A b C d Kohli M (leden 2006). „Fáze II studie transdermálního estradiolu u androgenu nezávislého karcinomu prostaty“. Rakovina. 106 (1): 234–5, odpověď autora 235. doi:10.1002 / cncr.21528. PMID 16284988. S2CID 11047031.
[...] zkoumali jsme účinek kombinace parenterálního estrogenu (intramuskulárního estradiolvalerátu) a chemoterapie na koagulaci a aktivaci plazminogenového systému v androgenním nezávislém stadiu ve studii fáze I. 3 Naším primárním cílem bylo sledovat koagulaci a aktivaci plazminogenového systému a bylo prováděno pomocí subklinických markerů, jako je komplex trombinu a antitrombinu (TAT; referenční rozmezí, 1,0 - 4,1 μg / l) a kvantitativní hladiny D-dimeru (QDD, rozmezí: 0 - 250 ng / ml) jako náhradní markery prediktivní pro trombohemoragické komplikace. Tři zvyšující se dávky (10 mg, 20 mg, 40 mg) intramuskulárního estradiolvalerátu byly podávány každé 2 týdny 12 pacientům. Před každou dávkou estradiolvalerátu byly tyto markery měřeny a pacientům se stoupajícími hladinami nad výchozími hodnotami byla podávána profylaxe jednou denně 60 mg nízkomolekulárního heparinu. Zjistili jsme, že většina pacientů (10 z 12) měla subklinickou hemostatickou aktivaci měřenou zvýšením plazmatických hladin TAT a QDD po podání estradiolu, které se vrátily na výchozí úroveň specifickou pro pacienta s denní profylaktickou antikoagulací. Nebyla pozorována žádná klinická trombóza ani hemoragická příhoda.
- ^ George Morris Piersol (1975). Cyclopedia of Medicine, Surgery, Specialties. Společnost F. A. Davise.
- ^ Wajchenberg BL (prosinec 2000). "Subkutánní a viscerální tuková tkáň: jejich vztah k metabolickému syndromu". Endocr. Rev. 21 (6): 697–738. doi:10.1210 / edrv.21.6.0415. PMID 11133069.
Zdá se, že androgenní receptor v ženské tukové tkáni má stejné vlastnosti jako ten, který se nachází v mužské tukové tkáni, zatímco léčba estrogenem reguluje hustotu tohoto receptoru (34), což může být mechanismus, kterým estrogeny chrání tukovou tkáň před androgenními účinky. [...] Možné mechanismy účinků estrogenů na stanovení distribuce tělesného tuku zahrnují down-regulaci androgenního receptoru, čímž zabraňují účinkům androgenu (34), jak již bylo zmíněno dříve [...]
- ^ Brown LM, Clegg DJ (říjen 2010). „Centrální účinky estradiolu na regulaci příjmu potravy, tělesné hmotnosti a adipozity“. J. Steroid Biochem. Mol. Biol. 122 (1–3): 65–73. doi:10.1016 / j.jsbmb.2009.12.005. PMC 2889220. PMID 20035866.
[...] estrogen down-reguluje expresi AR v podkožním tuku [17].
- ^ Bjorntorp P (leden 1997), "Endokrinní abnormality v obezitě", Recenze na cukrovku, 5 (1): 52–68, ISSN 1066-9442,
Transsexuální ženy léčené testosteronem hromadí viscerální tuk, ale zdá se, že tomu tak je pouze v případě, že byla provedena ooforektomie (119). [...] Pozorování, že k akumulaci viscerálního tuku dochází pouze u transsexuálních žen, které podstoupily ooforektomii (119), naznačuje, že zbývající produkce estrogenu před ooforektomií (106) byla ochranná. Zdá se, že androgenní receptor v ženské tukové tkáni má stejné vlastnosti jako receptor v mužské tukové tkáni (85; M. Li a P. B., nepublikovaná pozorování). Léčba estrogenem však reguluje hustotu tohoto receptoru (M. Li a P. B., nepublikovaná pozorování), což může být mechanismus, kterým estrogen chrání tukovou tkáň před androgenními účinky. Když se tedy hladina estrogenu dostatečně sníží, může dojít k hromadění viscerálního tuku. Rovnováha mezi androgeny a estrogeny se proto zdá být důležitá; možná nedostatek estrogenu je důležitější než relativně malý nadbytek androgenu u hyperandrogenních žen s viscerální akumulací tělesného tuku. [...] Dále se zdá, že estrogen downreguluje hustotu androgenního receptoru (M. Li a P. B., nepublikovaná pozorování), a může proto bránit účinkům androgenu. Tuto možnost naznačují nedávná pozorování, která naznačují, že pro androgeny pro podporu akumulace viscerálního tuku u žen se zdá být nutná ooforektomie (119).
- ^ A b Ottosson UB, Carlström K, Johansson BG, von Schoultz B (1986). „Estrogenová indukce jaterních proteinů a cholesterolu s vysokou hustotou lipoproteinů: srovnání mezi estradiolvalerátem a ethinylestradiolem“. Gynecol. Obstet. Investovat. 22 (4): 198–205. doi:10.1159/000298914. PMID 3817605.
- ^ Stanczyk, Frank Z .; Archer, David F .; Bhavnani, Bhagu R. (2013). „Ethinylestradiol a 17β-estradiol v kombinovaných perorálních kontraceptivech: farmakokinetika, farmakodynamika a hodnocení rizik“. Antikoncepce. 87 (6): 706–727. doi:10.1016 / j. Antikoncepce.2012.12.011. ISSN 0010-7824. PMID 23375353.
- ^ Fotherby K (srpen 1996). "Biologická dostupnost orálně podávaných pohlavních steroidů používaných při perorální antikoncepci a hormonální substituční terapii". Antikoncepce. 54 (2): 59–69. doi:10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ Victor Gomel; Malcolm G. Munro; Timothy C. Rowe (1990). Gynekologie: praktický přístup. Williams & Wilkins. p. 132 134. ISBN 978-0-683-03631-2.
Syntetický estrogen, ethinylestradiol, běžněji používaný v perorálních kontraceptivech, má biologickou aktivitu stokrát vyšší než u nativních a konjugovaných látek.
- ^ Nathaniel McConaghy (21. listopadu 2013). Sexuální chování: Problémy a řízení. Springer Science & Business Media. 177–. ISBN 978-1-4899-1133-9.
Meyer a kol. zjistili, že ethinylestradiol je 75 až 100krát účinnější než konjugovaný estrogen na základě dávek potřebných ke snížení testosteronu na rozmezí dospělých žen, přičemž je zapotřebí 0,1 mg první a 7,5 až 10 mg druhé.
- ^ A b Bruce Chabner; Dan Louis Longo (1996). Chemoterapie a bioterapie rakoviny: principy a praxe. Vydavatelé Lippincott-Raven. p. 186. ISBN 978-0-397-51418-2.
Piperazin estronsulfát a mikronizovaný estradiol byly ekvipotentní s ohledem na zvýšení SHBG, [...] S ohledem na snížení FSH byl [...] ethinylestradiol 80 až 200krát účinnější než piperazin estronsulfát. [...] Počáteční poločas rozpadu DES je 80 minut, se sekundárním poločasem 24 hodin.222
- ^ Tommaso Falcone; William W. Hurd (2007). Klinická reprodukční medicína a chirurgie. Elsevier Health Sciences. 22, 362, 388. ISBN 978-0-323-03309-1.
- ^ Düsterberg B, Nishino Y (1982). "Farmakokinetické a farmakologické vlastnosti estradiolvalerátu". Maturitas. 4 (4): 315–24. doi:10.1016/0378-5122(82)90064-0. PMID 7169965.
- ^ Goldzieher JW, Brody SA (1990). "Farmakokinetika ethinylestradiolu a mestranolu". American Journal of Obstetrics and Gynecology. 163 (6 Pt 2): 2114–9. doi:10.1016 / 0002-9378 (90) 90550-Q. PMID 2256522.
- ^ Elger W, Wyrwa R, Ahmed G, Meece F, Nair HB, Santhamma B, Killeen Z, Schneider B, Meister R, Schubert H, Nickisch K (leden 2017). „Proléčiva estradiolu (EP) pro účinnou perorální léčbu estrogeny a zrušené účinky na funkce jater modulované estrogeny“. J. Steroid Biochem. Mol. Biol. 165 (Pt B): 305–311. doi:10.1016 / j.jsbmb.2016.07.008. PMID 27449818. S2CID 26650319.
- ^ A b Marc A. Fritz; Leon Speroff (28. března 2012). Klinická gynekologická endokrinologie a neplodnost. Lippincott Williams & Wilkins. str. 753–. ISBN 978-1-4511-4847-3.
- ^ Notelovitz M (březen 2006). „Klinický názor: biologické a farmakologické principy estrogenové terapie pro symptomatickou menopauzu“. MedGenMed. 8 (1): 85. PMC 1682006. PMID 16915215.
- ^ Goodman MP (únor 2012). „Jsou všechny estrogeny vytvářeny stejné? Přehled orální vs. transdermální terapie“. J Zdraví žen (Larchmt). 21 (2): 161–9. doi:10.1089 / jwh.2011.2839. PMID 22011208.
- ^ Nachtigall LE, Raju U, Banerjee S, Wan L, Levitz M (2000). „Profily vazby na estradiol v séru u postmenopauzálních žen podstupujících tři běžné estrogenové substituční terapie: asociace s hladinami globulinu vázajícího pohlavní hormony, estradiolu a estronu“. Menopauza. 7 (4): 243–50. doi:10.1097/00042192-200007040-00006. ISSN 1072-3714. PMID 10914617. S2CID 3076514.
- ^ Carlström K, Collste L, Eriksson A, Henriksson P, Pousette A, Stege R, von Schoultz B (1989). "Srovnání androgenního stavu u pacientů s rakovinou prostaty léčených orálními a / nebo parenterálními estrogeny nebo orchidektomií". Prostata. 14 (2): 177–82. doi:10.1002 / pros.2990140210. PMID 2523531. S2CID 25516937.
- ^ A b Scarabin PY (prosinec 2014). "Hormony a žilní tromboembolismus u žen po menopauze". Klimakterický. 17 Suppl 2: 34–7. doi:10.3109/13697137.2014.956717. PMID 25223916. S2CID 5084606.
- ^ A b Mohammed K, Abu Dabrh AM, Benkhadra K, Al Nofal A, Carranza Leon BG, Prokop LJ, Montori VM, Faubion SS, Murad MH (listopad 2015). „Orální vs. transdermální léčba estrogenem a vaskulární příhody: Systematický přehled a metaanalýza“. J. Clin. Endokrinol. Metab. 100 (11): 4012–20. doi:10.1210 / jc.2015-2237. PMID 26544651.
- ^ Bińkowska M (říjen 2014). „Menopauzální hormonální terapie a žilní tromboembolismus“. Prz Menopauzalny. 13 (5): 267–72. doi:10.5114 / pm.2014.46468. PMC 4520375. PMID 26327865.
- ^ Campbell (6. prosince 2012). Řízení menopauzy a postmenopauzálních let: sborník z mezinárodního sympozia konaného v Londýně ve dnech 24. – 26. Listopadu 1975 Pořádá Institut porodnictví a gynekologie, Londýnská univerzita. Springer Science & Business Media. str. 395–. ISBN 978-94-011-6165-7.
- ^ Phillips I, Shah SI, Duong T, Abel P, Langley RE (2014). „Androgen Deprivation Therapy and the Re-emergent of Parenteral Estrogen in Cancer prostate“. Oncol Hematol Rev. 10 (1): 42–47. doi:10.17925 / ohr.2014.10.1.42. PMC 4052190. PMID 24932461.
- ^ Henriksson P, Carlström K, Pousette A, Gunnarsson PO, Johansson CJ, Eriksson B, Altersgård-Brorsson AK, Nordle O, Stege R (1999). „Čas na oživení estrogenů při léčbě pokročilého karcinomu prostaty? Farmakokinetika a endokrinní a klinické účinky parenterálního estrogenového režimu“. Prostata. 40 (2): 76–82. doi:10.1002 / (sici) 1097-0045 (19990701) 40: 2 <76 :: aid-pros2> 3.0.co; 2-q. PMID 10386467.
- ^ Russell N, Cheung A, Grossmann M (srpen 2017). „Estradiol pro zmírnění negativních účinků deprivační terapie androgenů“. Endocr. Relat. Rakovina. 24 (8): R297 – R313. doi:10.1530 / ERC-17-0153. PMID 28667081.
- ^ A b Shellenberger, T. E. (1986). "Farmakologie estrogenů". Perspektiva Climacteric. 393–410. doi:10.1007/978-94-009-4145-8_36. ISBN 978-94-010-8339-3.
Ethinylestradiol je syntetický a poměrně silný estrogen. V důsledku alkylace v poloze 17-C nejde o substrát pro 17p dehydrogenázu, což je enzym, který transformuje přírodní estradiol-17p na méně účinný estron v cílových orgánech.
- ^ Mueck AO, Seeger H, Rabe T (prosinec 2010). „Hormonální antikoncepce a riziko rakoviny endometria: systematický přehled“. Endocr. Relat. Rakovina. 17 (4): R263–71. doi:10.1677 / ERC-10-0076. PMID 20870686.
Další čtení
- Alfred S. Wolf; H.P.G. Schneider (1989). Östrogene in Diagnostik und Therapie [Estrogeny v diagnostice a terapii]. Springer-Verlag. str. 1–. ISBN 978-3-642-75101-1.
- Kuhl H (září 1990). "Farmakokinetika estrogenů a progestogenů". Maturitas. 12 (3): 171–97. doi:10.1016 / 0378-5122 (90) 90003-O. PMID 2170822.
- Lobo RA, Cassidenti DL (leden 1992). "Farmakokinetika orálního 17 beta-estradiolu". J Reprod Med. 37 (1): 77–84. PMID 1548642.
- O'Connell MB (září 1995). "Farmakokinetické a farmakologické rozdíly mezi různými estrogenovými produkty". J Clin Pharmacol. 35 (9S): 18S – 24S. doi:10.1002 / j.1552-4604.1995.tb04143.x. PMID 8530713. S2CID 10159196.
- Michael Oettel; Ekkehard Schillinger (1999). Estrogeny a antiestrogeny I: Fyziologie a mechanismy působení estrogenů a antiestrogenů. Springer Science & Business Media. ISBN 978-3-642-58616-3.
- Michael Oettel; Ekkehard Schillinger (1999). Estrogeny a antiestrogeny II: Farmakologie a klinické použití estrogenů a antiestrogenů. Springer Science & Business Media. ISBN 978-3-642-60107-1.
- Ruggiero RJ, Likis FE (2002). "Estrogen: fyziologie, farmakologie a formulace pro substituční terapii". J Porodní asistence Dámské zdraví. 47 (3): 130–8. doi:10.1016 / S1526-9523 (02) 00233-7. PMID 12071379.
- Kuhl H (2005). „Farmakologie estrogenů a progestogenů: vliv různých cest podání“ (PDF). Klimakterický. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- Barnes, Randall B .; Levrant, Seth G. (2007). Léčba postmenopauzální ženy. 767–777. doi:10.1016 / B978-012369443-0 / 50066-1. ISBN 9780123694430.
- Fruzzetti F, Trémollieres F, Bitzer J (2012). „Přehled vývoje kombinovaných perorálních kontraceptiv obsahujících estradiol: zaměření na estradiol valerát / dienogest“. Gynecol. Endokrinol. 28 (5): 400–8. doi:10.3109/09513590.2012.662547. PMC 3399636. PMID 22468839.
- Stanczyk FZ, Archer DF, Bhavnani BR (2013). „Ethinylestradiol a 17β-estradiol v kombinovaných perorálních kontraceptivech: farmakokinetika, farmakodynamika a hodnocení rizik“. Antikoncepce. 87 (6): 706–27. doi:10.1016 / j. Antikoncepce.2012.12.011. PMID 23375353.