Hypotalamus - Hypothalamus
| Hypotalamus | |
|---|---|
 Umístění lidského hypotalamu | |
 Umístění hypotalamu (modrý) ve vztahu k hypofýze a zbytku mozku | |
| Detaily | |
| Část | Mozek |
| Identifikátory | |
| latinský | hypotalamus |
| Pletivo | D007031 |
| NeuroLex ID | birnlex_734 |
| TA98 | A14.1.08.401 A14.1.08.901 |
| TA2 | 5714 |
| FMA | 62008 |
| Anatomické pojmy neuroanatomie | |
The hypotalamus (z Starořečtina .πό, „pod“ a θάλαμος, "komora") je část mozek který obsahuje několik malých jádra s řadou funkcí. Jednou z nejdůležitějších funkcí hypotalamu je propojení nervový systém do endokrinní systém přes hypofýza. Hypotalamus se nachází pod thalamus a je součástí limbický systém.[1] V terminologii neuroanatomie, tvoří břišní část diencephalon. Všechno obratlovců mozky obsahují hypotalamus. U lidí je to velikost mandle.
Hypotalamus je zodpovědný za regulaci určitých metabolické procesy a další činnosti autonomní nervový systém. To syntetizuje a vylučuje jisté neurohormony, volala uvolňující hormony nebo hormony hypotalamu, a ty zase stimulují nebo inhibují sekreci hormony z hypofýzy. Hypotalamus ovládá tělesná teplota, hlad, důležité aspekty rodičovství a chování příloh, žízeň,[2] únava, spát, a cirkadiánní rytmy.[3]
Struktura

Hypotalamus je rozdělen do 3 oblastí (supraoptická, tuberální, mammilární) v parazagitální rovině, což naznačuje umístění předozadní; a 3 oblasti (periventrikulární, mediální, laterální) v koronální rovině, označující umístění medial-lateral. Hypothalamická jádra se nacházejí v těchto specifických oblastech a oblastech.[4] Nachází se ve všech nervových systémech obratlovců. U savců magnocelulární neurosekreční buňky v paraventrikulární jádro a supraoptické jádro produkce hypotalamu neurohypofyziální hormony, oxytocin a vazopresin. Tyto hormony se uvolňují do krve v zadní hypofýza.[5] Mnohem menší parvocelulární neurosekreční buňky, neurony paraventrikulárního jádra, uvolnění hormon uvolňující kortikotropin a další hormony do hypofyzární portálový systém, kde tyto hormony difundují do přední hypofýza.
Jádra
Hypotalamická jádra zahrnují následující:[6][7][8]
| Kraj | Plocha | Jádro | Funkce[9] |
| Přední (supraoptický) | Preoptic | Preoptické jádro | |
| Mediální | Mediální preoptické jádro |
| |
| Supraoptické jádro |
| ||
| Paraventrikulární jádro |
| ||
| Přední hypotalamické jádro | |||
| Suprachiasmatické jádro | |||
| Postranní | |||
| Postranní jádro | Vidět Laterální hypotalamus § Funkce - primární zdroj orexin neurony, které se promítají do mozku a míchy | ||
| Střední (tuberální) | Mediální | Dorsomediální hypotalamické jádro |
|
| Ventromediální jádro |
| ||
| Obloukové jádro |
| ||
| Postranní | Postranní jádro | Vidět Laterální hypotalamus § Funkce - primární zdroj orexin neurony, které se promítají do mozku a míchy | |
| Laterální tuberální jádra | |||
| Zadní (mammillary) | Mediální | Mammilární jádra (část mammilární těla ) | |
| Zadní jádro |
| ||
| Postranní | Postranní jádro | Vidět Laterální hypotalamus § Funkce - primární zdroj orexin neurony, které se promítají do mozku a míchy | |
| Tuberomamilární jádro[11] |
|
- Viz také

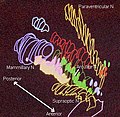
Průřez hypotalamu opice zobrazuje dvě hlavní jádra hypotalamu na obou stranách třetí komory naplněné tekutinou.
Hypotalamická jádra
Hypothalamická jádra na jedné straně hypotalamu, ukázaná v 3D rekonstrukci počítače[12]
Připojení
Hypotalamus je vysoce propojen s ostatními částmi centrální nervový systém, zejména mozkový kmen a jeho retikulární formace. Jako součást limbický systém, má spojení s dalšími limbickými strukturami včetně amygdala a septum, a je také spojen s oblastmi autonomní nervový systém.
Hypotalamus přijímá mnoho vstupů z mozkový kmen, nejpozoruhodnější z jádro solitérního traktu, locus coeruleus a ventrolaterální dřeň.
Většina nervová vlákna v hypotalamu probíhají dvěma způsoby (obousměrně).
- Projekce do oblastí ocasní do hypotalamu projít mediální svazek předního mozku, mammillotegmentální trakt a hřbetní podélný fasciculus.
- Projekce do oblastí rostrálních k hypotalamu jsou přenášeny mammillothalamický trakt, fornix a terminální stria.
- Projekce do oblastí EU sympatický motorický systém (boční roh spinální segmenty T1-L2 / L3) jsou neseny hypotalamospinální trakt a aktivují sympatickou motorickou dráhu.
Sexuální dimorfismus
Několik jader hypotalamu je sexuálně dimorfní; tj. existují jasné rozdíly ve struktuře i funkci mezi muži a ženami.[13] Některé rozdíly jsou patrné i v hrubé neuroanatomii: nejpozoruhodnější je sexuálně dimorfní jádro v rámci preoptická oblast,[13] ve kterých rozdíly jsou jemné změny v konektivitě a chemické citlivosti konkrétních sad neuronů. Důležitost těchto změn lze uznat podle funkčních rozdílů mezi muži a ženami. Například muži většiny druhů dávají přednost vůni a vzhledu žen před muži, což napomáhá stimulaci mužského sexuálního chování. Pokud dojde k poškození sexuálně dimorfního jádra, tato preference pro ženy u mužů klesá. Také vzor vylučování růstový hormon je sexuálně dimorfní;[14] to je důvod, proč u mnoha druhů jsou dospělí muži viditelně odlišitelní od žen.
Reakce na ovariální steroidy
Další nápadné funkční dimorfismy jsou v behaviorálních reakcích na ovariální steroidy dospělého. Muži a ženy reagují na ovariální steroidy různými způsoby, částečně proto, že exprese neuronů citlivých na estrogen v hypotalamu je sexuálně dimorfní; tj. estrogenové receptory jsou exprimovány v různých souborech neuronů.
Estrogen a progesteron může ovlivnit genovou expresi v konkrétních neuronech nebo vyvolat změny v buněčná membrána potenciál a kináza aktivace, vedoucí k různým negenomickým buněčným funkcím. Estrogen a progesteron se váží na své příbuzné receptory jaderných hormonů, které se translokují do buněčného jádra a interagují s oblastmi DNA známými jako prvky hormonální odezvy (HRE) nebo se připojte k jinému transkripční faktor vazebné místo. Estrogenový receptor Bylo prokázáno, že (ER) tímto způsobem transaktivuje další transkripční faktory, a to navzdory absenci prvek odpovědi na estrogen (ERE) v oblasti proximálního promotoru genu. Obecně platí, že ER a receptory progesteronu (PR) jsou genové aktivátory se zvýšenou mRNA a následnou syntézou proteinů po expozici hormonům.[Citace je zapotřebí ]
Mužský a ženský mozek se liší v distribuci estrogenových receptorů a tento rozdíl je nevratným důsledkem expozice neonatálních steroidů. Estrogenové receptory (a receptory progesteronu) se nacházejí hlavně v neuronech v předním a mediobazálním hypotalamu, zejména:
- the preoptická oblast (kde LHRH neurony jsou lokalizovány, regulují dopaminové reakce a chování matky;[15]
- the periventrikulární jádro kde somatostatin jsou umístěny neurony regulující hladinu stresu;[16]
- the ventromediální hypotalamus který reguluje hlad a sexuální vzrušení.
Rozvoj

V novorozeneckém životě ovlivňují gonadální steroidy vývoj neuroendokrinního hypotalamu. Například určují schopnost žen vykazovat normální reprodukční cyklus a mužů a žen projevovat odpovídající reprodukční chování v dospělosti.
- Pokud samice krysy je injikován jednou testosteronem během prvních několika dnů po narození (během „kritického období“ vlivu pohlavních steroidů), hypotalamus je nevratně maskulinizován; dospělá krysa nebude schopna generovat nárůst LH v reakci na estrogen (charakteristika samic), ale bude schopna vykazovat mužský sexuální chování (montáž sexuálně vnímavé ženy).[17]
- Naproti tomu a samec krysy kastrovaný hned po narození bude feminizovanáa dospělý se ukáže ženský sexuální chování v reakci na estrogen (sexuální vnímavost, chování lordózy ).[17]
U primátů vývojový vliv androgeny je méně jasné a důsledky jsou méně pochopitelné. V mozku je testosteron aromatizovaný (až estradiol ), který je hlavním aktivním hormonem pro vývojové vlivy. Člověk varle vylučuje vysoké hladiny testosteronu přibližně od 8. týdne života plodu do 5–6 měsíců po narození (podobný perinatální nárůst testosteronu je pozorován u mnoha druhů), což je proces, který se zdá být základem mužského fenotypu. Estrogen z mateřského oběhu je relativně neúčinný, částečně kvůli vysokým cirkulujícím hladinám proteinů vázajících steroidy v těhotenství.[17]
Sexuální steroidy nejsou jedinými důležitými vlivy na vývoj hypotalamu; zejména, před pubertou stres v raném věku (u potkanů) určuje schopnost dospělého hypotalamu reagovat na akutní stresor.[18] Na rozdíl od gonadálních steroidních receptorů glukokortikoid receptory jsou velmi rozšířené po celém mozku; v paraventrikulární jádro, zprostředkovávají kontrolu negativní zpětné vazby CRF syntéza a sekrece, ale jinde není jejich role dobře pochopena.
Funkce
Uvolňování hormonů
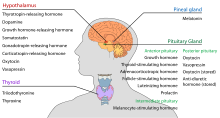
Hypotalamus má centrální neuroendokrinní funkce, zejména její kontrolou nad přední hypofýza, který zase reguluje různé endokrinní žlázy a orgány. Uvolňující hormony (nazývané také uvolňovací faktory) se produkují v jádrech hypotalamu a poté se transportují axony buď střední eminence nebo zadní hypofýza, kde jsou uloženy a uvolněny podle potřeby.[19]
- Přední hypofýza
V ose hypotalamus – adenohypofýza se uvolňující hormony, známé také jako hypofyziotropní nebo hypotalamové hormony, uvolňují ze střední eminence, prodloužení hypotalamu, do hypofyzární portálový systém, který je přenáší do přední hypofýzy, kde uplatňují své regulační funkce na sekreci adenohypofyzálních hormonů.[20] Tyto hypofyziotropní hormony jsou stimulovány parvocelulárními neurosekrečními buňkami umístěnými v periventrikulární oblasti hypotalamu. Po jejich uvolnění do kapilár třetí komory procházejí hypofyziotropní hormony takzvanou hypotalamo-hypofyzární portální cirkulací. Jakmile dosáhnou svého cíle v přední hypofýze, tyto hormony se vážou na specifické receptory umístěné na povrchu buněk hypofýzy. V závislosti na tom, které buňky jsou touto vazbou aktivovány, hypofýza začne vylučovat nebo přestane vylučovat hormony do zbytku krevního řečiště.[21]
Mezi další hormony vylučované ze střední eminence patří vazopresin, oxytocin, a neurotensin.[23][24][25][26]
- Zadní hypofýza
V ose hypotalamus-neurohypofýza neurohypofyziální hormony jsou uvolňovány ze zadní hypofýzy, což je vlastně prodloužení hypotalamu, do oběhu.
| Vylučovaný hormon | Zkratka | Produkovaný | Účinek |
|---|---|---|---|
| Oxytocin | OXY nebo OXT | Magnocelulární neurosekreční buňky paraventrikulárního jádra a supraoptické jádro | Kontrakce dělohy Kojení (letdown reflex) |
| Vazopresin (antidiuretický hormon) | ADH nebo AVP | Magnocelulární a parvocelulární neurosekreční buňky paraventrikulárního jádra, magnocelulární buňky v supraoptickém jádře | Zvýšení propustnosti pro buňky buněk distální tubul a sběrné potrubí v ledvinách a umožňuje tak reabsorpci vody a vylučování koncentrované moči |
Je také známo, že osa hypotalamus-hypofýza-nadledviny Hormony (HPA) souvisejí s určitými kožními chorobami a homeostázou kůže. Existují důkazy spojující hyperaktivitu hormonů HPA s kožními chorobami a nádory kůže souvisejícími se stresem.[27]
Stimulace
Hypotalamus koordinuje mnoho hormonálních a behaviorálních cirkadiánních rytmů, složitých vzorců neuroendokrinní výstupy, komplexní homeostatický mechanismy a důležité chování. Hypotalamus proto musí reagovat na mnoho různých signálů, z nichž některé jsou generovány externě a jiné interně. Delta vlna signalizace vznikající buď v thalamu nebo v mozkové kůře ovlivňuje sekreci uvolňujících hormonů; GHRH a prolaktin jsou stimulovány TRH je potlačen.
Hypotalamus reaguje na:
- Světlo: délka dne a fotoperioda pro regulaci cirkadiánní a sezónní rytmy
- Čichový podněty, včetně feromony
- Steroidy, počítaje v to gonadální steroidy a kortikosteroidy
- Nervově přenášené informace vycházející zejména ze srdce, střevní nervový systém (z gastrointestinální trakt ),[28] a reprodukční trakt.[Citace je zapotřebí ]
- Autonomní vstupy
- Krevní podněty, včetně leptin, ghrelin, angiotensin, inzulín, hormony hypofýzy, cytokiny, plazmatické koncentrace glukózy a osmolarita atd.
- Stres
- Napadení mikroorganismů zvýšením tělesné teploty a resetováním termostatu těla nahoru.
Čichové podněty
Čichové podněty jsou důležité pro sexuální reprodukce a neuroendokrinní funkce u mnoha druhů. Například pokud je těhotná myš vystavena moči „podivného“ muže během kritického období po pohlavním styku, těhotenství selže ( Bruceův efekt ). Během pohlavního styku si tedy samice myši vytvoří přesnou „čichovou paměť“ svého partnera, která přetrvává několik dní. Feromonální narážky pomáhají synchronizovat říje u mnoha druhů; u žen synchronizované menstruace mohou také vzniknout z feromonálních podnětů, i když je role feromonů u lidí sporná.
Krevní podněty
Peptid hormony mají významný vliv na hypotalamus, a proto musí projít hematoencefalická bariéra. Hypotalamus je částečně ohraničen specializovanými oblastmi mozku, které postrádají účinnou hematoencefalickou bariéru; the kapilární endotel na těchto místech je fenestrován, aby umožnil volný průchod i velkých proteinů a dalších molekul. Některá z těchto stránek jsou neurosekrecí - neurohypofýza a střední eminence. Jiná jsou však místa, kde mozek vzorkuje složení krve. Dva z těchto webů, SFO (subfornický orgán ) a OVLT (organum vasculosum z lamina terminalis ) jsou tzv cirkumventrikulární orgány, kde jsou neurony v těsném kontaktu s krví i Mozkomíšní mozek. Tyto struktury jsou hustě vaskularizované a obsahují osmoreceptivní a na sodík přijímající neurony, které řídí pití, vazopresin uvolňování, vylučování sodíku a chuť k jídlu. Obsahují také neurony s receptory pro angiotensin, atriální natriuretický faktor, endotelin a relaxovat, z nichž každý je důležitý při regulaci rovnováhy tekutin a elektrolytů. Neurony v projektu OVLT a SFO k supraoptické jádro a paraventrikulární jádro, a také do preoptických hypotalamických oblastí. Místem působení mohou být také cirkumventrikulární orgány interleukiny vyvolat jak horečku, tak sekreci ACTH prostřednictvím účinků na paraventrikulární neurony.[Citace je zapotřebí ]
Není jasné, jak všechny peptidy, které ovlivňují hypotalamovou aktivitu, získávají potřebný přístup. V případě prolaktin a leptin, existují důkazy o aktivním příjmu na choroidalis plexus z krve do mozkomíšní mok (CSF). Některé hormony hypofýzy mají negativní zpětnovazebný vliv na sekreci hypotalamu; například, růstový hormon se živí hypotalamem, ale jak vstupuje do mozku, není jasné. Existují také důkazy o ústředních akcích prolaktin.[Citace je zapotřebí ]
Nálezy tomu nasvědčují hormon štítné žlázy (T4) je absorbován hypotalamem gliové buňky v infundibulární jádro / střední eminence, a že je zde převeden na T3 deiodinázou typu 2 (D2). Následně je T3 transportován do hormon uvolňující thyrotropin (TRH ) -produkce neurony v paraventrikulární jádro. Receptory hormonů štítné žlázy byly nalezeny v těchto neurony, což naznačuje, že jsou skutečně citlivé na podněty T3. Kromě toho se tyto neurony exprimovaly MCT8, a hormon štítné žlázy transportér, podporující teorii, že se do nich transportuje T3. T3 by se pak mohl vázat na receptor hormonu štítné žlázy v těchto neuronech a ovlivnit produkci hormonu uvolňujícího thyrotropin, čímž reguluje produkci hormonu štítné žlázy.[29]
Hypotalamus funguje jako typ termostat pro tělo.[30] Nastavuje požadovanou tělesnou teplotu a stimuluje buď produkci a zadržování tepla ke zvýšení teploty krve na vyšší nastavení nebo pocení a vazodilatace k ochlazení krve na nižší teplotu. Všechno horečky výsledek zvýšeného nastavení v hypotalamu; zvýšené tělesné teploty z jakékoli jiné příčiny jsou klasifikovány jako hypertermie.[30] Zřídka přímé poškození hypotalamu, například z a mrtvice, způsobí horečku; někdy se tomu říká a hypotalamová horečka. Je však častější, že takové poškození způsobuje neobvykle nízké teploty těla.[30]
Steroidy
Hypotalamus obsahuje neurony, které silně reagují na steroidy a glukokortikoidy - (steroidní hormony nadledvina, vydané v reakci na ACTH ). Obsahuje také specializované neurony citlivé na glukózu (v obloukovité jádro a ventromediální hypotalamus ), které jsou důležité pro chuť. Preoptická oblast obsahuje termosenzitivní neurony; jsou důležité pro TRH vylučování.
Neurální
Oxytocin sekrece v reakci na sání nebo vaginálně-cervikální stimulaci je zprostředkována některými z těchto cest; vazopresin sekrece v reakci na kardiovaskulární podněty vznikající z chemoreceptorů v krční tělo a aortální oblouk a z nízkého tlaku receptory síňového objemu, je zprostředkována jinými. U potkanů stimulace pochva také způsobuje prolaktin sekrece, a to má za následek pseudo-těhotenství po neplodném páření. U králíka koit vyvolává reflex ovulace. V ovcích krční stimulace v přítomnosti vysokých hladin estrogenu může vyvolat mateřské chování v panenské bahnici. Všechny tyto účinky jsou zprostředkovány hypotalamem a informace jsou přenášeny hlavně páteřními cestami, které se přenášejí v mozkovém kmeni. Stimulace bradavek stimuluje uvolňování oxytocinu a prolaktinu a potlačuje uvolňování LH a FSH.
Kardiovaskulární podněty jsou přenášeny bludný nerv. Vagus také zprostředkovává řadu viscerálních informací, včetně například signálů vyplývajících z distenze nebo vyprazdňování žaludku, k potlačení nebo podpoře krmení, signalizací uvolnění leptin nebo gastrin, resp. Tato informace se opět dostává do hypotalamu prostřednictvím relé v mozkovém kmeni.
Kromě toho hypotalamická funkce reaguje na - a reguluje - úrovněmi všech tří klasických monoaminové neurotransmitery, noradrenalin, dopamin, a serotonin (5-hydroxytryptamin), v těch traktech, ze kterých dostává inervaci. Například noradrenergní vstupy vznikající z locus coeruleus mají důležité regulační účinky hormon uvolňující kortikotropin (CRH) úrovně.
Kontrola příjmu potravy
| Peptidy, které se zvyšují krmení | Peptidy, které se snižují krmení |
|---|---|
| Ghrelin | Leptin |
| Neuropeptid Y | (α, β, γ) -Hormony stimulující melanocyty |
| Peptid související s aguti | Kokainem a amfetaminem regulované transkriptové peptidy |
| Orexiny (A, B) | Hormon uvolňující kortikotropin |
| Hormon koncentrující melanin | Cholecystokinin |
| Galanin | Inzulín |
| Peptid podobný glukagonu 1 |
Extrém postranní část ventromediální jádro hypotalamu je odpovědný za kontrolu jídlo přívod. Stimulace této oblasti způsobuje zvýšený příjem potravy. Bilaterální léze této oblasti způsobí úplné zastavení příjmu potravy. Mediální části jádra mají kontrolní účinek na boční část. Bilaterální léze střední části ventromediálního jádra způsobuje hyperfágie a obezita zvířete. Další léze laterální části ventromediálního jádra u stejného zvířete způsobí úplné zastavení příjmu potravy.
S tímto nařízením souvisejí různé hypotézy:[32]
- Lipostatická hypotéza: Tato hypotéza platí tukové tkáň vyrábí a Humorný signál, který je úměrný množství tuku a působí na hypotalamus, aby snížil příjem potravy a zvýšil energetický výdej. Bylo zřejmé, že a hormon leptin působí na hypotalamus, aby snížil příjem potravy a zvýšil energetický výdej.
- Gutpeptidová hypotéza: gastrointestinální hormony jako Grp, glukagony, CCK a další tvrdili, že inhibují příjem potravy. Jídlo vstupující do gastrointestinálního traktu spouští uvolňování těchto hormonů, které působí na mozek a vytvářejí sytost. Mozek obsahuje receptory CCK-A i CCK-B.
- Glukostatická hypotéza: Aktivita centra sytosti ve ventromediálních jádrech je pravděpodobně řízena glukóza využití v neuronech. Předpokládá se, že když je jejich využití glukózy nízké a následně když je nízký arteriovenózní rozdíl glukózy v krvi, aktivita v neuronech klesá. Za těchto podmínek není činnost centra krmení kontrolována a jedinec má pocit hladu. Příjem potravy se rychle zvyšuje intraventrikulárním podáním 2-deoxyglukóza proto snižuje využití glukózy v buňkách.
- Termostatická hypotéza: Podle této hypotézy snížení tělesné teploty pod danou nastavenou hodnotu stimuluje chuť k jídlu, zatímco zvýšení nad nastavenou hodnotu potlačuje chuť k jídlu.
Zpracování strachu
Mediální zóna hypotalamu je součástí obvodu, který řídí motivované chování, jako je obranné chování.[33] Analýzy Fos -značení ukázalo, že řada jader ve „sloupci kontroly chování“ je důležitá pro regulaci exprese vrozeného a podmíněného obranného chování.[34]
- Antipredatory defenzivní chování
Vystavení dravci (například kočce) vyvolává u laboratorních hlodavců obranné chování, i když zvíře nikdy nebylo kočce vystaveno.[35] V hypotalamu způsobuje tato expozice nárůst Označeno Fos buňky v přední části hypotalamického jádra, v dorsomediální části ventromediálního jádra a ve ventrolaterální části premammilárního jádra (PMDvl).[36] Premammilární jádro hraje důležitou roli ve vyjádření obranného chování vůči dravci, protože léze v tomto jádře ruší obranné chování, jako je zmrazení a útěk.[36][37] PMD nemoduluje obranné chování v jiných situacích, protože léze tohoto jádra měly minimální účinky na skóre zmrazení po šoku.[37] PMD má důležité spojení s hřbetem periaqueductal šedá, důležitá struktura projevu strachu.[38][39] Kromě toho zvířata vykazují chování při hodnocení rizika pro prostředí dříve spojené s kočkou. Fos-značená buněčná analýza ukázala, že PMDvl je nejvíce aktivovaná struktura v hypotalamu a inaktivace s muscimol před vystavením kontextu ruší obranné chování.[36] Proto má hypotalamus, zejména PMDvl, důležitou roli ve vyjádření vrozeného a podmíněného obranného chování predátora.
- Sociální porážka
Podobně hraje roli hypotalamus sociální porážka: Jádra ve střední zóně jsou také mobilizována během setkání s agresivním konzpecifikem. Poražené zvíře má zvýšené hladiny Fos v sexuálně dimorfních strukturách, jako je mediální předoptické jádro, ventrolaterální část ventromediálního jádra a ventrální premammilary jádro.[40] Tyto struktury jsou důležité v dalším sociálním chování, jako je sexuální a agresivní chování. Kromě toho je premammilární jádro také mobilizováno, dorsomediální část, ale ne ventrolaterální část.[40] Léze v tomto jádru ruší pasivní obranné chování, jako je zmrazení a držení těla „na zádech“.[40]
Další obrázky

Lidský mozek opustil členitý střední pohled

Umístění hypotalamu
Viz také
- Copeptin
- Osa hypotalamus-hypofýza-nadledvina (Osa HPA)
- Osa hypotalamus – hypofýza – gonadální (Osa HPG)
- Osa hypotalamus – hypofýza – štítná žláza (Osa HPT)
- Incertohypotalamická cesta
- Neuroendokrinologie
- Neurověda spánku
Reference
- ^ Dr. Boeree, C. George. "Emoční nervový systém". Limbický systém. Citováno 18. dubna 2016.
- ^ „Slovník pojmů rakoviny NCI“. Národní onkologický institut.
- ^ Saper, Clifford B .; Scammell, Thomas E .; Lu, červen (2005). „Hypotalamická regulace spánku a cirkadiánních rytmů“. Příroda. 437 (7063): 1257–1263. Bibcode:2005 Natur.437.1257S. doi:10.1038 / příroda04284. ISSN 1476-4687. PMID 16251950. S2CID 1793658.
- ^ Inderbir Singh (září 2011). Učebnice anatomie: Svazek 3: Hlava a krk, centrální nervový systém. JP Medical Ltd. str. 1101–. ISBN 978-93-5025-383-0.
- ^ Melmed, S; Polonsky, KS; Larsen, PR; Kronenberg, HM (2011). Williamsova učebnice endokrinologie (12. vydání). Saunders. p. 107. ISBN 978-1437703245.
- ^ „Zvětšený pohled na hypotalamus“. psycheducation.org. Jim Phelps. Archivovány od originál dne 15. prosince 2005. Citováno 7. února 2020.
- ^ „Diagram jader“. vesmír-review.ca. Citováno 7. února 2020.
- ^ „Emoce a limbický systém“. utdallas.edu. Lucien T. "Tres" Thompson, University of Texas v Dallasu. Citováno 7. února 2020.
- ^ Hall, John E .; Guyton, Arthur C. (2011). Guyton a Hall učebnice lékařské fyziologie (12. vydání). Saunders / Elsevier. ISBN 978-1416045748.
- ^ Yoshida K, Li X, Cano G, Lazarus M, Saper CB (září 2009). "Paralelní preoptické dráhy pro termoregulaci". The Journal of Neuroscience. 29 (38): 11954–64. doi:10.1523 / JNEUROSCI.2643-09.2009. PMC 2782675. PMID 19776281.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). „Kapitola 6: Široce vyčnívající systémy: monoaminy, acetylcholin a orexin“. In Sydor A, Brown RY (eds.). Molekulární neurofarmakologie: Nadace pro klinickou neurovědu (2. vyd.). New York: McGraw-Hill Medical. str. 175–176. ISBN 9780071481274.
V mozku je histamin syntetizován výhradně neurony s těly buněk v tuberomammilárním jádru (TMN), které leží v zadním hypotalamu. U lidí je na každé straně přibližně 64 000 histaminergních neuronů. Tyto buňky se promítají do mozku a míchy. Oblasti, které dostávají obzvláště husté projekce, zahrnují mozkovou kůru, hipokampus, neostriatum, nucleus accumbens, amygdala a hypotalamus. ... Zatímco nejlépe charakterizovanou funkcí histaminového systému v mozku je regulace spánku a vzrušení, histamin se také podílí na učení a paměti ... Zdá se také, že histamin se podílí na regulaci výživy a energetické rovnováhy.
- ^ Bulletin Brain Research 35: 323–327, 1994
- ^ A b Hofman MA, Swaab DF (červen 1989). „Sexuálně dimorfní jádro preoptické oblasti v lidském mozku: srovnávací morfometrická studie“. Anatomy Journal. 164: 55–72. PMC 1256598. PMID 2606795.
- ^ Quinnies KM, Bonthuis PJ, Harris EP, Shetty SR, Rissman EF (2015). „Nervový růstový hormon: regionální regulace estradiolem a / nebo doplňkem pohlavního chromozomu u samců a samic myší“. Biologie sexuálních rozdílů. 6: 8. doi:10.1186 / s13293-015-0026-x. PMC 4434521. PMID 25987976.
- ^ Castañeyra-Ruiz L, González-Marrero I, Castañeyra-Ruiz A, González-Toledo JM, Castañeyra-Ruiz M, de Paz-Carmona H, Castañeyra-Perdomo A, Carmona-Calero EM (2013). „Distribuce hormonu uvolňujícího luteinizační hormon v předním hypotalamu samic potkanů“. Anatomie ISRN. 2013: 1–6. doi:10.5402/2013/870721. PMC 4392965. PMID 25938107.
- ^ Isgor C, Cecchi M, Kabbaj M, Akil H, Watson SJ (2003). „Estrogenový receptor beta v paraventrikulárním jádru hypotalamu reguluje neuroendokrinní reakci na stres a je regulován kortikosteronem“. Neurovědy. 121 (4): 837–45. doi:10.1016 / S0306-4522 (03) 00561-X. PMID 14580933. S2CID 31026141.
- ^ A b C McCarthy MM, Arnold AP, Ball GF, Blaustein JD, De Vries GJ (únor 2012). „Sexuální rozdíly v mozku: nepříjemná pravda“. The Journal of Neuroscience. 32 (7): 2241–7. doi:10.1523 / JNEUROSCI.5372-11.2012. PMC 3295598. PMID 22396398.
- ^ Romeo RD, Bellani R, Karatsoreos IN, Chhua N, Vernov M, Conrad CD, McEwen BS (duben 2006). „Historie stresu a pubertální vývoj interagují a formují plasticitu osy hypotalamus-hypofýza-nadledvina“. Endokrinologie. 147 (4): 1664–74. doi:10.1210 / cs.2005-1432. PMID 16410296.
- ^ Bowen, R. "Přehled hypotalamických a hypofyzárních hormonů". Citováno 5. října 2014.
- ^ Melmed S, Jameson JL (2005). "Poruchy přední hypofýzy a hypotalamu". V publikaci Kasper DL, Braunwald E, Fauci AS a kol. (eds.). Harrisonovy principy interního lékařství (16. vydání). New York, NY: McGraw-Hill. str.2076 –97. ISBN 978-0-07-139140-5.
- ^ Bear MF, Connors BW, Paradiso MA (2016). "Hypotalamická kontrola přední hypofýzy". Neuroscience: Exploring the Brain (4. vydání). Philadelphia: Wolters Kluwer. p. 528. ISBN 978-0-7817-7817-6.
- ^ Ben-Shlomo A, Melmed S (březen 2010). "Signalizace receptoru somatostatinu hypofýzy". Trendy v endokrinologii a metabolismu. 21 (3): 123–33. doi:10.1016 / j.tem.2009.12.003. PMC 2834886. PMID 20149677.
- ^ Horn AM, Robinson IC, Fink G (únor 1985). „Oxytocin a vasopresin v hypofyziální portální krvi potkanů: experimentální studie u normálních potkanů a potkanů Brattleboro“. The Journal of Endocrinology. 104 (2): 211–24. doi:10.1677 / joe.0.1040211. PMID 3968510.
- ^ Date Y, Mondal MS, Matsukura S, Ueta Y, Yamashita H, Kaiya H, Kangawa K, Nakazato M (březen 2000). "Distribuce orexinu / hypokretinu v mediánové eminenci a hypofýze krysy". Výzkum mozku. Molekulární výzkum mozku. 76 (1): 1–6. doi:10.1016 / s0169-328x (99) 00317-4. PMID 10719209.
- ^ Watanobe H, Takebe K (duben 1993). „In vivo uvolňování neurotensinu ze střední eminence potkanů s ovariektomizovaným estrogenem, jak je odhadnuto pomocí push-pull perfúze: korelace s luteinizačním hormonem a nárůstem prolaktinu“. Neuroendokrinologie. 57 (4): 760–4. doi:10.1159/000126434. PMID 8367038.
- ^ Spinazzi R, Andreis PG, GP Rossi, Nussdorfer GG (březen 2006). „Orexiny v regulaci osy hypotalamus-hypofýza-nadledviny“. Farmakologické recenze. 58 (1): 46–57. doi:10.1124 / pr.58.1.4. PMID 16507882. S2CID 17941978.
- ^ Jung Eun Kim; Baik Kee Cho; Dae Ho Cho; Hyun Jeong Park (2013). „Vyjádření osy hypotalamus-hypofýza-nadledvina u běžných kožních onemocnění: Důkazy o její asociaci s aktivitou související se stresem“. Korejská národní výzkumná nadace. Citováno 4. března 2014.
- ^ Mayer EA (červenec 2011). „Pocity střeva: nastupující biologie komunikace střeva a mozku“. Recenze přírody. Neurovědy. 12 (8): 453–66. doi:10.1038 / nrn3071. PMC 3845678. PMID 21750565.
- ^ Fliers E, Unmehopa UA, Alkemade A (červen 2006). "Funkční neuroanatomie zpětné vazby hormonů štítné žlázy v lidském hypotalamu a hypofýze". Molekulární a buněčná endokrinologie. 251 (1–2): 1–8. doi:10.1016 / j.mce.2006.03.042. PMID 16707210. S2CID 33268046.
- ^ A b C Fauci, Anthony; et al. (2008). Harrisonovy principy interního lékařství (17 ed.). McGraw-Hill Professional. str.117 –121. ISBN 978-0-07-146633-2.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). „Kapitola 10: Nervová a neuroendokrinní kontrola vnitřního prostředí - tabulka 10: 3“. In Sydor A, Brown RY (eds.). Molekulární neurofarmakologie: Nadace pro klinickou neurovědu (2. vyd.). New York: McGraw-Hill Medical. p. 263. ISBN 9780071481274.
- ^ Theologides A (květen 1976). "Anorexie produkující meziprodukty metabolitů". American Journal of Clinical Nutrition. 29 (5): 552–8. doi:10.1093 / ajcn / 29.5.552. PMID 178168.
- ^ Swanson LW (prosinec 2000). "Regulace mozkové hemisféry motivovaného chování". Výzkum mozku. 886 (1–2): 113–164. doi:10.1016 / S0006-8993 (00) 02905-X. PMID 11119693. S2CID 10167219.
- ^ Canteras, N.S. (2002). „Mediální hypotalamický obranný systém: Hodologická organizace a funkční důsledky“. Farmakologická biochemie a chování. 71 (3): 481–491. doi:10.1016 / S0091-3057 (01) 00685-2. PMID 11830182. S2CID 12303256.
- ^ Ribeiro-Barbosa ER, Canteras NS, Cezário AF, Blanchard RJ, Blanchard DC (2005). "Alternativní experimentální postup pro studium obranných odpovědí souvisejících s predátory". Neurovědy a biobehaviorální recenze. 29 (8): 1255–63. doi:10.1016 / j.neubiorev.2005.04.006. PMID 16120464. S2CID 8063630.
- ^ A b C Cezario AF, Ribeiro-Barbosa ER, Baldo MV, Canteras NS (září 2008). „Hypotalamická místa reagující na hrozby predátorů - role hřbetního premammilárního jádra v nepodmíněném a podmíněném antipredátorském obranném chování“. Evropský žurnál neurovědy. 28 (5): 1003–15. doi:10.1111 / j.1460-9568.2008.06392.x. PMID 18691328. S2CID 10073236.
- ^ A b Blanchard, D.C. (2003). "Hřbetní premammilární jádro odlišně moduluje obranné chování vyvolané různými stimulačními hrozbami u krys". Neurovědy Dopisy. 345 (3): 145–148. doi:10.1016 / S0304-3940 (03) 00415-4. PMID 12842277. S2CID 16406187.
- ^ Canteras NS, Swanson LW (listopad 1992). „Hřbetní premammilární jádro: neobvyklá součást mammilárního těla“. Sborník Národní akademie věd Spojených států amerických. 89 (21): 10089–93. Bibcode:1992PNAS ... 8910089C. doi:10.1073 / pnas.89.21.10089. PMC 50283. PMID 1279669.
- ^ Behbehani MM (srpen 1995). Msgstr "Funkční vlastnosti periaqueduktální šedé barvy středního mozku". Pokrok v neurobiologii. 46 (6): 575–605. doi:10.1016 / 0301-0082 (95) 00009-K. PMID 8545545. S2CID 24690642.
- ^ A b C Motta SC, Goto M, Gouveia FV, Baldo MV, Canteras NS, Swanson LW (březen 2009). „Pitva mozkového strachu odhaluje, že hypotalamus je kritický pro reakci u podřízených stejných vetřelců.“. Sborník Národní akademie věd Spojených států amerických. 106 (12): 4870–5. Bibcode:2009PNAS..106,4870M. doi:10.1073 / pnas.0900939106. PMC 2660765. PMID 19273843.
Další čtení
- de Vries GJ, Södersten P (květen 2009). „Pohlavní rozdíly v mozku: vztah mezi strukturou a funkcí“. Hormony a chování. 55 (5): 589–96. doi:10.1016 / j.yhbeh.2009.03.012. PMC 3932614. PMID 19446075.
externí odkazy
- Obarvené obrázky mozkových řezů, které obsahují „hypotalamus“ na Projekt BrainMaps
- Hypotalamus a hypofýza na endotexts.org
- Vyhledávání NIF - hypotalamus přes Informační rámec pro neurovědy
- Prostorové a průřezové diagramy hypotalamových jader: pravý hypotalamus, přední, trubkovitý, zadní.