Cytosol - Cytosol - Wikipedia

| Buněčná biologie | |
|---|---|
| The zvířecí buňka | |
 Složky typické zvířecí buňky:
|
The cytosol, také známý jako intracelulární tekutina (ICF) nebo cytoplazmatická maticenebo přízemní plazma,[2] je kapalina uvnitř buňky.[3] Je oddělena membránami do oddílů. Například mitochondriální matice odděluje mitochondrie do mnoha oddílů.
V eukaryotická buňka, je cytosol obklopen buněčná membrána a je součástí cytoplazma, který také zahrnuje mitochondrie, plastidy, a další organely (ale ne jejich vnitřní tekutiny a struktury); the buněčné jádro je samostatný. Cytosol je tedy kapalná matrice kolem organel. v prokaryoty, většina chemických reakcí metabolismus probíhají v cytosolu, zatímco několik probíhá v membránách nebo v periplazmatický prostor. V eukaryotech, zatímco mnoho metabolické cesty stále se vyskytují v cytosolu, jiné probíhají v organelách.
Cytosol je komplexní směs látek rozpuštěných ve vodě. I když voda tvoří velkou většinu cytosolu, její struktura a vlastnosti v buňkách nejsou dobře známy. Koncentrace ionty jako sodík a draslík se liší v cytosolu než v extracelulární tekutina; tyto rozdíly v úrovních iontů jsou důležité v procesech, jako je osmoregulace, buněčná signalizace a generace akční potenciály v excitabilních buňkách, jako jsou endokrinní, nervové a svalové buňky. Cytosol také obsahuje velké množství makromolekuly, což může změnit způsob, jakým se molekuly chovají makromolekulární shlukování.
Ačkoli se kdysi myslelo, že jde o jednoduché řešení molekul, má cytosol několik úrovní organizace. Tyto zahrnují koncentrační gradienty malých molekul jako např vápník, velké komplexy enzymy kteří jednají společně a účastní se metabolické cesty, a proteinové komplexy jako proteazomy a karboxysomy které uzavírají a oddělují části cytosolu.
Definice
Termín „cytosol“ poprvé zavedl v roce 1965 H. A. Lardy a původně odkazoval na kapalinu, která byla vyrobena rozbitím buněk a granulováním všech nerozpustných složek ultracentrifugace.[4][5] Takový rozpustný buněčný extrakt není totožný s rozpustnou částí buněčné cytoplazmy a obvykle se nazývá cytoplazmatická frakce.[6]
Termín cytosol se nyní používá k označení kapalné fáze cytoplazmy v intaktní buňce.[6] To vylučuje jakoukoli část cytoplazmy, která je obsažena v organelách.[7] Vzhledem k možnosti záměny mezi použitím slova „cytosol“ pro označení extraktů buněk a rozpustné části cytoplazmy v intaktních buňkách se k popisu kapalného obsahu cytoplazmy používá výraz „vodná cytoplazma“. živých buněk.[5]
Před tím, další podmínky, včetně hyaloplazma,[8] byly použity pro buněčnou tekutinu, ne vždy jako synonyma, protože její povaha nebyla příliš jasná (viz protoplazma ).[6]
Vlastnosti a složení
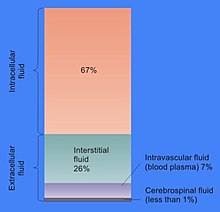
Podíl objemu buněk, kterým je cytosol, se mění: například zatímco tento oddíl tvoří podstatnou část buněčné struktury bakterie,[9] v rostlinných buňkách je hlavní kompartment velkým středem vakuola.[10] Cytosol se skládá převážně z vody, rozpuštěných iontů, malých molekul a velkých molekul rozpustných ve vodě (jako jsou proteiny). Většina těchto neproteinových molekul má a molekulová hmotnost méně než 300Da.[11] Tato směs malých molekul je mimořádně složitá, protože řada molekul, které se podílejí na metabolismu ( metabolity ) je obrovský. Například v rostlinách může být vyrobeno až 200 000 různých malých molekul, i když ne všechny budou přítomny ve stejném druhu nebo v jedné buňce.[12] Odhady počtu metabolitů v jednotlivých buňkách, jako např E-coli a pekařské droždí předpovídají, že je vyrobeno méně než 1000.[13][14]
Voda
Většina cytosolu je voda, který tvoří asi 70% z celkového objemu typické buňky.[15] The pH intracelulární tekutiny je 7,4.[16] zatímco lidský cytosol pH se pohybuje mezi 7,0–7,4 a je obvykle vyšší, pokud buňka roste.[17] The viskozita cytoplazmy je zhruba stejný jako čistá voda difúze malých molekul v této kapalině je asi čtyřikrát pomalejší než v čisté vodě, hlavně kvůli srážkám s velkým počtem makromolekuly v cytosolu.[18] Studie v slané krevety zkoumali, jak voda ovlivňuje funkce buněk; tito viděli, že 20% snížení množství vody v buňce inhibuje metabolismus, přičemž metabolismus se postupně snižuje, jak buňka vysychá a veškerá metabolická aktivita se zastaví, když hladina vody dosáhne 70% pod normální hodnotu.[5]
I když je voda životně důležitá, struktura této vody v cytosolu není dobře známa, hlavně proto, že metody jako spektroskopie nukleární magnetické rezonance poskytují pouze informace o průměrné struktuře vody a nemohou měřit místní variace v mikroskopickém měřítku. Dokonce i struktura čisté vody je špatně pochopena, kvůli schopnosti vody vytvářet struktury, jako je vodní klastry přes Vodíkové vazby.[19]
Klasický pohled na vodu v buňkách je takový, že asi 5% této vody je silně vázáno rozpuštěnými látkami nebo makromolekulami jako voda solvatace, zatímco většina má stejnou strukturu jako čistá voda.[5] Tato solvatační voda není aktivní v osmóza a mohou mít různé vlastnosti rozpouštědla, takže některé rozpuštěné molekuly jsou vyloučeny, zatímco jiné se koncentrují.[20][21] Jiní však tvrdí, že účinky vysokých koncentrací makromolekul v buňkách se šíří skrz cytosol a že voda v buňkách se chová velmi odlišně od vody ve zředěných roztocích.[22] Tyto myšlenky zahrnují návrh, aby buňky obsahovaly zóny vody s nízkou a vysokou hustotou, což by mohlo mít rozsáhlé účinky na struktury a funkce ostatních částí buňky.[19][23] Použití pokročilých metod nukleární magnetické rezonance k přímému měření pohyblivosti vody v živých buňkách je však v rozporu s touto myšlenkou, protože naznačuje, že 85% buněčné vody působí jako čistá voda, zatímco zbytek je méně mobilní a pravděpodobně vázaný na makromolekuly .[24]
Ionty
Koncentrace druhého ionty v cytosolu jsou zcela odlišné od těch v extracelulární tekutina a cytosol také obsahuje mnohem vyšší množství nabitých makromolekul, jako jsou proteiny a nukleové kyseliny, než vně buněčné struktury.
| Ion | Koncentrace (milimolární) | |
|---|---|---|
| V cytosolu | V plazmě | |
| Draslík | 139–150[25][26] | 4 |
| Sodík | 12 | 145 |
| Chlorid | 4 | 116 |
| Hydrogenuhličitan | 12 | 29 |
| Aminokyseliny v bílkovinách | 138 | 9 |
| Hořčík | 0.8 | 1.5 |
| Vápník | <0.0002 | 1.8 |
Na rozdíl od extracelulární tekutiny má cytosol vysokou koncentraci draslík ionty a nízká koncentrace sodík ionty.[27] Tento rozdíl v koncentracích iontů je pro osmoregulace, protože pokud by hladiny iontů byly uvnitř buňky stejné jako venku, voda by neustále pronikla dovnitř osmóza - od úrovně makromolekuly uvnitř buněk jsou vyšší než jejich úrovně venku. Místo toho jsou vylučovány sodíkové ionty a draselné ionty přijímány Na⁺ / K⁺-ATPáza ionty draslíku poté proudí dolů svým koncentračním gradientem přes iontové kanály pro výběr draslíku, tato ztráta kladného náboje vytváří záporný membránový potenciál. Abychom to vyvážili potenciální rozdíl, negativní chloridové ionty také opouštějí buňku prostřednictvím selektivních chloridových kanálů. Ztráta iontů sodíku a chloridů kompenzuje osmotický účinek vyšší koncentrace organických molekul uvnitř buňky.[27]
Buňky se dokážou vyrovnat s ještě většími osmotickými změnami akumulací osmoprotektory jako betaines nebo trehalóza v jejich cytosolu.[27] Některé z těchto molekul mohou umožnit buňkám přežít úplné vysušení a umožnit organismu vstoupit do stavu pozastavené animace zvané kryptobióza.[28] V tomto stavu se cytosol a osmoprotektanty stávají sklovitou pevnou látkou, která pomáhá stabilizovat proteiny a buněčné membrány před škodlivými účinky vysoušení.[29]
Nízká koncentrace vápník v cytosolu umožňuje iontům vápníku fungovat jako a druhý posel v signalizace vápníku. Zde je signál jako a hormon nebo akční potenciál otevře se vápníkový kanál takže vápník zaplavuje cytosol.[30] Toto náhlé zvýšení cytosolického vápníku aktivuje další signální molekuly, jako je klimodulin a protein kináza C..[31] Jiné ionty, jako je chlorid a draslík, mohou mít také signální funkce v cytosolu, ale nejsou dobře známy.[32]
Makromolekuly
Molekuly bílkovin, na které se neváže buněčné membrány nebo cytoskelet jsou rozpuštěny v cytosolu. Množství bílkovin v buňkách je extrémně vysoké a blíží se 200 mg / ml, což zabírá asi 20–30% objemu cytosolu.[1] Přesné měření množství proteinu v cytosolu v intaktních buňkách je však obtížné, protože některé proteiny se zdají být slabě asociované s membránami nebo organelami v celých buňkách a jsou uvolňovány do roztoku po lýza buněk.[5] Ve skutečnosti, v experimentech, kde byla plazmatická membrána buněk opatrně narušena použitím saponin, aniž by došlo k poškození ostatních buněčných membrán, byla uvolněna pouze asi jedna čtvrtina buněčného proteinu. Tyto buňky byly také schopné syntetizovat proteiny, pokud dostaly ATP a aminokyseliny, což znamená, že mnoho z enzymů v cytosolu je vázáno na cytoskelet.[33] Myšlenka, že většina proteinů v buňkách je pevně vázána v síti zvané mikrotrabekulární mřížka je nyní považována za nepravděpodobnou.[34]
U prokaryot cytosol obsahuje buňky genom, ve struktuře známé jako a nukleoid.[35] Toto je nepravidelná masa DNA a přidružené proteiny, které řídí transkripce a replikace bakteriální chromozóm a plazmidy. U eukaryot je genom držen uvnitř buněčné jádro, která je od cytosolu oddělena jaderné póry které blokují volnou difúzi jakékoli molekuly větší než asi 10nanometry v průměru.[36]
Tato vysoká koncentrace makromolekul v cytosolu způsobuje tzv. Efekt makromolekulární shlukování, což je, když efektivní koncentrace ostatních makromolekul se zvýší, protože mají menší objem, aby se mohly pohybovat. Tento efekt vytěsnění může způsobit velké změny v obou sazby a pozice chemická rovnováha reakcí v cytosolu.[1] Je to zvláště důležité v jeho schopnosti měnit se disociační konstanty upřednostňováním asociace makromolekul, například když se spojí více proteinů a vytvoří se proteinové komplexy nebo kdy Proteiny vázající DNA vázat na své cíle v genom.[37]
Organizace
Ačkoli složky cytosolu nejsou odděleny do oblastí buněčnými membránami, tyto složky se ne vždy náhodně mísí a několik úrovní organizace může lokalizovat konkrétní molekuly na definovaná místa v cytosolu.[38]
Koncentrační přechody
Ačkoli malé molekuly šířit rychle v cytosolu mohou být v tomto kompartmentu stále vytvářeny gradienty koncentrace. Dobře prostudovaným příkladem jsou „jiskry vápníku“, které se na krátkou dobu produkují v oblasti kolem otevřeného prostoru vápníkový kanál.[39] Jedná se o 2mikrometry v průměru a vydrží jen pár milisekundy, i když několik jisker může sloučit a vytvořit větší přechody, nazývané „vápenaté vlny“.[40] Koncentrační gradienty jiných malých molekul, jako např kyslík a adenosintrifosfát mohou být produkovány v buňkách kolem shluků mitochondrie, i když jsou méně dobře pochopeny.[41][42]
Proteinové komplexy
Proteiny se mohou sdružovat do formy proteinové komplexy, tyto často obsahují sadu proteinů s podobnými funkcemi, jako jsou enzymy, které provádějí několik kroků stejnou metabolickou cestou.[43] Tato organizace to může povolit směrování substrátu, kdy produkt jednoho enzymu prochází přímo na další enzym v cestě, aniž by byl uvolněn do roztoku.[44] Channeling může učinit cestu rychlejší a efektivnější, než by byla, kdyby byly enzymy náhodně distribuovány v cytosolu, a může také zabránit uvolňování nestabilních reakčních meziproduktů.[45] Ačkoli široká škála metabolických drah zahrnuje enzymy, které jsou navzájem pevně vázány, jiné mohou zahrnovat volněji asociované komplexy, které je velmi obtížné studovat mimo buňku.[46][47] V důsledku toho zůstává důležitost těchto komplexů pro metabolismus obecně nejasná.

Proteinové oddíly
Některé proteinové komplexy obsahují velkou centrální dutinu, která je izolována od zbytku cytosolu. Jedním příkladem takového uzavřeného oddílu je proteazom.[48] Zde sada podjednotek tvoří dutou hlaveň obsahující proteázy které degradují cytosolické proteiny. Protože by to bylo škodlivé, pokud by se volně smísily se zbytkem cytosolu, je hlaveň uzavřena sadou regulačních proteinů, které rozpoznávají proteiny signálem, který je směruje k degradaci (a ubikvitin tag) a vložte je do proteolytické dutiny.[49]
Další velkou třídou proteinových oddílů jsou bakteriální mikrokomponenty, které jsou vyrobeny z proteinového obalu, který zapouzdřuje různé enzymy.[50] Tyto oddíly jsou obvykle kolem 100–200 nanometry napříč a ze vzájemně propojených proteinů.[51] Dobře srozumitelným příkladem je carboxysome, který obsahuje enzymy podílející se na uhlíková fixace jako RuBisCO.[52]
Biomolekulární kondenzáty
Nemembránově vázané organely se mohou tvořit jako biomolekulární kondenzáty, které vznikají shlukováním, oligomerizace nebo polymerace z makromolekuly řídit koloidní fázová separace cytoplazmy nebo jádra.
Cytoskeletální prosévání
Ačkoliv cytoskelet není součástí cytosolu, přítomnost této sítě vláken omezuje difúzi velkých částic v buňce. Například v několika studiích sledovací částice větší než asi 25nanometry (o velikosti a ribozom )[53] byly vyloučeny z částí cytosolu kolem okrajů buňky a vedle jádra.[54][55] Tato „vyjímající oddělení“ mohou obsahovat mnohem hustší síťovinu aktin vlákna než zbytek cytosolu. Tyto mikrodomény by mohly ovlivnit distribuci velkých struktur, jako jsou ribozomy a organely v cytosolu jejich vyloučením z některých oblastí a jejich soustředěním do jiných.[56]
Funkce
Cytosol nemá jedinou funkci a je místo toho místem mnoha buněčných procesů. Mezi příklady těchto procesů patří signální transdukce z buněčné membrány do míst v buňce, jako je buněčné jádro,[57] nebo organely.[58] Tento oddíl je také místem mnoha procesů cytokineze, po poruše jaderná membrána v mitóza.[59] Další hlavní funkcí cytosolu je transport metabolitů z místa jejich výroby tam, kde jsou použity. To je relativně jednoduché pro molekuly rozpustné ve vodě, jako jsou aminokyseliny, které mohou rychle difundovat cytosolem.[18] Nicméně, hydrofobní molekuly, jako např mastné kyseliny nebo steroly, mohou být transportovány přes cytosol specifickými vazebnými proteiny, které tyto molekuly dopravují mezi buněčnými membránami.[60][61] Molekuly odebrané do buňky endocytóza nebo na cestě k tomu být vylučováno lze také transportovat uvnitř cytosolu vezikuly,[62] což jsou malé kuličky lipidů, které se pohybují podél cytoskeletu motorické proteiny.[63]
Cytosol je místem většiny metabolismu u prokaryot,[9] a velká část metabolismu eukaryot. Například u savců je přibližně polovina proteinů v buňce lokalizována v cytosolu.[64] Nejúplnější údaje jsou k dispozici u kvasinek, kde metabolické rekonstrukce naznačují, že většina metabolických procesů a metabolitů se vyskytuje v cytosolu.[65] Hlavní metabolické dráhy, které se vyskytují v cytosolu u zvířat, jsou biosyntéza bílkovin, pentóza fosfátová cesta, glykolýza a glukoneogeneze.[66] Lokalizace drah může být u jiných organismů odlišná, například k syntéze mastných kyselin dochází chloroplasty v rostlinách[67][68] a v apikoplasty v apicomplexa.[69]
Reference
- ^ A b C Ellis RJ (říjen 2001). „Makromolekulární shlukování: zjevné, ale nedoceněné“. Trends Biochem. Sci. 26 (10): 597–604. doi:10.1016 / S0968-0004 (01) 01938-7. PMID 11590012.
- ^ Cammack, Richard Cammack Richard; Atwood, Teresa Atwood Teresa; Campbell, Peter Campbell Peter; Farnost, Howard ParishHoward; Smith, Anthony Smith Anthony; Vella, Frank VellaFrank; Stirling, John StirlingJohn (2006). Cammack, Richard; Atwood, Teresa; Campbell, Peter; Farnost, Howard; Smith, Anthony; Vella, Frank; Stirling, John (eds.). "Cytoplazmatická matice". Oxfordský slovník biochemie a molekulární biologie. Oxford University Press. doi:10.1093 / acref / 9780198529170.001.0001. ISBN 9780198529170.
- ^ Brown, Thomas A. (2011). Fyziologie rychlého přehledu. Elsevier Health Sciences. p. 2. ISBN 978-0323072601.
- ^ Lardy, H. A. 1965. O směru oxidačně-redukčních reakcí pyridinových nukleotidů v glukoneogenezi a lipogenezi. V: Řízení energetického metabolismu, editoval B. Chance, R. Estabrook a J. R. Williamson. New York: Academic, 1965, str. 245, [1].
- ^ A b C d E Clegg James S. (1984). "Vlastnosti a metabolismus vodné cytoplazmy a její hranice". Dopoledne. J. Physiol. 246 (2 Pt 2): R133–51. doi:10.1152 / ajpregu.1984.246.2.R133. PMID 6364846.
- ^ A b C Cammack, Richard; Teresa Atwoodová; Attwood, Teresa K .; Campbell, Peter Scott; Parish, Howard I .; Smith, Tony; Vella, Frank; Stirling, John (2006). Oxfordský slovník biochemie a molekulární biologie. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-852917-1. OCLC 225587597.
- ^ A b Lodish, Harvey F. (1999). Molekulární buněčná biologie. New York: Scientific American Books. ISBN 0-7167-3136-3. OCLC 174431482.
- ^ Hanstein, J. (1880). Das Protoplasma. Heidelberg. p. 24.
- ^ A b Hoppert M, Mayer F (1999). "Principy makromolekulární organizace a funkce buněk v bakteriích a archaeách". Cell Biochem. Biophys. 31 (3): 247–84. doi:10.1007 / BF02738242. PMID 10736750. S2CID 21004307.
- ^ Bowsher CG, Tobin AK (duben 2001). "Rozdělení metabolismu v mitochondriích a plastidech". J. Exp. Bot. 52 (356): 513–27. doi:10.1093 / jexbot / 52.356.513. PMID 11373301.
- ^ Goodacre R, Vaidyanathan S, Dunn WB, Harrigan GG, Kell DB (květen 2004). „Metabolomika podle čísel: získávání a porozumění globálním datům metabolitů“ (PDF). Trends Biotechnol. 22 (5): 245–52. doi:10.1016 / j.tibtech.2004.03.007. PMID 15109811. Archivovány od originál (PDF) dne 17. 12. 2008.
- ^ Weckwerth W (2003). "Metabolomika v systémové biologii". Annu Rev Plant Biol. 54: 669–89. doi:10.1146 / annurev.arplant.54.031902.135014. PMID 14503007. S2CID 1197884.
- ^ Reed JL, Vo TD, Schilling CH, Palsson BO (2003). „Rozšířený model Escherichia coli K-12 v měřítku genomu (iJR904 GSM / GPR)“. Genome Biol. 4 (9): R54. doi:10.1186 / gb-2003-4-9-r54. PMC 193654. PMID 12952533.
- ^ Förster J, Famili I, Fu P, Palsson BØ, Nielsen J (únor 2003). „Rekonstrukce genomové metabolické sítě Saccharomyces cerevisiae“. Genome Res. 13 (2): 244–53. doi:10,1101 / gr. 234503. PMC 420374. PMID 12566402.
- ^ Luby-Phelps K (2000). „Cytoarchitektura a fyzikální vlastnosti cytoplazmy: objem, viskozita, difúze, intracelulární povrchová plocha“ (PDF). Int. Reverend Cytol. International Review of Cytology. 192: 189–221. doi:10.1016 / S0074-7696 (08) 60527-6. ISBN 978-0-12-364596-8. PMID 10553280. Archivovány od originál (PDF) dne 19. 7. 2011.
- ^ Roos A, Boron WF (duben 1981). "Intracelulární pH". Physiol. Rev. 61 (2): 296–434. doi:10.1152 / fyzrev.1981.61.2.296. PMID 7012859.
- ^ Bright, G R; Fisher, GW; Rogowska, J; Taylor, DL (1987). „Zobrazovací mikroskopie s fluorescenčním poměrem: časová a prostorová měření cytoplazmatického pH“. The Journal of Cell Biology. 104 (4): 1019–1033. doi:10.1083 / jcb.104.4.1019. PMC 2114443. PMID 3558476.
- ^ A b Verkman AS (leden 2002). "Difúze rozpuštěných látek a makromolekul v buněčných vodných kompartmentech". Trends Biochem. Sci. 27 (1): 27–33. doi:10.1016 / S0968-0004 (01) 02003-5. PMID 11796221.
- ^ A b Wiggins PM (1. prosince 1990). „Role vody v některých biologických procesech“. Microbiol. Rev. 54 (4): 432–49. doi:10.1128 / MMBR.54.4.432-449.1990. PMC 372788. PMID 2087221.
- ^ Fulton AB (září 1982). „Jak přeplněná je cytoplazma?“. Buňka. 30 (2): 345–7. doi:10.1016/0092-8674(82)90231-8. PMID 6754085. S2CID 6370250.
- ^ Garlid KD (2000). "Stav vody v biologických systémech". Int. Reverend Cytol. International Review of Cytology. 192: 281–302. doi:10.1016 / S0074-7696 (08) 60530-6. ISBN 978-0-12-364596-8. PMID 10553283.
- ^ Chaplin M (listopad 2006). „Podceňujeme význam vody v buněčné biologii?“. Nat. Rev. Mol. Cell Biol. 7 (11): 861–6. doi:10.1038 / nrm2021. PMID 16955076. S2CID 42919563.
- ^ Wiggins PM (červen 1996). "Voda s vysokou a nízkou hustotou a klidové, aktivní a transformované buňky". Cell Biol. Int. 20 (6): 429–35. doi:10.1006 / cbir.1996.0054. PMID 8963257. S2CID 42866068.
- ^ Persson E, Halle B (duben 2008). „Dynamika vody v buňce na více časových stupnicích“. Proc. Natl. Acad. Sci. USA. 105 (17): 6266–71. Bibcode:2008PNAS..105,6266P. doi:10.1073 / pnas.0709585105. PMC 2359779. PMID 18436650.
- ^ Thier, S. O. (25. dubna 1986). "Fyziologie draslíku". American Journal of Medicine. 80 (4A): 3–7. doi:10.1016/0002-9343(86)90334-7. PMID 3706350.
- ^ Lote, Christopher J. (2012). Principy fyziologie ledvin, 5. vydání. Springer. p. 12.
- ^ A b C Lang F (říjen 2007). "Mechanismy a význam regulace objemu buněk". J Am Coll Nutr. 26 (5 doplňků): 613S - 623S. doi:10.1080/07315724.2007.10719667. PMID 17921474. S2CID 1798009.
- ^ Sussich F, Skopec C, Brady J, Cesàro A (srpen 2001). „Reverzibilní dehydratace trehalózy a anhydrobiózy: od stavu roztoku k exotickému krystalu?“. Sacharidy. Res. 334 (3): 165–76. doi:10.1016 / S0008-6215 (01) 00189-6. PMID 11513823.
- ^ Crowe JH, Carpenter JF, Crowe LM (1998). "Role vitrifikace v anhydrobioze". Annu. Physiol. 60: 73–103. doi:10,1146 / annurev.physiol.60.1.73. PMID 9558455.
- ^ Berridge MJ (1. března 1997). „Základní a globální aspekty signalizace vápníku“. J. Physiol. 499 (Pt 2): 291–306. doi:10.1113 / jphysiol.1997.sp021927. PMC 1159305. PMID 9080360.
- ^ Kikkawa U, Kishimoto A, Nishizuka Y (1989). „Rodina proteinových kináz C: heterogenita a její důsledky“. Annu. Biochem. 58: 31–44. doi:10.1146 / annurev.bi.58.070189.000335. PMID 2549852.
- ^ Orlov SN, Hamet P (duben 2006). "Intracelulární monovalentní ionty jako druzí poslové". J. Membr. Biol. 210 (3): 161–72. doi:10.1007 / s00232-006-0857-9. PMID 16909338. S2CID 26068558.
- ^ Hudder A, Nathanson L, Deutscher MP (prosinec 2003). „Organizace savčí cytoplazmy“. Mol. Buňka. Biol. 23 (24): 9318–26. doi:10.1128 / MCB.23.24.9318-9326.2003. PMC 309675. PMID 14645541.
- ^ Heuser J (2002). „Co se stalo s„ mikrotrabekulárním konceptem “?“. Biol Cell. 94 (9): 561–96. doi:10.1016 / S0248-4900 (02) 00013-8. PMID 12732437. S2CID 45792524.
- ^ Thanbichler M, Wang S, Shapiro L (2005). "Bakteriální nukleoid: vysoce organizovaná a dynamická struktura". J Cell Biochem. 96 (3): 506–21. doi:10.1002 / jcb.20519. PMID 15988757. S2CID 25355087.
- ^ Peters R (2006). Úvod do nukleocytoplazmatického transportu: molekuly a mechanismy. Methods Mol. Biol. Metody v molekulární biologii ™. 322. 235–58. doi:10.1007/978-1-59745-000-3_17. ISBN 978-1-58829-362-6. PMID 16739728.
- ^ Zhou HX, Rivas G, Minton AP (2008). „Makromolekulární shlukování a uvěznění: biochemické, biofyzikální a potenciální fyziologické důsledky“. Annu Rev Biophys. 37: 375–97. doi:10.1146 / annurev.biophys.37.032807.125817. PMC 2826134. PMID 18573087.
- ^ Norris V, den Blaauwen T, Cabin-Flaman A (březen 2007). "Funkční taxonomie bakteriálních hyperstruktur". Microbiol. Mol. Biol. Rev. 71 (1): 230–53. doi:10.1128 / MMBR.00035-06. PMC 1847379. PMID 17347523.
- ^ Wang SQ, Wei C, Zhao G (duben 2004). „Zobrazování mikrodomény Ca2 + ve svalových buňkách“. Circ. Res. 94 (8): 1011–22. doi:10.1161 / 01.RES.0000125883.68447.A1. PMID 15117829.
- ^ Jaffe LF (listopad 1993). "Třídy a mechanismy vápníkových vln". Buněčný vápník. 14 (10): 736–45. doi:10.1016 / 0143-4160 (93) 90099-R. PMID 8131190.
- ^ Aw, T.Y. (2000). "Intracelulární kompartmentace organel a gradienty druhů s nízkou molekulovou hmotností". Int Rev Cytol. International Review of Cytology. 192: 223–53. doi:10.1016 / S0074-7696 (08) 60528-8. ISBN 978-0-12-364596-8. PMID 10553281.
- ^ Weiss JN, Korge P (20. července 2001). „Cytoplazma: už není dobře namíchaná taška“. Circ. Res. 89 (2): 108–10. doi:10.1161 / res.89.2.108. PMID 11463714.
- ^ Srere PA (1987). "Komplexy sekvenčních metabolických enzymů". Annu. Biochem. 56: 89–124. doi:10.1146 / annurev.bi.56.070187.000513. PMID 2441660.
- ^ Perham RN (2000). "Kyvné ramena a kyvné domény v multifunkčních enzymech: katalytické stroje pro vícestupňové reakce". Annu. Biochem. 69: 961–1004. doi:10,1146 / annurev.biochem.69.1.961. PMID 10966480.
- ^ Huang X, Holden HM, Raushel FM (2001). „Usměrňování substrátů a meziproduktů v reakcích katalyzovaných enzymy“. Annu. Biochem. 70: 149–80. doi:10.1146 / annurev.biochem.70.1.149. PMID 11395405. S2CID 16722363.
- ^ Mowbray J, Moses V (červen 1976). „Předběžná identifikace multienzymového komplexu s glykolytickou aktivitou v Escherichia coli“. Eur. J. Biochem. 66 (1): 25–36. doi:10.1111 / j.1432-1033.1976.tb10421.x. PMID 133800.
- ^ Srivastava DK, Bernhard SA (listopad 1986). "Přenos metabolitů prostřednictvím komplexů enzym-enzym". Věda. 234 (4780): 1081–6. Bibcode:1986Sci ... 234.1081S. doi:10.1126 / science.3775377. PMID 3775377.
- ^ Groll M, Clausen T (prosinec 2003). "Molekulární drtiče: jak proteazomy plní svoji roli". Curr. Opin. Struct. Biol. 13 (6): 665–73. doi:10.1016 / j.sbi.2003.10.005. PMID 14675543.
- ^ Nandi D, Tahiliani P, Kumar A, Chandu D (březen 2006). „Systém ubikvitin-proteazom“ (PDF). J. Biosci. 31 (1): 137–55. doi:10.1007 / BF02705243. PMID 16595883. S2CID 21603835.
- ^ Bobik, T. A. (2007). „Bakteriální mikrokomponenty“ (PDF). Mikrob. Am Soc Microbiol. 2: 25–31. Archivovány od originál (PDF) dne 2008-08-02.
- ^ Yeates TO, Kerfeld CA, Heinhorst S, Cannon GC, Shively JM (srpen 2008). „Proteinové organely v bakteriích: karboxysomy a související mikrokomponenty“. Nat. Rev. Microbiol. 6 (9): 681–691. doi:10.1038 / nrmicro1913. PMID 18679172. S2CID 22666203.
- ^ Badger MR, Price GD (únor 2003). „CO2 mechanismy koncentrace v sinicích: molekulární složky, jejich rozmanitost a evoluce ". J. Exp. Bot. 54 (383): 609–22. doi:10.1093 / jxb / erg076. PMID 12554704.
- ^ Cate JH (listopad 2001). „Konstrukce rentgenových krystalografických map elektronové hustoty ribozomu s nízkým rozlišením“. Metody. 25 (3): 303–8. doi:10.1006 / meth.2001.1242. PMID 11860284.
- ^ Provance DW, McDowall A, Marko M, Luby-Phelps K (1. října 1993). „Cytoarchitektura oddílů v živých buňkách bez velikosti“. J. Cell Sci. 106 (2): 565–77. PMID 7980739.
- ^ Luby-Phelps K, Castle PE, Taylor DL, Lanni F (červenec 1987). „Omezená difúze inertních stopovacích částic v cytoplazmě myších buněk 3T3“. Proc. Natl. Acad. Sci. USA. 84 (14): 4910–3. Bibcode:1987PNAS ... 84.4910L. doi:10.1073 / pnas.84.14.4910. PMC 305216. PMID 3474634.
- ^ Luby-Phelps K (červen 1993). "Vliv cytoarchitektury na transport a lokalizaci proteinových syntetických strojů". J. Cell. Biochem. 52 (2): 140–7. doi:10.1002 / jcb.240520205. PMID 8366131. S2CID 12063324.
- ^ Kholodenko BN (červen 2003). „Čtyřrozměrná organizace signálních kaskád proteinových kináz: role difúze, endocytózy a molekulárních motorů“. J. Exp. Biol. 206 (Pt 12): 2073–82. doi:10.1242 / jeb.00298. PMID 12756289.
- ^ Pesaresi P, Schneider A, Kleine T, Leister D (prosinec 2007). "Interorganellar komunikace". Curr. Opin. Plant Biol. 10 (6): 600–6. doi:10.1016 / j.pbi.2007.07.007. PMID 17719262.
- ^ Winey M, Mamay CL, O'Toole ET (červen 1995). „Trojrozměrná ultrastrukturální analýza mitotického vřetena Saccharomyces cerevisiae“. J. Cell Biol. 129 (6): 1601–15. doi:10.1083 / jcb.129.6.1601. PMC 2291174. PMID 7790357.
- ^ Weisiger RA (říjen 2002). „Cytosolické proteiny vázající mastné kyseliny katalyzují dva odlišné kroky v intracelulárním transportu jejich ligandů“. Mol. Buňka. Biochem. 239 (1–2): 35–43. doi:10.1023 / A: 1020550405578. PMID 12479566. S2CID 9608133.
- ^ Maxfield FR, Mondal M (červen 2006). "Obchodování se steroly a lipidy v buňkách savců". Biochem. Soc. Trans. 34 (Pt 3): 335–9. doi:10.1042 / BST0340335. PMID 16709155.
- ^ Pelham HR (srpen 1999). „Croonian Lecture 1999. Intracelulární membránový provoz: získávání proteinů tříděno“. Philos. Trans. R. Soc. Lond. B Biol. Sci. 354 (1388): 1471–8. doi:10.1098 / rstb.1999.0491. PMC 1692657. PMID 10515003.
- ^ Kamal A, Goldstein LS (únor 2002). "Zásady připevnění nákladu k cytoplazmatickým motorickým proteinům". Curr. Opin. Cell Biol. 14 (1): 63–8. doi:10.1016 / S0955-0674 (01) 00295-2. PMID 11792546.
- ^ Foster LJ, de Hoog CL, Zhang Y (duben 2006). "Mapa savčích organel podle profilování korelace proteinů". Buňka. 125 (1): 187–99. doi:10.1016 / j.cell.2006.03.022. PMID 16615899. S2CID 32197.
- ^ Herrgård, MJ; Swainston, N; Dobson, P; Dunn, WB; Arga, KY; Arvas, M; Blüthgen, N; Borger, S; Costenoble, R; et al. (Říjen 2008). „Konsenzuální rekonstrukce metabolické sítě kvasinek získaná z komunitního přístupu k biologii systémů“. Přírodní biotechnologie. 26 (10): 1155–60. doi:10.1038 / nbt1492. PMC 4018421. PMID 18846089.
- ^ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2002). Biochemie. San Francisco: W.H. Freemane. ISBN 0-7167-4684-0. OCLC 179705944.
- ^ Ohlrogge J, Pollard M, Bao X (prosinec 2000). „Syntéza mastných kyselin: z CO2 funkční genomiky “. Biochem. Soc. Trans. 28 (6): 567–73. doi:10.1042 / BST0280567. PMID 11171129.
- ^ Ohlrogge JB, Kuhn DN, Stumpf PK (březen 1979). "Subcelulární lokalizace acylového nosného proteinu v listových protoplastech Spinacia oleracea". Proc. Natl. Acad. Sci. USA. 76 (3): 1194–8. Bibcode:1979PNAS ... 76.1194O. doi:10.1073 / pnas.76.3.1194. PMC 383216. PMID 286305.
- ^ Goodman CD, McFadden GI (leden 2007). "Biosyntéza mastných kyselin jako cíl léku u parazitů apicomplexan". Curr drogové cíle. 8 (1): 15–30. doi:10.2174/138945007779315579. PMID 17266528. S2CID 2565225.
Další čtení
- Wheatley, Denys N .; Pollack, Gerald H .; Cameron, Ivan L. (2006). Voda a buňka. Berlín: Springer. ISBN 1-4020-4926-9. OCLC 71298997.
