Vnitřní kanál usměrňovače draslíku - Inward-rectifier potassium channel
| Vnitřní kanál usměrňovače draslíku | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 krystalová struktura draslíkového kanálu dovnitř usměrňovače | |||||||||
| Identifikátory | |||||||||
| Symbol | DRÁŽDIT | ||||||||
| Pfam | PF01007 | ||||||||
| Pfam klan | CL0030 | ||||||||
| InterPro | IPR013521 | ||||||||
| SCOP2 | 1n9p / Rozsah / SUPFAM | ||||||||
| TCDB | 1.A.2 | ||||||||
| OPM nadčeleď | 8 | ||||||||
| OPM protein | 3SPG | ||||||||
| |||||||||
Vnitřní kanály usměrňovače draslíku (K.ir, DRÁŽDIT) jsou specifické lipidovou bránou podmnožina draslíkové kanály. K dnešnímu dni bylo identifikováno sedm podrodin v různých typech savčích buněk,[1] rostliny,[2] a bakterie.[3] Jsou aktivovány fosfatidylinositol 4,5-bisfosfátem (PIP2 ). Porucha kanálů byla zapletena do několika nemocí.[4][5] Kanály IRK mají doménu pórů, homologní s doménou napěťově řízené iontové kanály a lemující transmembránové segmenty (TMS). Mohou existovat v membráně jako homo- nebo heterooligomery a každý monomer má mezi 2 a 4 TMS. Z hlediska funkce se tyto proteiny transportují draslík (K.+), s větší tendencí k K.+ absorpce než K.+ vývozní.[3] Proces vnitřní opravy objevil Denis Noble v buňkách srdečního svalu v 60. letech a do Richard Adrian a Alan Hodgkin v roce 1970 v buňkách kosterního svalstva.[6]
Přehled vnitřní opravy
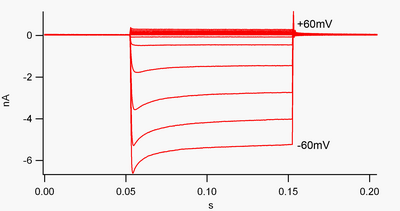
Kanál, který je „dovnitř usměrňující“, je kanál, který prochází proudem (kladný náboj) snadněji směrem dovnitř (do článku) než směrem ven (ven z článku). Předpokládá se, že tento proud může hrát důležitou roli v regulaci neuronální aktivity tím, že pomáhá stabilizovat klidový membránový potenciál buňky.
Podle konvence se vnitřní proud (kladný náboj pohybující se do článku) zobrazuje v napěťová svorka jako výchylka dolů, zatímco vnější proud (kladný náboj pohybující se ven z buňky) je zobrazen jako výchylka nahoru. Na membránových potenciálech negativních na draslík reverzní potenciál, dovnitř napravující K.+ kanály podporují tok kladně nabitého K.+ ionty do buňky, tlačí membránový potenciál zpět na klidový potenciál. To lze vidět na obrázku 1: když je membránový potenciál sevřen záporně vůči klidovému potenciálu kanálu (např. -60 mV), proudí dovnitř proud (tj. Kladný náboj teče do buňky). Pokud je však potenciál membrány kladně nastaven na klidový potenciál kanálu (např. +60 mV), tyto kanály procházejí velmi malým proudem. Jednoduše řečeno, tento kanál v rozsahu provozního napětí prochází mnohem více proudu směrem dovnitř než směrem ven. Tyto kanály nejsou dokonalými usměrňovači, protože mohou procházet určitým vnějším proudem v napěťovém rozsahu až asi 30 mV nad klidovým potenciálem.
Tyto kanály se liší od draslíkových kanálů, které jsou obvykle odpovědné za repolarizaci buňky po akční potenciál, tak jako zpožděný usměrňovač a Typ draslíkové kanály. Tyto více „typické“ draslíkové kanály přednostně provádějí vnější (spíše než vnitřní) draslíkové proudy při depolarizovaných membránových potenciálech a lze je považovat za „navenek usměrňující“. Když byl poprvé objeven, vnitřní náprava byla pojmenována „anomální náprava“, aby se odlišila od vnějších draslíkových proudů.[7]
Dovnitř usměrňovače se také liší od draselné kanály v doméně tandemových pórů, které jsou do značné míry zodpovědné za „únik“ K.+ proudy.[8] Některé dovnitř usměrňovače, nazývané „slabé dovnitř usměrňovače“, nesou měřitelné ven K+ proudy při kladných napětích K+ reverzní potenciál (odpovídá malým proudům nad řádkem 0 nA na obrázku 1, ale je větší než tyto). Spolu s „únikovými“ kanály vytvářejí klidový membránový potenciál buňky. Jiné dovnitř usměrňující kanály, nazývané „silné dovnitř usměrňovače“, nesou vůbec velmi malý vnější proud a jsou aktivní hlavně při záporných napětích K+ reverzní potenciál, kde přenášejí dovnitř proud (mnohem větší proudy pod linkou 0 nA na obrázku 1).[9]
Mechanismus vnitřní opravy
Fenomén vnitřní korekce K.ir kanály je výsledkem vysokoafinitního blokování endogenním polyaminy, jmenovitě spermin, stejně jako hořčík ionty, které zapojují kanál pór na kladných potenciálech, což má za následek pokles vnějších proudů. Tento napěťově závislý blok polyaminů vede k účinnému vedení proudu pouze ve směru dovnitř. I když je pochopena hlavní myšlenka polyaminového bloku, specifické mechanismy jsou stále kontroverzní.[10]
Aktivace pomocí PIP2
Vše K.ir kanály vyžadují fosfatidylinositol 4,5-bisfosfát (PIP.)2) pro aktivaci.[11] PIP2 váže se na a přímo aktivuje K.ir 2.2 s vlastnostmi podobnými agonistům.[12] V tomto ohledu K.ir kanály jsou PIP2 ligandem řízené iontové kanály.
Role K.ir kanály
K.ir kanály se nacházejí ve více typech buněk, včetně makrofágy, srdeční a ledviny buňky, leukocyty, neurony a endoteliální buňky. Zprostředkováním malého depolarizující K.+ proudu při záporných membránových potenciálech, pomáhají vytvořit klidový membránový potenciál a v případě K.ir3 skupiny, pomáhají zprostředkovat inhibici neurotransmiter odpovědi, ale jejich role v buněčné fyziologii se u různých typů buněk liší:
| Umístění | Funkce |
|---|---|
| srdeční myocyty | K.ir kanály se po depolarizaci uzavírají, zpomalují repolarizaci membrány a pomáhají udržovat delší dobu srdeční akční potenciál. Tento typ kanálu dovnitř usměrňovače je odlišný od zpožděný usměrňovač K+ kanály, které pomáhají repolarizovat nervové a svalové buňky po akční potenciály; a kanály úniku draslíku, které poskytují velkou část základu pro klidový membránový potenciál. |
| endoteliální buňky | K.ir kanály se podílejí na regulaci syntáza oxidu dusnatého. |
| ledviny | K.ir exportovat přebytečný draslík do sběrných tubulů k odstranění v moči nebo alternativně může být zapojen do zpětného vychytávání draslíku zpět do těla. |
| neurony a v srdečních buňkách | IRK aktivované G-proteinem (K.ir3) jsou důležité regulátory, modulované neurotransmitery. Mutace v GIRK2 kanál vede k mutaci myši tkáče. "Weaver" mutantní myši jsou ataxické a vykazují degeneraci dopaminergních neuronů zprostředkovanou zánětem.[13] Ve srovnání s neataxickými kontrolami mají Weaver mutanti deficity v motorické koordinaci a změny v regionálním metabolismu mozku.[14] Myši Weaver byly po více než 30 let zkoumány v laboratořích se zájmem o vývoj a onemocnění nervů. |
| pankreatické beta buňky | K.ATP kanály (složen z K.ir6.2 a SUR1 podjednotky) kontrolují uvolňování inzulínu. |
Nařízení
Závislost na napětí může být regulována externím K.+, vnitřním Mg2+interním ATP a / nebo G-proteiny. P domény IRK kanálů vykazují omezenou sekvenční podobnost s těmi z rodiny VIC. Vnitřní usměrňovače hrají roli při nastavování potenciálů buněčné membrány a uzavření těchto kanálů při depolarizaci umožňuje výskyt akčních potenciálů s dlouhou dobou s plató fází. Dovnitř usměrňovače postrádají spirály snímající vnitřní napětí, které se nacházejí v mnoha kanálech rodiny VIC. V několika případech, například Kir1.1a, Kir6.1 a Kir6.2, byla navržena přímá interakce s členem nadrodiny ABC, která heteromernímu komplexu propůjčuje jedinečné funkční a regulační vlastnosti, včetně citlivosti na ATP . Tyto kanály citlivé na ATP se nacházejí v mnoha tělesných tkáních. Poskytují aktivitu kanálu v reakci na cytoplazmatický poměr ATP / ADP (zvýšený ATP / ADP kanál uzavírá). Lidský SUR1 a SUR2 sulfonylmočovina receptory (spQ09428 a Q15527) jsou proteiny ABC, které regulují jak kanály Kir6.1, tak Kir6.2 v reakci na ATP, a CFTR (TC # 3.A.1.208.4 ) může regulovat Kir1.1a.[15]
Struktura
Krystalová struktura[16] a funkce[17] bakteriálních členů rodiny IRK-C. KirBac1.1, od Burkholderia pseudomallei, je dlouhý 333 aminoacylových zbytků (aas) se dvěma N-koncovými TMS obklopujícími P-smyčku (zbytky 1-150) a C-koncová polovina proteinu je hydrofilní. Transportuje jednomocné kationty se selektivitou: K ≈ Rb ≈ Cs ≫ Li ≈ Na ≈ NMGM (protonovaný N-methyl-D-glukamin ). Aktivita je inhibována Ba2+, Ca2+a nízké pH.[17]
Klasifikace K.ir kanály
Existuje sedm podskupin K.ir kanály, označované jako K.ir1 - K.ir7.[1] Každá podrodina má více členů (tj. K.ir2,1, K.ir2,2, K.ir2.3 atd.), Které mají téměř identické aminokyselinové sekvence napříč známými druhy savců.
K.ir kanály jsou tvořeny jako homotetramerické membránové proteiny. Každá ze čtyř identických proteinových podjednotek je složena ze dvou rozpětí membrány alfa helixy (M1 a M2). Heterotetramery se mohou tvořit mezi členy stejné podrodiny (tj. K.ir2.1 a K.ir2.3), když jsou kanály přeexprimovány.
Rozmanitost
| Gen | Protein | Aliasy | Přidružené podjednotky |
|---|---|---|---|
| KCNJ1 | K.ir1.1 | ROMK1 | NHERF2 |
| KCNJ2 | K.ir2.1 | IRK1 | K.ir2,2, K.ir4.1, PSD-95, SAP97, AKAP79 |
| KCNJ12 | K.ir2.2 | IRK2 | K.ir2.1 a K.ir2.3 k vytvoření heteromerního kanálu, pomocná podjednotka: SAP97, Veli-1, Veli-3, PSD-95 |
| KCNJ4 | K.ir2.3 | IRK3 | K.ir2.1 a K.ir2.3 k vytvoření heteromerního kanálu, PSD-95, Chapsyn-110 / PSD-93 |
| KCNJ14 | K.ir2.4 | IRK4 | K.ir2.1 za vzniku heteromerního kanálu |
| KCNJ3 | K.ir3.1 | GIRK1, KGA | K.ir3,2, K.ir3,4, K.ir3,5, K.ir3.1 není sám o sobě funkční |
| KCNJ6 | K.ir3.2 | GIRK2 | K.ir3,1, K.ir3,3, K.ir3.4 za vzniku heteromerního kanálu |
| KCNJ9 | K.ir3.3 | GIRK3 | K.ir3,1, K.ir3.2 za vzniku heteromerního kanálu |
| KCNJ5 | K.ir3.4 | GIRK4 | K.ir3,1, K.ir3,2, K.ir3.3 |
| KCNJ10 | K.ir4.1 | K.ir1.2 | K.ir4,2, K.ir5,1 a K.ir2.1 za vzniku heteromerních kanálů |
| KCNJ15 | K.ir4.2 | K.ir1.3 | |
| KCNJ16 | K.ir5.1 | BIR 9 | |
| KCNJ8 | K.ir6.1 | K.ATP | SUR2B |
| KCNJ11 | K.ir6.2 | K.ATP | SUR1, SUR2A, a SUR2B |
| KCNJ13 | K.ir7.1 | K.ir1.4 |
- Trvalá hyperinzulinemická hypoglykemie v dětství souvisí s autozomálně recesivními mutacemi v K.ir6.2. Určité mutace tohoto genu snižují schopnost kanálu regulovat sekreci inzulínu, což vede k hypoglykémie.
- Bartterův syndrom mohou být způsobeny mutacemi v Kir kanály. Tento stav je charakterizován neschopností ledvin recyklovat draslík nízké hladiny draslíku v těle.
- Andersenův syndrom je vzácný stav způsobený několika mutacemi K.ir2.1. V závislosti na mutaci může být dominantní nebo recesivní. Vyznačuje se periodická paralýza, srdeční arytmie a dysmorfní funkce. (Viz také KCNJ2 )
- Otrava bariem je pravděpodobně kvůli jeho schopnosti blokovat K.ir kanály.
- Ateroskleróza (srdeční choroba) může souviset s K.ir kanály. Ztráta K.ir proudy v endoteliálních buňkách je jedním z prvních známých indikátorů aterogeneze (počátek srdečních onemocnění).
- Tyreotoxická hypokalemická periodická paralýza byl spojen se změněným K.ir2.6 funkce.[18]
- EAST / SeSAME syndrom mohou být způsobeny mutacemi KCNJ10.[Citace je zapotřebí ]
Viz také
Reference
- ^ A b Kubo Y, Adelman JP, Clapham DE, Jan LY, Karschin A, Kurachi Y, Lazdunski M, Nichols CG, Seino S, Vandenberg, CA (prosinec 2005). "International Union of Pharmacology. LIV. Nomenclature and Molecular Relationships of Inwardly Rectifying Drasel Channels". Farmakologické recenze. 57 (4): 509–26. doi:10.1124 / pr.57.4.11. PMID 16382105.
- ^ Hedrich R, Moran O, Conti F, Busch H, Becker D, Gambale F, Dreyer I, Küch A, Neuwinger K, Palme K (1995). "Vnitřní usměrňovací draslíkové kanály v rostlinách se liší od jejich zvířecích protějšků v reakci na modulátory napětí a kanálu". Evropský biofyzikální časopis. 24 (2): 107–15. doi:10.1007 / BF00211406. PMID 8582318.
- ^ A b „1.A.2 Rodina vnitřního usměrňovače K Channel (IRK-C)“. TCDB. Citováno 2016-04-09.
- ^ Hansen, SB (květen 2015). „Lipidový agonismus: PIP2 paradigma iontových kanálů řízených ligandem“. Biochimica et Biophysica Acta (BBA) - molekulární a buněčná biologie lipidů. 1851 (5): 620–8. doi:10.1016 / j.bbalip.2015.01.011. PMC 4540326. PMID 25633344.
- ^ Abraham MR, Jahangir A, Alekseev AE, Terzic A (listopad 1999). "Channelopatie vnitřně napravujících draslíkových kanálů". FASEB Journal. 13 (14): 1901–10. doi:10.1096 / fasebj.13.14.1901. PMID 10544173.
- ^ Adrian RH, Chandler WK, Hodgkin AL (červenec 1970). „Pomalé změny propustnosti draslíku v kosterním svalu“. The Journal of Physiology. 208 (3): 645–68. doi:10.1113 / jphysiol.1970.sp009140. PMC 1348790. PMID 5499788.
- ^ Bertil Hille (2001). Iontové kanály vzrušivých membrán 3. vyd. (Sinauer: Sunderland, MA), s. 151. ISBN 0-87893-321-2.
- ^ Hille, str. 155.
- ^ Hille, str. 153.
- ^ Lopatin AN, Makhina EN, Nichols CG (listopad 1995). „Mechanismus vnitřní korekce draslíkových kanálů:„ ucpávání s dlouhými póry “cytoplazmatickými polyaminy“. The Journal of General Physiology. 106 (5): 923–55. doi:10.1085 / jgp.106.5.923. PMC 2229292. PMID 8648298.
- ^ Tucker SJ, Baukrowitz T (květen 2008). "Jak vysoce nabité aniontové lipidy se vážou a regulují iontové kanály". The Journal of General Physiology. 131 (5): 431–8. doi:10.1085 / jgp.200709936. PMC 2346576. PMID 18411329.
- ^ Hansen SB, Tao X, MacKinnon R (září 2011). "Strukturální základ aktivace PIP2 klasického dovnitř usměrňovače K + kanál Kir2.2". Příroda. 477 (7365): 495–8. Bibcode:2011Natur.477..495H. doi:10.1038 / příroda10370. PMC 3324908. PMID 21874019.
- ^ Peng J, Xie L, Stevenson FF, Melov S, Di Monte DA, Andersen JK (listopad 2006). „Nigrostriatální dopaminergní neurodegenerace u tkalcovské myši je zprostředkována neurozánětem a zmírněna podáváním minocyklinů“. The Journal of Neuroscience. 26 (45): 11644–51. doi:10.1523 / JNEUROSCI.3447-06.2006. PMC 6674792. PMID 17093086.
- ^ Strazielle C, Deiss V, Naudon L, Raisman-Vozari R, Lalonde R (říjen 2006). „Regionální mozkové variace aktivity cytochromoxidázy a motorické koordinace u mutovaných myší Girk2 (Wv) (Weaver)“. Neurovědy. 142 (2): 437–49. doi:10.1016 / j.neuroscience.2006.06.011. PMID 16844307.
- ^ WO přihláška 0190360 „Wei MH, Chaturvedi K, Guegler K, Webster M, Ketchum KA, Di Francesco V, Beasley E,„ Izolované lidské transportní proteiny, molekuly nukleové kyseliny kódující lidské transportní proteiny a jejich použití “, zveřejněné 29. listopadu 2001, přidělené společnosti Apperla Korporace
- ^ Kuo A, Gulbis JM, Antcliff JF, Rahman T, Lowe ED, Zimmer J, Cuthbertson J, Ashcroft FM, Ezaki T, Doyle DA (červen 2003). "Krystalová struktura draslíkového kanálu KirBac1.1 v uzavřeném stavu". Věda. 300 (5627): 1922–6. Bibcode:2003Sci ... 300,1922K. doi:10.1126 / science.1085028. PMID 12738871.
- ^ A b Enkvetchakul D, Bhattacharyya J, Jeliazkova I, Groesbeck DK, Cukras CA, Nichols CG (listopad 2004). "Funkční charakterizace prokaryotického kanálu Kir". The Journal of Biological Chemistry. 279 (45): 47076–80. doi:10.1074 / jbc.C400417200. PMID 15448150.
- ^ Ryan DP, da Silva MR, Soong TW, Fontaine B, Donaldson MR, Kung AW, Jongjaroenprasert W, Liang MC, Khoo DH, Cheah JS, Ho SC, Bernstein HS, Maciel RM, Brown RH, Ptácek LJ (leden 2010). "Mutace v draslíkovém kanálu Kir2.6 způsobují náchylnost k thyrotoxické hypokalemické periodické paralýze". Buňka. 140 (1): 88–98. doi:10.1016 / j.cell.2009.12.024. PMC 2885139. PMID 20074522.
Další čtení
Bertil Hille (2001). Iontové kanály vzrušivých membrán 3. vyd. (Sinauer: Sunderland, MA), s. 149–154. ISBN 0-87893-321-2.
externí odkazy
- Dovnitř + Usměrňovač + Draslík + Kanály v americké národní lékařské knihovně Lékařské předměty (Pletivo).
- „Vnitřně přijímající draslíkové kanály“. Databáze IUPHAR receptorů a iontových kanálů. Mezinárodní unie základní a klinické farmakologie.
- UMich Orientace proteinů v membránách rodiny / rodina-85 - Prostorové polohy draslíkových kanálů dovnitř usměrňovače v membránách.
