VDAC1 - VDAC1
Kanál selektivní na anionty závislý na napětí 1 (VDAC-1) je a beta barel protein, který je u lidí kódován VDAC1 gen umístěný na chromozom 5.[4][5] Tvoří iontový kanál v vnější mitochondriální membrána (OMM) a také vnější buněčná membrána. V OMM umožňuje ATP difundovat z mitochondrií do cytoplazma. V buněčné membráně se podílí na regulaci objemu. Ve všech eukaryotických buňkách jsou mitochondrie odpovědné za syntézu ATP mezi ostatními metabolity potřebnými pro přežití buněk. VDAC1 proto umožňuje komunikaci mezi mitochondrie a buňka zprostředkující rovnováhu mezi buněčným metabolismem a smrtí buněk. Kromě metabolické permeace působí VDAC1 také jako kostra pro proteiny, jako jsou hexokináza které zase mohou regulovat metabolismus.[6]
Tento protein je aniontový kanál závislý na napětí a sdílí vysokou strukturní homologii s ostatními izoformami VDAC (VDAC2 a VDAC3 ), které se podílejí na regulaci buňky metabolismus, mitochondriální apoptóza a spermatogeneze.[7][8][9][10] Nadměrná exprese a nesprávná regulace tohoto póru by mohla vést k apoptóze v buňce, což by vedlo k řadě nemocí v těle. Zejména proto, že VDAC1 je hlavním transportním kanálem vápníkových iontů, jeho dysfunkce se podílí na rakovině, Parkinsonova choroba (PD) a Alzheimerova choroba.[11][12][13]Nedávné studie navíc ukázaly, že nadměrná exprese v proteinu VDAC1 je spojena s diabetem typu 2. Univerzita v Lundu vydala studii, která prokázala, že účinky blokování VDAC1 nad expresí mohou zabránit šíření diabetu 2. typu. [14]

Struktura
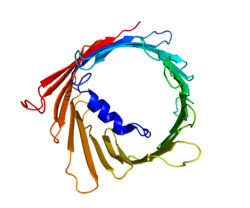
Tři izoformy VDAC (VDAC1, VDAC2 a VDAC3) mají vysoce konzervované sekvence DNA a také 3D struktury tvořící širokou strukturu p-barelu, uvnitř nichž se nachází alfa šroubovicový N-koncový segment, který částečně uzavírá póry.[15] Strukturu VDAC1 vyřešili 3 nezávislé laboratoře rentgenová krystalografie, Spektroskopie nukleární magnetické rezonance (NMR), nebo kombinace obou. Dvě z těchto strukturálních studií byly použity ke stanovení struktury lidského VDAC1 (hVDAC1), zatímco rentgenová krystalografie byla použita k řešení myší struktury VDAC1 (mVDAC1), která se liší od hVDAC1 pouze o dva zbytky.[16][17][18] Tyto určené struktury byly srovnány s předchozími kruhový dichorismus studie, které předpovídaly přítomnost domén alfa šroubovice a β-řetězce.[19]
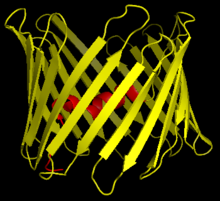
Strukturní analýza struktury mVDAC1 ukázala barel podobný kanál složený z 19 amfipatických β-řetězců, přičemž N-konec a C-konec oba směřovaly k mezembránovému prostoru mitochondrie.[20][21] β-prameny jsou spojeny smyčkami a jsou uspořádány v antiparalelním vzoru, s výjimkou β-řetězců 1 a 19, které jsou paralelní.[18] Pór má výšku 40 Ẳ, překlenuje vzdálenost 27 Ẳ o 20 Ẳ u otvorů a v otevřeném stavu se zužuje na 20 Ẳ o 14 Ẳ u segmentu N-terminální α-šroubovice.[22] Konformaci uzavřeného stavu je třeba ještě izolovat a určit. Kromě toho má N-konec alfa spirálovitý segment, který je držen na vnitřní stěně póru hydrofobními interakcemi se zbytky na β-listech 8-18.[18] Tento N-konec může sloužit jako lešení pro pohyb iontů nebo připojení proteinů. Jeden takový příklad je viděn, protože jde o dokovací místo pro vazbu HK1.[6] Významným zbytkem, na který je třeba poukázat, je glutamát nacházející se na 73. zbytku na aminokyselinovém řetězci (E73). Tento zbytek se nachází ve VDAC1 a VDAC2, ale ne ve VDAC3. Postranní řetězec tohoto nabitého zbytku směřuje do fosfolipidová dvojvrstva což by normálně způsobilo vznik odpudivých sil. E73 se však podílí na funkci a interakci VDAC1.[23]
Funkce
VDAC1 patří do rodiny mitochondriálních porinů a očekává se, že bude mít podobné biologické funkce jako ostatní izoformy VDAC.[24] Ze tří izoforem je VDAC1 hlavním transportním kanálem vápníkových iontů a nejhojněji transkribovaným.[12][25] VDAC1 se účastní buněčného metabolismu transportem ATP a dalších malých metabolitů napříč vnější mitochondriální membrána (OMM) umožňující regulaci cyklu TCA a rozšířením reaktivní formy kyslíku (ROS) produkce.[11] V kvasinkových buňkách se ROS hromadí v reakci na oxidační stres, což má za následek zhoršenou mitochondriální funkci a „drobný“ fenotyp. Drobné kvasinkové buňky však vykazují delší životnost než buňky divokého typu a naznačují ochrannou funkci pomocí VDAC1 za podobných okolností, jako je stárnutí.[6][25]
Napěťové hradlo
VDAC1 umožňuje vodivost molekul do a ven z mitochondrie. Jeho propustnost závisí na konformačním stavu VDAC1, který je určen napětím. Při nízkém napětí (10 mV) je pór v „otevřeném“ stavu, kdy je kanál slabě aniontově selektivní a umožňuje větší tok metabolitů. Vzhledem k velké velikosti pórů odhaluje metabolické hradlování za podmínek nasyceného ATP transport 2 000 000 ATP za sekundu a transport 10 000 ATP za fyziologických podmínek.[26] Při vyšším napětí v kladném nebo záporném směru (> 30 mV) jsou póry v „uzavřeném“ stavu a jsou slabě kationtově selektivní, což umožňuje transport méně metabolitů.[18] Tok metabolitů lze považovat za zanedbatelný. Tato změna stavů je zprostředkována konformační změnou proteinu, který ještě nebyl objeven. Vzhledem k tomu, že alfa spirálovitý N-terminální segment je umístěn ve středu póru, je ideálně situován pro metabolické hradlování. To vedlo vědce k přesvědčení, že spirála Alpha byla klíčovým přispěvatelem k určování konformačních stavů. Novější studie však ukázaly, že N-terminál je pro řádné napěťové hradlování zbytečný, a proto navrhují flexibilní beta hlaveň jako mechanismus konformačních změn.[22]
Oligomerizace
Mikroskopie atomové síly (AFM) odhalily přítomnost monomerů VDAC1 i dimerů a větších oligomerů, které ukazují interakci pórů se sebou samými, nicméně dimery jsou častější.[27] Ukázalo se, že zejména hVDAC1 uspořádává paralelní dimery, což vede ke zvýšené propustnosti pórů.[16] Bylo také prokázáno, že glutamát umístěný na 73. pozici na VDAC1 hraje roli v oligomerizaci, když je v přítomnosti vápníku.[23] VDAC mohou také oligomerizovat a tvořit součást mitochondriální propustnost přechodový pór (MPTP), a tak usnadňují uvolňování cytochromu C, což vede k apoptóze. Bylo také pozorováno, že VDAC interagují s pro- nebo antiapoptotickými proteiny, jako jsou proteiny a kinázy rodiny Bcl-2, a tak mohou přispívat k apoptóze nezávisle na MPTP.[24]
Klinický význam
Napěťově závislé aniontové kanály fungují v transportu iontů a metabolitů, i když jejich fyziologické role jsou odlišné. Z důvodu jejich role může dysfunkce kanálů vést k různým onemocněním. VDAC1 se podílí na rakovině prostřednictvím svých interakcí s antiapoptotickou rodinou proteinů, Bcl-2 zejména proteiny Bcl-xl, a Mcl-1, které jsou nadměrně exprimovány během rakoviny. Tyto dva proteiny Bcl-2 interagují s VDAC1, aby regulovaly transport iontů vápníku přes OMM a nakonec produkci ROS. Zatímco vysoké hladiny ROS indukují buněčnou smrt, neletální hladiny interferují se signálními transdukčními cestami, které pak mohou podporovat buněčnou proliferaci, migraci a invazi v rakovinných buňkách.[11] Nadměrná exprese VDAC1 byla navíc spojena se zvýšenou apoptotickou odpovědí a protirakovinovými léky a účinností léčby, což dále podporuje VDAC1 jako terapeutický cíl pro léčbu rakoviny.[11][28]
Funkce VDAC1 v transportu iontů vápníku byla také spojena s neurodegenerativními chorobami. V PD zvyšuje VDAC1 hladiny vápníkových iontů v mitochondriích, což vede ke zvýšené mitochondriální permeabilitě, narušení potenciálu mitochondriální membrány, zvýšené produkci ROS, buněčné smrti a neuronové degeneraci.[12] Ukázalo se, že VDAC1 interaguje s amyloidem β (Ap), což vede ke zvýšené vodivosti kanálu a nakonec k apoptóze buňky.[13]
Interakce
VDAC1 působí jako lešení pro mnoho proteinů a také umožňuje tok iontů a metabolitů prostřednictvím interakcí uvnitř pórů.
Hlavním metabolitem, který se pohybuje tímto kanálem, je ATP. Nízkoafinitní vazebné místo použité pro rychlý transport této molekuly bylo objeveno Markovův přístup k modelování státu. Ukázalo se, že ATP se váže na několik základních zbytků v póru postupně, v podstatě se pohybuje kanálem.[29]
Bylo také prokázáno, že VDAC1 komunikovat s:
Viz také
Reference
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000020402 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Blachly-Dyson E, Baldini A, Litt M, McCabe ER, Forte M (březen 1994). „Lidské geny kódující napěťově závislý aniontový kanál (VDAC) vnější mitochondriální membrány: mapování a identifikace dvou nových izoforem“. Genomika. 20 (1): 62–7. doi:10.1006 / geno.1994.1127. PMID 7517385.
- ^ „Entrez Gene: VDAC1 napěťově závislý aniontový kanál 1“.
- ^ A b C d Reina S, Palermo V, Guarnera A, Guarino F, Messina A, Mazzoni C, De Pinto V (červenec 2010). „Výměna N-konce VDAC1 s VDAC3 obnovuje plnou aktivitu kanálu a dodává buňce funkce proti stárnutí“. FEBS Dopisy. 584 (13): 2837–44. doi:10.1016 / j.febslet.2010.04.066. PMID 20434446. S2CID 22130291.
- ^ Subedi KP, Kim JC, Kang M, Son MJ, Kim YS, Woo SH (únor 2011). „Aniontový kanál 2 závislý na napětí moduluje klidové jiskry Ca² +, ale ne signalizaci Ca² + indukovanou akčním potenciálem v srdečních myocytech“. Buněčný vápník. 49 (2): 136–43. doi:10.1016 / j.ceca.2010.12.004. PMID 21241999.
- ^ A b Alvira CM, Umesh A, Husted C, Ying L, Hou Y, Lyu SC, Nowak J, Cornfield DN (listopad 2012). „Interakce aniontového kanálu-2 závislá na napětí s syntázou oxidu dusnatého zvyšuje produkci oxidu dusnatého v endoteliálních buňkách plicní arterie“. American Journal of Respiratory Cell and Molecular Biology. 47 (5): 669–78. doi:10.1165 / rcmb.2011-0436OC. PMC 3547107. PMID 22842492.
- ^ Cheng EH, Sheiko TV, Fisher JK, Craigen WJ, Korsmeyer SJ (červenec 2003). "VDAC2 inhibuje aktivaci BAK a mitochondriální apoptózu". Věda. 301 (5632): 513–7. Bibcode:2003Sci ... 301..513C. doi:10.1126 / science.1083995. PMID 12881569. S2CID 37099525.
- ^ Li Z, Wang Y, Xue Y, Li X, Cao H, Zheng SJ (únor 2012). „Kritická role pro napěťově závislý aniontový kanál 2 v apoptóze vyvolané virem infekční bursální choroby v hostitelských buňkách prostřednictvím interakce s VP5“. Journal of Virology. 86 (3): 1328–38. doi:10.1128 / JVI.06104-11. PMC 3264341. PMID 22114330.
- ^ A b C d E Huang H, Shah K, Bradbury NA, Li C, White C (říjen 2014). „Mcl-1 podporuje migraci buněk rakoviny plic přímou interakcí s VDAC za účelem zvýšení absorpce Ca2 + v mitochondriích a tvorby reaktivních forem kyslíku“. Buněčná smrt a nemoc. 5 (10): e1482. doi:10.1038 / cddis.2014.419. PMC 4237246. PMID 25341036.
- ^ A b C Chu Y, Goldman JG, Kelly L, He Y, Waliczek T, Kordower JH (září 2014). „Abnormální alfa-synuklein snižuje nigrální napěťově závislý aniontový kanál 1 u sporadické a experimentální Parkinsonovy choroby“. Neurobiologie nemocí. 69: 1–14. doi:10.1016 / j.nbd.2014.05.003. PMID 24825319. S2CID 22722682.
- ^ A b Smilansky A, Dangoor L, Nakdimon I, Ben-Hail D, Mizrachi D, Shoshan-Barmatz V (prosinec 2015). „Aniontový kanál 1 závislý na napětí zprostředkovává toxicitu amyloidu β a představuje potenciální cíl pro léčbu Alzheimerovy choroby“. The Journal of Biological Chemistry. 290 (52): 30670–83. doi:10,1074 / jbc.M115,691493. PMC 4692199. PMID 26542804.
- ^ Zhang, Enming; Mohammed Al-Amily, Israa; Mohammed, Sarheed; Luan, Cheng; Asplund, Olof; Ahmed, Meftun; Ye, Yingying; Ben-Hail, Danya; Soni, Arvind; Vishnu, Neelanjan; Bompada, Pradeep (01.01.2019). „Zachování sekrece inzulínu u diabetu inhibicí nadměrné exprese VDAC1 a povrchové translokace v β buňkách“. Buněčný metabolismus. 29 (1): 64–77.e6. doi:10.1016 / j.cmet.2018.09.008. ISSN 1550-4131. PMC 6331340. PMID 30293774.
- ^ Amodeo GF, Scorciapino MA, Messina A, De Pinto V, Ceccarelli M (2014). „Distribuce nabitých reziduí moduluje selektivitu otevřeného stavu lidských izoforem napěťově závislého aniontově selektivního kanálu“. PLOS ONE. 9 (8): e103879. Bibcode:2014PLoSO ... 9j3879A. doi:10.1371 / journal.pone.0103879. PMC 4146382. PMID 25084457.
- ^ A b Bayrhuber M, Meins T, Habeck M, Becker S, Giller K, Villinger S, Vonrhein C, Griesinger C, Zweckstetter M, Zeth K (říjen 2008). "Struktura lidského napěťově závislého aniontového kanálu". Sborník Národní akademie věd Spojených států amerických. 105 (40): 15370–5. Bibcode:2008PNAS..10515370B. doi:10.1073 / pnas.0808115105. PMC 2557026. PMID 18832158.
- ^ Hiller S, Garces RG, Malia TJ, Orekhov VY, Colombini M, Wagner G (srpen 2008). "Struktura řešení integrovaného lidského membránového proteinu VDAC-1 v mycích micelách". Věda. 321 (5893): 1206–10. Bibcode:2008Sci ... 321.1206H. doi:10.1126 / science.1161302. PMC 2579273. PMID 18755977.
- ^ A b C d Ujwal R, Cascio D, Colletier JP, Faham S, Zhang J, Toro L, Ping P, Abramson J (listopad 2008). „Krystalová struktura myšího VDAC1 v rozlišení 2,3 A odhaluje mechanické pohledy na bránu metabolitů“. Sborník Národní akademie věd Spojených států amerických. 105 (46): 17742–7. doi:10.1073 / pnas.0809634105. PMC 2584669. PMID 18988731.
- ^ Shanmugavadivu B, Apell HJ, Meins T, Zeth K, Kleinschmidt JH (duben 2007). „Správné skládání beta-barelu lidského membránového proteinu VDAC vyžaduje lipidovou dvojvrstvu“. Journal of Molecular Biology. 368 (1): 66–78. doi:10.1016 / j.jmb.2007.01.066. PMID 17336328.
- ^ McCommis KS, Baines CP (červen 2012). „Role VDAC při buněčné smrti: přítel nebo nepřítel?“. Biochimica et Biophysica Acta (BBA) - Biomembrány. 1818 (6): 1444–50. doi:10.1016 / j.bbamem.2011.10.025. PMC 3288473. PMID 22062421.
- ^ Tomasello MF, Guarino F, Reina S, Messina A, De Pinto V (prosinec 2013). „Napěťově závislá aniontová selektivní topologie kanálu 1 (VDAC1) v mitochondriální vnější membráně, jak byla detekována v intaktní buňce“. PLOS ONE. 8 (12): e81522. Bibcode:2013PLoSO ... 881522T. doi:10.1371 / journal.pone.0081522. PMC 3855671. PMID 24324700.
- ^ A b Teijido O, Ujwal R, Hillerdal CO, Kullman L, Rostovtseva TK, Abramson J (březen 2012). „Připevnění N-terminální α-šroubovice ke stěně aniontového kanálu závislého na napětí nebrání jeho napěťovému hradlování“. The Journal of Biological Chemistry. 287 (14): 11437–45. doi:10.1074 / jbc.M111.314229. PMC 3322836. PMID 22275367.
- ^ A b Keinan N, Pahima H, Ben-Hail D, Shoshan-Barmatz V (červenec 2013). „Role vápníku při oligomerizaci VDAC1 a apoptóze zprostředkované mitochondrie“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1833 (7): 1745–54. doi:10.1016 / j.bbamcr.2013.03.017. PMID 23542128.
- ^ A b Lee MJ, Kim JY, Suk K, Park JH (květen 2004). "Identifikace hypoxií indukovatelného faktoru 1 alfa-reagujícího genu HGTD-P jako mediátoru v mitochondriální apoptotické dráze". Molekulární a buněčná biologie. 24 (9): 3918–27. doi:10.1128 / mcb.24.9.3918-3927.2004. PMC 387743. PMID 15082785.
- ^ A b De Pinto V, Guarino F, Guarnera A, Messina A, Reina S, Tomasello FM, Palermo V, Mazzoni C (2010). "Charakterizace lidských izoforem VDAC: zvláštní funkce pro VDAC3?". Biochimica et Biophysica Acta (BBA) - bioenergetika. 1797 (6–7): 1268–75. doi:10.1016 / j.bbabio.2010.01.031. PMID 20138821.
- ^ Rostovtseva, T .; Colombini, M. (1997). „Kanály VDAC zprostředkovávají a brání toku ATP: důsledky pro regulaci mitochondriální funkce“. Biofyzikální deník. 72 (5): 1954–1962. Bibcode:1997BpJ .... 72.1954R. doi:10.1016 / s0006-3495 (97) 78841-6. PMC 1184392. PMID 9129800.
- ^ Hoogenboom BW, Suda K, Engel A, Fotiadis D (červenec 2007). "Supramolekulární sestavy napěťově závislých aniontových kanálů v nativní membráně". Journal of Molecular Biology. 370 (2): 246–55. doi:10.1016 / j.jmb.2007.04.073. PMID 17524423.
- ^ A b Weisthal S, Keinan N, Ben-Hail D, Arif T, Shoshan-Barmatz V (říjen 2014). „Regulace hladin exprese VDAC1 zprostředkovaná Ca (2 +) je spojena s indukcí buněčné smrti“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1843 (10): 2270–81. doi:10.1016 / j.bbamcr.2014.03.021. PMID 24704533.
- ^ Choudhary, Om P; Paz, Aviv; Adelman, Joshua L; Colletier, Jacques-Philippe; Abramson, Jeff; Grabe, Michael (2014). „Strukturované simulace osvětlují mechanismus přenosu ATP přes VDAC1“. Přírodní strukturní a molekulární biologie. 21 (7): 626–632. doi:10.1038 / nsmb.2841. PMC 4157756. PMID 24908397.
- ^ A b Weng C, Li Y, Xu D, Shi Y, Tang H (březen 2005). „Specifické štěpení Mcl-1 kaspázou-3 v tumor-nekrotickém faktoru související s apoptózou indukujícím ligandem (TRAIL) indukovanou apoptózou v T buňkách Jurkat leukémie“. The Journal of Biological Chemistry. 280 (11): 10491–500. doi:10,1074 / jbc.M412819200. PMID 15637055.
- ^ A b Shi Y, Chen J, Weng C, Chen R, Zheng Y, Chen Q, Tang H (červen 2003). "Identifikace kontaktního místa protein-protein a způsob interakce lidského VDAC1 s proteiny rodiny Bcl-2". Sdělení o biochemickém a biofyzikálním výzkumu. 305 (4): 989–96. doi:10.1016 / s0006-291x (03) 00871-4. PMID 12767928.
- ^ Shimizu S, Konishi A, Kodama T, Tsujimoto Y (březen 2000). „Doména BH4 antiapoptotických členů rodiny Bcl-2 uzavírá napěťově závislý aniontový kanál a inhibuje apoptotické mitochondriální změny a buněčnou smrt“. Sborník Národní akademie věd Spojených států amerických. 97 (7): 3100–5. Bibcode:2000PNAS ... 97.3100S. doi:10.1073 / pnas.97.7.3100. PMC 16199. PMID 10737788.
- ^ Shimizu S, Narita M, Tsujimoto Y (červen 1999). „Proteiny rodiny Bcl-2 regulují uvolňování apoptogenního cytochromu c mitochondriálním kanálem VDAC“. Příroda. 399 (6735): 483–7. Bibcode:1999 Natur.399..483S. doi:10.1038/20959. PMID 10365962. S2CID 4423304.
- ^ Schwarzer C, Barnikol-Watanabe S, Thinnes FP, Hilschmann N (září 2002). „Napěťově závislý aniontový selektivní kanál (VDAC) interaguje s dyneinovým lehkým řetězcem Tctex1 a proteinem tepelného šoku PBP74“. International Journal of Biochemistry & Cell Biology. 34 (9): 1059–70. doi:10.1016 / s1357-2725 (02) 00026-2. PMID 12009301.
- ^ Kusano H, Shimizu S, Koya RC, Fujita H, Kamada S, Kuzumaki N, Tsujimoto Y (říjen 2000). „Lidský gelsolin předchází apoptóze inhibicí apoptotických mitochondriálních změn uzavřením VDAC“. Onkogen. 19 (42): 4807–14. doi:10.1038 / sj.onc.1203868. PMID 11039896.
- ^ Baines CP, Song CX, Zheng YT, Wang GW, Zhang J, Wang OL, Guo Y, Bolli R, Cardwell EM, Ping P (květen 2003). „Protein kináza Cepsilon interaguje s a inhibuje přechodový pór propustnosti v srdečních mitochondriích“. Výzkum oběhu. 92 (8): 873–80. doi:10.1161 / 01.RES.0000069215.36389.8D. PMC 3691672. PMID 12663490.
- ^ Sun Y, Vashisht AA, Tchieu J, Wohlschlegel JA, Dreier L (listopad 2012). „Napěťově závislé aniontové kanály (VDAC) získávají Parkina do defektních mitochondrií, aby podporovaly mitochondriální autofagii“. The Journal of Biological Chemistry. 287 (48): 40652–60. doi:10.1074 / jbc.M112.419721. PMC 3504778. PMID 23060438.
- ^ Noskov SY, Rostovtseva TK, Bezrukov SM (prosinec 2013). „Transport ATP přes VDAC a komplex VDAC-tubulin zkoumaný pomocí simulací rovnováhy a nerovnováhy MD“. Biochemie. 52 (51): 9246–56. doi:10.1021 / bi4011495. PMC 7259721. PMID 24245503.
Další čtení
- Verrier F, Mignotte B, Jan G, Brenner C (prosinec 2003). "Studie složení PTPC během apoptózy pro identifikaci cíle virového proteinu". Annals of the New York Academy of Sciences. 1010 (1): 126–42. Bibcode:2003NYASA1010..126V. doi:10.1196 / anály.1299.022. PMID 15033708.
- McEnery MW, Snowman AM, Trifiletti RR, Snyder SH (duben 1992). „Izolace mitochondriálního benzodiazepinového receptoru: asociace s napěťově závislým aniontovým kanálem a nosičem adeninového nukleotidu“. Sborník Národní akademie věd Spojených států amerických. 89 (8): 3170–4. Bibcode:1992PNAS ... 89,3170M. doi:10.1073 / pnas.89.8.3170. PMC 48827. PMID 1373486.
- Dawson SJ, White LA (květen 1992). „Léčba endokarditidy Haemophilus aphrophilus ciprofloxacinem“. The Journal of Infection. 24 (3): 317–20. doi:10.1016 / S0163-4453 (05) 80037-4. PMID 1602151.
- Jürgens L, Ilsemann P, Kratzin HD, Hesse D, Eckart K, Thinnes FP, Hilschmann N (červenec 1991). "Studie na lidském porinu. IV. Primární struktury" Porinu 31HM "purifikovaného z membrán lidského kosterního svalstva a" Porinu 31HL "odvozeného z lidských B lymfocytárních membrán jsou identické." Biologická chemie Hoppe-Seyler. 372 (7): 455–63. doi:10.1515 / bchm3.1991.372.2.455. PMID 1657034.
- Kayser H, Kratzin HD, Thinnes FP, Götz H, Schmidt WE, Eckart K, Hilschmann N (prosinec 1989). „[Identifikace lidských porinů. II. Charakterizace a primární struktura 31-lDa porinu z lidských B lymfocytů (Porin 31HL)]“. Biologická chemie Hoppe-Seyler. 370 (12): 1265–78. PMID 2559745.
- Brdiczka D, Kaldis P, Wallimann T (listopad 1994). „Tvorba komplexu in vitro mezi oktamerem mitochondriální kreatinkinázy a porinem“. The Journal of Biological Chemistry. 269 (44): 27640–4. PMID 7525559.
- Yu WH, Wolfgang W, Forte M (červen 1995). "Subcelulární lokalizace lidských napěťově závislých izoforem aniontového kanálu". The Journal of Biological Chemistry. 270 (23): 13998–4006. doi:10.1074 / jbc.270.23.13998. PMID 7539795.
- Thomas L, Blachly-Dyson E, Colombini M, Forte M (červen 1993). "Mapování zbytků tvořících napěťový senzor napěťově závislého aniontově selektivního kanálu". Sborník Národní akademie věd Spojených států amerických. 90 (12): 5446–9. Bibcode:1993PNAS ... 90.5446T. doi:10.1073 / pnas.90.12.5446. PMC 46737. PMID 7685903.
- Blachly-Dyson E, Zambronicz EB, Yu WH, Adams V, McCabe ER, Adelman J, Colombini M, Forte M (leden 1993). „Klonování a funkční exprese dvou lidských izoforem vnějšího mitochondriálního membránového kanálu v kvasinkách, aniontový kanál závislý na napětí“. The Journal of Biological Chemistry. 268 (3): 1835–41. PMID 8420959.
- Schleiff E, Shore GC, Goping IS (březen 1997). "Lidský mitochondriální importní receptor, Tom20p. Použití glutathionu k odhalení specifických interakcí mezi Tom20-glutathion S-transferázou a mitochondriálními prekurzorovými proteiny". FEBS Dopisy. 404 (2–3): 314–8. doi:10.1016 / S0014-5793 (97) 00145-2. PMID 9119086. S2CID 29177508.
- Reymann S, Haase W, Krick W, Burckhardt G, Thinnes FP (srpen 1998). "Endosomy: další extra mitochondriální umístění kanálů selektivních na porin / napětí závislé na aniontech typu 1". Archiv Pflügers. 436 (3): 478–80. doi:10,1007 / s004240050659. PMID 9644232. S2CID 670898.
- Narita M, Shimizu S, Ito T, Chittenden T, Lutz RJ, Matsuda H, Tsujimoto Y (prosinec 1998). „Bax interaguje s pórem přechodu permeability a indukuje přechod permeability a uvolňování cytochromu c v izolovaných mitochondriích“. Sborník Národní akademie věd Spojených států amerických. 95 (25): 14681–6. Bibcode:1998PNAS ... 9514681N. doi:10.1073 / pnas.95.25.14681. PMC 24509. PMID 9843949.
- Crompton M, Virji S, Ward JM (prosinec 1998). „Cyklofilin-D se silně váže na komplexy aniontového kanálu závislého na napětí a translokázu nukleotidů adeninu za vzniku přechodového póru propustnosti“. European Journal of Biochemistry. 258 (2): 729–35. doi:10.1046 / j.1432-1327.1998.2580729.x. PMID 9874241.
- Messina A, Oliva M, Rosato C, Huizing M, Ruitenbeek W, van den Heuvel LP, Forte M, Rocchi M, De Pinto V (únor 1999). "Mapování lidských napěťově závislých aniontových kanálů izoforem 1 a 2 přehodnoceno". Sdělení o biochemickém a biofyzikálním výzkumu. 255 (3): 707–10. doi:10.1006 / bbrc.1998.0136. PMID 10049775.
- Shimizu S, Narita M, Tsujimoto Y (červen 1999). „Proteiny rodiny Bcl-2 regulují uvolňování apoptogenního cytochromu c mitochondriálním kanálem VDAC“. Příroda. 399 (6735): 483–7. Bibcode:1999 Natur.399..483S. doi:10.1038/20959. PMID 10365962. S2CID 4423304.
- Decker WK, Bowles KR, Schatte EC, Towbin JA, Craigen WJ (říjen 1999). "Upravené jemné mapování lokusů aniontového kanálu závislých na lidském napětí pomocí hybridní analýzy záření". Savčí genom. 10 (10): 1041–2. doi:10,1007 / s003359901158. PMID 10501981. S2CID 27663120.
- Jacotot E, Ravagnan L, Loeffler M, Ferri KF, Vieira HL, Zamzami N, Costantini P, Druillennec S, Hoebeke J, Briand JP, Irinopoulou T, Daugas E, Susin SA, Cointe D, Xie ZH, Reed JC, Roques BP , Kroemer G (leden 2000). „Virový protein HIV-1 R indukuje apoptózu přímým účinkem na přechodový pór mitochondriální permeability“. The Journal of Experimental Medicine. 191 (1): 33–46. doi:10.1084 / jem.191.1.33. PMC 2195797. PMID 10620603.
- Shimizu S, Tsujimoto Y (leden 2000). „Proapoptotičtí členové rodiny Bcl-2 pouze BH3 indukují uvolňování cytochromu c, ale ne ztrátu potenciálu mitochondriální membrány a přímo nemodulují aktivitu aniontového kanálu závislou na napětí“. Sborník Národní akademie věd Spojených států amerických. 97 (2): 577–82. Bibcode:2000PNAS ... 97..577S. doi:10.1073 / pnas.97.2.577. PMC 15372. PMID 10639121.
- Stadtmüller U, Eben-Brunnen J, Schmid A, Hesse D, Klebert S, Kratzin HD, Hesse J, Zimmermann B, Reymann S, Thinnes FP, Benz R, Götz H, Hilschmann N (prosinec 1999). „Mitochondrie odvozené a extra mitochondriální lidské poriny typu 1 jsou identické, jak vyplývá ze sekvenování aminokyselin a elektrofyziologické charakterizace“. Biologická chemie. 380 (12): 1461–6. doi:10.1515 / BC.1999.189. PMID 10661876. S2CID 1566781.
externí odkazy
- VDAC1 + protein, + člověk v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P21796 (Napěťově závislý aniontově selektivní kanálový protein 1) na PDBe-KB.