Aniontový kanál závislý na napětí - Voltage-dependent anion channel
| Eukaryotický porin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
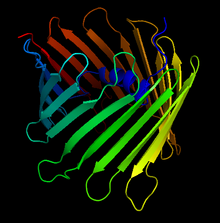 Krystalová struktura aniontového kanálu závislého na lidském napětí. Šipky označují antiparalelní beta listy, které tvoří charakteristickou beta hlaveň | |||||||||
| Identifikátory | |||||||||
| Symbol | Porin_3 | ||||||||
| Pfam | PF01459 | ||||||||
| InterPro | IPR001925 | ||||||||
| STRÁNKA | PDOC00483 | ||||||||
| TCDB | 1.B.8 | ||||||||
| OPM nadčeleď | 189 | ||||||||
| OPM protein | 3emn | ||||||||
| CDD | cd07306 | ||||||||
| |||||||||
Aniontové kanály závislé na napětínebo mitochondriální poriny, jsou třídou porin iontový kanál nachází se na vnější mitochondriální membrána.[1][2] Diskutuje se o tom, zda je nebo není tento kanál exprimován v buněčné povrchové membráně.[3][4][5]
Tento hlavní protein vnější mitochondriální membrána z eukaryoty tvoří napěťově závislý aniontový selektivní kanál (VDAC), který se chová jako obecný difúzní pór pro malé hydrofilní molekuly.[6][7][8][9] Kanál přijímá otevřenou konformaci při nízkém nebo nulovém potenciálu membrány a uzavřenou konformaci při potenciálech nad 30–40 mV. VDAC usnadňuje výměnu iontů a molekul mezi mitochondriemi a cytosolem a je regulován interakcemi s jinými proteiny a malými molekulami.[10]
Struktura
Tento protein obsahuje asi 280 aminokyselin a tvoří a beta barel který překlenuje mitochondriální vnější membránu.[11][12]
Od svého objevu v roce 1976 byla provedena rozsáhlá funkční a strukturní analýza proteinů VDAC. Objevil se výrazný rys póru: po rekonstituci na rovinný lipidové dvojvrstvy, existuje přepínač závislý na napětí mezi aniontově selektivním stavem vysoké vodivosti s vysokým metabolit tok a kationtově selektivní stav s nízkou vodivostí s omezeným průchodem metabolitů.
Více než 30 let po počátečním objevu, v roce 2008, byly dokončeny tři nezávislé strukturální projekty VDAC-1. První vyřešil vícerozměrná NMR spektroskopie. Druhý použil hybridní přístup využívající krystalografická data. Třetí byl pro myší krystaly VDAC-1 stanoven pomocí Rentgenová krystalografická techniky. Tři projekty 3D struktur VDAC-1 odhalily mnoho strukturálních rysů. Za prvé, VDAC-1 představuje novou strukturní třídu proteinů β-barelu vnější membrány s lichým počtem řetězců. Dalším aspektem je, že záporně nabitý postranní řetězec zbytku E73 je orientován směrem k prostředí hydrofobní membrány. 19vláknová 3D struktura získaná z různých experimentálních zdrojů třemi různými laboratořemi odpovídá datům EM a AFM z nativních membránových zdrojů a představuje biologicky relevantní stav VDAC-1.[10]
Mechanismus
Při potenciálech membrány přesahujících 30 mV (kladných nebo záporných) předpokládá VDAC uzavřený stav a přechází do otevřeného stavu, jakmile Napětí klesne pod tuto hranici. Ačkoli oba státy umožňují průchod jednoduchých solí, VDAC je mnohem přísnější s organickými anionty, což je kategorie, do které nejvíce metabolity podzim.[13] Přesný mechanismus spojování změn napětí s konformačními změnami v proteinu dosud nebyl vypracován, ale studie Thomas et al. naznačují, že při přechodu proteinu do uzavřené formy vedou změny napětí k odstranění velké části proteinu z kanálu a ke snížení účinného poloměru pórů.[14] Několik lysin zbytky, stejně jako Glu-152, byly zahrnuty jako obzvláště důležité zbytky senzoru v proteinu.[15]
Biologická funkce
Napěťově závislý iontový kanál hraje klíčovou roli v regulaci metabolického a energetického toku přes vnější mitochondriální membránu. Podílí se na přepravě ATP, ADP, pyruvát, malát a další metabolity, a tak intenzivně komunikuje s enzymy z metabolických drah.[13] Cytosolické enzymy závislé na ATP hexokináza, glukokináza, a glycerolkináza, stejně jako mitochondriální enzym kreatinkináza Bylo zjištěno, že se všechny váží na VDAC. Tato vazba je staví do těsné blízkosti ATP uvolněného z mitochondrií. Především se předpokládá, že vazba hexokinázy hraje klíčovou roli při vazbě glykolýza na oxidační fosforylace.[14] VDAC je navíc důležitým regulátorem Ca2+ transport do a z mitochondrií. Protože Ca2+ je kofaktorem metabolických enzymů, jako je pyruvátdehydrogenáza a isocitrát dehydrogenáza, energetická produkce a homeostáza jsou ovlivněny propustností VDAC pro Ca2+.[16]
Relevance nemoci
Ukázalo se také, že VDAC hraje roli v apoptóza.[17]Během apoptózy VDAC upravuje Přechodový pór mitochondriální permeability k uvolňování apoptogenních faktorů, jako je cytochrom c. VDAC však nejsou základními složkami přechodového póru mitochondriální permeability. Ačkoli cyt. c hraje zásadní roli při oxidativní fosforylaci v mitochondrii, v cytosolu aktivuje proteolytické enzymy zvané kaspázy, které hrají hlavní roli v buněčné smrti.[18] Přestože mechanismus pro cyt. Uvolnění c dosud nebylo zcela objasněno, některé výzkumy naznačují, že oligomerizace mezi jednotlivými podjednotkami může vytvořit velký flexibilní pór, kterým prochází cyt. c může projít.[19] Důležitějším faktorem je uvolnění cyt c. upravuje také Bcl-2 rodina bílkovin: Bax interaguje přímo s VDAC ke zvýšení velikosti pórů a podpoře cyt. c uvolnění, zatímco antiapoptotické Bcl-xL vytváří přesně opačný efekt.[20] Ve skutečnosti se ukázalo, že protilátky, které inhibují VDAC, také interferují s Bax zprostředkovaným cyt. Uvolňování c jak v izolovaných mitochondriích, tak v celých buňkách.[21] Tato klíčová role v apoptóze naznačuje VDAC jako potenciální cíl pro chemoterapeutická léčiva.
Příklady
Kvasinky obsahují dva členy této rodiny (geny POR1 a POR2); obratlovci mají alespoň tři členy (geny VDAC1, VDAC2 a VDAC3).[11]
Lidé, stejně jako většina vyšších eukaryot, kódují tři různé VDAC; VDAC1, VDAC2, a VDAC3. Dohromady s TOMM40 a TOMM40L představují rodinu evolučně příbuzných β-barelů.[22]
Rostliny mají největší počet VDAC. Arabidopsis kóduje čtyři různé VDAC, ale u jiných druhů může být toto číslo větší.[23]
Reference
- ^ Hoogenboom BW, Suda K, Engel A, Fotiadis D (2007). "Supramolekulární sestavy napěťově závislých aniontových kanálů v nativní membráně". J. Mol. Biol. 370 (2): 246–55. doi:10.1016 / j.jmb.2007.04.073. PMID 17524423.
- ^ Blachly-Dyson, E; Forte, M (září 2001). Msgstr "Kanály VDAC". IUBMB Life. 52 (3–5): 113–8. doi:10.1080/15216540152845902. PMID 11798022.
- ^ Sabirov RZ, Merzlyak PG (červen 2012). „Plasmalemmal VDAC kontroverze a maxi-anionová skládačka“. Biochim. Biophys. Acta. 1818 (6): 1570–80. doi:10.1016 / j.bbamem.2011.09.024. PMID 21986486.
- ^ De Pinto, V .; Messina, A .; Lane, D. J. R .; Lawen, A. (2010). "Napěťově závislý aniontový selektivní kanál (VDAC) v plazmatické membráně". FEBS Dopisy. 584 (9): 1793–1799. doi:10.1016 / j.febslet.2010.02.049. PMID 20184885. S2CID 3391282.
- ^ Niehage, C .; Steenblock, C .; Pursche, T .; Bornhäuser, M .; Corbeil, D .; Hoflack, B. (2011). Borlongan, Cesario V (ed.). "Proteom buněčného povrchu lidských mezenchymálních stromálních buněk". PLOS ONE. 6 (5): e20399. Bibcode:2011PLoSO ... 620399N. doi:10,1371 / journal.pone.0020399. PMC 3102717. PMID 21637820.
- ^ Benz R (1994). „Prostupování hydrofilních rozpuštěných látek mitochondriálními vnějšími membránami: přehled mitochondriálních porinů“. Biochim. Biophys. Acta. 1197 (2): 167–196. doi:10.1016/0304-4157(94)90004-3. PMID 8031826.
- ^ Mannella CA (1992). "Vstupy a výstupy kanálů mitochondriální membrány". Trends Biochem. Sci. 17 (8): 315–320. doi:10.1016 / 0968-0004 (92) 90444-E. PMID 1384178.
- ^ Dihanich M (1990). "Biogeneze a funkce eukaryotických porinů". Experientia. 46 (2): 146–153. doi:10.1007 / BF02027310. PMID 1689252. S2CID 2199583.
- ^ Forte M, Guy HR, Mannella CA (1987). „Molekulární genetika iontového kanálu VDAC: strukturální model a sekvenční analýza“. J. Bioenerg. Biomembr. 19 (4): 341–350. doi:10.1007 / BF00768537. PMID 2442148. S2CID 10219032.
- ^ A b Hiller S, Abramson J, Mannella C, Wagner G, Zeth K (září 2010). „3D struktury VDAC představují nativní konformaci“. Trends Biochem. Sci. 35 (9): 514–21. doi:10.1016 / j.tibs.2010.03.005. PMC 2933295. PMID 20708406.
- ^ A b Sampson MJ, Lovell RS, Davison DB, Craigen WJ (1996). „Nový myší mitochondriální napěťově závislý gen aniontového kanálu se lokalizuje do chromozomu 8“. Genomika. 36 (1): 192–196. doi:10.1006 / geno.1996.0445. PMID 8812436.
- ^ Zeth K (2010). "Struktura a vývoj mitochondriálních proteinů vnější membrány topologie beta-barelu". Biochim. Biophys. Acta. 1797 (6–7): 1292–9. doi:10.1016 / j.bbabio.2010.04.019. PMID 20450883.
- ^ A b Blachly-Dyson, E. & Forte, M. (2001). "Kanály VDAC". IUBMB Life. 52 (3–5): 113–18. doi:10.1080/15216540152845902. PMID 11798022.
- ^ A b Colombini M, Blachly-Dyson E, Forte M (1996). "VDAC, kanál ve vnější mitochondriální membráně". Ionové kanály. 4: 169–202. doi:10.1007/978-1-4899-1775-1_5. ISBN 978-1-4899-1777-5. PMID 8744209.
- ^ Thomas L, Blachly-Dyson E, Colombini M, Forte M (červen 1993). "Mapování zbytků tvořících napěťový senzor napěťově závislého aniontově selektivního kanálu". Proc. Natl. Acad. Sci. USA. 90 (12): 5446–9. Bibcode:1993PNAS ... 90.5446T. doi:10.1073 / pnas.90.12.5446. PMC 46737. PMID 7685903.
- ^ Shoshan-Barmatz V; Gincel D. (2003). "Napěťově závislý aniontový kanál: charakterizace, modulace a role v mitochondriální funkci v životě a smrti buněk". Cell Biochem. Biophys. 39 (3): 279–92. doi:10,1385 / CBB: 39: 3: 279. PMID 14716081. S2CID 33628015.
- ^ Lemasters JJ; Holmuhamedov E. (2006). "Napěťově závislý aniontový kanál (VDAC) jako mitochondriální regulátor - myšlení mimo krabici". Biochim. Biophys. Acta. 1762 (2): 181–90. doi:10.1016 / j.bbadis.2005.10.006. PMID 16307870.
- ^ Tsujimoto Y, Shimizu S (2002). "Aniontový kanál závislý na napětí: základní hráč v apoptóze". Biochimie. 84 (2–3): 187–93. doi:10.1016 / S0300-9084 (02) 01370-6. PMID 12022949.
- ^ Zalk R; Israelson A; Garty ES; Azoulay-Zohar H; Shoshan-Barmatz V. (2005). „Oligomerní stavy napěťově závislého aniontového kanálu a uvolňování cytochromu c z mitochondrií“. Biochem. J. 386 (1): 73–83. doi:10.1042 / BJ20041356. PMC 1134768. PMID 15456403.
- ^ Shimizu S; Narita M; Tsujimoto Y. (1999). „Proteiny rodiny Bcl-2 regulují uvolňování apoptogenního cytochromu c mitochondriálním kanálem VDAC“. Příroda. 399 (6735): 483–7. Bibcode:1999 Natur.399..483S. doi:10.1038/20959. PMID 10365962. S2CID 4423304.
- ^ Shimizu S; Matsuoka Y; Shinohara Y; Yoneda Y; Tsujimoto Y. (2001). „Základní role napěťově závislého aniontového kanálu v různých formách apoptózy v savčích buňkách“. J. Cell Biol. 152 (2): 237–50. doi:10.1083 / jcb.152.2.237. PMC 2199613. PMID 11266442.
- ^ Bay DC, Hafez M, Young MJ, Court DA (červen 2012). „Fylogenetická a koevoluční analýza rodiny proteinů β-barelu složená z mitochondriálního porinu (VDAC) a Tom40“. Biochim. Biophys. Acta. 1818 (6): 1502–19. doi:10.1016 / j.bbamem.2011.11.027. PMID 22178864.
- ^ Homblé F, Krammer E, Prevost M (červen 2012). „Plant VDAC: fakta a spekulace“. Biochim. Biophys. Acta. 1818 (6): 1486–501. doi:10.1016 / j.bbamem.2011.11.028. PMID 22155681.
externí odkazy
- Závislé na napětí + Anion + kanály v americké národní lékařské knihovně Lékařské předměty (Pletivo)
