SCNN1G - SCNN1G
The SCNN1G Gen kóduje y podjednotku epiteliálního sodíkového kanálu ENaC u obratlovců. ENaC je sestaven jako heterotrimer složený ze tří homologních podjednotek α, β a γ nebo δ, β a γ. Ostatní podjednotky ENAC jsou kódovány pomocí SCNN1A, SCNN1B, a SCNN1D.[5]
ENaC je exprimován v epitelových buňkách a liší se od napěťově řízeného sodíkového kanálu, který se podílí na generování akčních potenciálů v neuronech. Zkratka pro geny kódující napěťově řízený sodíkový kanál začíná třemi písmeny: SCN. Na rozdíl od těchto sodíkových kanálů je ENaC konstitutivně aktivní a nezávisí na napětí. Druhý N ve zkratce (SCNN1) představuje, že se jedná o NON-napěťově řízené kanály.
U většiny obratlovců jsou sodíkové ionty hlavním určujícím činitelem osmolarity extracelulární tekutiny.[6] ENaC umožňuje přenos sodíkových iontů přes buněčnou membránu epitelu v takzvaných „těsných epitelích“, které mají nízkou propustnost. Tok sodíkových iontů přes epitel ovlivňuje osmolaritu extracelulární tekutiny. ENaC tedy hraje ústřední roli v regulaci homeostázy tělesných tekutin a elektrolytů a následně ovlivňuje krevní tlak.[7]
Protože ENaC je silně inhibován amilorid, je také označován jako „sodíkový kanál citlivý na amilorid“.
Dějiny
První cDNA kódující gama podjednotku ENaC byla klonována a sekvenována Canessa et al. z krysí mRNA.[8] O rok později uvedly dvě nezávislé skupiny sekvence cDNA beta- a gama podjednotek lidské ENaC.[9][10] Kompletní kódující sekvence lidské y podjednotky byla uvedena v Saxena et al.[11]
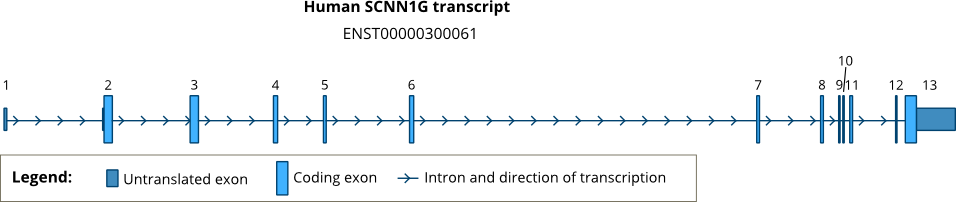
Genová struktura
Zatímco lidský gen SCNN1A nachází se v chromozomu 12p,[12] lidské geny kódující SCNN1B a SCNN1G jsou umístěny v juxtopozici v krátkém rameni chromozomu 16 (16p12-p13).[10] Struktury lidských a krysích SCNN1G genů byly poprvé popsány Thomasem et al.[13][14] Pozdější studie Saxena et al. uvádí úplnou kódující sekvenci lidského genu SCNN1G, která stanoví, že má 13 exonů [11] Pozice intronů jsou zachovány ve všech třech lidských genech ENaC, SCNN1A, SCNN1B a SCNN1G.[15] Pozice intronů jsou také vysoce zachovány u obratlovců. Viz: Soubor GeneTree.
Tkáňově specifický výraz
Tři podjednotky ENaC kódované pomocí SCNN1A, SCNN1B a SCNN1G se běžně exprimují v těsných epitelích, které mají nízkou propustnost pro vodu. Mezi hlavní orgány, kde je exprimován ENaC, patří části tubulárního epitelu ledvin,[5][7][16] dýchací cesty,[17] ženský reprodukční trakt,[17] tlusté, slinné a potní žlázy.[16]
ENaC je také vyjádřen v jazyku, kde se ukázalo, že je nezbytný pro vnímání slané chuti.[16]
Exprese genů podjednotky ENaC je regulována hlavně mineralokortikoidním hormonem aldosteronem, který je aktivován systémem renin-angiotensin.[18][19]
Struktura bílkovin
Primární struktury všech čtyř podjednotek ENaC vykazují silnou podobnost. Tyto čtyři proteiny tedy představují rodinu proteinů, které sdílejí společného předka. V globálním zarovnání (to znamená zarovnání sekvencí po celé jejich délce a ne jen částečném segmentu) má lidská y podjednotka 34% identitu s podjednotkou β a 27 a 23% identitu s podjednotkami α a 5.
Všechny čtyři sekvence podjednotky ENaC mají dva hydrofobní úseky, které tvoří dva transmembránové segmenty pojmenované jako TM1 a TM2.[5][20]Ve formě vázané na membránu jsou segmenty TM vloženy do membránové dvojvrstvy, amino- a karboxy-koncové oblasti jsou umístěny uvnitř buňky a segment mezi dvěma TM zůstává mimo buňku jako extracelulární oblast ENaC. Tato extracelulární oblast zahrnuje přibližně 70% zbytků každé podjednotky. Ve formě vázané na membránu je tedy převážná část každé podjednotky umístěna mimo buňku.[5]
Struktura ENaC dosud nebyla stanovena. Přesto byla struktura homologního proteinu ASIC1 vyřešena.[21][22] Struktura kuřecího ASIC1 odhalila, že ASIC1 je sestaven jako homotrimer tří identických podjednotek. Autoři původní studie naznačili, že trimer ASIC1 připomíná ruku, která drží míč.[21] Z tohoto důvodu byly odlišné domény ASIC1 označovány jako dlaň, klouby prstů, prst, palec a β-koule.[21]
Místně zaměřená mutageneze lidské γ podjednotky naznačuje, že ENaC podjednotky mají strukturu podobnou struktuře ASIC1.[23] Filtr iontové selektivity ENaC byl modelován na základě struktury ASIC1.[24]
Zarovnání sekvencí podjednotek ENaC se sekvencí ASIC1 ukazuje, že segmenty TM1 a TM2 a palmová doména jsou zachovány a domény kloubů, prstů a palců mají inzerce v ENaC. Studie mutageneze zaměřené na místo na podjednotkách ENaC poskytují důkaz, že mnoho základních rysů strukturálního modelu ASIC1 platí také pro ENaC.[5]
Na karboxylovém konci tří podjednotek ENaC (α, β a γ) existuje speciální konzervovaná konsensuální sekvence PPPXYXXL, která se nazývá PY motiv. Tuto sekvenci rozpoznávají takzvané WW domény ve speciální E3 ubikvitin-proteinové ligase s názvem Nedd4-2.[25] Nedd4-2 ligáty ubikvitin na C-konec ENaC podjednotky, která označuje protein pro degradaci.[25]
Přidružené nemoci
V současnosti je známo, že s mutacemi v genu SCNN1G souvisejí tři hlavní dědičné poruchy. Jedná se o: 1. Multisystémový pseudohypoaldosteronismus, 2. Liddleův syndrom a 3. Onemocnění podobné cystické fibróze.[5]
Vícesystémová forma pseudohypoaldosteronismu typu I (PHA1B)
Onemocnění nejčastěji spojené s mutacemi v SCNN1B je multisystémová forma pseudohypoaldosteronismu typu I (PHA1B), kterou A. Hanukoglu poprvé charakterizoval jako autozomálně recesivní onemocnění.[26] Jedná se o syndrom nereagování na aldosteron u pacientů, kteří mají vysoké hladiny aldosteronu v séru, ale trpí příznaky nedostatku aldosteronu s vysokým rizikem úmrtnosti v důsledku těžké ztráty solí. Původně se předpokládalo, že toto onemocnění je výsledkem mutace mineralokortikoidního receptoru (NR3C2), který váže aldosteron. Ale mapování homozygosity v 11 postižených rodinách odhalilo, že onemocnění je spojeno se dvěma lokusy na chromozomu 12p13.1-pter a chromozomu 16p12.2-13, které zahrnují geny pro SCNN1A a SCNN1B a SCNN1G.[27] Sekvenování genů ENaC identifikovalo mutaci u postižených pacientů a funkční exprese mutovaných cDNA dále potvrdila, že identifikované mutace vedou ke ztrátě aktivity ENaC.[28]
U většiny pacientů s vícesystémovým PHA1B byla detekována homozygotní mutace nebo dvě složené heterozygotní mutace.[29][30][31]
Liddleův syndrom
Liddleův syndrom je obecně způsoben mutacemi v PY motivu nebo zkrácením C-konce včetně ztráty PY motivu v β nebo γ ENaC podjednotkách.[32][33][34][35][36][37] I když existuje motiv PY také v podjednotce α, Liddleova choroba dosud nebyla pozorována ve spojení s mutací v podjednotce α. Liddleův syndrom se dědí jako autozomálně dominantní onemocnění s fenotypem, který zahrnuje hypertenzi s časným nástupem, metabolickou alkalózu a nízkou hladinu aktivity reninu v plazmě a mineralokortikoidní hormon aldosteron. Při absenci rozpoznatelného PY motivu se ubikvitin-protein ligáza Nedd4-2 nemůže vázat na podjednotku ENaC, a proto k ní nemůže připojit ubikvitin. V důsledku toho je proteolýza ENaC proteazomem inhibována a ENaC se hromadí v membráně, což vede ke zvýšené aktivitě ENaC, která způsobuje hypertenzi.[38][39][40][41]
Interakce
Bylo prokázáno, že SCNN1G komunikovat s:
Viz také
Poznámky
Verze tohoto článku z roku 2016 byla aktualizována externím odborníkem na základě modelu dvojího publikace. Korespondence akademický recenzent článek byl publikován v Gen a lze jej citovat jako: Izrael Hanukoglu; Aaron Hanukoglu (1. dubna 2016), „Rodina epitelových sodíkových kanálů (ENaC): fylogeneze, strukturní funkce, distribuce tkání a související dědičné nemoci“, Gen, 579 (2): 95–132, doi:10.1016 / J.GENE.2015.12.061, ISSN 0378-1119, PMC 4756657, PMID 26772908, Wikidata Q28272095 |
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000166828 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000000216 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b C d E F Hanukoglu I, Hanukoglu A (leden 2016). „Rodina epitelových sodíkových kanálů (ENaC): fylogeneze, struktura-funkce, distribuce tkání a související dědičná onemocnění“. Gen. 579 (2): 95–132. doi:10.1016 / j.gene.2015.12.061. PMC 4756657. PMID 26772908.
- ^ Bourque CW (červenec 2008). "Centrální mechanismy osmózy a systémové osmoregulace". Recenze přírody. Neurovědy. 9 (7): 519–31. doi:10.1038 / nrn2400. PMID 18509340. S2CID 205504313.
- ^ A b Rossier BC, Baker ME, Studer RA (leden 2015). „Epiteliální transport sodíku a jeho kontrola aldosteronem: příběh našeho vnitřního prostředí se vrátil“. Fyziologické recenze. 95 (1): 297–340. doi:10.1152 / physrev.00011.2014. PMID 25540145.
- ^ Canessa CM, Schild L, Buell G, Thorens B, Gautschi I, Horisberger JD, Rossier BC (únor 1994). „Amiloridově citlivý epitelový kanál Na + je vyroben ze tří homologních podjednotek“. Příroda. 367 (6462): 463–7. doi:10.1038 / 367463a0. PMID 8107805. S2CID 769822.
- ^ McDonald FJ, Price MP, Snyder PM, Welsh MJ (květen 1995). "Klonování a exprese beta- a gama podjednotek lidského epiteliálního sodíkového kanálu". American Journal of Physiology. 268 (5 Pt 1): C1157–63. doi:10.1152 / ajpcell.1995.268.5.C1157. PMID 7762608.
- ^ A b Voilley N, Bassilana F, Mignon C, Merscher S, Mattéi MG, Carle GF, Lazdunski M, Barbry P (srpen 1995). „Klonování, chromozomální lokalizace a fyzická vazba beta a gama podjednotek (SCNN1B a SCNN1G) sodného kanálu citlivého na amilorid lidského epitelu“. Genomika. 28 (3): 560–5. doi:10.1006 / geno.1995.1188. PMID 7490094.
- ^ A b Saxena A, Hanukoglu I, Saxena D, Thompson RJ, Gardiner RM, Hanukoglu A (červenec 2002). „Nové mutace zodpovědné za autosomálně recesivní multisystémový pseudohypoaldosteronismus a varianty sekvencí v genech alfa-, beta- a gama podjednotky epiteliálního sodíkového kanálu“. Journal of Clinical Endocrinology and Metabolism. 87 (7): 3344–50. doi:10.1210 / jcem.87.7.8674. PMID 12107247.
- ^ Ludwig M, Bolkenius U, Wickert L, Marynen P, Bidlingmaier F (květen 1998). "Strukturální organizace genu kódujícího alfa podjednotku lidského amiloridově citlivého epiteliálního sodíkového kanálu". Genetika člověka. 102 (5): 576–81. doi:10,1007 / s004390050743. PMID 9654208. S2CID 22547152.
- ^ Thomas CP, Doggett NA, Fisher R, Stokes JB (říjen 1996). „Genomická organizace a 5 'ohraničující oblast gama podjednotky lidského amiloridově citlivého epiteliálního sodíkového kanálu“. Journal of Biological Chemistry. 271 (42): 26062–6. doi:10.1074 / jbc.271.42.26062. PMID 8824247.
- ^ Thomas CP, Auerbach SD, Zhang C, Stokes JB (březen 1999). „Struktura genu podjednotky gama epitheliálního sodíkového kanálu citlivého na amilorid potkana a funkční analýza jeho promotoru“. Gen. 228 (1–2): 111–22. doi:10.1016 / s0378-1119 (99) 00016-5. PMID 10072764.
- ^ Saxena A, Hanukoglu I, Strautnieks SS, Thompson RJ, Gardiner RM, Hanukoglu A (listopad 1998). "Genová struktura lidské podjednotky beta epitelového sodíkového kanálu citlivého na amilorid sodný". Sdělení o biochemickém a biofyzikálním výzkumu. 252 (1): 208–213. doi:10.1006 / bbrc.1998.9625. PMID 9813171.
- ^ A b C Duc C, Farman N, Canessa CM, Bonvalet JP, Rossier BC (prosinec 1994). „Buněčně specifická exprese epiteliálního sodíkového kanálu alfa, beta a gama podjednotek v epitelu reagujícím na aldosteron u krysy: lokalizace in situ hybridizací a imunocytochemií“. The Journal of Cell Biology. 127 (6 Pt 2): 1907–21. doi:10.1083 / jcb.127.6.1907. PMC 2120291. PMID 7806569.
- ^ A b Enuka Y, Hanukoglu I, Edelheit O, Vaknine H, Hanukoglu A (březen 2012). „Epitelové sodíkové kanály (ENaC) jsou rovnoměrně rozloženy na pohyblivých řasinkách ve vejcovodu a v dýchacích cestách“. Histochemie a buněčná biologie. 137 (3): 339–53. doi:10.1007 / s00418-011-0904-1. PMID 22207244. S2CID 15178940.
- ^ Palmer LG, Patel A, Frindt G (únor 2012). "Regulace a dysregulace epitelových Na + kanálů". Klinická a experimentální nefrologie. 16 (1): 35–43. doi:10.1007 / s10157-011-0496-z. PMID 22038262. S2CID 19437696.
- ^ Thomas W, Harvey BJ (2011). "Mechanismy ovlivňující rychlé účinky aldosteronu v ledvinách". Roční přehled fyziologie. 73: 335–57. doi:10.1146 / annurev-physiol-012110-142222. PMID 20809792.
- ^ Canessa CM, Merillat AM, Rossier BC (prosinec 1994). "Membránová topologie epiteliálního sodíkového kanálu v intaktních buňkách". Americký žurnál fyziologie. 267 (6 Pt 1): C1682–90. doi:10.1152 / ajpcell.1994.267.6.C1682. PMID 7810611.
- ^ A b C Jasti J, Furukawa H, Gonzales EB, Gouaux E (září 2007). "Struktura iontového kanálu 1 snímajícího kyselinu při rozlišení 1,9 A a nízkém pH". Příroda. 449 (7160): 316–23. doi:10.1038 / nature06163. PMID 17882215.
- ^ Baconguis I, Bohlen CJ, Goehring A, Julius D, Gouaux E (únor 2014). „Rentgenová struktura komplexu 1-hadího toxinu iontového kanálu snímajícího kyselinu odhaluje otevřený stav Na (+) - selektivního kanálu“. Buňka. 156 (4): 717–29. doi:10.1016 / j.cell.2014.01.011. PMC 4190031. PMID 24507937.
- ^ Edelheit O, Ben-Shahar R, Dascal N, Hanukoglu A, Hanukoglu I (duben 2014). "Zachované nabité zbytky na povrchu a na rozhraní podjednotek epiteliálního sodíkového kanálu (ENaC): role v expresi na buněčném povrchu a autoinhibiční reakce Na +". FEBS Journal. 281 (8): 2097–2111. doi:10.1111 / febs.12765. PMID 24571549. S2CID 5807500.
- ^ Hanukoglu I (2017). „Sodné kanály typu ASIC a ENaC: Konformační stavy a struktury iontových selektivních filtrů“. FEBS Journal. 284 (4): 525–545. doi:10.1111 / febs.13840. PMID 27580245. S2CID 24402104.
- ^ A b Rotin D, Staub O (leden 2011). „Role ubikvitinového systému při regulaci transportu iontů“ (PDF). Archiv Pflügers: European Journal of Physiology. 461 (1): 1–21. doi:10.1007 / s00424-010-0893-2. PMID 20972579. S2CID 23272309.
- ^ Hanukoglu A (listopad 1991). „Pseudohypoaldosteronismus typu I zahrnuje dvě klinicky a geneticky odlišné entity s vadami ledvin nebo více cílových orgánů“. The Journal of Clinical Endocrinology and Metabolism. 73 (5): 936–44. doi:10.1210 / jcem-73-5-936. PMID 1939532.
- ^ Strautnieks SS, Thompson RJ, Hanukoglu A, Dillon MJ, Hanukoglu I, Kuhnle U, Seckl J, Gardiner RM, Chung E (únor 1996). „Lokalizace genů pseudohypoaldosteronismu na chromozom 16p12.2-13.11 a 12p13.1-pter pomocí homozygotního mapování“. Lidská molekulární genetika. 5 (2): 293–9. doi:10,1093 / hmg / 5.2.293. PMID 8824886.
- ^ Chang SS, Grunder S, Hanukoglu A, Rösler A, Mathew PM, Hanukoglu I, Schild L, Lu Y, Shimkets RA, Nelson-Williams C, Rossier BC, Lifton RP (březen 1996). „Mutace v podjednotkách epiteliálního sodíkového kanálu způsobují plýtvání solí s hyperkalemickou acidózou, pseudohypoaldosteronismem typu 1“. Genetika přírody. 12 (3): 248–53. doi:10.1038 / ng0396-248. PMID 8589714. S2CID 8185511.
- ^ Strautnieks SS, Thompson RJ, Gardiner RM, Chung E (červen 1996). „Nová mutace místa sestřihu v gama podjednotce genu epitelového sodíkového kanálu ve třech rodinách pseudohypoaldosteronismu typu 1“. Genetika přírody. 13 (2): 248–50. doi:10.1038 / ng0696-248. PMID 8640238. S2CID 21124946.
- ^ Edelheit O, Hanukoglu I, Gizewska M, Kandemir N, Tenenbaum-Rakover Y, Yurdakök M, Zajaczek S, Hanukoglu A (květen 2005). „Nové mutace v genech podjednotky epiteliálního sodíkového kanálu (ENaC) a fenotypová exprese multisystémového pseudohypoaldosteronismu“. Klinická endokrinologie. 62 (5): 547–53. doi:10.1111 / j.1365-2265.2005.02255.x. PMID 15853823. S2CID 2749562.
- ^ Zennaro MC, Hubert EL, Fernandes-Rosa FL (březen 2012). „Aldosteronová rezistence: strukturální a funkční aspekty a nové perspektivy“. Molekulární a buněčná endokrinologie. 350 (2): 206–15. doi:10.1016 / j.mce.2011.04.023. PMID 21664233. S2CID 24896754.
- ^ Hansson JH, Nelson-Williams C, Suzuki H, Schild L, Shimkets R, Lu Y, Canessa C, Iwasaki T, Rossier B, Lifton RP (1995). „Hypertenze způsobená zkrácenou podjednotkou gamma epiteliálního sodíkového kanálu: genetická heterogenita Liddleova syndromu“. Nat. Genet. 11 (1): 76–82. doi:10.1038 / ng0995-76. PMID 7550319. S2CID 22106822.
- ^ Shimkets RA, Warnock DG, Bositis CM, Nelson-Williams C, Hansson JH, Schambelan M, Gill JR, Ulick S, Milora RV, Findling JW (1994). „Liddleův syndrom: dědičná lidská hypertenze způsobená mutacemi v beta podjednotce epiteliálního sodíkového kanálu“. Buňka. 79 (3): 407–14. doi:10.1016 / 0092-8674 (94) 90250-X. PMID 7954808. S2CID 54282654.
- ^ Hansson JH, Schild L, Lu Y, Wilson TA, Gautschi I, Shimkets R, Nelson-Williams C, Rossier BC, Lifton RP (1996). „De novo missense mutace beta podjednotky epiteliálního sodíkového kanálu způsobuje hypertenzi a Liddleův syndrom a identifikuje segment bohatý na prolin kritický pro regulaci aktivity kanálu“. Proc. Natl. Acad. Sci. USA. 92 (25): 11495–9. doi:10.1073 / pnas.92.25.11495. PMC 40428. PMID 8524790.
- ^ Inoue J, Iwaoka T, Tokunaga H, Takamune K, Naomi S, Araki M, Takahama K, Yamaguchi K, Tomita K (1998). "Rodina s Liddleovým syndromem způsobená novou missense mutací v beta podjednotce epiteliálního sodíkového kanálu". J. Clin. Endokrinol. Metab. 83 (6): 2210–3. doi:10.1210 / jc.83.6.2210. PMID 9626162.
- ^ Persu A, Barbry P, Bassilana F, Houot AM, Mengual R, Lazdunski M, Corvol P, Jeunemaitre X (1998). „Genetická analýza beta podjednotky epitelového kanálu Na + u esenciální hypertenze“. Hypertenze. 32 (1): 129–37. doi:10.1161 / 01.hy.32.1.129. PMID 9674649.
- ^ Uehara Y, Sasaguri M, Kinoshita A, Tsuji E, Kiyose H, Taniguchi H, Noda K, Ideishi M, Inoue J, Tomita K, Arakawa K (1998). "Genetická analýza epiteliálního sodíkového kanálu u Liddleova syndromu". J. Hypertens. 16 (8): 1131–5. doi:10.1097/00004872-199816080-00008. PMID 9794716. S2CID 31393115.
- ^ Snyder PM, Price MP, McDonald FJ, Adams CM, Volk KA, Zeiher BG, Stokes JB, Welsh MJ (1996). "Mechanismus, kterým mutace Liddleova syndromu zvyšují aktivitu lidského epiteliálního kanálu Na +". Buňka. 83 (6): 969–78. doi:10.1016/0092-8674(95)90212-0. PMID 8521520. S2CID 970556.
- ^ Tamura H, Schild L, Enomoto N, Matsui N, Marumo F, Rossier BC (1996). "Liddle nemoc způsobená missense mutací beta podjednotky genu pro epitelový sodíkový kanál". J. Clin. Investovat. 97 (7): 1780–4. doi:10.1172 / JCI118606. PMC 507244. PMID 8601645.
- ^ Firsov D, Schild L, Gautschi I, Mérillat AM, Schneeberger E, Rossier BC (1997). "Exprese buněčného povrchu epiteliálního Na kanálu a mutanta způsobujícího Liddleův syndrom: kvantitativní přístup". Proc. Natl. Acad. Sci. USA. 93 (26): 15370–5. doi:10.1073 / pnas.93.26.15370. PMC 26411. PMID 8986818.
- ^ Pirozzi G, McConnell SJ, Uveges AJ, Carter JM, Sparks AB, Kay BK, Fowlkes DM (1997). "Identifikace nových proteinů obsahujících lidskou WW doménu klonováním ligandových cílů". J. Biol. Chem. 272 (23): 14611–6. doi:10.1074 / jbc.272.23.14611. PMID 9169421.
- ^ Farr TJ, Coddington-Lawson SJ, Snyder PM, McDonald FJ (únor 2000). „Human Nedd4 interaguje s lidským epiteliálním kanálem Na +: WW3, ale ne WW1 se váže na podjednotky kanálu Na +“. Biochem. J. 345 (3): 503–9. doi:10.1042/0264-6021:3450503. PMC 1220784. PMID 10642508.
- ^ McDonald FJ, Western AH, McNeil JD, Thomas BC, Olson DR, Snyder PM (září 2002). „Ubikvitin-proteinová ligáza WWP2 se váže na epiteliální Na (+) kanál a snižuje jeho hladinu“. Dopoledne. J. Physiol. Renal Physiol. 283 (3): F431–6. doi:10.1152 / ajprenal.00080.2002. PMID 12167593.
- ^ Harvey KF, Dinudom A, Cook DI, Kumar S (březen 2001). „Protein podobný Nedd4 KIAA0439 je potenciálním regulátorem sodíkového kanálu epitelu“. J. Biol. Chem. 276 (11): 8597–601. doi:10,1074 / jbc.C000906200. PMID 11244092.
- ^ Berdiev BK, Jovov B, Tucker WC, Naren AP, Fuller CM, Chapman ER, Benos DJ (červen 2004). "Interakce podjednotky a inhibice ENaC a inhibice syntaxinem 1A". Dopoledne. J. Physiol. Renal Physiol. 286 (6): F1100–6. doi:10.1152 / ajprenal.00344.2003. PMID 14996668.
- ^ Boulkroun S, Ruffieux-Daidié D, Vitagliano JJ, Poirot O, Charles RP, Lagnaz D, Firsov D, Kellenberger S, Staub O (říjen 2008). „Vasopresinem indukovatelná ubikvitinově specifická proteáza 10 zvyšuje expresi povrchu buněk ENaC deubikvitylací a stabilizací třídění nexinu 3“. Dopoledne. J. Physiol. Renal Physiol. 295 (4): F889–900. doi:10.1152 / ajprenal.00001.2008. PMID 18632802.
- ^ Raikwar NS, Thomas CP (květen 2008). "Isoformy Nedd4-2 ubikvitinují jednotlivé podjednotky epiteliálního sodíkového kanálu a snižují povrchovou expresi a funkci epiteliálního sodíkového kanálu". Dopoledne. J. Physiol. Renal Physiol. 294 (5): F1157–65. doi:10.1152 / ajprenal.00339.2007. PMC 2424110. PMID 18322022.
Další čtení
- Staub O, Gautschi I, Ishikawa T, Breitschopf K, Ciechanover A, Schild L, Rotin D (1998). "Regulace stability a funkce epiteliálního Na+ kanál (ENaC) ubikvitinací ". EMBO J.. 16 (21): 6325–36. doi:10.1093 / emboj / 16.21.6325. PMC 1170239. PMID 9351815.
- Arai K, Zachman K, Shibasaki T, Chrousos GP (1999). „Polymorfismy podjednotek sodíkových kanálů citlivých na amilorid v pěti sporadických případech pseudohypoaldosteronismu: mají patologický potenciál?“. J. Clin. Endokrinol. Metab. 84 (7): 2434–7. doi:10.1210 / jc.84.7.2434. PMID 10404817.
- Auerbach SD, Loftus RW, Itani OA, Thomas CP (2000). „Lidský amilorid citlivý epitel Na+ promotor podjednotky gama kanálu: funkční analýza a identifikace traktu polypurin-polypyrimidinu s potenciálem pro tvorbu triplexové DNA ". Biochem. J. 347 (1): 105–14. doi:10.1042/0264-6021:3470105. PMC 1220937. PMID 10727408.
- Shi H, Asher C, Chigaev A, Yung Y, Reuveny E, Seger R, Garty H (2002). „Interakce beta a gama ENaC s Nedd4 lze usnadnit fosforylací zprostředkovanou ERK“. J. Biol. Chem. 277 (16): 13539–47. doi:10,1074 / jbc.M111717200. PMID 11805112.
externí odkazy
- SCNN1G + protein, + člověk v americké národní lékařské knihovně Lékařské předměty (Pletivo)