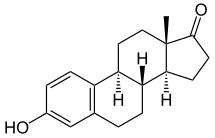
Estrone - Estrone
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC (8R,9S,13S,14S) -3-hydroxy-13-methyl-7,8,9,11,12,14,15,16-oktahydro-6H-cyklopenta [A] fenanthren-17-on | |
| Ostatní jména Estron; E1; 3-Hydroxyestra-1,3,5 (10) -trien-17-on | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.000.150 |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C18H22Ó2 | |
| Molární hmotnost | 270,366 g / mol |
| Bod tání | 254.5 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Estrone (E1), také hláskoval estron, je steroid, slabý estrogen a nezletilá žena pohlavní hormon.[1] Je to jeden ze tří hlavních endogenní estrogeny, ostatní jsou estradiol a estriol.[1] Estrone, stejně jako ostatní estrogeny, jsou syntetizován z cholesterol a vylučováno hlavně z pohlavní žlázy, ačkoli mohou být také vytvořeny z nadledvin androgeny v tuková tkáň.[2] Ve srovnání s estradiolem mají estron i estriol mnohem slabší aktivitu jako estrogeny.[1] Estrone lze převést na estradiol a slouží hlavně jako a předchůdce nebo metabolický meziprodukt estradiolu.[1][3] Je to předchůdce i metabolit estradiolu.[4][1]
Kromě své role přírodního hormonu se estron používá jako a léky, například v menopauzální hormonální terapie; informace o estronu jako léku viz estron (léky) článek.
Biologická aktivita
Estrone je estrogen, konkrétně agonista z estrogenové receptory ERα a ERβ.[1][5] Je to mnohem méně silný estrogen, než je estradiol, a jako takový je relativně slabý estrogen.[1][5][6] Dána subkutánní injekce u myší je estradiol asi 10krát účinnější než estron a asi 100krát účinnější než estriol.[7] Podle jedné studie relativní vazebné afinity estronu pro lidský ERα a ERp bylo 4,0%, respektive 3,5% estradiolu, a relativní transaktivační kapacity estronu na ERα a ERβ bylo 2,6% a 4,3% estradiolu.[5] V souladu s tím se uvádí, že estrogenní aktivita estronu je přibližně 4% aktivity estradiolu.[1] Kromě nízké estrogenní účinnosti se estron na rozdíl od estradiolu a estriolu nehromadí v cílových tkáních estrogenu.[1] Protože estron může být transformovaný na estradiol, většinu nebo celou estrogenní sílu estronu in vivo je ve skutečnosti důsledkem přeměny na estradiol.[1][8] Jako takový je estron považován za a předchůdce nebo prohormon estradiolu.[3] Na rozdíl od estradiolu a estriolu estron není a ligand z Estrogenový receptor spojený s G proteinem (afinita> 10 000 nM).[9]
Klinický výzkum potvrdila povahu estronu jako relativně inertního prekurzoru estradiolu.[1][10][11][12] S ústní podání estradiolu je poměr hladin estradiolu k hladinám estronu v průměru asi 5krát vyšší než za normálních podmínek fyziologický okolnosti v premenopauzální ženy a s parenterální (neorální) trasy estradiolu.[1] Perorální podání menopauzální náhrada dávky estradiolu vedou k nízkým, folikulární fáze hladiny estradiolu, zatímco hladiny estronu se podobají vysokým hladinám pozorovaným během první trimestr z těhotenství.[1][13][14] Navzdory výrazně zvýšeným hladinám estronu s perorálním estradiolem, ale ne s transdermální estradiol, klinické studie ukázaly, že dávky orálního a transdermálního estradiolu dosahující podobných hladin estradiolu mají ekvivalentní a nevýznamně odlišné potence z hlediska opatření včetně potlačení luteinizační hormon a folikuly stimulující hormon hladiny, inhibice kostní resorpce a úleva od menopauzální příznaky jako návaly horka.[1][10][11][12][15] Kromě toho bylo zjištěno, že hladiny estradiolu korelují s těmito účinky, zatímco hladiny estronu ne.[10][11] Tato zjištění potvrzují, že estron má velmi nízkou estrogenní aktivitu, a také naznačují, že estron nesnižuje estrogenní aktivitu estradiolu.[1][10][11][12] To některým odporuje bez buněk in-vitro výzkum naznačující, že vysoké koncentrace estronu mohou být schopné částečně znepřátelit si působení estradiolu.[16][17][18]
| Estrogen | ER RBA (%) | Hmotnost dělohy (%) | Uterotrofie | LH úrovně (%) | SHBG RBA (%) |
|---|---|---|---|---|---|
| Řízení | – | 100 | – | 100 | – |
| Estradiol | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| Estrone | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| Estriol | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| Estetrol | 0.5 ± 0.2 | ? | Neaktivní | ? | 1 |
| 17α-estradiol | 4.2 ± 0.8 | ? | ? | ? | ? |
| 2-hydroxyestradiol | 24 ± 7 | 285 ± 8 | +b | 31–61 | 28 |
| 2-methoxyestradiol | 0.05 ± 0.04 | 101 | Neaktivní | ? | 130 |
| 4-hydroxyestradiol | 45 ± 12 | ? | ? | ? | ? |
| 4-methoxyestradiol | 1.3 ± 0.2 | 260 | ++ | ? | 9 |
| 4-fluorestradiolA | 180 ± 43 | ? | +++ | ? | ? |
| 2-hydroxyestron | 1.9 ± 0.8 | 130 ± 9 | Neaktivní | 110–142 | 8 |
| 2-methoxyestron | 0.01 ± 0.00 | 103 ± 7 | Neaktivní | 95–100 | 120 |
| 4-hydroxyestron | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-methoxyestron | 0.13 ± 0.04 | 338 | ++ | 65–92 | 12 |
| 16α-hydroxyestron | 2.8 ± 1.0 | 552 ± 42 | +++ | 7–24 | <0.5 |
| 2-hydroxyestriol | 0.9 ± 0.3 | 302 | +b | ? | ? |
| 2-methoxyestriol | 0.01 ± 0.00 | ? | Neaktivní | ? | 4 |
| Poznámky: Hodnoty jsou průměr ± SD nebo rozsah. ER RBA = Relativní vazebná afinita na estrogenové receptory krysy děložní cytosol. Hmotnost dělohy = procento změny hmotnosti dělohy za mokra ovariektomizováno krysy po 72 hodinách s kontinuálním podáváním 1 μg / hodinu přes subkutánně implantován osmotické pumpy. LH úrovně = Luteinizační hormon hladiny ve srovnání s výchozí hodnotou krys po ovariektomii po 24 až 72 hodinách kontinuálního podávání subkutánním implantátem. Poznámky pod čarou: A = Syntetický (tj. ne endogenní ). b = Atypický uterotrofický účinek, který náhorní plošiny do 48 hodin (uterotrofie estradiolu pokračuje lineárně až do 72 hodin). Zdroje: Viz šablona. | |||||
Biochemie

Biosyntéza
Estrone je biosyntetizovaný z cholesterol. Hlavní cesta zahrnuje androstendion jako středně pokročilí s androstendionem transformovaný do estronu enzym aromatáza. K této reakci dochází v obou pohlavní žlázy a v některých dalších papírové kapesníky, zejména tuková tkáň, a estron je následně vylučováno z těchto tkání.[2] Kromě aromatizace androstendionu se také tvoří estron reverzibilně z estradiolu enzymem 17β-hydroxysteroid dehydrogenáza (17β-HSD) v různých tkáních, včetně játra, děloha, a prsní žláza.[1]
Rozdělení
Estrone je vázán přibližně na 16% globulin vázající pohlavní hormony (SHBG) a 80% až albumin v oběh,[1] zbytek (2,0 až 4,0%) cirkuluje volně nebo bez vazby.[20] Má přibližně 24% relativní vazebné afinity estradiolu k SHBG.[1] Estron je jako takový relativně špatně vázán na SHBG.[21]
Metabolismus
Estrone je konjugované do estrogenové konjugáty jako estron sulfát a estron glukuronid podle sulfotransferázy a glukuronidázy, a může také být hydroxylovaný podle cytochrom P450 enzymy do katechol estrogeny jako 2-hydroxyestron a 4-hydroxyestron nebo do estriol.[1] Obě tyto transformace probíhají převážně v EU játra.[1] Estron lze také reverzibilně přeměnit na estradiol pomocí 17β-HSD.[1] The poločas krve estronu je asi 10 až 70 minut a je podobný účinku estradiolu.[22][23]
Metabolické dráhy z estradiol u lidí |
Vylučování
Estrone je vylučován v moč ve formě estrogenové konjugáty jako estron sulfát.[1] Po intravenózní injekci označeno estron u žen, téměř 90% se vylučuje močí a výkaly do 4 až 5 dnů.[22] Enterohepatální recirkulace způsobuje zpoždění vylučování estronu.[22]
Úrovně
| Sex | Sexuální hormon | Reprodukční fáze | Krev rychlost výroby | Gonadal rychlost sekrece | Metabolické rychlost odbavení | Referenční rozsah (hladiny v séru) | |
|---|---|---|---|---|---|---|---|
| SI Jednotky | Ne-SI Jednotky | ||||||
| Muži | Androstendion | – | 2,8 mg / den | 1,6 mg / den | 2200 l / den | 2,8–7,3 nmol / l | 80–210 ng / dl |
| Testosteron | – | 6,5 mg / den | 6,2 mg / den | 950 l / den | 6,9–34,7 nmol / l | 200–1000 ng / dl | |
| Estrone | – | 150 μg / den | 110 μg / den | 2050 l / den | 37–250 pmol / l | 10–70 pg / ml | |
| Estradiol | – | 60 μg / den | 50 μg / den | 1600 l / den | <37–210 pmol / l | 10–57 pg / ml | |
| Estrone sulfát | – | 80 μg / den | Bezvýznamné | 167 l / den | 600–2500 pmol / l | 200–900 pg / ml | |
| Ženy | Androstendion | – | 3,2 mg / den | 2,8 mg / den | 2000 l / den | 3,1–12,2 nmol / l | 89–350 ng / dl |
| Testosteron | – | 190 μg / den | 60 μg / den | 500 l / den | 0,7–2,8 nmol / l | 20–81 ng / dl | |
| Estrone | Folikulární fáze | 110 μg / den | 80 μg / den | 2200 l / den | 110–400 pmol / l | 30–110 pg / ml | |
| Luteální fáze | 260 μg / den | 150 μg / den | 2200 l / den | 310–660 pmol / l | 80–180 pg / ml | ||
| Postmenopauza | 40 μg / den | Bezvýznamné | 1610 l / den | 22–230 pmol / l | 6–60 pg / ml | ||
| Estradiol | Folikulární fáze | 90 μg / den | 80 μg / den | 1200 l / den | <37–360 pmol / l | 10–98 pg / ml | |
| Luteální fáze | 250 μg / den | 240 μg / den | 1200 l / den | 699–1250 pmol / l | 190–341 pg / ml | ||
| Postmenopauza | 6 μg / den | Bezvýznamné | 910 l / den | <37–140 pmol / l | 10–38 pg / ml | ||
| Estrone sulfát | Folikulární fáze | 100 μg / den | Bezvýznamné | 146 l / den | 700–3600 pmol / l | 250–1300 pg / ml | |
| Luteální fáze | 180 μg / den | Bezvýznamné | 146 l / den | 1100–7300 pmol / l | 400–2600 pg / ml | ||
| Progesteron | Folikulární fáze | 2 mg / den | 1,7 mg / den | 2100 l / den | 0,3–3 nmol / l | 0,1–0,9 ng / ml | |
| Luteální fáze | 25 mg / den | 24 mg / den | 2100 l / den | 19–45 nmol / l | 6–14 ng / ml | ||
Poznámky a zdroje Poznámky: „The koncentrace Steroid v oběhu je určen rychlostí, kterou je vylučován ze žláz, rychlostí metabolismu prekurzoru nebo prehormonů na steroid a rychlostí, jakou je extrahován tkáněmi a metabolizován. The rychlost sekrece steroidu označuje celkovou sekreci sloučeniny z žlázy za jednotku času. Míry sekrece byly hodnoceny vzorkováním venózního výtoku z žlázy v průběhu času a odečtením koncentrace arteriálního a periferního venózního hormonu. The rychlost metabolické clearance steroidu je definován jako objem krve, který byl zcela odstraněn z hormonu za jednotku času. The rychlost výroby "Steroidní hormon" znamená vstup sloučeniny do krve ze všech možných zdrojů, včetně sekrece ze žláz a přeměny prohormonů na požadovaný steroid. V ustáleném stavu se množství hormonu vstupujícího do krve ze všech zdrojů bude rovnat rychlosti vylučování (rychlost metabolické clearance) vynásobené koncentrací v krvi (rychlost produkce = rychlost metabolické clearance × koncentrace). Pokud je malý podíl metabolismu prohormonu na cirkulující skupině steroidů, pak se rychlost produkce bude přibližovat rychlosti vylučování. “ Zdroje: Viz šablona. | |||||||
Chemie
Estrone, také známý jako estra-1,3,5 (10) -trien-3-ol-17-on, je přirozeně se vyskytující estrane steroid s dvojné vazby na pozicích C1, C3 a C5, a hydroxylová skupina v poloze C3 a a keton skupina v poloze C17. Název estron byl odvozen z chemických výrazů estrv (estra-1,3,5 (10) -trien) a ketjeden.
The chemický vzorec estronu je C18H22Ó2 a jeho molekulární váha je 270,366 g / mol. Je to bílý, bez zápachu, pevný krystalický prášek, s bod tání 254,5 ° C (490 ° F) a a specifická gravitace ze dne 1.23.[24][25] Estrone je hořlavý při vysokých teplotách kysličník uhelnatý (CO) a oxid uhličitý (CO.)2).[24]
Lékařské použití
Estrone je k dispozici jako injekčně estrogen pro lékařské použití, například v hormonální terapie pro menopauzální příznaky, ale nyní již většinou není na trhu.[26]
Dějiny
Estrone byl první steroidní hormon být objeven.[27][28] To bylo objeveno v roce 1929 nezávisle na americký vědci Edward Doisy a Edgar Allen a Němec biochemik Adolf Butenandt, ačkoli Doisy a Allen to izolovali dva měsíce před Butenandtem.[27][29][30] Izolovali a očištěno estron v krystalický formulář z moč z těhotná ženy.[29][30][31] Doisy a Allen to pojmenovali theelin, zatímco Butenandt to pojmenoval progynon a následně jej označil jako folikulin ve své druhé publikaci o látce.[30][32] Butenandt byl později oceněn Nobelova cena v roce 1939 za izolaci estronu a jeho práci na pohlavní hormony obecně.[31][33] The molekulární vzorec estronu bylo známo do roku 1931,[34] a jeho chemická struktura byl určen Butenandtem do roku 1932.[30][29] Po objasnění jeho struktury byl estron dále označován jako ketohydroxyestrin nebo oxohydroxyestrin,[35][36] a jméno estron, na základě svého C17 keton Skupina byla formálně založena v roce 1932 na prvním zasedání mezinárodní konference o standardizaci pohlavních hormonů v Londýně.[37][38]
A parciální syntéza estronu z ergosterol bylo dosaženo Russell Earl Marker v roce 1936 a byl první chemická syntéza estronu.[39][40] Alternativní parciální syntéza estronu z cholesterol prostřednictvím dehydroepiandrosteron (DHEA) byl vyvinut společností Hans Herloff Inhoffen a Walter Hohlweg v roce 1939 nebo 1940,[39] a a celková syntéza estronu dosáhli Anner a Miescher v roce 1948.[38]
Reference
- ^ A b C d E F G h i j k l m n Ó p q r s t u proti Kuhl H (srpen 2005). „Farmakologie estrogenů a progestogenů: vliv různých cest podání“ (PDF). Klimakterický. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947.
- ^ A b Hornstein T, Schwerin JL (1. ledna 2012). Biologie žen. Cengage Learning. str. 369–. ISBN 978-1-285-40102-7.
- ^ A b van Keep PA, Utian WH, Vermeulen A (6. prosince 2012). Kontroverzní klimakterik: Zprávy moderátorů workshopu prezentované na třetím mezinárodním kongresu o menopauze, který se konal v belgické Ostende v červnu 1981 pod záštitou Mezinárodní menopauzální společnosti. Springer Science & Business Media. p. 92. ISBN 978-94-011-7253-0.
- ^ Chervenak J (říjen 2009). "Bioidentical hormony pro zrání žen". Maturitas. 64 (2): 86–9. doi:10.1016 / j.maturitas.2009.08.002. PMID 19766414.
- ^ A b C Escande A, Pillon A, Servant N, Cravedi JP, Larrea F, Muhn P, Nicolas JC, Cavaillès V, Balaguer P (květen 2006). "Hodnocení selektivity ligandu pomocí reportérových buněčných linií stabilně exprimujících estrogenový receptor alfa nebo beta". Biochemická farmakologie. 71 (10): 1459–69. doi:10.1016 / j.bcp.2006.02.002. PMID 16554039.
- ^ Ruggiero RJ, Likis FE (2002). "Estrogen: fyziologie, farmakologie a formulace pro substituční terapii". Journal of porodní asistence a zdraví žen. 47 (3): 130–8. doi:10.1016 / s1526-9523 (02) 00233-7. PMID 12071379.
- ^ A. Labhart (6. prosince 2012). Klinická endokrinologie: teorie a praxe. Springer Science & Business Media. str. 548–. ISBN 978-3-642-96158-8.
- ^ Fishman, J .; Martucci, C. P. (1980). „Nové koncepty estrogenní aktivity: úloha metabolitů při expresi působení hormonů“. V N. Pasetto; R. Paoletti; J. L. Ambrus (eds.). Menopauza a postmenopauza. 43–52. doi:10.1007/978-94-011-7230-1_5. ISBN 978-94-011-7232-5.
- ^ Prossnitz ER, Arterburn JB (červenec 2015). „International Union of Basic and Clinical Pharmacology. XCVII. G Protein-Coupled Estrogen Receptor and its Pharmacologic Modulators“. Pharmacol. Rev. 67 (3): 505–40. doi:10.1124 / pr.114.009712. PMC 4485017. PMID 26023144.
- ^ A b C d Selby P, McGarrigle HH, Peacock M (březen 1989). „Srovnání účinků orálního a transdermálního podávání estradiolu na metabolismus estrogenu, syntézu bílkovin, uvolňování gonadotropinu, kostní obrat a klimakterické příznaky u postmenopauzálních žen“. Klinická endokrinologie. 30 (3): 241–9. doi:10.1111 / j.1365-2265.1989.tb02232.x. PMID 2512035.
- ^ A b C d Powers MS, Schenkel L, Darley PE, Good WR, Balestra JC, Place VA (srpen 1985). „Farmakokinetika a farmakodynamika transdermálních lékových forem 17 beta-estradiolu: srovnání s běžnými perorálními estrogeny používanými pro hormonální substituci“. American Journal of Obstetrics and Gynecology. 152 (8): 1099–106. doi:10.1016/0002-9378(85)90569-1. PMID 2992279.
- ^ A b C Fåhraeus L, Larsson-Cohn U (prosinec 1982). „Estrogeny, gonadotropiny a SHBG během orálního a kožního podávání estradiolu-17 beta ženám v menopauze“. Acta Endocrinologica. 101 (4): 592–6. doi:10.1530 / acta.0.1010592. PMID 6818806.
- ^ Wright JV (prosinec 2005). „Biologická identifikace steroidních hormonů: vybraná pozorování z 23 let klinické a laboratorní praxe“. Annals of the New York Academy of Sciences. 1057 (1): 506–24. Bibcode:2005NYASA1057..506W. doi:10.1196 / annals.1356.039. PMID 16399916.
- ^ Friel PN, Hinchcliffe C, Wright JV (březen 2005). „Hormonální náhrada estradiolem: běžné perorální dávky vedou k nadměrné expozici estronu.“ Recenze alternativní medicíny. 10 (1): 36–41. PMID 15771561.
- ^ De Lignieres B, Basdevant A, Thomas G, Thalabard JC, Mercier-Bodard C, Conard J, Guyene TT, Mairon N, Corvol P, Guy-Grand B (březen 1986). „Biologické účinky estradiolu-17 beta u postmenopauzálních žen: orální versus perkutánní podání“. J. Clin. Endokrinol. Metab. 62 (3): 536–41. doi:10.1210 / jcem-62-3-536. PMID 3080464.
- ^ Kloosterboer, HJ; Schoonen, WG; Verheul, HA (11. dubna 2008). „Proliferace prsních buněk steroidními hormony a jejich metabolity“. V Pasqualini, Jorge R (ed.). Rakovina prsu: prognóza, léčba a prevence. CRC Press. str. 343–366. ISBN 978-1-4200-5873-4.
- ^ Sasson S, Notides AC (červenec 1983). „Interakce estriolu a estronu s estrogenovým receptorem. II. Estriol a estronem indukovaná inhibice kooperativní vazby [3H] estradiolu na estrogenový receptor“. The Journal of Biological Chemistry. 258 (13): 8118–22. PMID 6863280.
- ^ Lundström E, Conner P, Naessén S, Löfgren L, Carlström K, Söderqvist G (2015). "Estrone - částečný antagonista estradiolu v normálním prsu". Gynekologická endokrinologie. 31 (9): 747–9. doi:10.3109/09513590.2015.1062866. PMID 26190536.
- ^ Häggström M, Richfield D (2014). „Schéma cest lidské steroidogeneze“. WikiJournal of Medicine. 1 (1). doi:10.15347 / wjm / 2014.005. ISSN 2002-4436.
- ^ Jameson JL, De Groot LJ (18. května 2010). Endokrinologie - elektronická kniha: dospělí a pediatři. Elsevier Health Sciences. str. 2813–. ISBN 978-1-4557-1126-0.
- ^ H. J. Buchsbaum (6. prosince 2012). Menopauza. Springer Science & Business Media. 62, 64. ISBN 978-1-4612-5525-3.
- ^ A b C Dorfman, Ralph I. (1961). „Metabolismus steroidních hormonů“: 1223–1241. doi:10.1007/978-3-642-49761-2_39. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Sandberg AA, Slaunwhite WR (srpen 1957). „Studie na fenolických steroidech u lidských subjektů. II. Metabolický osud a hepato-biliární-enterická cirkulace C14-estronu a C14-estradiolu u žen“. J. Clin. Investovat. 36 (8): 1266–78. doi:10,1172 / JCI103524. PMC 1072719. PMID 13463090.
- ^ A b "Bezpečnostní list materiálu Estrone" (PDF). ScienceLab.com. Citováno 21. února 2013.
- ^ „Estrone -PubChem“. Národní centrum pro biotechnologické informace. Citováno 6. září 2009.
- ^ „Drugs @ FDA: FDA Approved Drug Products“.
- ^ A b Vern L. Bullough (19. května 1995). Science in the Bedroom: A History of Sex Research. Základní knihy. str. 128–. ISBN 978-0-465-07259-0.
Když se Allen a Doisy dozvěděli o [Ascheim-Zondekově testu na diagnostiku těhotenství], uvědomili si, že v moči je bohatý a snadno ovladatelný zdroj hormonů, ze kterého mohou vyvinout silný extrakt. [...] Výzkum Allena a Doisyho sponzoroval výbor, zatímco výzkum jejich hlavního rivala Adolta Butenandta (nar. 1903) z univerzity v Gottingenu sponzorovala německá farmaceutická firma. V roce 1929 oba termíny oznámily izolaci ženského pohlavního hormonu čistého krystalu, estronu, v roce 1929, ačkoli Doisy a Allen tak učinily o dva měsíce dříve než Butenandt.27 V roce 1931 byl estron v této zemi komerčně vyráběn společností Parke Davis a Schering-Kahlbaum v Německu. Je zajímavé, že když Butenandt (který v roce 1939 sdílel Nobelovu cenu za chemii) izoloval estron a analyzoval jeho strukturu, zjistil, že jde o steroid, první hormon zařazený do této molekulární rodiny.
- ^ Nielsch U, Fuhrmann U, Jaroch S (30. března 2016). Nové přístupy k objevování drog. Springer. str. 7–. ISBN 978-3-319-28914-4.
První steroidní hormon byl izolován z moči těhotných žen Adolfem Butenandtem v roce 1929 (estron; viz obr. 1) (Butenandt 1931).
- ^ A b C Fritz F. Parl (2000). Estrogeny, estrogenový receptor a rakovina prsu. IOS Press. s. 4–5. ISBN 978-0-9673355-4-4.
[Doisy] zaměřil svůj výzkum na izolaci ženských pohlavních hormonů ze stovek galonů lidské těhotenské moči na základě zjištění Ascheima a Zondecka v roce 1927, že moč těhotných žen má estrogenní aktivitu [9]. V létě roku 1929 se Doisy podařilo izolovat estron (pojmenovaný jím theelin), současně s Adolfem Butenandtem z německé univerzity v Gottingenu, ale nezávisle na něm. Doisy představil své výsledky krystalizace estronu na XIII. Mezinárodním fyziologickém kongresu v Bostonu v srpnu 1929 [10].
- ^ A b C d James K. Laylin (30. října 1993). Laureáti Nobelovy ceny za chemii, 1901–1992. Nadace chemického dědictví. str. 255–. ISBN 978-0-8412-2690-6.
Adolt Friedrich Johann Butenandt získal Nobelovu cenu za chemii v roce 1939 „za práci o pohlavních hormonech“; [...] V roce 1929 izoloval Butenandt estron [...] v čisté krystalické formě. [...] Butenandt i Edward Doisy izolovali estron současně, ale nezávisle v roce 1929. [...] Butenandt udělal velký krok vpřed v historii biochemie, když izoloval estron z moči těhotných žen. [...] Ve své první publikaci jej pojmenoval „progynon“ a poté „folikulin“, [...] Do roku 1932 [...] mohl určit jeho chemickou strukturu, [...]
- ^ A b Arthur Greenberg (14. května 2014). Chemistry: Decade by Decade. Publikování na Infobase. str. 127–. ISBN 978-1-4381-0978-7.
Racionální chemické studie lidských pohlavních hormonů začaly v roce 1929 izolací čistého krystalického estronu, folikulárního hormonu, z moči těhotných žen, kterou provedl Adolph Butenandt. [...] Butenandt a Ruzicka sdíleli Nobelovu cenu za chemii z roku 1939.
- ^ A. Labhart (6. prosince 2012). Klinická endokrinologie: teorie a praxe. Springer Science & Business Media. str. 511–. ISBN 978-3-642-96158-8.
E. A. Doisy a A. Butenandt uváděli téměř současně izolaci estrogenově účinné látky v krystalické formě z moči těhotných žen. N. K. Adam navrhl, aby tato látka byla pojmenována estron kvůli přítomné C-17-ketonové skupině (1933).
- ^ Thom Rooke (1. ledna 2012). Pátrání po kortizonu. Stiskněte MSU. str. 54–. ISBN 978-1-60917-326-5.
V roce 1929 byl Doisy izolován a purifikován první estrogen, steroid zvaný „estron“; později za tuto práci získal Nobelovu cenu.
- ^ D. Lynn Loriaux (23. února 2016). Biografická historie endokrinologie. Wiley. str. 345–. ISBN 978-1-119-20247-9.
- ^ Campbell, A. D. (1933). „Ohledně placentárních hormonů a poruch menstruace“. Annals of Internal Medicine. 7 (3): 330. doi:10.7326/0003-4819-7-3-330. ISSN 0003-4819.
- ^ Fluhmann CF (listopad 1938). „Estrogenní hormony: jejich klinické využití“. Kalifornie a západní medicína. 49 (5): 362–6. PMC 1659459. PMID 18744783.
- ^ Fritz MA, Speroff L (28. března 2012). Klinická gynekologická endokrinologie a neplodnost. Lippincott Williams & Wilkins. str. 750–. ISBN 978-1-4511-4847-3.
V roce 1926 vytvořili Sir Alan S. Parkes a C.W Bellerby základní slovo „estrin“ k označení hormonu nebo hormonů, které u zvířat indukují říje, tedy v době, kdy jsou samice savců plodné a vnímavé k mužům. [...] Terminologie byla rozšířena o hlavní estrogeny u lidí, estron, estradiol a estriol, v roce 1932 na prvním zasedání Mezinárodní konference o standardizaci pohlavních hormonů v Londýně, [...]
- ^ A b Oettel M, Schillinger E (6. prosince 2012). Estrogeny a antiestrogeny I: Fyziologie a mechanismy působení estrogenů a antiestrogenů. Springer Science & Business Media. s. 2–. ISBN 978-3-642-58616-3.
Strukturu estrogenních hormonů stanovili Butenandt, Thayer, Marrian a Hazlewood v letech 1930 a 1931 (viz Butenandt 1980). V návaznosti na návrh skupiny Marrian dostaly estrogenní hormony triviální názvy estradiol, estron a estriol. Na prvním zasedání Mezinárodní konference o standardizaci pohlavních hormonů v Londýně (1932) byla zavedena standardní příprava estronu. [...] Částečnou syntézu estradiolu a estronu z cholesterolu a dehydroepiandrosteronu dosáhli Inhoffen a Howleg (Berlin 1940); úplnou syntézu dosáhli Anner a Miescher (Basel, 1948).
- ^ A b Elizabeth Siegel Watkins (6. března 2007). Estrogenový elixír: Historie hormonální substituční terapie v Americe. JHU Stiskněte. str. 21–. ISBN 978-0-8018-8602-7.
- ^ Gregory Pincus; Thimann Kenneth Vivian Pincus Gregory (2. prosince 2012). Hormony V1: Fyziologie, chemie a aplikace. Elsevier. str. 360–. ISBN 978-0-323-14206-9.


