MMP1 - MMP1
Matricová metaloproteináza-1 (MMP-1) také známý jako intersticiální kolagenáza a fibroblastová kolagenáza je enzym že u lidí je kódován MMP1 gen.[5][6][7] Tento gen je součástí shluku genů MMP, které se lokalizují do chromozomu 11q22.3.[5] MMP-1 byla první kolagenáza obratlovců, která byla purifikována do homogenity jako protein a klonována jako cDNA.[8][9]
Strukturální prvky
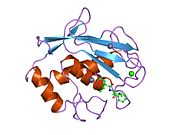
MMP-1 má archetypální strukturu skládající se z pre-domény, pro-domény, katalytické domény, spojovací oblasti a hemopexin podobná doména.[10] Primární struktura MMP-1 byla poprvé publikována Goldbergem, G I, et al.[9] V současné době se používají dvě hlavní nomenklatury pro primární strukturu, původní, ze které první aminokyselina začíná signálním peptidem a druhá, kde první aminokyselina začíná počítat z prodomény (názvosloví proenzymu).
Katalytická doména
Katalytické domény MMP mají velmi podobné vlastnosti a mají obecný tvar zploštělého elipsoidu o průměru ~ 40 Á.[11] Navzdory podobnosti katalytických domén MMP se tato položka zaměří pouze na strukturální vlastnosti katalytické domény MMP-1.
Celkové strukturální charakteristiky
Katalytická doména MMP-1 se skládá z pěti vysoce zkroucených β-řetězců (sI-sV), tří α-šroubovice (hA-hC) a celkem osmi smyček, které obklopují celkem pět kovových iontů, tři Ca2+ a dva Zn2+, z nichž jeden má katalytickou roli.[12]
Katalytická doména (CAT) MMP-1 začíná F100 (nezkrácená CAT) jako první aminokyselina N-koncové smyčky domény CAT. První publikovaná rentgenová struktura domény CAT představovala zkrácenou formu této domény, kde prvních 7 aminokyselin není přítomno.[12]
Po počáteční smyčce následují sekvence k prvnímu a nejdelšímu β-listu (sI). Druhá smyčka předchází velkou „amfipatickou α-šroubovici“ (hA), která podélně překlenuje proteinové místo. Následují β-řetězce sII a sIII oddělené příslušnými smyčkami, přičemž smyčka 4 je běžně označována jako „krátká smyčka“ přemosťující sII na sIII. Po řetězci sIII se sekvence setkává s „dvojitou smyčkou ve tvaru písmene S“, která má primární význam pro peptidovou strukturu a katalytickou aktivitu (viz dále), protože sahá až k „rozštěpení“ rozštěpené strany a pokračuje k jedinému antiparalelnímu β-řetězci sIV, který má zásadní význam pro vazbu peptidových substrátů nebo inhibitorů vytvořením hlavního řetězce vodíková vazba. Po sIV jsou smyčka Gln186-Gly192 a p-vlákno sV odpovědné za přispění mnoha ligandů k několika kovovým iontům přítomným v proteinu (čtěte dále). Po sV následuje velká otevřená smyčka, která se ukázala jako důležitá pro specificitu substrátu v rodině MMP.[13] Specifická oblast (183) RWTNNFREY (191) byla identifikována jako kritický segment matricové metaloproteinázy 1 pro expresi kolagenolytické aktivity.[14] Na C-koncové části CAT domény hB α-šroubovice, známá jako „spirála aktivního místa“, zahrnuje část „konsensuální sekvence vázající zinek“ HEXXHXXGXXH, která je charakteristická pro Nadrodina metzincinu.[15][16] Α-helix hB končí náhle na Gly225, kde začíná poslední smyčka domény. Tato poslední smyčka obsahuje „smyčku specifičnosti“, která je nejkratší v rodině MMP. Katalytická doména končí na Gly261 s α-helix hC.
Funkce
MMP podílejí se na rozpadu extracelulární matrix v normálních fyziologických procesech, jako je embryonální vývoj, reprodukce a remodelace tkání, stejně jako v chorobných procesech, jako je artritida a metastázy. Konkrétně MMP-1 rozbíjí vsunutou reklamu kolageny, typy I, II a III.
 Indukce matrixové metaloproteinázy 1 in krysa rohovky ciprofloxacin, ofloxacinu a levofloxacin (b, c, d) ve srovnání s umělé slzy (A). Reviglio a kol., 2003. |
Nařízení
Mechanická síla může zvýšit expresi MMP1 v lidských parodontálních vazivových buňkách.[17]
Interakce
MMP1 bylo prokázáno komunikovat s CD49b.[18][19]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000196611 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000043089 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b EntrezGene 4312
- ^ Brinckerhoff CE, Ruby PL, Austin SD, Fini ME, White HD (únor 1987). „Molekulární klonování lidské synoviální buněčné kolagenázy a výběr jediného genu z genomové DNA“. J. Clin. Investovat. 79 (2): 542–6. doi:10.1172 / JCI112845. PMC 424122. PMID 3027129.
- ^ Pendás AM, Santamaría I, Alvarez MV, Pritchard M, López-Otín C (říjen 1996). "Jemné fyzické mapování genů metaloproteinázy lidské matrice seskupených na chromozomu 11q22.3". Genomika. 37 (2): 266–8. doi:10.1006 / geno.1996.0557. PMID 8921407.
- ^ Gross J, Lapiere CM (červen 1962). „Kolagenolytická aktivita v tkáních obojživelníků: test tkáňové kultury“. Proc. Natl. Acad. Sci. USA. 48 (6): 1014–22. doi:10.1073 / pnas.48.6.1014. PMC 220898. PMID 13902219.
- ^ A b Goldberg GI, Wilhelm SM, Kronberger A, Bauer EA, Grant GA, Eisen AZ (květen 1986). "Lidská fibroblastová kolagenáza. Kompletní primární struktura a homologie s krysím proteinem indukovaným transformací onkogenu". J. Biol. Chem. 261 (14): 6600–5. PMID 3009463.
- ^ Li J, Brick P, O'Hare MC, Skarzynski T, Lloyd LF, Curry VA, Clark IM, Bigg HF, Hazleman BL, Cawston TE (červen 1995). „Struktura prasečí synoviální kolagenázy o plné délce odhaluje C-koncovou doménu obsahující čtyřlistou beta-vrtuli spojenou s vápníkem“. Struktura. 3 (6): 541–9. doi:10.1016 / S0969-2126 (01) 00188-5. PMID 8590015.
- ^ Tallant C, Marrero A, Gomis-Rüth FX (leden 2010). „Matricové metaloproteinázy: složení a funkce jejich katalytických domén“. Biochim. Biophys. Acta. 1803 (1): 20–8. doi:10.1016 / j.bbamcr.2009.04.003. PMID 19374923.
- ^ A b Spurlino JC, Smallwood AM, Carlton DD, Banks TM, Vavra KJ, Johnson JS, Cook ER, Falvo J, Wahl RC, Pulvino TA (červen 1994). "1.56 Struktura zralé zkrácené lidské fibroblastové kolagenázy". Proteiny. 19 (2): 98–109. doi:10,1002 / prot. 340190203. PMID 8090713. S2CID 23973090.
- ^ Maskos K, Bode W (listopad 2003). "Strukturní základ matricových metaloproteináz a tkáňových inhibitorů metaloproteináz". Mol. Biotechnol. 25 (3): 241–66. doi:10,1385 / MB: 25: 3: 241. PMID 14668538. S2CID 24110599.
- ^ Chung L, Shimokawa K, Dinakarpandian D, Grams F, Fields GB, Nagase H (září 2000). „Identifikace oblasti (183) RWTNNFREY (191) jako kritického segmentu matricové metaloproteinázy 1 pro expresi kolagenolytické aktivity“. J. Biol. Chem. 275 (38): 29610–7. doi:10,1074 / jbc.M004039200. PMID 10871619.
- ^ Bode W, Gomis-Rüth FX, Stöckler W (září 1993). „Astaciny, serralysiny, hadí jed a metaloproteinázy matrice vykazují identické prostředí vázající zinek (HEXXHXXGXXH a Met-turn) a topologie a měly by být seskupeny do společné rodiny, metzinciny'". FEBS Lett. 331 (1–2): 134–40. doi:10.1016 / 0014-5793 (93) 80312-I. PMID 8405391. S2CID 27244239.
- ^ Stöcker W, Grams F, Baumann U, Reinemer P, Gomis-Rüth FX, McKay DB, Bode W (květen 1995). „Metzinciny - topologické a sekvenční vztahy mezi astaciny, adamalysiny, serralysiny a matrixiny (kolagenázy) definují nadrodinu peptidů zinku“. Protein Sci. 4 (5): 823–40. doi:10.1002 / pro.5560040502. PMC 2143131. PMID 7663339.
- ^ Huang SF, Li YH, Ren YJ, Cao ZG, Long X (srpen 2008). "Účinek polymorfismu jednoho nukleotidu v promotoru matricové metaloproteinázy-1 (MMP-1) na silou indukovanou expresi MMP-1 v lidských parodontálních vazivových buňkách". Eur. J. Oral Sci. 116 (4): 319–23. doi:10.1111 / j.1600-0722.2008.00552.x. PMID 18705799.
- ^ Stricker TP, Dumin JA, Dickeson SK, Chung L, Nagase H, Parks WC, Santoro SA (srpen 2001). „Strukturní analýza interakce domény alfa (2) integrin I / prokolagenáza-1 (matrix metaloproteináza-1)“. J. Biol. Chem. 276 (31): 29375–81. doi:10,1074 / jbc.M102217200. PMID 11359774.
- ^ Dumin JA, Dickeson SK, Stricker TP, Bhattacharyya-Pakrasi M, Roby JD, Santoro SA, Parks WC (srpen 2001). „Pro-kolagenáza-1 (matrix metaloproteináza-1) váže alfa (2) beta (1) integrin po uvolnění z keratinocytů migrujících na kolagen typu I“. J. Biol. Chem. 276 (31): 29368–74. doi:10,1074 / jbc.M104179200. PMID 11359786.
Další čtení
- Krane SM (1995). „Je kolagenáza (matrix metaloproteináza-1) nezbytná pro přestavbu kostí a jiných pojivových tkání?“. Clin. Orthop. Relat. Res. (313): 47–53. PMID 7641497.
- Massova I, Kotra LP, Fridman R, Mobashery S (1998). "Maticové metaloproteinázy: struktury, evoluce a diverzifikace". FASEB J. 12 (25n26): 1075–95. CiteSeerX 10.1.1.31.3959. doi:10.1142 / S0217984998001256. PMID 9737711.
- Nagase H, Woessner JF (1999). "Matricové metaloproteinázy". J. Biol. Chem. 274 (31): 21491–4. doi:10.1074 / jbc.274.31.21491. PMID 10419448.
- Okada Y, Hashimoto G (2001). "[Degradace extracelulární matrix matricovými metaloproteinázami a destrukcí kloubů]". Seikagaku. 73 (11): 1309–21. PMID 11831026.
- Seiki M (2003). „Matricová metaloproteináza typu 1 membrány: klíčový enzym pro invazi nádoru“. Cancer Lett. 194 (1): 1–11. doi:10.1016 / S0304-3835 (02) 00699-7. PMID 12706853.
- Golubkov VS, Strongin AY (2007). „Proteolýzou řízená onkogeneze“. Buněčný cyklus. 6 (2): 147–50. doi:10,4161 / cc.6.2.3706. PMID 17245132.
externí odkazy
- The MEROPS online databáze peptidáz a jejich inhibitorů: M10.001
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P03956 (Intersticiální kolagenáza) na PDBe-KB.