Katalytická triáda - Catalytic triad

A katalytická triáda je sada tří koordinovaných aminokyseliny které lze najít v Aktivní stránky některých enzymy.[1][2] Katalytické triády se nejčastěji vyskytují v hydroláza a transferáza enzymy (např. proteázy, amidázy, esterázy, acylázy, lipázy a β-laktamázy ). An Kyselina -Základna -Nukleofil triáda je běžný motiv pro generování nukleofilního zbytku pro kovalentní katalýza. The zbytky vytvoří síť nabíjecího relé k polarizaci a aktivaci nukleofilu, který útočí na Podklad, tvořící a kovalentní meziprodukt, který je pak hydrolyzovaný uvolnit produkt a regenerovat volný enzym. Nukleofil je nejčastěji a serin nebo cystein aminokyselina, ale občas threonin nebo dokonce selenocystein. The 3D struktura enzymu spojuje zbytky triády v přesné orientaci, i když mohou být v sekvenci daleko od sebe (primární struktura ).[3]
Stejně jako odlišná evoluce funkce (a dokonce i nukleofil triády), katalytické triády ukazují některé z nejlepších příkladů konvergentní evoluce. Chemická omezení katalýzy vedla k tomu, že se stejné katalytické řešení vyvíjí nezávisle v nejméně 23 samostatných superrodiny.[2] Jejich mechanismus účinku je následně jedním z nejlépe studovaných v biochemie.[4][5]
Dějiny
Enzymy trypsin a chymotrypsin byly poprvé vyčištěny ve 30. letech 20. století.[6] Serin v každém z trypsinu a chymotrypsinu byl identifikován jako katalytický nukleofil (podle diisopropyl fluorofosfát modifikace) v 50. letech.[7] Struktura chymotrypsinu byla vyřešena Rentgenová krystalografie v 60. letech, ukazující orientaci katalytické triády v aktivním místě.[8] Ostatní proteázy byly sekvenovány a srovnány, aby odhalily rodinu souvisejících proteáz,[9][10][11] nyní nazývá rodina S1. Současně struktury evolučně nesouvisející papain a subtilisin Bylo zjištěno, že proteázy obsahují analogické triády. Mechanismus „přenosu náboje“ pro aktivaci nukleofilu ostatními členy triády byl navržen koncem šedesátých let.[12] Jak více proteázových struktur bylo vyřešeno Rentgenová krystalografie v 70. a 80. letech, homologní (jako TEV proteáza ) a byly nalezeny analogické (například papainové) triády.[13][14][15] The MEROPS klasifikační systém v 90. a 2000 letech začal třídit proteázy na strukturálně související enzym superrodiny a funguje jako databáze konvergentního vývoje triád ve více než 20 superrodinách.[16][17] Pochopení toho, jak chemická omezení evoluce vedla ke konvergenci tolika rodin enzymů ke stejné triádě geometrie se vyvinula v roce 2010.[2]
Od jejich počátečního objevu se stále více podrobně zkoumá jejich přesný katalytický mechanismus. Obzvláště v 90. a 90. letech 20. století bylo sporné, zda vodíkové vazby s nízkou bariérou přispěl ke katalýze,[18][19][20] nebo zda obyčejný vodíkové vazby je dostatečný k vysvětlení mechanismu.[21][22] Masivní část práce na kovalentní katalýze nábojového relé používaná katalytickými triádami vedla k tomu, že mechanismus je nejlépe charakterizován ve všech biochemiích.[4][5][21]
Funkce
Enzymy, které obsahují katalytickou triádu, ji používají pro jeden ze dvou typů reakcí: buď na rozdělit substrát (hydrolázy ) nebo přenést jednu část substrátu na druhý substrát (transferázy ). Triády jsou vzájemně závislá sada reziduí v Aktivní stránky enzymu a působí ve shodě s jinými zbytky (např. vazebné místo a oxyanionový otvor ) dosáhnout nukleofilní katalýza. Tyto zbytky triády působí společně a vytvářejí nukleofil člen velmi reaktivní, generování kovalentního meziproduktu se substrátem, který je poté rozdělen k dokončení katalýzy.
Mechanismus
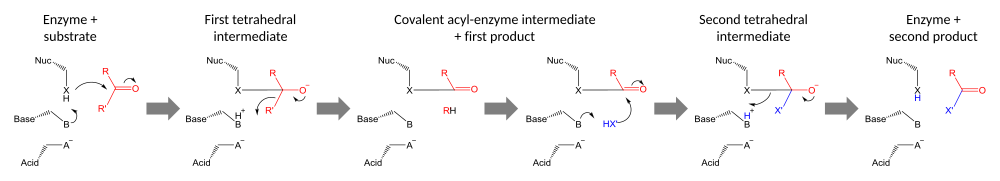
Katalytické triády fungují kovalentní katalýza za použití zbytku jako nukleofilu. Reaktivita nukleofilního zbytku se zvyšuje o funkční skupiny ostatních členů triády. Nukleofil je polarizován a orientován bází, která je sama vázána a stabilizována kyselinou.
Katalýza se provádí ve dvou fázích. Nejprve aktivovaný nukleofil zaútočí na karbonyl uhlík a nutí karbonylový kyslík přijmout elektron, což vede k čtyřboké středně pokročilí. Nahromadění záporného náboje na tomto meziproduktu je obvykle stabilizováno pomocí oxyanionový otvor v rámci aktivního webu. Meziprodukt se poté zhroutí zpět na karbonylovou skupinu, přičemž vyvrhne první polovinu substrátu, ale druhou polovinu ponechá stále kovalentně navázanou na enzym jako acyl-enzymový meziprodukt. Nejprve vysunutí opouštějící skupina je často podporováno darováním protonu základnou.
Druhým stupněm katalýzy je štěpení acyl-enzymového meziproduktu útokem druhého substrátu. Pokud je tímto substrátem voda, výsledkem je hydrolýza; pokud se jedná o organickou molekulu, výsledkem je přenos této molekuly na první substrát. Útok tímto druhým substrátem vytvoří nový čtyřboký meziprodukt, který se vyřeší vysunutím nukleofilu enzymu, uvolní druhý produkt a regeneruje volný enzym.[23]
Totožnost členů triády

Nukleofil
Postranní řetězec nukleofilního zbytku provádí kovalentní katalýzu na Podklad. The osamělý pár elektronů přítomných na kyslíku nebo síře útočí na elektropozitiv karbonyl uhlík.[3] 20 přirozeně se vyskytující biologické aminokyseliny neobsahují dostatečně nukleofilní funkční skupiny pro mnoho obtížných katalytické reakce. Vložení nukleofilu do triády zvyšuje jeho reaktivitu pro účinnou katalýzu. Nejčastěji používanými nukleofily jsou hydroxyl (OH) serinu a thiol / thiolátový ion (SH / S−) cysteinu.[2] Alternativně, threoninové proteázy použijte sekundární hydroxylová skupina threoninu, avšak kvůli sterická překážka doplňku bočního řetězu methylová skupina takové proteázy používají své N-terminál amid jako báze, spíše než samostatná aminokyselina.[1][24]
Použití kyslíku nebo síry jako nukleofilního atomu způsobuje malé rozdíly v katalýze. Ve srovnání s kyslík, síra je navíc d orbitální zvětšuje (o 0,4 Å)[25] a měkčí, umožňuje mu vytvářet delší vazby (dC-X adX-H 1,3krát) a dává mu nižší pK.A (o 5 jednotek).[26] Serin je proto více než cystein závislý na optimální orientaci členů acidobazické triády, aby snížil její pK.A[26] za účelem dosažení společného jednání deprotonace s katalýzou.[2] Nízká strK.A cysteinu pracuje v jeho nevýhodě při řešení prvního čtyřboký meziprodukt protože neproduktivní obrácení původního nukleofilního útoku je příznivější produkt rozpadu.[2] Základna triády je proto přednostně orientována na protonovat amid odstupující skupiny, aby se zajistilo, že je vypuzen, aby opustil enzym síru kovalentně navázaný na N-konec substrátu. Nakonec rozlišení acyl-enzymu (k uvolnění substrátu na C-konci) vyžaduje, aby byl serin znovu protonován, zatímco cystein může odcházet jako S−. Stericky, síra cysteinu také tvoří delší vazby a má objemnější poloměr van der Waals[2] a pokud zmutovaný serin může být zachycen v neproduktivní orientaci v aktivním místě.[25]
Velmi zřídka selen atom neobvyklé aminokyseliny selenocystein se používá jako nukleofil.[27] Deprotonovaná Se− stát je silně upřednostňován v katalytické triádě.[27]
Základna
Vzhledem k tomu, že žádné přirozené aminokyseliny nejsou silně nukleofilní, je báze v katalytické triádě polarizuje a deprotonuje nukleofil ke zvýšení jeho reaktivity.[3] Navíc protonuje první produkt na podporu odchodu ze skupiny.
Základem je nejčastěji histidin, protože jeho pK.A umožňuje účinnou bazickou katalýzu, vodíkovou vazbu na kyselý zbytek a deprotonaci nukleofilního zbytku.[1] β-laktamázy jako TEM-1 použijte a lysin zbytek jako báze. Protože lysinová strK.A je tak vysoká (strK.A= 11), glutamát a několik dalších zbytků působí jako kyselina ke stabilizaci deprotonovaného stavu během katalytického cyklu.[28][29] Threoninové proteázy používají své N-terminální amid jako báze, protože sterické shlukování methylem katalytického threoninu brání tomu, aby ostatní zbytky byly dostatečně blízko.[30][31]
Kyselina
Kyselý člen triády tvoří vodíkovou vazbu s bazickým zbytkem. To vyrovná základní zbytek omezením jeho rotace postranního řetězce a polarizuje ho stabilizací jeho kladného náboje.[3] Dvě aminokyseliny jsou kyselé boční řetězy při fyziologickém pH (aspartát nebo glutamát) a tak se pro tento triádový člen nejčastěji používají.[3] Cytomegalovirus proteáza[b] používá pár histidinů, jeden jako báze, jako obvykle, a jeden jako kyselina.[1] Druhý histidin není tak účinný jako kyselina jako běžnější aspartát nebo glutamát, což vede k nižší katalytické účinnosti. V některých enzymech je kyselý člen triády méně nezbytný a některé působí pouze jako dyad. Například, papain[C] používá asparagin jako jeho třetí člen triády, který orientuje histidinový základ, ale nepůsobí jako kyselina. Podobně, žloutenka typu A virová proteáza[d] obsahuje objednanou vodu v poloze, kde by měl být kyselý zbytek.
Příklady triád

Ser-His-Asp
Motiv serin-histidin-aspartát je jedním z nejdůkladněji charakterizovaných katalytických motivů v biochemii.[3] Příkladem triády je chymotrypsin,[E] modelová serinová proteáza z PA nadčeleď který používá svou triádu k hydrolýze proteinových páteří. Aspartát je vodíkově vázán k histidinu, čímž zvyšuje pK.A jeho imidazolového dusíku od 7 do přibližně 12. To umožňuje histidinu působit jako silná obecná báze a aktivovat serinový nukleofil. Má také oxyanionový otvor skládající se z několika amidů páteře, které stabilizují hromadění náboje na meziproduktech. Histidinová báze pomáhá první odcházející skupině darováním protonu a také aktivuje hydrolytický vodní substrát abstrahováním protonu jako zbývajícího OH− napadá meziprodukt acyl-enzym.
Stejná triáda se také sbližovala α / β hydrolázy jako někteří lipázy a esterázy, nicméně orientace členů triády je obrácen.[32][33] Navíc mozek acetylhydroláza (který má stejný záhyb jako malý G-protein ) bylo také zjištěno, že má tuto triádu. Ekvivalentní Ser-His-Glu triáda se používá v acetylcholinesteráza.
Cys-His-Asp
Druhou nejvíce studovanou triádou je motiv cystein-histidin-aspartát.[2] Několik rodin cysteinové proteázy použijte tuto sadu triád, například TEV proteázu[A] a papain.[C] Triáda působí podobně jako triády serinových proteáz, s několika významnými rozdíly. Kvůli nízkému obsahu cysteinuK.A, důležitost Asp pro katalýzu se liší a několik cysteinových proteáz je účinně Cys-His dyád (např. virus hepatitidy A. proteáza), zatímco u jiných je cystein již deprotonován před zahájením katalýzy (např. papain).[34] Tuto triádu používají také některé amidázy, jako např N-glykanáza hydrolyzovat nepeptidové vazby C-N.[35]
Ser-His-His
Triáda cytomegalovirus proteáza[b] používá histidin jako členy kyselé i bazické triády. Odstranění kyselého histidinu má za následek pouze 10násobnou ztrátu aktivity (ve srovnání s> 10 000násobkem, když je aspartát odstraněn z chymotrypsinu). Tato triáda byla interpretována jako možný způsob generování méně aktivního enzymu pro řízení rychlosti štěpení.[24]
Ser-Glu-Asp
Neobvyklá triáda se nachází v seldolisinových proteázách.[F] Nízká strK.A glutamátkarboxylátové skupiny znamená, že působí pouze jako báze v triádě při velmi nízkém pH. Předpokládá se, že triáda je přizpůsobování do konkrétních prostředí, jako je kyselé horké prameny (např. kumamolysin ) nebo buňka lysozom (např. tripeptidyl peptidáza ).[24]
Cys-His-Ser
The endoteliální proteáza vasohibin[G] používá cystein jako nukleofil, ale serin ke koordinaci histidinové báze.[36][37] Přestože je serin špatná kyselina, je stále účinný při orientaci histidinu v katalytické triádě.[36] Některé homology mají alternativně threonin místo serinu v kyselém místě.[36]
Thr-Nter, Ser-Nter a Cys-Nter
Threoninové proteázy, jako je proteazom proteázová podjednotka[h] a ornithin acyltransferázy[i] použít sekundární hydroxyl threoninu způsobem analogickým k použití serinu primární hydroxyl.[30][31] Avšak vzhledem ke sterické interferenci extra methylové skupiny threoninu je základním členem triády N-terminální amid, který polarizuje uspořádanou vodu, která zase deprotonuje katalytický hydroxyl ke zvýšení jeho reaktivity.[1][24] Podobně existují ekvivalentní konfigurace „pouze serin“ a „pouze cystein“, jako například penicilin acyláza G[j] a penicilin acyláza PROTI[k] které jsou evolučně příbuzné proteasomovým proteázám. Opět platí, že tyto používají své N-terminální amid jako základ.[24]
Ser-cisSer-Lys
Tato neobvyklá triáda se vyskytuje pouze v jedné nadrodině amidáz. V tomto případě působí lysin na polarizaci středního serinu.[38] Střední serin poté vytvoří dvě silné vodíkové vazby k nukleofilnímu serinu, aby jej aktivoval (jeden s hydroxylovým řetězcem postranního řetězce a druhý s amidem hlavního řetězce). Střední serin je držen neobvykle cis orientace pro usnadnění přesných kontaktů s dalšími dvěma zbytky triády. Triáda je dále neobvyklá v tom, že lysin a cis-serin působí jako báze při aktivaci katalytického serinu, ale stejný lysin také plní úlohu kyselého člena a navazuje klíčové strukturní kontakty.[38][39]
Sec-His-Glu
Vzácná, ale přirozeně se vyskytující aminokyselina selenocystein (Sec), lze také nalézt jako nukleofil v některých katalytických triádách.[27] Selenocystein je podobný cysteinu, ale obsahuje a selen atom místo síry. Příklad je na aktivním webu thioredoxin reduktáza, který používá selen k redukci disulfidu v thioredoxinu.[27]
Upravené triády
Kromě přirozeně se vyskytujících typů katalytických triád proteinové inženýrství byl použit k vytvoření enzymových variant s nepůvodními aminokyselinami nebo zcela syntetickými aminokyselinami.[40] Katalytické triády byly také vloženy do jinak nekatalytických proteinů nebo proteinových napodobenin.
Subtilisin (serinová proteáza) má svůj kyslíkový nukleofil nahrazen každým ze síry,[41][42] selen,[43] nebo telur.[44] Cystein a selenocystein byly vloženy pomocí mutageneze vzhledem k tomu, že nepřirozená aminokyselina, telurocystein, byl vložen pomocí auxotrofní buňky krmena syntetickým telurocysteinem. Tyto prvky jsou všechny v 16 sloupec periodické tabulky (chalkogeny ), takže mají podobné vlastnosti.[45][46] V každém případě změna nukleofilu snížila aktivitu proteázy enzymu, ale zvýšila jinou aktivitu. Nukleofil síry zlepšil enzymy transferáza aktivita (někdy nazývaná subtiligáza). Nukleofily selenu a telluru přeměnily enzym na oxidoreduktáza.[43][44] Když byl nukleofil proteázy TEV převeden z cysteinu na serin, byla aktivita proteázy silně snížena, ale mohla být obnovena řízená evoluce.[47]
Jako lešení byly použity nekatalytické proteiny, do kterých byly vloženy katalytické triády, které byly poté vylepšeny přímou evolucí. Triáda Ser-His-Asp byla vložena do protilátky,[48] stejně jako řada dalších proteinů.[49] Podobně byly vytvořeny napodobeniny katalytické triády malé organické molekuly jako diaryl diselenid,[50][51] a zobrazeny na větších polymerech jako Merrifieldovy pryskyřice,[52] a samo-sestavující krátký peptid nanostruktury.[53]
Odlišný vývoj
Sofistikovanost sítě aktivních míst způsobuje, že zbytky podílející se na katalýze (a zbytky v kontaktu s nimi) jsou vysoce evolučně konzervované.[54] Existují však příklady odlišného vývoje v katalytických triádách, jak při katalyzované reakci, tak při zbytcích použitých při katalýze. Triáda zůstává jádrem aktivního místa, ale je evoluční přizpůsobeno sloužit různým funkcím.[55][56] Některé proteiny, tzv pseudoenzymy, mají nekatalytické funkce (např. regulaci inhibiční vazbou) a nahromadily mutace, které inaktivují jejich katalytickou triádu.[57]
Reakční změny
Katalytické triády fungují kovalentní katalýza přes meziprodukt acyl-enzym. Pokud se tento meziprodukt rozdělí vodou, výsledkem je hydrolýza substrátu. Pokud je však meziprodukt vyřešen útokem druhého substrátu, působí enzym jako a transferáza. Například útok pomocí acyl skupina má za následek acyltransferáza reakce. Několik rodin enzymů transferázy se vyvinulo z hydroláz adaptací, aby se vyloučila voda a upřednostnil útok druhého substrátu.[58] V různých členech nadrodiny α / β-hydrolázy je triáda Ser-His-Asp vyladěna okolními zbytky tak, aby provedla alespoň 17 různých reakcí.[33][59] Některé z těchto reakcí jsou také dosaženy mechanismy, které změnily tvorbu nebo štěpení meziproduktu acyl-enzym, nebo které neprobíhají přes meziprodukt acyl-enzym.[33]
Navíc byl vyvinut alternativní mechanismus transferázy amidofosforibosyltransferázy, který má dvě aktivní stránky.[l] V prvním aktivním místě cysteinová triáda hydrolyzuje a glutamin substrát k uvolnění volného amoniaku. Amoniak pak difunduje skrz vnitřní tunel v enzymu do druhého aktivního místa, kde je přenesen do druhého substrátu.[60][61]
Změny nukleofilů

Odlišný vývoj aktivních zbytků místa je pomalý kvůli silným chemickým omezením. Nějaká proteáza superrodiny se vyvinuly z jednoho nukleofilu do druhého. To lze odvodit, když nadrodina (se stejným složit ) obsahuje rodiny které používají různé nukleofily.[47] K takovýmto nukleofilním přepínačům došlo během evoluční historie několikrát, avšak mechanismy, kterými se to stalo, jsou stále nejasné.[17][47]
V superrodinách proteáz, které obsahují směs nukleofilů (např Klan PA ), rodiny jsou označeny jejich katalytickým nukleofilem (C = cysteinové proteázy, S = serinové proteázy).
| Nadčeleď | Rodiny | Příklady |
|---|---|---|
| Klan PA | C3, C4, C24, C30, C37, C62, C74, C99 | TEV proteáza (Virus tabáku ) |
| S1, S3, S6, S7, S29, S30, S31, S32, S39, S46, S55, S64, S65, S75 | Chymotrypsin (savci, např. Bos taurus ) | |
| PB klan | C44, C45, C59, C69, C89, C95 | Amidofosforibosyltransferáza předchůdce (Homo sapiens ) |
| S45, S63 | Penicilin G acyláza předchůdce (Escherichia coli ) | |
| T1, T2, T3, T6 | Archaeanský proteazom, beta složka (Thermoplasma acidophilum ) | |
| PC klan | C26, C56 | Gama-glutamylhydroláza (Rattus norvegicus ) |
| S51 | Dipeptidáza E (Escherichia coli ) | |
| Klan PD | C46 | Ježkový protein (Drosophila melanogaster ) |
| N9, N10, N11 | Intein -obsahující Protonová ATPáza typu V. katalytická podjednotka A (Saccharomyces cerevisiae ) | |
| PE klan | P1 | DmpA aminopeptidáza (Ochrobactrum anthropi ) |
| T5 | Ornithin acetyltransferáza předchůdce (Saccharomyces cerevisiae ) |
Pseudoenzymy
Další podtřída variant katalytické triády je pseudoenzymy, které mají triádové mutace, díky nimž jsou katalyticky neaktivní, ale schopné fungovat jako vazebné nebo strukturní proteiny.[63][64] Například heparin -vazebný protein Azurocidin je členem klanu PA, ale s glycinem místo nukleofilu a serinem místo histidinu.[65] Podobně, RHBDF1 je homolog rodiny S54 kosodélníkové proteázy s alaninem místo nukleofilního serinu.[66][67] V některých případech mohou mít pseudoenzymy stále intaktní katalytickou triádu, ale mutace ve zbytku proteinu odstraňují katalytickou aktivitu. Klan CA obsahuje katalyticky neaktivní členy s mutovanými triádami (kalpamodulin má lysin místo svého cysteinového nukleofilu) a s intaktními triádami, ale inaktivující mutace jinde (krysí testin si zachovává triádu Cys-His-Asn).[68]
| Nadčeleď | Rodiny obsahující pseudoenzymy | Příklady |
|---|---|---|
| Klan CA. | C1, C2, C19 | Kalpamodulin |
| CD klan | C14 | CFLAR |
| SC klan | S9, S33 | Neuroligin |
| SK klan | S14 | ClpR |
| SR klan | S60 | Serotransferinová doména 2 |
| Klan ST | S54 | RHBDF1 |
| Klan PA | S1 | Azurocidin 1 |
| PB klan | T1 | PSMB3 |
Konvergentní evoluce

The enzymologie proteáz poskytuje některé z nejjasnějších známých příkladů konvergentní evoluce. Stejné geometrické uspořádání zbytků triády se vyskytuje ve více než 20 samostatných enzymech superrodiny. Každá z těchto superrodin je výsledkem konvergentní evoluce pro stejné uspořádání triády v jiném strukturální záhyb. Je to proto, že existují omezené produktivní způsoby, jak uspořádat tři zbytky triády, hlavní řetězec enzymu a substrát. Tyto příklady odrážejí vnitřní chemická a fyzikální omezení enzymů, což vede k tomu, že evoluce opakovaně a nezávisle konverguje na ekvivalentních řešeních.[1][2]
Cysteinové a serinové hydrolázy
Stejné geometrie triády byly sbližovány serinovými proteázami, jako je chymotrypsin[E] a subtilisin superrodiny. Podobná konvergentní evoluce nastala u cysteinových proteáz, jako jsou virové C3 proteáza a papain[C] superrodiny. Tyto triády konvergovaly do téměř stejného uspořádání kvůli mechanickým podobnostem v cysteinových a serinových proteolytických mechanismech.[2]
Rodiny cysteinových proteáz
Rodiny serinových proteáz
| Nadčeleď | Rodiny | Příklady |
|---|---|---|
| SB | S8, S53 | Subtilisin (Bacillus licheniformis ) |
| SC | S9, S10, S15, S28, S33, S37 | Prolyl oligopeptidáza (Sus scrofa ) |
| SE | S11, S12, S13 | D-Ala-D-Ala peptidáza C (Escherichia coli ) |
| SF | S24, S26 | Signální peptidáza Já (Escherichia coli ) |
| SH | S21, S73, S77, S78, S80 | Cytomegalovirus assemblin (člověk herpesvirus 5) |
| SJ | S16, S50, S69 | Lon-A peptidáza (Escherichia coli ) |
| SK | S14, S41, S49 | Clp proteáza (Escherichia coli ) |
| TAK | S74 | Fágový GA-1 krční přívěsek CIMCD samolepicí protein (Fág Bacillus GA-1 ) |
| SP | S59 | Nucleoporin 145 (Homo sapiens ) |
| SR | S60 | Laktoferin (Homo sapiens ) |
| SS | S66 | Murein tetrapeptidáza LD-karboxypeptidáza (Pseudomonas aeruginosa ) |
| SVATÝ | S54 | Kosodélník -1 (Drosophila melanogaster ) |
| PA | S1, S3, S6, S7, S29, S30, S31, S32, S39, S46, S55, S64, S65, S75 | Chymotrypsin A (Bos taurus ) |
| PB | S45, S63 | Penicilin G acyláza předchůdce (Escherichia coli ) |
| PC | S51 | Dipeptidáza E (Escherichia coli ) |
| PE | P1 | DmpA aminopeptidáza (Ochrobactrum anthropi ) |
| Nepřiřazeno | S48, S62, S68, S71, S72, S79, S81 |
Threoninové proteázy
Threoninové proteázy používají jako svůj katalytický nukleofil aminokyselinu threonin. Na rozdíl od cysteinu a serinu je threonin sekundární hydroxyl (tj. Má methylovou skupinu). Tato methylová skupina značně omezuje možné orientace triády a substrátu, protože methylová skupina se střetává buď s páteří enzymu, nebo s histidinovou bází.[2] Když byl nukleofil serinové proteázy mutován na threonin, methyl obsadil směs pozic, z nichž většina zabránila vazbě substrátu.[69] V důsledku toho se na něm nachází katalytický zbytek threoninové proteázy N-minus.[2]
Dva evolučně nezávislé enzymové superrodiny je známo, že používají různé proteinové záhyby N-terminální zbytek jako nukleofil: nadčeleď PB (proteazomy využívající Ntn záhyb)[30] a nadčeleď PE (acetyltransferázy pomocí skládačky DOM)[31] Tato obecnost Aktivní stránky struktura ve zcela odlišných proteinových záhybech naznačuje, že aktivní místo se v těchto superrodinách vyvíjelo konvergentně.[2][24]
Rodiny threoninových proteáz
| Nadčeleď | Rodiny | Příklady |
|---|---|---|
| PB klan | T1, T2, T3, T6 | Archaeanský proteazom, beta složka (Thermoplasma acidophilum ) |
| PE klan | T5 | Ornitin acetyltransferáza (Saccharomyces cerevisiae ) |
Viz také
Reference
Poznámky
- ^ A b C d TEV proteáza MEROPS: klan PA, rodina C4
- ^ A b Cytomegalovirová proteáza MEROPS: klan SH, rodina S21
- ^ A b C d Papain MEROPS: klan CA, rodina C1
- ^ Proteáza viru hepatitidy A. MEROPS: klan PA, rodina C3
- ^ A b C Chymotrypsin MEROPS: klan PA, rodina S1
- ^ Seldolisinová proteáza MEROPS: klan SB, rodina 53
- ^ Vasohibinová proteáza MEROPS: klan CA
- ^ A b Proteazom MEROPS: klan PB, rodina T1
- ^ A b Ornithin acyltransferázy MEROPS: klan PE, rodina T5
- ^ Penicilin acyláza G. MEROPS: klan PB, rodina S45
- ^ Penicilin acyláza V. MEROPS: klan PB, rodina C59
- ^ amidofosforibosyltransferáza MEROPS: klan PB, rodina C44
- ^ Subtilisin MEROPS: klan SB, rodina S8
- ^ Prolyl oligopeptidáza MEROPS: klan SC, rodina S9
Citace
- ^ A b C d E F Dodson G, Wlodawer A (1998). "Katalytické triády a jejich příbuzní". Trends Biochem. Sci. 23 (9): 347–52. doi:10.1016 / S0968-0004 (98) 01254-7. PMID 9787641.
- ^ A b C d E F G h i j k l m Buller AR, Townsend CA (2013). „Vnitřní evoluční omezení struktury proteáz, acylace enzymů a identity katalytické triády“. Proc. Natl. Acad. Sci. USA 110 (8): E653–61. Bibcode:2013PNAS..110E.653B. doi:10.1073 / pnas.1221050110. PMC 3581919. PMID 23382230.
- ^ A b C d E F Stryer L, Berg JM, Tymoczko JL (2002). „9 katalytických strategií“. Biochemie (5. vydání). San Francisco: W.H. Freemane. ISBN 9780716749554.
- ^ A b Perutz M (1992). Struktura bílkovin. Nové přístupy k chorobám a terapii. New York: W.H. Freeman and Co. ISBN 9780716770213.
- ^ A b Neurath H (1994). "Proteolytické enzymy minulost a současnost: druhá zlatá éra. Vzpomínky, speciální sekce na počest Maxe Perutze". Protein Sci. 3 (10): 1734–9. doi:10.1002 / pro.5560031013. PMC 2142620. PMID 7849591.
- ^ Ohman KP, Hoffman A, Keizer HR (1990). "Endotelinem indukovaná vazokonstrikce a uvolňování atriálních natriuretických peptidů u krysy". Acta Physiol. Scand. 138 (4): 549–56. doi:10.1111 / j.1748-1716.1990.tb08883.x. PMID 2141214.
- ^ Dixon GH, Kauffman DL, Neurath H (1958). "Sekvence aminokyselin v oblasti vázání diisopropylfosforylu v dip-trypsinu". J. Am. Chem. Soc. 80 (5): 1260–1. doi:10.1021 / ja01538a059.
- ^ Matthews BW, Sigler PB, Henderson R a kol. (1967). "Trojrozměrná struktura tosyl-α-chymotrypsinu". Příroda. 214 (5089): 652–656. Bibcode:1967Natur.214..652M. doi:10.1038 / 214652a0. PMID 6049071.
- ^ Walsh KA, Neurath H (1964). „Trypsinogen a Chymotrypsinogen jako homologní proteiny“. Proc. Natl. Acad. Sci. USA 52 (4): 884–9. Bibcode:1964PNAS ... 52..884W. doi:10.1073 / pnas.52.4.884. PMC 300366. PMID 14224394.
- ^ de Haën C, Neurath H, Teller DC (1975). „Fylogeneze serinproteáz souvisejících s trypsinem a jejich zymogenů. Nové metody pro zkoumání vzdálených evolučních vztahů“. J. Mol. Biol. 92 (2): 225–59. doi:10.1016/0022-2836(75)90225-9. PMID 1142424.
- ^ Lesk AM, Fordham WD (1996). "Zachování a variabilita ve strukturách serinových proteináz rodiny chymotrypsinů". J. Mol. Biol. 258 (3): 501–37. doi:10.1006 / jmbi.1996.0264. PMID 8642605.
- ^ Blow DM, Birktoft JJ, Hartley BS (1969). "Role pohřbené kyselé skupiny v mechanismu působení chymotrypsinu". Příroda. 221 (5178): 337–40. Bibcode:1969 Natur.221..337B. doi:10.1038 / 221337a0. PMID 5764436.
- ^ Gorbalenya AE, Blinov VM, Donchenko AP (1986). „Poliovirusem kódovaná proteináza 3C: možná evoluční vazba mezi rodinami buněčných serinových a cysteinových proteináz“. FEBS Lett. 194 (2): 253–7. doi:10.1016/0014-5793(86)80095-3. PMID 3000829.
- ^ Bazan JF, Fletterick RJ (1988). „Virové cysteinové proteázy jsou homologní s rodinou serinových proteáz podobných trypsinu: strukturální a funkční důsledky“. Proc. Natl. Acad. Sci. USA 85 (21): 7872–6. Bibcode:1988PNAS ... 85.7872B. doi:10.1073 / pnas.85.21.7872. PMC 282299. PMID 3186696.
- ^ Phan J, Zdanov A, Evdokimov AG a kol. (2002). "Strukturální základ pro substrátovou specificitu proteázy viru tabáku etch". J. Biol. Chem. 277 (52): 50564–72. doi:10,1074 / jbc.M207224200. PMID 12377789.
- ^ Rawlings ND, Barrett AJ (1993). "Evoluční rodiny peptidáz". Biochem. J. 290 (1): 205–18. doi:10.1042 / bj2900205. PMC 1132403. PMID 8439290.
- ^ A b Rawlings ND, Barrett AJ, Bateman A (2010). "MEROPS: databáze peptidáz". Nucleic Acids Res. 38 (supl_1): D227–33. doi:10.1093 / nar / gkp971. PMC 2808883. PMID 19892822.
- ^ Frey PA, Whitt SA, Tobin JB (1994). „Vodíková vazba s nízkou bariérou v katalytické triádě serinových proteáz“. Věda. 264 (5167): 1927–30. Bibcode:1994Sci ... 264.1927F. doi:10.1126 / science.7661899. PMID 7661899.
- ^ Ash EL, Sudmeier JL, De Fabo EC a kol. (1997). „Vodíková vazba s nízkou bariérou v katalytické triádě serinových proteáz? Teorie versus experiment“. Věda. 278 (5340): 1128–32. Bibcode:1997Sci ... 278.1128A. doi:10.1126 / science.278.5340.1128. PMID 9353195.
- ^ Agback P, Agback T (2018). „Přímý důkaz vodíkové vazby s nízkou bariérou v katalytické triádě serinové proteázy“. Sci. Rep. 8 (1): 10078. Bibcode:2018NatSR ... 810078A. doi:10.1038 / s41598-018-28441-7. PMC 6031666. PMID 29973622.
- ^ A b Schutz CN, Warshel A (2004). „Návrh s nízkou bariérovou vodíkovou vazbou (LBHB) se vrátil: případ Asp ... Jeho páru v serinových proteázách“. Proteiny. 55 (3): 711–23. doi:10.1002 / prot.20096. PMID 15103633.
- ^ Warshel A, Papazyan A (1996). „Energetické úvahy ukazují, že vodíkové vazby s nízkou bariérou nenabízejí katalytickou výhodu oproti běžným vodíkovým vazbám.“. Proc. Natl. Acad. Sci. USA 93 (24): 13665–70. Bibcode:1996PNAS ... 9313665W. doi:10.1073 / pnas.93.24.13665. PMC 19385. PMID 8942991.
- ^ Shafee T (2014). Evoluční schopnost virové proteázy: experimentální vývoj katalýzy, robustnosti a specificity (Disertační práce). Univerzita v Cambridge. doi:10.17863 / CAM.16528.
- ^ A b C d E F Ekici OD, Paetzel M, Dalbey RE (2008). „Nekonvenční serinové proteázy: variace na katalytickou konfiguraci triády Ser / His / Asp“. Protein Sci. 17 (12): 2023–37. doi:10.1110 / ps.035436.108. PMC 2590910. PMID 18824507.
- ^ A b McGrath ME, Wilke ME, Higaki JN a kol. (1989). "Krystalové struktury dvou vytvořených thiolových trypsinů". Biochemie. 28 (24): 9264–70. doi:10.1021 / bi00450a005. PMID 2611228.
- ^ A b Polgár L, Asbóth B (1986). „Základní rozdíl v katalýzách serinovými a cysteinovými proteinázami spočívá ve stabilizaci náboje v přechodném stavu“. J. Theor. Biol. 121 (3): 323–6. doi:10.1016 / s0022-5193 (86) 80111-4. PMID 3540454.
- ^ A b C d Brandt W, Wessjohann LA (2005). „Funkční role selenocysteinu (Sec) v katalytickém mechanismu velkých thioredoxin reduktáz: návrh záměny katalytické triády zahrnující stav Sec-His-Glu“. ChemBioChem. 6 (2): 386–94. doi:10.1002 / cbic.200400276. PMID 15651042.
- ^ Damblon C, Raquet X, Lian LY a kol. (1996). „Katalytický mechanismus beta-laktamáz: NMR titrace aktivního lysinového zbytku enzymu TEM-1“. Proc. Natl. Acad. Sci. USA 93 (5): 1747–52. Bibcode:1996PNAS ... 93.1747D. doi:10.1073 / pnas.93.5.1747. PMC 39852. PMID 8700829.
- ^ Jelsch C, Lenfant F, Masson JM a kol. (1992). „Beta-laktamáza TEM1 z E. coli. Stanovení krystalové struktury při rozlišení 2,5 A“. FEBS Lett. 299 (2): 135–42. doi:10.1016/0014-5793(92)80232-6. PMID 1544485.
- ^ A b C Brannigan JA, Dodson G, Duggleby HJ a kol. (1995). „Proteinová katalytická kostra s N-koncovým nukleofilem je schopná samo-aktivace“. Příroda. 378 (6555): 416–9. Bibcode:1995 Natur.378..416B. doi:10.1038 / 378416a0. PMID 7477383.
- ^ A b C Cheng H, Grishin NV (2005). „DOM-fold: struktura s křížením smyček nalezená v DmpA, ornithin acetyltransferáze a doméně vázající kofaktor molybdenu“. Protein Sci. 14 (7): 1902–10. doi:10.1110 / ps.051364905. PMC 2253344. PMID 15937278.
- ^ Sun Y, Yin S, Feng Y a kol. (2014). „Molekulární základ obecné katalýzy katalytické triády α / β-hydrolázy“. J. Biol. Chem. 289 (22): 15867–79. doi:10.1074 / jbc.m113.535641. PMC 4140940. PMID 24737327.
- ^ A b C Rauwerdink A, Kazlauskas RJ (2015). „Jak stejné jádro katalytických strojů katalyzuje 17 různých reakcí: serin-histidin-aspartátová katalytická triáda α / β-hydrolázových skládacích enzymů“. ACS Catal. 5 (10): 6153–6176. doi:10.1021 / acscatal.5b01539. PMC 5455348. PMID 28580193.
- ^ Beveridge AJ (1996). „Teoretická studie aktivních míst papainu a trypsinu potkana S195C: důsledky pro nízkou reaktivitu mutantních serinových proteináz“. Protein Sci. 5 (7): 1355–65. doi:10.1002 / pro.5560050714. PMC 2143470. PMID 8819168.
- ^ Allen MD, Buchberger A, Bycroft M (2006). "PUB doména funguje jako vazebný modul p97 v lidské peptidové N-glykanáze". J. Biol. Chem. 281 (35): 25502–8. doi:10,1074 / jbc.M601173200. PMID 16807242.
- ^ A b C Sanchez-Pulido L, Ponting CP (2016). „Vasohibiny: nové cysteinové proteázy podobné transglutamináze, které mají nekanonickou katalytickou triádu Cys-His-Ser“. Bioinformatika. 32 (10): 1441–5. doi:10.1093 / bioinformatika / btv761. PMC 4866520. PMID 26794318.
- ^ Sato Y, Sonoda H (2007). „Rodina vasohibinů: negativní regulační systém angiogeneze geneticky naprogramovaný v endotelových buňkách“. Arter. Tromb. Vasc. Biol. 27 (1): 37–41. doi:10.1161 / 01.atv.0000252062.48280.61. PMID 17095714.
- ^ A b Shin S, Yun YS, Koo HM a kol. (2003). „Charakterizace nové katalytické triády Ser-cisSer-Lys ve srovnání s klasickou triádou Ser-His-Asp“. J. Biol. Chem. 278 (27): 24937–43. doi:10,1074 / jbc.M302156200. PMID 12711609.
- ^ Cerqueira NM, Moorthy H, Fernandes PA a kol. (2017). „Mechanismus katalytické triády Ser- (cis) Ser-Lys peptidových amidáz“. Phys. Chem. Chem. Phys. 19 (19): 12343–12354. Bibcode:2017PCCP ... 1912343C. doi:10.1039 / C7CP00277G. PMID 28453015.
- ^ Toscano MD, Woycechowsky KJ, Hilvert D (2007). "Minimalistický redesign aktivních stránek: výuka starých enzymů nové triky". Angew. Chem. 46 (18): 3212–36. doi:10.1002 / anie.200604205. PMID 17450624.
- ^ Abrahmsén L, Tom J, Burnier J a kol. (1991). "Engineering subtilisin a jeho substráty pro účinnou ligaci peptidových vazeb ve vodném roztoku". Biochemie. 30 (17): 4151–9. CiteSeerX 10.1.1.461.9606. doi:10.1021 / bi00231a007. PMID 2021606.
- ^ Jackson DY, Burnier J, Quan C a kol. (1994). „Navržená peptidová ligáza pro celkovou syntézu ribonukleázy A s nepřirozenými katalytickými zbytky“. Věda. 266 (5183): 243–7. Bibcode:1994Sci ... 266..243J. doi:10.1126 / science.7939659. JSTOR 2884761. PMID 7939659.
- ^ A b Syed R, Wu ZP, Hogle JM a kol. (1993). "Krystalová struktura selenosubtilisinu v rozlišení 2,0-A". Biochemie. 32 (24): 6157–64. doi:10.1021 / bi00075a007. PMID 8512925.
- ^ A b Mao S, Dong Z, Liu J a kol. (2005). "Semisyntetický tellurosubtilisin s aktivitou glutathionperoxidázy". J. Am. Chem. Soc. 127 (33): 11588–9. doi:10.1021 / ja052451v. PMID 16104720.
- ^ Devillanova FA, Du Mont W (2013). Příručka chemie chalkogenu. Sv. 1: nové pohledy na síru, selen a tellur (2. vyd.). Cambridge: RSC. ISBN 9781849736237. OCLC 868953797.
- ^ Bouroushian M (2010). „Elektrochemie chalkogenů“. Elektrochemie kovových chalkogenidů. Monografie z elektrochemie. Berlín, Heidelberg: Springer. str. 57–75. doi:10.1007/978-3-642-03967-6_2. ISBN 9783642039669.
- ^ A b C Shafee T, Gatti-Lafranconi P, Minter R a kol. (2015). „Evoluce hendikepu a obnovy vede k chemicky univerzální, nukleofilní permisivní proteáze“. ChemBioChem. 16 (13): 1866–9. doi:10.1002 / cbic.201500295. PMC 4576821. PMID 26097079.
- ^ Okochi N, Kato-Murai M, Kadonosono T a kol. (2007). „Návrh katalytické triády podobné serinové proteáze na lehkém řetězci protilátky zobrazeném na povrchu kvasinkových buněk“. Appl. Microbiol. Biotechnol. 77 (3): 597–603. doi:10.1007 / s00253-007-1197-0. PMID 17899065.
- ^ Rajagopalan S, Wang C, Yu K a kol. (2014). "Návrh aktivovaných katalytických triád obsahujících serin s přesností na atomové úrovni". Nat. Chem. Biol. 10 (5): 386–91. doi:10.1038 / nchembio.1498. PMC 4048123. PMID 24705591.
- ^ Bhowmick D, Mugesh G (2015). „Zavedení katalytické triády zvyšuje aktivitu diaryldiselenidů podobnou glutathionperoxidáze“. Org. Biomol. Chem. 13 (34): 9072–82. doi:10.1039 / C5OB01294E. PMID 26220806.
- ^ Bhowmick D, Mugesh G (2015). "Pohledy na katalytický mechanismus syntetických mimetik glutathionperoxidázy". Org. Biomol. Chem. 13 (41): 10262–72. doi:10.1039 / c5ob01665g. PMID 26372527.
- ^ Nothling MD, Ganesan A, Condic-Jurkic K, et al. (2017). „Jednoduchý design katalyzátoru inspirovaného enzymy na základě katalytické triády“. Chem. 2 (5): 732–745. doi:10.1016 / j.chempr.2017.04.004.
- ^ Gulseren G, Khalily MA, Tekinay AB a kol. (2016). "Katalytické supramolekulární samo-sestavené peptidové nanostruktury pro hydrolýzu esterů". J. Mater. Chem. B. 4 (26): 4605–4611. doi:10.1039 / c6tb00795c. hdl:11693/36666. PMID 32263403.
- ^ Halabi N, Rivoire O, Leibler S a kol. (2009). „Proteinové sektory: evoluční jednotky trojrozměrné struktury“. Buňka. 138 (4): 774–86. doi:10.1016 / j.cell.2009.07.038. PMC 3210731. PMID 19703402.
- ^ Murzin AG (1998). "Jak daleko divergentní evoluce jde v bílkovinách". Aktuální názor na strukturní biologii. 8 (3): 380–387. doi:10.1016 / S0959-440X (98) 80073-0. PMID 9666335.
- ^ Gerlt JA, Babbitt PC (2001). „Odlišný vývoj enzymatické funkce: mechanicky různorodé superrodiny a funkčně odlišné suprafamilie“. Annu. Biochem. 70 (1): 209–46. doi:10.1146 / annurev.biochem.70.1.209. PMID 11395407.
- ^ Murphy JM, Farhan H, Eyers PA (2017). „Bio-Zombie: vzestup pseudoenzymů v biologii“. Biochem. Soc. Trans. 45 (2): 537–544. doi:10.1042 / bst20160400. PMID 28408493.
- ^ Stehle F, Brandt W, Stubbs MT a kol. (2009). „Sinapoyltransferázy ve světle molekulární evoluce“. Fytochemie. Vývoj metabolické rozmanitosti. 70 (15–16): 1652–62. doi:10.1016 / j.phytochem.2009.07.023. PMID 19695650.
- ^ Dimitriou PS, Denesyuk A, Takahashi S, et al. (2017). "Alpha/beta-hydrolases: A unique structural motif coordinates catalytic acid residue in 40 protein fold families". Proteiny. 85 (10): 1845–1855. doi:10.1002/prot.25338. PMID 28643343.
- ^ Smith JL (1998). "Glutamine PRPP amidotransferase: snapshots of an enzyme in action". Aktuální názor na strukturní biologii. 8 (6): 686–94. doi:10.1016/s0959-440x(98)80087-0. PMID 9914248.
- ^ Smith JL, Zaluzec EJ, Wery JP, et al. (1994). "Structure of the allosteric regulatory enzyme of purine biosynthesis". Věda. 264 (5164): 1427–33. Bibcode:1994Sci...264.1427S. doi:10.1126/science.8197456. PMID 8197456.
- ^ "Clans of Mixed (C, S, T) Catalytic Type". www.ebi.ac.uk. MEROPS. Citováno 20.prosince 2018.
- ^ A b Fischer K, Reynolds SL (2015). "Pseudoproteases: mechanisms and function". Biochem. J. 468 (1): 17–24. doi:10.1042/BJ20141506. PMID 25940733.
- ^ Todd AE, Orengo CA, Thornton JM (2002). "Sequence and structural differences between enzyme and nonenzyme homologs". Struktura. 10 (10): 1435–51. doi:10.1016/s0969-2126(02)00861-4. PMID 12377129.
- ^ Iversen LF, Kastrup JS, Bjørn SE, et al. (1997). "Structure of HBP, a multifunctional protein with a serine proteinase fold". Nat. Struct. Biol. 4 (4): 265–8. doi:10.1038/nsb0497-265. PMID 9095193.
- ^ Zettl M, Adrain C, Strisovsky K, et al. (2011). "Rhomboid family pseudoproteases use the ER quality control machinery to regulate intercellular signaling". Cell. 145 (1): 79–91. doi:10.1016/j.cell.2011.02.047. PMC 3149277. PMID 21439629.
- ^ Lemberg MK, Adrain C (2016). "Inactive rhomboid proteins: New mechanisms with implications in health and disease". Semin. Cell Dev. Biol. 60: 29–37. doi:10.1016/j.semcdb.2016.06.022. hdl:10400.7/759. PMID 27378062.
- ^ Cheng CY, Morris I, Bardin CW (1993). "Testins Are Structurally Related to the Mouse Cysteine Proteinase Precursor But Devoid of Any Protease/Anti-Protease Activity". Biochem. Biophys. Res. Commun. 191 (1): 224–231. doi:10.1006/bbrc.1993.1206. PMID 8447824.
- ^ Pelc LA, Chen Z, Gohara DW, et al. (2015). "Why Ser and not Thr brokers catalysis in the trypsin fold". Biochemie. 54 (7): 1457–64. doi:10.1021/acs.biochem.5b00014. PMC 4342846. PMID 25664608.