Alzheimerova choroba - Alzheimers disease - Wikipedia
| Alzheimerova choroba | |
|---|---|
| Ostatní jména | Alzheimerova choroba, Alzheimerova choroba |
 | |
| Srovnání normálního věku mozku (vlevo) a mozku osoby s Alzheimerovou chorobou (vpravo). Jsou zdůrazněny charakteristiky, které je oddělují. | |
| Výslovnost |
|
| Specialita | Neurologie |
| Příznaky | Problémy s pamětí na nedávné události, problémy s jazykem, dezorientace, změny nálady[1][2] |
| Obvyklý nástup | Více než 65 let[3] |
| Doba trvání | Dlouhodobý[2] |
| Příčiny | Špatně pochopený[1] |
| Rizikové faktory | Genetika, zranění hlavy, Deprese, hypertenze[1][4] |
| Diagnostická metoda | Na základě příznaků a kognitivní testování po vyloučení dalších možných příčin[5] |
| Diferenciální diagnostika | Normální stárnutí[1] |
| Léky | Inhibitory acetylcholinesterázy, Antagonisté NMDA receptoru (malá výhoda)[6] |
| Prognóza | Očekávaná délka života 3–9 let[7] |
| Frekvence | 29,8 milionu (2015)[2][8] |
| Úmrtí | 1,9 milionu (2015)[9] |
Alzheimerova choroba (INZERÁT), označovaný také jednoduše jako Alzheimerova choroba, je chronický neurodegenerativní onemocnění který obvykle začíná pomalu a postupem času se postupně zhoršuje.[1][2] Je příčinou 60–70% případů demence.[1][2] Nejběžnějším časným příznakem je potíže s pamětí na nedávné události.[1] Jak nemoc postupuje, mohou zahrnovat příznaky problémy s jazykem, dezorientace (včetně snadného ztracení), změny nálady, ztráta motivace, ne správu péče o sebe, a problémy s chováním.[1][2] Jak stav člověka klesá, často se stáhne z rodiny a společnosti.[1] Postupně dochází ke ztrátě tělesných funkcí, což nakonec vede k smrti.[10] I když se rychlost progrese může lišit, průměrná délka života po diagnóze je tři až devět let.[7][11]
Příčina Alzheimerovy choroby není dostatečně známa.[1] Předpokládá se, že je to asi 70% rizika zdědil po rodičích osoby, s mnoha geny obvykle zapojen.[4] Mezi další rizikové faktory patří anamnéza zranění hlavy, Deprese, a hypertenze.[1] Proces nemoci je spojen s plakety a neurofibrilární spleti v mozek.[4] Pravděpodobná diagnóza je založena na historii onemocnění a kognitivní testování s lékařské zobrazování a krevní testy vyloučit další možné příčiny.[5] Počáteční příznaky jsou často mylně považovány za normální stárnutí.[1] Pro definitivní diagnózu je nutné vyšetření mozkové tkáně.[4] Duševní a tělesné cvičení a vyhýbání se obezita může snížit riziko AD; důkazů na podporu těchto doporučení je však málo.[4][12] Ukázalo se, že neexistují žádné léky ani doplňky, které by snižovaly riziko.[13]
Žádná léčba nezastaví ani nezvrátí její progresi, i když některé mohou dočasně zlepšit příznaky.[2] Postižení lidé se stále více spoléhají na pomoc ostatních, což často zatěžuje pečovatel.[14] Tlak může zahrnovat sociální, psychologické, fyzické a ekonomické prvky.[14] Cvičební programy mohou být s ohledem na činnosti každodenního života a může potenciálně zlepšit výsledky.[15] Problémy s chováním nebo psychóza kvůli demenci jsou často léčeni antipsychotika, ale to se obvykle nedoporučuje, protože existuje malý přínos a zvýšené riziko předčasné smrti.[16][17]
V roce 2015 žilo na celém světě přibližně 29,8 milionu lidí s AD[8] s přibližně 50 miliony od roku 2020.[2] Nejčastěji začíná u lidí starších 65 let, i když je to 4–5% případů Alzheimerova choroba s časným nástupem.[3] Postihuje asi 6% lidí ve věku 65 let a starších.[1] V roce 2015 vedla demence k přibližně 1,9 milionu úmrtí.[9] Tato nemoc je pojmenována po německém psychiatrovi a patologovi Alois Alzheimer, který to poprvé popsal v roce 1906.[18] v rozvinuté země „AD je jednou z finančně nejnákladnějších nemocí.[19][20]
Příznaky a symptomy
- Účinky stárnutí na paměť ale ne AD
- Zapomínání věci občas
- Chybně umístěné předměty
- Méně důležitý krátkodobá paměť ztráta
- Nepamatuji si přesné podrobnosti
- Raná fáze Alzheimerovy choroby
- Nepamatuji si epizody zapomnění
- Zapomene jména rodiny nebo přátel
- Změny si mohou všimnout pouze blízcí přátelé nebo příbuzní
- Nějaký zmatek v situacích mimo známé
- Střední stupeň Alzheimerovy choroby
- Větší potíže si pamatovat nedávno naučené informace
- Prohlubování zmatku za mnoha okolností
- Problémy se spánkem
- Při určování jejich polohy došlo k potížím
- Pozdní fáze Alzheimerovy choroby
- Špatná schopnost myslet
- Problémy s mluvením
- Opakuje stejné konverzace
- Urážlivější, úzkostnější nebo paranoidnější
Průběh nemoci je rozdělen do čtyř fází s progresivním průběhem poznávací a funkční poškození.

Pre-demence
První příznaky jsou často mylně přisuzovány stárnutí nebo stres.[22] Detailní neuropsychologické testování může odhalit mírné kognitivní potíže až osm let, než osoba splní klinická kritéria pro diagnóza AD.[23] Tyto časné příznaky mohou ovlivnit ty nejsložitější činnosti každodenního života.[24] Nejviditelnější deficit je krátkodobá paměť ztráta, která se projevuje jako potíže si zapamatovat nedávno naučená fakta a neschopnost získat nové informace.[23][25]
Drobné problémy s výkonné funkce z pozornost, plánování, flexibilita a abstraktní myšlení nebo poškození v sémantická paměť (paměť významů a pojmových vztahů) může být také příznačná pro raná stadia AD.[23] Apatie v této fázi lze pozorovat depresi, přičemž nejtrvalejším příznakem v průběhu nemoci zůstává apatie.[26][27]Bylo také označeno preklinické stádium onemocnění mírné kognitivní poruchy (MCI).[25] Toto se často považuje za přechodné období mezi normálním stárnutím a demence. MCI se může projevovat různými příznaky, a když je převládajícím příznakem ztráta paměti, označuje se jako „amnestický MCI“ a je často považována za prodromální stádium Alzheimerovy choroby.[28]
Brzy
U lidí s AD vede rostoucí narušení učení a paměti nakonec k definitivní diagnóze. V malém procentu jsou potíže s jazykem, výkonnými funkcemi, vnímání (agnosie ), nebo provedení pohybů (apraxie ) jsou výraznější než problémy s pamětí.[29] AD neovlivňuje všechny kapacity paměti stejně. Starší vzpomínky života člověka (epizodická paměť ), zjištěná fakta (sémantická paměť ), a implicitní paměť (paměť těla na to, jak dělat věci, jako je použití vidličky k jídlu nebo jak pít ze sklenice) jsou ovlivněny v menší míře než nová fakta nebo vzpomínky.[30][31]
Jazykové problémy jsou charakterizovány hlavně zmenšováním slovní zásoba a snížené slovo plynulost, což vede k obecnému zbídačení orálního a psaný jazyk.[29][32] V této fázi je člověk s Alzheimerovou chorobou obvykle schopen adekvátně komunikovat základní myšlenky.[29][32][33] Při hraní jemné motorické úkoly mohou se vyskytnout určité potíže s koordinací pohybu a plánování (apraxie), jako je psaní, kreslení nebo oblékání, které jsou však obvykle nepovšimnuté.[29] Jak nemoc postupuje, lidé s AD mohou často i nadále vykonávat mnoho úkolů nezávisle, ale mohou potřebovat pomoc nebo dohled nad kognitivně náročnými činnostmi.[29]
Mírný
Postupné zhoršování nakonec brání nezávislosti a subjekty nemohou vykonávat většinu běžných činností každodenního života.[29] Řečové obtíže se projevují kvůli neschopnosti připomenout slovní zásobu, což vede k častým nesprávným substitucím slov (parafázie ). Čtení a psaní se také postupně ztrácejí.[29][33] Složité motorické sekvence se postupem času a průběhu AD méně koordinují, takže se zvyšuje riziko pádu.[29] Během této fáze se problémy s pamětí zhoršují a osoba nemusí rozpoznat blízké příbuzné.[29] Dlouhodobá paměť, který byl předtím neporušený, bude narušen.[29]
Behaviorální a neuropsychiatrické změny jsou stále častější. Běžné projevy jsou putování, podrážděnost a labilní vliv, vedoucí k pláči, výbuchy nepřipraveného agrese nebo odpor vůči pečování.[29] Sundowning může se také objevit.[34] Přibližně 30% lidí s AD se vyvíjí iluzorní nesprávná identifikace a další klam příznaky.[29] Subjekty také ztrácejí přehled o svém chorobném procesu a omezeních (anosognosia ).[29] Únik moči se může vyvinout.[29] Tyto příznaky vytvářejí stres pro příbuzné a pečovatele, což lze snížit přesunem osoby z domácí péče jiným zařízení dlouhodobé péče.[29][35]
Pokročilý
Během závěrečných fází je pacient zcela závislý na pečovatelích.[29] Jazyk se omezuje na jednoduché fráze nebo dokonce na jednotlivá slova, což nakonec vede k úplné ztrátě řeči.[29][33] I přes ztrátu verbálních jazykových schopností mohou lidé často porozumět emocionálním signálům a vrátit je. Ačkoli agresivita může být stále přítomna, extrémní apatie a vyčerpání jsou mnohem častější příznaky. Lidé s Alzheimerovou chorobou nakonec nebudou schopni samostatně provádět ani ty nejjednodušší úkoly; svalová hmota a pohyblivost se zhoršuje do bodu, kdy jsou upoutáni na lůžko a nemohou se samy najíst. Příčinou smrti je obvykle vnější faktor, například infekce dekubity nebo zápal plic, ne samotná nemoc.[29]
Příčiny
Předpokládá se, že k Alzheimerově chorobě dochází, když abnormální množství bílkovin, amyloidy a možná tau proteiny, se tvoří v mozku a začínají zasahovat do buněk orgánu. Výsledek plaketa narušuje normální funkci a chemii a vede k významnému deficitu neurotransmitery, což vede k postupné ztrátě mozkových funkcí.[36] Co se týče proč k těmto „poruchám funkce“ bílkovin dochází na prvním místě, jejich konečná příčina je špatně pochopena a je předmětem probíhajících výzkumů a spekulací.
Příčina většiny případů Alzheimerovy choroby je stále většinou neznámá, kromě 1% až 5% případů, kdy byly zjištěny genetické rozdíly.[37][38] Několik soutěžících hypotézy existují a snaží se vysvětlit příčinu nemoci.
Genetický
Genetická dědičnost Alzheimerovy choroby (a jejích paměťových složek) se na základě hodnocení studií dvojčat a rodin pohybuje od 49% do 79%.[39] Přibližně 0,1% případů jsou rodinné formy autosomální (ne spojeno se sexem ) dominantní dědictví, které mají nástup před dosažením věku 65 let.[40] Tato forma onemocnění je známá jako časný nástup familiární Alzheimerovy choroby. Většina autosomálně dominantních familiárních AD může být přičítána mutacím v jednom ze tří genů: kódujících amyloidový prekurzorový protein (APP) a preseniliny PSEN1 a PSEN2.[41] Většina mutací v genech APP a presenilinu zvyšuje produkci malého proteinu zvaného Ap 42, což je hlavní složka senilní plaky.[42] Některé z mutací pouze mění poměr mezi Ap42 a jinými hlavními formami - zejména Ap40 - aniž by zvyšovaly hladiny Ap42.[43] Dva další geny spojené s autozomálně dominantní Alzheimerovou chorobou jsou ABCA7 a SORL1.[44]
Většina případů Alzheimerovy choroby nevykazuje autozomálně dominantní dědičnost a označuje se jako sporadická AD, při které mohou působit environmentální a genetické rozdíly. rizikové faktory. Nejznámějším genetickým rizikovým faktorem je dědičnost ε4 alela z apolipoprotein E. (APOE).[45][46] Mezi 40 a 80% lidí s AD vlastní alespoň jednu alelu APOEε4.[46] Alela APOEε4 zvyšuje riziko onemocnění třikrát u heterozygotů a 15krát u homozygotů.[40] Stejně jako mnoho jiných lidských nemocí jsou i dopady na životní prostředí a genetické modifikátory neúplné pronikavost. Například některé nigerijské populace nevykazují vztah mezi dávkou APOEε4 a výskytem nebo věkem nástupu Alzheimerovy choroby pozorovaným u jiných lidských populací.[47][48] První pokusy o screening až 400 kandidátských genů na asociaci s pozdním nástupem sporadické AD (LOAD) vedly k nízkému výtěžku.[40][41] Novější genomové asociační studie (GWAS) našli 19 oblastí v genech, které ovlivňují riziko.[49] Mezi tyto geny patří: CASS4, CELF1, FERMT2, HLA-DRB5, INPP5D, MEF2C, NME8, PTK2B, SORL1, ZCWPW1, SLC24A4, CLU, PICALM, CR1, BIN1, MS4A, ABCA7, EPHA1, a CD2AP.[49]
Alely v TREM2 Gen 3 byl spojen s 3 až 5krát vyšším rizikem vzniku Alzheimerovy choroby.[50][51] Navrhovaný mechanismus účinku je ten, že v některých variantách v TREM2 bílé krvinky v mozku již nejsou schopny kontrolovat množství přítomného beta amyloidu. Mnoho jedno-nukleotidové polymorfismy (SNP) jsou spojeny s Alzheimerovou chorobou, přičemž studie z roku 2018 přidává 30 SNP rozlišením AD do 6 kategorií, včetně paměti, jazyka, vizualizace a výkonného fungování.[52]
Cholinergní hypotéza
Nejstarší hypotézou, na které je založena většina aktuálně dostupných lékových terapií, je cholinergní hypotéza,[53] který navrhuje, aby AD byla způsobena sníženou syntézou neurotransmiter acetylcholin. Cholinergní hypotéza si neudržela širokou podporu, zejména proto, že léky určené k léčbě nedostatku acetylcholinu nebyly příliš účinné.[54]
Amyloidová hypotéza
V roce 1991 amyloid hypotéza předpokládal, že extracelulární amyloid beta (Aβ) vklady jsou základní příčinou nemoci.[55][56] Podpora tohoto postulátu pochází z umístění genu pro amyloidový prekurzorový protein (APP) zapnuto chromozom 21, spolu s tím, že lidé s trizomie 21 (Downův syndrom), kteří mají navíc genová kopie téměř všeobecně vykazují alespoň nejčasnější příznaky AD do 40 let.[57][58] Také konkrétní izoforma apolipoproteinu, APOE4, je hlavním genetickým rizikovým faktorem pro AD. Zatímco apolipoproteiny zvyšují štěpení beta amyloidu, některé izoformy nejsou při tomto úkolu příliš účinné (například APOE4), což vede k nadměrnému hromadění amyloidu v mozku.[59] Další důkazy vycházejí ze zjištění, že transgenní myši, které exprimují mutantní formu lidského genu APP, vyvinou fibrilární amyloidové plaky a Alzheimerovu mozkovou patologii s deficitem prostorového učení.[60]
Bylo zjištěno, že experimentální vakcína vyčistila amyloidové plaky v časných pokusech na lidech, ale neměla žádný významný účinek na demenci.[61] Výzkumníci byli vedeni k podezření na neplaketu A.β oligomery (agregáty mnoha monomerů) jako primární patogenní forma Aβ. Tyto toxické oligomery, označované také jako difuzní ligandy odvozené od amyloidů (ADDL), se vážou na povrchový receptor na neuronech a mění strukturu synapsí, čímž narušují neuronovou komunikaci.[62] Jeden receptor pro Aβ oligomery mohou být prionový protein stejný protein, se kterým byl spojen nemoc šílených krav a související stav člověka, Creutzfeldt – Jakobova choroba, což potenciálně spojuje jejich základní mechanismus neurodegenerativní poruchy spojené s Alzheimerovou chorobou.[63]
V roce 2009 byla tato hypotéza aktualizována, což naznačuje, že blízký příbuzný beta-amyloidového proteinu, a ne nutně samotný beta-amyloid, může být hlavním viníkem onemocnění. Hypotéza tvrdí, že mechanismus související s amyloidy, který prořezává neuronální spojení v mozku ve fázi rychlého růstu raného života, může být spuštěn procesy souvisejícími se stárnutím v pozdějším životě, které způsobí neuronální ochabnutí Alzheimerovy choroby.[64] N-APP, fragment APP z peptidu N-konec, sousedí s beta-amyloidem a je štěpen z APP jedním ze stejných enzymů. N-APP spouští autodestrukční dráhu vazbou na neuronový receptor zvaný receptor smrti 6 (DR6, také známý jako TNFRSF21 ).[64] DR6 je vysoce exprimován v oblastech lidského mozku nejvíce postižených Alzheimerovou chorobou, takže je možné, že by cesta N-APP / DR6 mohla být v stárnutí mozku způsobit škodu. V tomto modelu hraje beta-amyloid doplňkovou roli tím, že potlačuje synaptickou funkci.
Osaka mutace
Bylo zjištěno, že japonský rodokmen familiární Alzheimerovy choroby je spojen s deleční mutací kodonu 693 APP.[65] Tato mutace a její souvislost s Alzheimerovou chorobou byla poprvé zaznamenána v roce 2008.[66] Tato mutace je známá jako mutace v Osace. Pouze u homozygotů s touto mutací se rozvine Alzheimerova choroba. Tato mutace urychluje Ap oligomerizaci, ale proteiny netvoří amyloidní fibrily, což naznačuje, že příčinou tohoto onemocnění může být spíše oligomerizace Ap než fibrily. Myši exprimující tuto mutaci mají všechny obvyklé patologické stavy Alzheimerovy choroby.
Tau hypotéza

The tau hypotéza navrhuje to tau protein abnormality iniciují kaskádu onemocnění.[56] V tomto modelu hyperfosforylovaný tau se začíná párovat s jinými vlákny tau. Nakonec se vytvoří neurofibrilární spleti uvnitř těl nervových buněk.[67] Pokud k tomu dojde, mikrotubuly rozpadají se a ničí strukturu buňky cytoskelet který zhroutí transportní systém neuronu.[68] To může mít za následek nejprve poruchy v biochemické komunikaci mezi neurony a později smrt buněk.[69]
Další hypotézy
Zánětlivá hypotéza spočívá v tom, že AD je způsobena samo-trvajícím progresivním zánětem v mozku kulminujícím neurodegenerací.[70] Možná role chronické parodontální infekce[70] a střevní mikrobiota bylo navrženo.[71]
Byla navržena neurovaskulární hypotéza, která uvádí, že špatné fungování hematoencefalická bariéra může být zapojen.[72] Infekce spirochetou byly také spojeny s demencí.[73][74]
Celulární homeostáza z biometalů jako je iontová měď, železo a zinek je narušen v AD, ačkoli zůstává nejasné, zda je to produkováno nebo způsobuje změny v proteinech. Tyto ionty ovlivňují a jsou ovlivňovány tau, APP a APOE,[75] a jejich dysregulace může způsobit oxidační stres které mohou přispět k patologii.[76][77][78][79][80] Kvalita některých z těchto studií byla kritizována,[81][82] a odkaz zůstává kontroverzní.[83] Většina vědců nepodporuje kauzální souvislost s hliníkem.[82]
Kouření je významným rizikovým faktorem AD.[84] Systémové značky z vrozený imunitní systém jsou rizikové faktory pro pozdní nástup AD.[85]
Existují předběžné důkazy, že expozice znečištění ovzduší může být faktorem přispívajícím k rozvoji Alzheimerovy choroby.[86]
Jedna hypotéza předpokládá, že dysfunkce oligodendrocyty a jejich přidružený myelin během stárnutí přispívá k poškození axonů, což pak způsobuje produkci amyloidů a tau hyperfosforylaci jako vedlejší účinek.[87][88]
Retrogeneze je lékařská hypotéza o vývoji a pokroku Alzheimerovy choroby, který navrhl Barry Reisberg v 80. letech.[89] Hypotéza je, že stejně jako plod prochází procesem neurovývoj začínající na neurulace a končí na myelinizace, mozky lidí s AD procházejí opačným směrem neurodegenerace proces počínaje demyelinizace a smrt axonů (bílá hmota) a končí smrtí šedé hmoty.[90] Podobně platí hypotéza, že když kojenci procházejí stavy kognitivní vývoj, lidé s AD procházejí opačným procesem progresivního kognitivní porucha.[89] Reisberg vyvinul nástroj pro hodnocení péče známý jako „FAST“ (Functional Assessment Staging Tool), který podle něj umožňuje osobám pečujícím o lidi s AD identifikovat stádia progrese onemocnění a poskytuje rady ohledně druhu péče potřebné v každé fázi.[89][91]
Sdružení s celiakie je nejasný, studie z roku 2019 nezjistila celkový nárůst demence u pacientů s CD, zatímco přezkum z roku 2018 zjistil souvislost s několika typy demence, včetně AD.[92][93]
Patofyziologie

Neuropatologie
Alzheimerova choroba je charakterizována ztrátou neurony a synapse v mozková kůra a určité subkortikální oblasti. Tato ztráta vede k hrubému atrofie postižených oblastí, včetně degenerace v temporální lalok a temenní lalok a části frontální kůra a cingulate gyrus.[94] Degenerace je také přítomna v jádrech mozkových kmenů, jako je locus coeruleus.[95] Studie využívají MRI a PET zdokumentovali zmenšení velikosti specifických oblastí mozku u lidí s AD, jak postupovali od mírného kognitivního poškození k Alzheimerově chorobě, a ve srovnání s podobnými snímky zdravých starších dospělých.[96][97]
Oba amyloidové plaky a neurofibrilární spleti jsou jasně viditelné pomocí mikroskopie v mozku postižených AD,[98] zejména v hipokampus.[99] Plakety jsou většinou husté nerozpustný vklady beta-amyloid peptid a buněčný materiál vně a kolem neuronů. Splety (neurofibrilární spletence) jsou agregáty s proteiny tau asociované s mikrotubuly, které se staly hyperfosforylovanými a hromadí se uvnitř samotných buněk. Přestože se u mnoha starších jedinců v důsledku stárnutí vyvinou plaky a zamotání, mozek lidí s AD má větší počet v konkrétních oblastech mozku, jako je temporální lalok.[100] Lewy těla nejsou v mozku lidí s AD vzácné.[101]
Biochemie
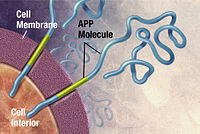


Alzheimerova choroba byla identifikována jako a nesprávné skládání bílkovin nemoc (proteopatie ), zapříčiněno plaketa akumulace abnormálně složeného amyloid beta bílkoviny a tau bílkoviny v mozku.[102] Plakety jsou tvořeny malými peptidy, 39–43 aminokyseliny na délku, tzv amyloid beta (Aβ). Aβ je fragment z většího amyloidový prekurzorový protein (APLIKACE). APP je a transmembránový protein který proniká membránou neuronu. APP je rozhodující pro růst neuronů, přežití a opravy po poranění.[103][104] U Alzheimerovy choroby gama sekretáza a beta sekretáza jednat společně v proteolytický proces, který způsobí, že se APP rozdělí na menší fragmenty.[105] Jeden z těchto fragmentů vede k tvorbě fibril amyloidu beta, které pak tvoří shluky, které se ukládají mimo neurony v hustých formacích známých jako senilní plaky.[98][106]
AD je také považován za tauopatie v důsledku abnormální agregace tau protein. Každý neuron má cytoskelet, vnitřní nosná konstrukce částečně tvořená tzv. strukturami mikrotubuly. Tyto mikrotubuly fungují jako stopy a vedou živiny a molekuly z těla buňky na konce axon a zpět. Volal protein tau stabilizuje mikrotubuly, když fosforylovaný, a proto se nazývá a protein spojený s mikrotubuly. V AD prochází tau chemickými změnami hyperfosforylovaný; poté se začne spárovat s jinými vlákny a vytváří se neurofibrilární spleti a rozpad transportního systému neuronu.[107] Patogenní tau může také způsobit smrt neuronů transponovatelný prvek dysregulace.[108]
Mechanismus nemoci
Jak přesně poruchy produkce a agregace beta-amyloidového peptidu způsobují patologii AD, není známo.[109][110]Amyloidová hypotéza tradičně poukazuje na akumulaci beta-amyloidu peptidy jako centrální událost spouštějící degeneraci neuronů. Akumulace agregovaného amyloidu fibrily, o kterých se předpokládá, že jsou toxickou formou proteinu odpovědného za narušení buněk vápník ion homeostáza, indukuje programovaná buněčná smrt (apoptóza ).[111] Je také známo, že Aβ se selektivně hromadí v mitochondrie v buňkách mozku postižených Alzheimerovou chorobou a také inhibuje určité enzym funkce a využití glukóza neurony.[112]
Různé zánětlivé procesy a cytokiny může také hrát roli v patologii Alzheimerovy choroby. Zánět je obecný ukazatel tkáň poškození při jakémkoli onemocnění a může být buď sekundární k poškození tkáně v AD nebo markerem imunologické odpovědi.[113] Existuje stále více důkazů o silné interakci mezi neurony a imunologickými mechanismy v mozku. Obezita a systémový zánět mohou interferovat s imunologickými procesy, které podporují progresi onemocnění.[114]
Změny v distribuci různých neurotrofické faktory a při expresi jejich receptorů, jako je neurotrofický faktor odvozený z mozku (BDNF) byly popsány v AD.[115][116]
Diagnóza

Alzheimerova choroba je obvykle diagnostikována na základě osoby zdravotní historie, historie od příbuzných a pozorování chování. Přítomnost charakteristiky neurologický a neuropsychologické funkce a absence alternativních podmínek je podpůrný.[117][118] Pokročilý lékařské zobrazování s počítačová tomografie (CT) nebo magnetická rezonance (MRI) a s jednofotonová emisní počítačová tomografie (SPECT) nebo pozitronová emisní tomografie (PET) lze použít k vyloučení jiné mozkové patologie nebo podtypů demence.[119] Kromě toho může předvídat převod z prodromální stadia (mírné kognitivní poruchy) Alzheimerovy choroby.[120]
Posouzení intelektuálního fungování včetně testování paměti může dále charakterizovat stav onemocnění.[22] Lékařské organizace vytvořily diagnostická kritéria pro usnadnění a standardizaci diagnostického procesu pro praktické lékaře. Diagnózu lze potvrdit s velmi vysokou přesností posmrtný když je k dispozici mozkový materiál a lze jej vyšetřit histologicky.[121]
Kritéria
The Národní institut neurologických a komunikačních poruch a mozkové mrtvice (NINCDS) a Sdružení pro Alzheimerovu chorobu a související poruchy (ADRDA, nyní známý jako Alzheimerova asociace ) stanovil nejčastěji používané Kritéria Alzheimerovy choroby NINCDS-ADRDA pro diagnózu v roce 1984,[121] rozsáhle aktualizován v roce 2007.[122] Tato kritéria vyžadují, aby přítomnost kognitivní porucha a syndrom podezření na demenci potvrzuje neuropsychologické testování pro klinickou diagnózu možné nebo pravděpodobné AD. A histopatologické potvrzení včetně a mikroskopický zkouška mozková tkáň je nutná pro definitivní diagnózu. Dobrý statistická spolehlivost a platnost mezi diagnostickými kritérii a definitivním histopatologickým potvrzením.[123] Osm intelektuálních domén je nejčastěji narušeno v AD—Paměť, Jazyk, percepční dovednosti, Pozornost, motorické dovednosti, orientace, řešení problému a výkonné funkční schopnosti. Tyto domény jsou ekvivalentní Alzheimerovým kritériím NINCDS-ADRDA uvedeným v dokumentu Diagnostický a statistický manuál duševních poruch (DSM-IV-TR) publikoval Americká psychiatrická asociace.[124][125]
Techniky

Neuropsychologické testy tak jako mini-mentální vyšetření stavu (MMSE) jsou široce používány k hodnocení kognitivních poruch potřebných pro diagnostiku. Pro vysokou spolehlivost výsledků, zejména v nejranějších stadiích onemocnění, je zapotřebí komplexnějších testovacích polí.[126][127] Neurologické vyšetření na počátku AD obvykle poskytne normální výsledky, s výjimkou zjevného kognitivního poškození, které se nemusí lišit od výsledků vyplývajících z jiných chorobných procesů, včetně jiných příčin demence.
Další neurologická vyšetření jsou v diferenciální diagnostika AD a dalších nemocí.[22] Rozhovory s členy rodiny se také používají při hodnocení nemoci. Pečovatelé mohou poskytnout důležité informace o každodenních životních schopnostech a také o časovém poklesu osobního stavu mentální funkce.[128] Hledisko pečovatele je obzvláště důležité, protože osoba s AD obvykle neví o tom svém deficity.[129] Mnohokrát mají rodiny také potíže s detekcí počátečních příznaků demence a nemusí sdělit přesné informace lékaři.[130]
Doplňkové testování poskytuje další informace o některých vlastnostech onemocnění nebo se používá k vyloučení jiných diagnóz. Krevní testy může identifikovat jiné příčiny demence než AD[22]—Příčiny, které mohou být ve vzácných případech reverzibilní.[131] Je běžné hrát testy funkce štítné žlázy, posoudit B12, vyloučit syfilis, vyloučit metabolické problémy (včetně testů funkce ledvin, hladiny elektrolytů a cukrovky), posoudit hladiny těžkých kovů (např. olova, rtuti) a anémii. (Je také nutné vyloučit delirium ).
Psychologické testy pro Deprese jsou zaměstnáni, protože deprese může být buď souběžná s AD (viz Deprese Alzheimerovy choroby ), časný příznak kognitivního poškození,[132] nebo dokonce příčina.[133][134]
Vzhledem k nízké přesnosti se nedoporučuje používat C-PIB-PET sken jako nástroj včasné diagnostiky nebo k předpovědi vývoje Alzheimerovy choroby, když lidé vykazují známky mírné kognitivní poruchy (MCI).[135] Použití 18F-FDG PET skeny jako jediný test k identifikaci lidí, u kterých se může vyvinout Alzheimerova choroba, také nejsou podloženy důkazy.[136]
Prevence

Neexistují žádné definitivní důkazy na podporu toho, že jakékoli konkrétní opatření je účinné při prevenci AD.[13] Globální studie opatření k prevenci nebo oddálení nástupu AD často přinesly nekonzistentní výsledky. Epidemiologické studie navrhly vztahy mezi určitými upravitelnými faktory, jako je dieta, kardiovaskulární riziko, farmaceutické výrobky nebo intelektuální aktivity, a pravděpodobnost vývoje populace INZERÁT. Pouze další výzkum, včetně klinických studií, odhalí, zda tyto faktory mohou pomoci předcházet AD.[13]
Léky
Kardiovaskulární rizikové faktory, jako např hypercholesterolemie, hypertenze, cukrovka, a kouření, jsou spojeny s vyšším rizikem nástupu a zhoršeným průběhem AD.[137][138] Léky na krevní tlak mohou snížit riziko.[139] Statiny, které klesají cholesterol nebyly však účinné při prevenci nebo zlepšení průběhu onemocnění.[140][141][142]
Dlouhodobé používání nesteroidní protizánětlivé léky (NSAID) byly v roce 2007 považovány za spojené se sníženou pravděpodobností vývoje AD.[143] Důkazy rovněž naznačovaly představu, že by NSAID mohly snížit zánět související s amyloidové plaky, ale pokusy byly pozastaveny z důvodu vysokých nežádoucích účinků.[13] Nebyla dokončena žádná prevence.[13] Nezdá se, že by byly užitečné jako léčba, ale od roku 2011[Aktualizace] byly považovány za kandidáty jako preventivní opatření bez příznaků.[144] Hormonální substituční léčba v menopauze, i když byly dříve použity, mohou zvýšit riziko demence.[145]
Životní styl
Lidé, kteří se zabývají intelektuálními aktivitami, jako je čtení hrající stolní hry dokončení křížovky hrající hudební nástroje nebo pravidelné sociální interakce vykazují snížené riziko Alzheimerovy choroby.[146] To je kompatibilní s kognitivní rezerva teorie, která uvádí, že některé životní zkušenosti vedou k efektivnějšímu nervovému fungování, které poskytuje jednotlivci kognitivní rezervu, která oddaluje nástup projevů demence.[146] Vzdělávání oddaluje nástup syndromu AD beze změny trvání onemocnění.[147] Učení a druhý jazyk i později v životě se zdá, že oddaluje nástup Alzheimerovy choroby.[148]Fyzická aktivita je také spojena se sníženým rizikem AD.[147] Fyzické cvičení je spojeno se sníženou mírou demence.[149] Fyzické cvičení je také účinné při snižování závažnosti příznaků u pacientů s Alzheimerovou chorobou.[150]
Strava
Lidé, kteří udržují a zdravý, japonský nebo Středomořská strava mají snížené riziko AD.[151] Středomořská strava může zlepšit výsledky u pacientů s tímto onemocněním.[152] Ti, kteří jedí stravu s vysokým obsahem nasycené tuky a jednoduché sacharidy (mono- a disacharid ) mají vyšší riziko.[153] Jako mechanismus účinku byl navržen příznivý kardiovaskulární účinek středomořské stravy.[154]
Závěry týkající se složek stravy bylo někdy obtížné zjistit, protože výsledky se lišily mezi populačními studiemi a randomizovanými kontrolovanými studiemi.[151] Existují pouze omezené důkazy o tom, že užívání alkoholu je mírné až střední červené víno, je spojeno s nižším rizikem AD.[151] Existují předběžné důkazy o tom kofein může být ochranný.[155] Řada potravin s vysokým obsahem flavonoidy jako kakao, červené víno a čaj může snížit riziko AD.[156][157]
Recenze o používání vitamíny a minerály nenalezly dostatek konzistentních důkazů, aby je doporučily. To zahrnuje vitamin A,[158][159] C,[160][161] alfa-tokoferolová forma vitaminu E,[162] selen,[163] zinek,[164][165] a kyselina listová s vitaminem B nebo bez něj12.[166] Důkazy z jedné randomizované kontrolované studie naznačovaly, že alfa-tokoferolová forma vitaminu E může zpomalit kognitivní pokles, tato kvalita byla hodnocena jako „střední“.[162] Zkoumání zkoušek kyselina listová (B9) a další vitamíny skupiny B neprokázaly žádnou významnou souvislost s kognitivním poklesem.[167] Omega-3 doplňky mastných kyselin z rostlin a ryb a dietní kyselina dokosahexaenová (DHA) se nezdá, že by prospívali lidem s mírnou až středně těžkou Alzheimerovou chorobou.[168][169]
Kurkumin od roku 2010[Aktualizace] neprokázaly přínos u lidí, přestože u zvířat existují předběžné důkazy.[170] Existovaly nekonzistentní a nepřesvědčivé důkazy ginkgo má jakýkoli pozitivní účinek na kognitivní poruchy a demenci.[171] Od roku 2008[Aktualizace] neexistoval žádný konkrétní důkaz kanabinoidy jsou účinné při zlepšování příznaků AD nebo demence;[172] Některé výzkumy týkající se endokanabinoidů však vypadaly slibně.[173]
Řízení
Na Alzheimerovu chorobu neexistuje lék; dostupné léčby nabízejí relativně malý symptomatický přínos, ale zůstávají zmírňující bolest v přírodě. Současnou léčbu lze rozdělit na farmaceutickou, psychosociální a pečovatelskou.
Léky


V současné době se k léčbě kognitivních problémů s AD používá pět léků: čtyři inhibitory acetylcholinesterázy (takrin, rivastigmin, galantamin a donepezil ) a ostatní (memantin ) je Antagonista NMDA receptoru. Výhoda z jejich používání je malá.[174][175][176] Bylo jasně prokázáno, že žádný lék zpomaluje nebo nezastavuje progresi onemocnění.
Snížení činnosti EU cholinergní neurony jsou dobře známým rysem Alzheimerovy choroby.[177] Inhibitory acetylcholinesterázy se používají ke snížení rychlosti acetylcholin (ACh) se rozkládá, čímž se zvyšuje koncentrace ACh v mozku a bojuje se ztrátou ACh způsobenou smrtí cholinergních neuronů.[178] Existují důkazy o účinnosti těchto léků u mírné až středně závažné Alzheimerovy choroby,[179][175][174] a některé důkazy o jejich použití v pokročilé fázi.[174] Užívání těchto drog v mírné kognitivní poruchy neprokázala žádný účinek ve zpoždění nástupu AD.[180] Nejčastější vedlejší efekty jsou nevolnost a zvracení, které jsou spojeny s cholinergním přebytkem. Tyto nežádoucí účinky se vyskytují přibližně u 10–20% uživatelů, jsou mírné až střední závažnosti a lze je zvládnout pomalou úpravou dávek léků.[181] Méně časté sekundární účinky zahrnují svaly křeče, snížil Tepová frekvence (bradykardie ), snížil chuť a váha a zvýšila se žaludeční kyselina Výroba.[179]
Glutamát je vzrušující neurotransmiter z nervový systém, ačkoli nadměrné částky v EU mozek může vést k buňka smrt procesem zvaným excitotoxicita který spočívá v nadměrné stimulaci glutamátu receptory. Excitotoxicita se vyskytuje nejen u Alzheimerovy choroby, ale také u jiných neurologických onemocnění, jako je Parkinsonova choroba a roztroušená skleróza.[182] Memantin je nekonkurenceschopná Antagonista NMDA receptoru poprvé použit jako anti-chřipka činidlo. Působí na glutamatergický systém blokováním NMDA receptory a inhibici jejich nadměrné stimulace glutamátem.[182][183] Bylo prokázáno, že memantin má malý přínos při léčbě středně těžké až těžké Alzheimerovy choroby.[184] Hlášené nežádoucí účinky s memantinem jsou časté a mírné, včetně halucinace, zmatek, závrať, bolest hlavy a únava.[185] Ukázalo se, že kombinace memantinu a donepezilu je z statisticky významný ale klinicky okrajová účinnost “.[186]
Atypická antipsychotika jsou mírně užitečné při snižování agrese a psychóza u lidí s Alzheimerovou chorobou, ale jejich výhody jsou vyváženy vážnými nepříznivými účinky, jako je např mrtvice, pohybové potíže nebo kognitivní pokles.[187] Při dlouhodobém užívání se prokázalo, že souvisejí se zvýšenou úmrtností.[188] Ukončení užívání antipsychotik u této skupiny lidí se jeví jako bezpečné.[189]
Psychosociální intervence
Psychosociální intervence se používají jako doplněk farmaceutické léčby a lze je zařadit do přístupů zaměřených na chování, emoce, poznání nebo stimulaci. Výzkum účinnosti není k dispozici a je zřídka specifický pro AD, místo toho se obecně zaměřuje na demenci.[190]
Behaviorální intervence pokusit se identifikovat a omezit předchůdce a důsledky problémového chování. Tento přístup neprokázal úspěch při zlepšování celkového fungování,[191] ale může pomoci snížit některé konkrétní problémové chování, jako např inkontinence.[192] Chybí vysoce kvalitní údaje o účinnosti těchto technik při jiných problémech s chováním, jako je putování.[193][194] Hudební terapie účinně snižuje behaviorální a psychologické příznaky.[195]
Mezi intervence zaměřené na emoce patří reminiscenční terapie, validační terapie, podpůrné psychoterapie, senzorická integrace, také zvaný snoezelen, a simulovaná terapie přítomnosti. Cochraneova revize nenašla žádné důkazy o tom, že je to účinné.[196] Podpůrná psychoterapie neobdržela téměř žádné nebo žádné formální vědecké studie, ale někteří lékaři ji považují za užitečnou pro pomoc lidem s mírným postižením přizpůsobit se jejich nemoci.[190] Reminiscenční terapie (RT) zahrnuje diskuzi o minulých zkušenostech jednotlivě nebo ve skupině, mnohokrát pomocí fotografií, předmětů pro domácnost, hudebních a zvukových záznamů nebo jiných známých předmětů z minulosti. Přehled účinnosti RT z roku 2018 zjistil, že účinky byly nekonzistentní, malé velikosti a pochybného klinického významu a lišily se podle prostředí.[197] Simulovaná terapie přítomnosti (SPT) je založena na teorie příloh a zahrnuje přehrání nahrávky s hlasy nejbližších příbuzných osoby s Alzheimerovou chorobou. There is partial evidence indicating that SPT may reduce náročné chování.[198]A konečně, validační terapie je založena na přijetí reality a osobní pravdy zkušenosti jiného, zatímco senzorická integrace je založena na cvičeních zaměřených na stimulaci smysly. There is no evidence to support the usefulness of these therapies.[199][200]
Cílem léčby zaměřené na poznání, která zahrnuje orientaci na realitu a kognitivní rekvalifikace, is the reduction of kognitivní deficity. Reality orientation consists in the presentation of information about time, place or person to ease the understanding of the person about its surroundings and his or her place in them. Na druhou stranu kognitivní rekvalifikace se snaží zlepšit narušené kapacity prostřednictvím uplatnění mentálních schopností. Oba ukázaly určitou účinnost zlepšující kognitivní schopnosti,[201] although in some studies these effects were transient and negative effects, such as frustration, have also been reported.[190]
Mezi stimulačně zaměřené léčby patří umění, hudba a mazlíček terapie, cvičení a jakýkoli jiný druh rekreační aktivity. Stimulation has modest support for improving behaviour, mood, and, to a lesser extent, function. Nevertheless, as important as these effects are, the main support for the use of stimulation therapies is the change in the person's routine.[190]
Péče
Since Alzheimer's has no cure and it gradually renders people incapable of tending for their own needs, caregiving is essentially the treatment and must be carefully managed over the course of the disease.
During the early and moderate stages, modifications to the living environment and lifestyle can increase bezpečnost pacientů and reduce caretaker burden.[202][203] Examples of such modifications are the adherence to simplified routines, the placing of safety locks, the labelling of household items to cue the person with the disease or the use of modified daily life objects.[190][204][205] If eating becomes problematic, food will need to be prepared in smaller pieces or even pureed.[206] Když polykací potíže arise, the use of feeding tubes může být vyžadováno. In such cases, the medical efficacy and ethics of continuing feeding is an important consideration of the caregivers and family members.[207][208] The use of physical restraints is rarely indicated in any stage of the disease, although there are situations when they are necessary to prevent harm to the person with AD or their caregivers.[190]
As the disease progresses, different medical issues can appear, such as oral and dental disease, dekubity, podvýživa, hygiena problems, or respirační, kůže nebo oko infekce. Careful management can prevent them, while professional treatment is needed when they do arise.[209][210] During the final stages of the disease, treatment is centred on relieving discomfort until death, often with the help of hospic.[211]
Prognóza

The early stages of Alzheimer's disease are difficult to diagnose. A definitive diagnosis is usually made once cognitive impairment compromises daily living activities, although the person may still be living independently. The symptoms will progress from mild cognitive problems, such as memory loss through increasing stages of cognitive and non-cognitive disturbances, eliminating any possibility of independent living, especially in the late stages of the disease.[29]
Délka života of people with AD is reduced.[212] Following diagnosis it typically ranges from three to ten years.[212]
Fewer than 3% of people live more than fourteen years.[213] Disease features significantly associated with reduced survival are an increased severity of cognitive impairment, decreased functional level, history of falls, and disturbances in the neurological examination. Other coincident diseases such as srdeční problémy, cukrovka or history of zneužití alkoholu are also related with shortened survival.[214][215][216] While the earlier the age at onset the higher the total survival years, life expectancy is particularly reduced when compared to the healthy population among those who are younger.[217] Men have a less favourable survival prognosis than women.[213][218]
Zápal plic a dehydratace are the most frequent immediate causes of death brought by AD, while rakovina is a less frequent cause of death than in the general population.[218]
Epidemiologie
| Stáří | New affected per thousand osobo-let |
|---|---|
| 65–69 | 3 |
| 70–74 | 6 |
| 75–79 | 9 |
| 80–84 | 23 |
| 85–89 | 40 |
| 90– | 69 |
Two main measures are used in epidemiologické studies: incidence and prevalence. Incidence is the number of new cases per unit of person–time at risk (usually number of new cases per thousand person–years); zatímco prevalence is the total number of cases of the disease in the population at any given time.
Regarding incidence, kohorta podélné studie (studies where a disease-free population is followed over the years) provide rates between 10 and 15 per thousand person–years for all dementias and 5–8 for AD,[219][220] which means that half of new dementia cases each year are AD. Advancing age is a primary risk factor for the disease and incidence rates are not equal for all ages: every five years after the age of 65, the risk of acquiring the disease approximately doubles, increasing from 3 to as much as 69 per thousand person years.[219][220] There are also sex differences in the incidence rates, women having a higher risk of developing AD particularly in the population older than 85.[220][221] V Spojené státy, the risk of dying from Alzheimer's disease is 26% higher among the non-Hispanic white population than among the non-Hispanic black population, whereas the Hispanic population has a 30% lower risk than the non-Hispanic white population.[222]

Prevalence of AD in populations is dependent upon different factors including incidence and survival. Since the incidence of AD increases with age, it is particularly important to include the mean age of the population of interest. In the United States, Alzheimer prevalence was estimated to be 1.6% in 2000 both overall and in the 65–74 age group, with the rate increasing to 19% in the 75–84 group and to 42% in the greater than 84 group.[223] Prevalence rates in less developed regions are lower.[224] The Světová zdravotnická organizace estimated that in 2005, 0.379% of people worldwide had dementia, and that the prevalence would increase to 0.441% in 2015 and to 0.556% in 2030.[225] Other studies have reached similar conclusions.[224] Another study estimated that in 2006, 0.40% of the world population (range 0.17–0.89%; absolute number 26.6 million, range 11.4–59.4 million) were afflicted by AD, and that the prevalence rate would triple and the absolute number would quadruple by 2050.[226]
Dějiny

The ancient Greek and Roman filozofové a lékaři associated old age with increasing demence.[18] It was not until 1901 that German psychiatr Alois Alzheimer identified the first case of what became known as Alzheimer's disease, named after him, in a fifty-year-old woman he called Auguste D. He followed her case until she died in 1906, when he first reported publicly on it.[227] During the next five years, eleven similar cases were reported in the lékařská literatura, some of them already using the term Alzheimer's disease.[18] The disease was first described as a distinctive disease by Emil Kraepelin after suppressing some of the clinical (delusions and hallucinations) and pathological features (arteriosclerotic changes) contained in the original report of Auguste D.[228] Zahrnoval Alzheimerova choroba, také pojmenovaný presenile demence by Kraepelin, as a subtype of senilní demence in the eighth edition of his Textbook of Psychiatry, zveřejněno dne 15 July, 1910.[229]
For most of the 20th century, the diagnosis of Alzheimer's disease was reserved for individuals between the ages of 45 and 65 who developed symptoms of dementia. The terminology changed after 1977 when a conference on AD concluded that the clinical and patologické manifestations of presenile and senile dementia were almost identical, although the authors also added that this did not rule out the possibility that they had different causes.[230] This eventually led to the diagnosis of Alzheimerova choroba independent of age.[231] Termín senile dementia of the Alzheimer type (SDAT) was used for a time to describe the condition in those over 65, with classical Alzheimer's disease being used to describe those who were younger. Eventually, the term Alzheimer's disease was formally adopted in medical nomenklatura to describe individuals of all ages with a characteristic common symptom pattern, disease course, and neuropatologie.[232]
Společnost a kultura
Sociální náklady
Dementia, and specifically Alzheimer's disease, may be among the most costly diseases for society in Evropa a Spojené státy,[19][20] while their costs in other countries such as Argentina,[233] a Jižní Korea,[234] are also high and rising. These costs will probably increase with the ageing of society, becoming an important sociální problém. AD-associated costs include direct medical costs such as pečovatelská domácí péče, direct nonmedical costs such as in-home denní péče, and indirect costs such as lost produktivita of both patient and caregiver.[20] Numbers vary between studies but dementia costs worldwide have been calculated around $160 billion,[235] while costs of Alzheimer's disease in the United States may be $100 billion each year.[20]
The greatest origin of costs for society is the dlouhodobá péče podle zdravotničtí pracovníci a zejména institucionalizace, which corresponds to 2/3 of the total costs for society.[19] The cost of living at home is also very high,[19] especially when informal costs for the family, such as caregiving time and caregiver's lost earnings, are taken into account.[236]
Costs increase with dementia severity and the presence of behavioural disturbances,[237] and are related to the increased caregiving time required for the provision of physical care.[236] Therefore, any treatment that slows cognitive decline, delays institutionalisation or reduces caregivers' hours will have economic benefits. Economic evaluations of current treatments have shown positive results.[20]
Caregiving burden
The role of the main pečovatel is often taken by the spouse or a close relative.[238] Alzheimer's disease is known for placing a great burden on pečovatelé which includes social, psychological, physical or economic aspects.[14][239][240] Home care is usually preferred by people with AD and their families.[241] This option also delays or eliminates the need for more professional and costly levels of care.[241][242] Nevertheless, two-thirds of nursing home residents have dementias.[190]
Demence caregivers are subject to high rates of physical and duševní poruchy.[243] Factors associated with greater psychosocial problems of the primary caregivers include having an affected person at home, the carer being a spouse, demanding behaviours of the cared person such as depression, behavioural disturbances, hallucinations, sleep problems or walking disruptions and sociální izolace.[244][245] Regarding economic problems, family caregivers often give up time from work to spend 47 hours per week on average with the person with AD, while the costs of caring for them are high. Direct and indirect costs of caring for an Alzheimer's patient average between $18,000 and $77,500 per year in the United States, depending on the study.[236][238]
Kognitivně behaviorální terapie a výuka strategie zvládání either individually or in group have demonstrated their efficacy in improving caregivers' psychological health.[14][246]
Média
AD has been portrayed in films such as: Duhovka (2001), na základě John Bayley 's memoir of his wife Iris Murdoch;[247] Notebook (2004), based on Nicholas Sparks ' 1996 stejnojmenný román;[248] A Moment to Remember (2004); Thanmathra (2005);[249] Memories of Tomorrow (Ashita no Kioku) (2006), based on Hiroshi Ogiwara's novel of the same name;[250] Daleko od ní (2006), na základě Alice Munro je krátký příběh "The Bear Came over the Mountain ";[251] Stále Alice (2014), about a Columbia University professor who has early onset Alzheimer's disease, based on Lisa Genova je Román stejného jména z roku 2007 a představovat Julianne Moore v titulní roli. Documentaries on Alzheimer's disease include Malcolm and Barbara: A Love Story (1999) a Malcolm and Barbara: Love's Farewell (2007), both featuring Malcolm Pointon.[252][253][254] It has also been portrayed in music by správce v Všude na konci času.
Pokyny k výzkumu
Léky
In the decade 2002–2012, 244 compounds were assessed in Phase I, Phase II, or Phase III trials, and only one of these (memantin ) received FDA approval (though others were still in the pipeline).[255] Solanezumab a aducanumab failed to show effectiveness in people who already had Alzheimer's symptoms.[256]
One area of clinical research is focused on treating the underlying disease pathology. Snížení beta-amyloid levels is a common target of compounds[257] (jako apomorfin ) under investigation. Imunoterapie nebo očkování for the amyloid protein is one způsob léčby ve studii.[258] Unlike preventive vaccination, the putative therapy would be used to treat people already diagnosed. It is based upon the concept of training the immune system to recognise, attack, and reverse deposition of amyloid, thereby altering the course of the disease.[259] An example of such a vaccine under investigation was ACC-001,[260][261] although the trials were suspended in 2008.[262] Another similar agent is bapineuzumab, an antibody designed as identical to the naturally induced anti-amyloid antibody.[263] Nicméně, immunotherapeutic agents have been found to cause some concerning nežádoucí účinky, jako amyloid-related imaging abnormalities.[264] Other approaches are neuroprotective agents, such as AL-108,[265] and metal-protein interaction attenuation agents, such as PBT2.[266] A TNFa receptor-blocking fúzní protein, etanercept has showed encouraging results.[267]
In 2008, two separate clinical trials showed positive results in modifying the course of disease in mild to moderate AD with methylthioninium chloride, a drug that inhibits tau aggregation,[268][269] a dimebon, an antihistaminikum.[270]The consecutive phase-III trial of dimebon failed to show positive effects in the primary and secondary endpoints.[271][272][273] Work with methylthioninium chloride showed that bioavailability of methylthioninium from the gut was affected by feeding and by stomach acidity, leading to unexpectedly variable dosing.[274] A new stabilised formulation, as the proléčivo LMTX, is in phase-III trials (in 2014).[275]
In early 2017, a trial of verubecestat, which inhibits the beta-secretase protein responsible for creating beta-amyloid protein was discontinued as an independent panel found "virtually no chance of finding a positive clinical effect".[276] In 2018 and 2019, more trials, including aducanumab which reduced amyloid beta concentrations, failed, leading some to question the validity of the amyloid hypothesis.[277][278] However, in October 2019, an analysis of another dataset found that aducanumab may reduce clinical decline in people with early Alzheimer's disease and the Biogen company may seek regulatory approval again.[279]
The senescence accelerated mouse (SAMP8) is an Alzheimer's disease (AD) animal model in which amyloid precursor protein (APP) is overproduced. The mice develops early memory disturbances and alters the blood–brain barrier, which causes a decreased expulsion of amyloid-β protein from the brain. It has a marked increase in oxidative stress in the brain. Medications that reduce oxidative stress have been shown to improve memory. Treatments that reduce amyloid-β (antisense to APP and antibodies to amyloid-β) not only improve memory but also reduce oxidative stress. It has been shown that the initial deviations in lipid peroxidative damage favor mitochondrial dysfunction as being a trigger for amyloid-β overproduction in this AD mouse strain. This process begets increased amyloid-beta, which further damages mitochondria.[280]
Behavioral prevention
Research on the effects of meditation on preserving memory and cognitive functions is at an early stage.[281] A 2015 review suggests that všímavost -based interventions may prevent or delay the onset of mild cognitive impairment and Alzheimer's disease.[282]
Possible transmission
Rare cases of possible přenos between people are being studied,[283] např. na růstový hormon pacientů.[284]
Infekce
The herpes simplex virus HSV-1 has been found in the same areas as amyloid plaques.[285] This suggested the possibility that AD could be treated or prevented with antivirové léky.[285][286] Studies of antivirals in buněčné kultury have shown promising results.[287]
Fungal infection of AD brain has also been described.[288]This hypothesis was proposed by the mikrobiolog L. Carrasco when his group found statistical correlation between disseminated mycoses and AD.[289]Further work revealed that fungal infection is present in different brain regions of AD patients, but not in the control individuals.[290][291]A fungal infection explains the symptoms observed in AD patients. The slow progression of AD fits with the chronic nature of some systemic fungal infections, which can be asymptomatic and thus, unnoticed and untreated.[290]The fungal hypotheses are also compatible with some other established AD hypotheses, like the amyloid hypothesis, that can be explained as an immune system response to an infection in the CNS,[292][293][294] as found by R. Moir and R. Tanzi in mouse and worm models of AD.
Zobrazování
Tato část musí být aktualizováno. (Dubna 2018) |
Z mnoha lékařské zobrazování techniques available, počítačová tomografie s emisemi jednoho fotonu (SPECT) appears to be superior in differentiating Alzheimer's disease from other types of dementia, and this has been shown to give a greater level of accuracy compared with mental testing and zdravotní historie analýza.[295] Pokroky vedly k návrhu nových diagnostických kritérií.[22][122]
PiB PET remains investigational, but a similar PET scanning radiofarmaka volala florbetapir, containing the longer-lasting radionuclide fluor-18, is a diagnostic tool in Alzheimer's disease.[296][297]
Amyloid imaging is likely to be used in conjunction with other markers rather than as an alternative.[298] Objemový MRI can detect changes in the size of brain regions. Measuring those regions that atrophy during the progress of Alzheimer's disease is showing promise as a diagnostic indicator. It may prove less expensive than other imaging methods currently under study.[299]
In 2011, an FDA panel voted unanimously to recommend approval of florbetapir.[300] The imaging agent can help to detect Alzheimer's brain plaques.[301] A negative scan indicates sparse or no plaques, which is not consistent with a diagnosis of AD.[302]
Diagnóza
Emphasis in Alzheimer's research has been placed on diagnosing the condition before symptoms begin.[303] A number of biochemical tests have been developed to enable earlier detection. Some such tests involve the analysis of mozkomíšní mok for beta-amyloid, total tau protein and phosphorylated tau181P protein concentrations.[304] Because drawing CSF can be painful, repeated draws are avoided. A blood test for circulatory miRNA and inflammatory biomarkers is a potential alternative indicator.[304]
A series of studies suggest that ageing-related breakdown of the blood–brain barrier may be causative of AD, and conclude that markers for that damage may be an early predictor of the disease.[305][306][307]
Reference
- ^ A b C d E F G h i j k l m Burns A, Iliffe S (February 2009). "Alzheimer's disease". BMJ. 338: b158. doi:10.1136/bmj.b158. PMID 19196745. S2CID 8570146.
- ^ A b C d E F G h "Dementia Fact sheet". Světová zdravotnická organizace. 12. prosince 2017.
- ^ A b Mendez MF (November 2012). "Early-onset Alzheimer's disease: nonamnestic subtypes and type 2 AD". Archivy lékařského výzkumu. 43 (8): 677–85. doi:10.1016/j.arcmed.2012.11.009. PMC 3532551. PMID 23178565.
- ^ A b C d E Ballard C, Gauthier S, Corbett A, Brayne C, Aarsland D, Jones E (March 2011). "Alzheimer's disease". Lanceta. 377 (9770): 1019–31. doi:10.1016/S0140-6736(10)61349-9. PMID 21371747. S2CID 20893019.
- ^ A b "Dementia diagnosis and assessment" (PDF). National Institute for Health and Care Excellence (NICE). Archivovány od originál (PDF) dne 5. prosince 2014. Citováno 30. listopadu 2014.
- ^ Commission de la transparence (June 2012). "Drugs for Alzheimer's disease: best avoided. No therapeutic advantage" [Drugs for Alzheimer's disease: best avoided. No therapeutic advantage]. Prescrire International. 21 (128): 150. PMID 22822592.
- ^ A b Querfurth HW, LaFerla FM (January 2010). "Alzheimer's disease". The New England Journal of Medicine. 362 (4): 329–44. doi:10.1056/NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ A b GBD 2015 Disease Injury Incidence Prevalence Collaborators (October 2016). „Globální, regionální a národní výskyt, prevalence a roky prožité se zdravotním postižením pro 310 nemocí a úrazů, 1990–2015: systematická analýza studie Global Burden of Disease Study 2015“. Lanceta. 388 (10053): 1545–1602. doi:10.1016 / S0140-6736 (16) 31678-6. PMC 5055577. PMID 27733282.
- ^ A b GBD 2015 Mortality Causes of Death Collaborators (October 2016). „Globální, regionální a národní naděje dožití, úmrtnost ze všech příčin a specifická úmrtnost pro 249 příčin úmrtí, 1980–2015: systematická analýza studie Global Burden of Disease Study 2015“. Lanceta. 388 (10053): 1459–1544. doi:10.1016 / S0140-6736 (16) 31012-1. PMC 5388903. PMID 27733281.
- ^ "About Alzheimer's Disease: Symptoms". National Institute on Aging. Archivovány od originál dne 15. ledna 2012. Citováno 28. prosince 2011.
- ^ Todd S, Barr S, Roberts M, Passmore AP (November 2013). "Survival in dementia and predictors of mortality: a review". International Journal of Geriatric Psychiatry. 28 (11): 1109–24. doi:10.1002/gps.3946. PMID 23526458. S2CID 25445595.
- ^ "So, What Can You Do?". National Institute on Aging. 29. července 2016. Archivovány od originál dne 3. dubna 2017.
- ^ A b C d E Hsu D, Marshall GA (2017). "Primary and Secondary Prevention Trials in Alzheimer Disease: Looking Back, Moving Forward". Současný výzkum Alzheimerovy choroby. 14 (4): 426–40. doi:10.2174/1567205013666160930112125. PMC 5329133. PMID 27697063.
- ^ A b C d Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J (July 2007). "Systematic review of information and support interventions for caregivers of people with dementia". BMC geriatrie. 7: 18. doi:10.1186/1471-2318-7-18. PMC 1951962. PMID 17662119.
- ^ Forbes D, Forbes SC, Blake CM, Thiessen EJ, Forbes S (April 2015). "Exercise programs for people with dementia". Cochrane Database of Systematic Reviews (Vložený rukopis). 132 (4): CD006489. doi:10.1002/14651858.CD006489.pub4. PMID 25874613.
- ^ Národní institut pro zdraví a klinickou dokonalost. "Low-dose antipsychotics in people with dementia". National Institute for Health and Care Excellence (NICE). Archivovány od originál dne 5. prosince 2014. Citováno 29. listopadu 2014.
- ^ "Information for Healthcare Professionals: Conventional Antipsychotics". US Food and Drug Administration. 16. června 2008. Archivovány od originál dne 29. listopadu 2014. Citováno 29. listopadu 2014.
- ^ A b C Berchtold NC, Cotman CW (1998). "Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s". Neurobiologie stárnutí. 19 (3): 173–89. doi:10.1016/S0197-4580(98)00052-9. PMID 9661992. S2CID 24808582.
- ^ A b C d Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP (January 2005). "[The economical impact of dementia]". Presse Médicale (francouzsky). 34 (1): 35–41. doi:10.1016/s0755-4982(05)83882-5. PMID 15685097.
- ^ A b C d E Meek PD, McKeithan K, Schumock GT (1998). "Economic considerations in Alzheimer's disease". Farmakoterapie. 18 (2 Pt 2): 68–73, discussion 79–82. doi:10.1002/j.1875-9114.1998.tb03880.x (neaktivní 11. listopadu 2020). PMID 9543467.CS1 maint: DOI neaktivní od listopadu 2020 (odkaz)
- ^ "Evaluating Prescription Drugs Used to Treat: Alzheimer's Disease Comparing Effectiveness, Safety, and Price" (PDF). Zprávy pro spotřebitele Drug Effectiveness Review Project. Zprávy pro spotřebitele. Květen 2012. Archivovány od originál (PDF) dne 5. září 2012. Citováno 1. května 2013.
- ^ A b C d E Waldemar G, Dubois B, Emre M, Georges J, McKeith IG, Rossor M, Scheltens P, Tariska P, Winblad B (January 2007). "Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline". European Journal of Neurology. 14 (1): e1–26. doi:10.1111 / j.1468-1331.2006.01605.x. PMID 17222085. S2CID 2725064.
- ^ A b C Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ (September 2004). "Multiple cognitive deficits during the transition to Alzheimer's disease". Journal of Internal Medicine. 256 (3): 195–204. doi:10.1111/j.1365-2796.2004.01386.x. PMID 15324363. S2CID 37005854.
- ^ Nygård L (2003). "Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment?". Acta Neurologica Scandinavica. Supplementum. 179 (s179): 42–6. doi:10.1034/j.1600-0404.107.s179.8.x. PMID 12603250. S2CID 25313065.
- ^ A b Arnáiz E, Almkvist O (2003). "Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease". Acta Neurologica Scandinavica. Supplementum. 179: 34–41. doi:10.1034/j.1600-0404.107.s179.7.x. PMID 12603249. S2CID 22494768.
- ^ Deardorff WJ, Grossberg GT (2019). "Behavioral and psychological symptoms in Alzheimer's dementia and vascular dementia". Příručka klinické neurologie. 165: 5–32. doi:10.1016/B978-0-444-64012-3.00002-2. ISBN 9780444640123. PMID 31727229.
- ^ Murray ED, Buttner N, Price BH (2012). "Depression and Psychosis in Neurological Practice". In Bradley WG, Daroff RB, Fenichel GM, Jankovic J (eds.). Bradleyova neurologie v klinické praxi (6. vydání). Philadelphia, PA: Elsevier / Saunders. ISBN 978-1-4377-0434-1.
- ^ Grundman M, Petersen RC, Ferris SH, et al. (Leden 2004). "Mild cognitive impairment can be distinguished from Alzheimer disease and normal aging for clinical trials". Archives of Neurology. 61 (1): 59–66. doi:10.1001/archneur.61.1.59. PMID 14732621.
- ^ A b C d E F G h i j k l m n Ó p q r s Förstl H, Kurz A (1999). "Clinical features of Alzheimer's disease". Evropský archiv psychiatrie a klinické neurovědy. 249 (6): 288–90. doi:10,1007 / s004060050101. PMID 10653284. S2CID 26142779.
- ^ Carlesimo GA, Oscar-Berman M (June 1992). "Memory deficits in Alzheimer's patients: a comprehensive review". Recenze neuropsychologie. 3 (2): 119–69. doi:10.1007/BF01108841. PMID 1300219. S2CID 19548915.
- ^ Jelicic M, Bonebakker AE, Bonke B (1995). "Implicit memory performance of patients with Alzheimer's disease: a brief review". Mezinárodní psychogeriatrie. 7 (3): 385–92. doi:10.1017/S1041610295002134. PMID 8821346.
- ^ A b Taler V, Phillips NA (July 2008). "Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review". Journal of Clinical and Experimental Neuropsychology. 30 (5): 501–56. doi:10.1080/13803390701550128. PMID 18569251. S2CID 37153159.
- ^ A b C Frank EM (September 1994). "Effect of Alzheimer's disease on communication function". Journal of the South Carolina Medical Association. 90 (9): 417–23. PMID 7967534.
- ^ Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A (May 2001). "Sundowning and circadian rhythms in Alzheimer's disease". American Journal of Psychiatry. 158 (5): 704–11. doi:10.1176/appi.ajp.158.5.704. PMID 11329390. S2CID 10492607.
- ^ Gold DP, Reis MF, Markiewicz D, Andres D (January 1995). "When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia". Journal of the American Geriatrics Society. 43 (1): 10–6. doi:10.1111/j.1532-5415.1995.tb06235.x. PMID 7806732. S2CID 29847950.
- ^ Alzheimer's disease - Causes (NHS)
- ^ "What We Know Today About Alzheimer's Disease". Alzheimer's Association. Archivovány od originál dne 7. října 2011. Citováno 1. října 2011.
While scientists know Alzheimer's disease involves progressive brain cell failure, the reason cells fail isn't clear.
- ^ Reitz C, Mayeux R (April 2014). "Alzheimer disease: epidemiology, diagnostic criteria, risk factors and biomarkers". Biochemická farmakologie. 88 (4): 640–51. doi:10.1016/j.bcp.2013.12.024. PMC 3992261. PMID 24398425.
- ^ Wilson RS, Barral S, Lee JH, Leurgans SE, Foroud TM, Sweet RA, Graff-Radford N, Bird TD, Mayeux R, Bennett DA (2011). "Heritability of different forms of memory in the Late Onset Alzheimer's Disease Family Study". Journal of Alzheimer's Disease. 23 (2): 249–55. doi:10.3233/JAD-2010-101515. PMC 3130303. PMID 20930268.
- ^ A b C Blennow K, de Leon MJ, Zetterberg H (July 2006). "Alzheimer's disease". Lanceta. 368 (9533): 387–403. doi:10.1016/S0140-6736(06)69113-7. PMID 16876668. S2CID 47544338.
- ^ A b Waring SC, Rosenberg RN (March 2008). "Genome-wide association studies in Alzheimer disease". Archives of Neurology. 65 (3): 329–34. doi:10.1001/archneur.65.3.329. PMID 18332245.
- ^ Selkoe DJ (June 1999). "Translating cell biology into therapeutic advances in Alzheimer's disease". Příroda. 399 (6738 Suppl): A23–31. doi:10.1038/19866. PMID 10392577. S2CID 42287088.
- ^ Borchelt DR, Thinakaran G, Eckman CB, et al. (Listopad 1996). "Familial Alzheimer's disease-linked presenilin 1 variants elevate Abeta1-42/1-40 ratio in vitro and in vivo". Neuron. 17 (5): 1005–13. doi:10.1016/S0896-6273(00)80230-5. PMID 8938131. S2CID 18315650.
- ^ Kim, JH (December 2018). "Genetics of Alzheimer's Disease". Dementia and Neurocognitive Disorders. 17 (4): 131–36. doi:10.12779/dnd.2018.17.4.131. PMC 6425887. PMID 30906402.
- ^ Strittmatter WJ, Saunders AM, Schmechel D, Pericak-Vance M, Enghild J, Salvesen GS, Roses AD (March 1993). "Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease". Sborník Národní akademie věd Spojených států amerických. 90 (5): 1977–81. Bibcode:1993PNAS...90.1977S. doi:10.1073/pnas.90.5.1977. PMC 46003. PMID 8446617.
- ^ A b Mahley RW, Weisgraber KH, Huang Y (April 2006). "Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer's disease". Sborník Národní akademie věd Spojených států amerických. 103 (15): 5644–51. Bibcode:2006PNAS..103.5644M. doi:10.1073/pnas.0600549103. PMC 1414631. PMID 16567625.
- ^ Hall K, Murrell J, Ogunniyi A, Deeg M, Baiyewu O, Gao S, Gureje O, Dickens J, Evans R, Smith-Gamble V, Unverzagt FW, Shen J, Hendrie H (January 2006). "Cholesterol, APOE genotype, and Alzheimer disease: an epidemiologic study of Nigerian Yoruba". Neurologie. 66 (2): 223–27. doi:10.1212/01.wnl.0000194507.39504.17. PMC 2860622. PMID 16434658.
- ^ Gureje O, Ogunniyi A, Baiyewu O, et al. (Leden 2006). "APOE epsilon4 is not associated with Alzheimer's disease in elderly Nigerians". Annals of Neurology. 59 (1): 182–85. doi:10.1002/ana.20694. PMC 2855121. PMID 16278853.
- ^ A b Lambert JC, Ibrahim-Verbaas CA, Harold D, et al. (Prosinec 2013). "Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease". Genetika přírody. 45 (12): 1452–58. doi:10.1038/ng.2802. PMC 3896259. PMID 24162737.
- ^ Jonsson T, Stefansson H, Steinberg S, et al. (Leden 2013). "Variant of TREM2 associated with the risk of Alzheimer's disease". The New England Journal of Medicine (Původní článek). 368 (2): 107–16. doi:10.1056/NEJMoa1211103. PMC 3677583. PMID 23150908.
- ^ Guerreiro R, Wojtas A, Bras J, et al. (Leden 2013). "TREM2 variants in Alzheimer's disease". The New England Journal of Medicine (Původní článek). 368 (2): 117–27. doi:10.1056/NEJMoa1211851. PMC 3631573. PMID 23150934.
- ^ Mukherjee S, Mez J, Trittschuh EH, Saykin AJ, Gibbons LE, Fardo DW, Wessels M, Bauman J, Moore M, Choi SE, Gross AL, Rich J, Louden DK, Sanders RE, Grabowski TJ, Bird TD, et al. (Prosinec 2018). "Genetic data and cognitively defined late-onset Alzheimer's disease subgroups". Molekulární psychiatrie. 25 (11): 2942–2951. doi:10.1038/s41380-018-0298-8. PMC 6548676. PMID 30514930.
- ^ Francis PT, Palmer AM, Snape M, Wilcock GK (February 1999). „Cholinergní hypotéza Alzheimerovy choroby: přehled pokroku“. Časopis neurologie, neurochirurgie a psychiatrie. 66 (2): 137–47. doi:10.1136 / jnnp.66.2.137. PMC 1736202. PMID 10071091.
- ^ Martorana A, Esposito Z, Koch G (srpen 2010). „Kromě cholinergní hypotézy: fungují současné léky při Alzheimerově chorobě?“. CNS Neuroscience & Therapeutics. 16 (4): 235–45. doi:10.1111 / j.1755-5949.2010.00175.x. PMC 6493875. PMID 20560995.
- ^ Hardy J, Allsop D (říjen 1991). „Amyloidová depozice jako hlavní událost v etiologii Alzheimerovy choroby“. Trendy ve farmakologických vědách. 12 (10): 383–88. doi:10.1016 / 0165-6147 (91) 90609-V. PMID 1763432.
- ^ A b Mudher A, Lovestone S (leden 2002). „Alzheimerova choroba - dělají si tauisté a baptisté konečně ruce?“. Trendy v neurovědách. 25 (1): 22–26. doi:10.1016 / S0166-2236 (00) 02031-2. PMID 11801334. S2CID 37380445.
- ^ Nistor M, Don M, Parekh M, Sarsoza F, Goodus M, Lopez GE, Kawas C, Leverenz J, Doran E, Lott IT, Hill M, Head E (říjen 2007). „Alfa- a beta-sekretázová aktivita jako funkce věku a beta-amyloidu u Downova syndromu a normálního mozku“. Neurobiologie stárnutí. 28 (10): 1493–506. doi:10.1016 / j.neurobiolaging.2006.06.023. PMC 3375834. PMID 16904243.
- ^ Lott IT, vedoucí E (březen 2005). "Alzheimerova choroba a Downov syndrom: faktory patogeneze". Neurobiologie stárnutí. 26 (3): 383–89. doi:10.1016 / j.neurobiolaging.2004.08.005. PMID 15639317. S2CID 27716613.
- ^ Polvikoski T, Sulkava R, Haltia M, Kainulainen K, Vuorio A, Verkkoniemi A, Niinistö L, Halonen P, Kontula K (listopad 1995). „Apolipoprotein E, demence a kortikální depozice beta-amyloidního proteinu“. The New England Journal of Medicine. 333 (19): 1242–47. doi:10.1056 / NEJM199511093331902. PMID 7566000.
- ^ Transgenní myši:
- Games D, Adams D, Alessandrini R, Barbour R, Berthelette P, Blackwell C, Carr T, Clemens J, Donaldson T, Gillespie F (únor 1995). „Neuropatologie typu Alzheimerovy choroby u transgenních myší nadměrně exprimujících protein prekurzorů beta-amyloidu V717F“. Příroda. 373 (6514): 523–27. Bibcode:1995 Natur.373..523G. doi:10.1038 / 373523a0. PMID 7845465. S2CID 4255816.
- Masliah E, Sisk A, Mallory M, Mucke L, Schenk D, Games D (září 1996). „Srovnání neurodegenerativní patologie u transgenních myší s nadměrnou expresí proteinu prekurzoru beta-amyloidu V717F a Alzheimerovy choroby“. The Journal of Neuroscience. 16 (18): 5795–811. doi:10.1523 / JNEUROSCI.16-18-05795.1996. PMC 6578961. PMID 8795633.
- Hsiao K, Chapman P, Nilsen S, Eckman C, Harigaya Y, Younkin S, Yang F, Cole G (říjen 1996). „Korelační deficity paměti, elevace Abeta a amyloidové plaky u transgenních myší“. Věda. 274 (5284): 99–102. Bibcode:1996Sci ... 274 ... 99H. doi:10.1126 / science.274.5284,99. PMID 8810256. S2CID 32419070.
- Lalonde R, Dumont M, Staufenbiel M, Sturchler-Pierrat C, Strazielle C (listopad 2002). „Prostorové učení, zkoumání, úzkost a motorická koordinace u samic transgenních myší APP23 se švédskou mutací“. Výzkum mozku. 956 (1): 36–44. doi:10.1016 / S0006-8993 (02) 03476-5. PMID 12426044. S2CID 10083365.
- ^ Holmes C, Boche D, Wilkinson D, Yadegarfar G, Hopkins V, Bayer A, Jones RW, Bullock R, Love S, Neal JW, Zotova E, Nicoll JA (červenec 2008). „Dlouhodobé účinky imunizace Abeta42 u Alzheimerovy choroby: sledování randomizované, placebem kontrolované studie fáze I“. Lanceta. 372 (9634): 216–23. doi:10.1016 / S0140-6736 (08) 61075-2. PMID 18640458. S2CID 18340153.
- ^ Lacor PN, Buniel MC, Furlow PW a kol. (Leden 2007). „Aberace indukované oligomery Abeta ve složení, tvaru a hustotě synapsí poskytují molekulární základ pro ztrátu konektivity u Alzheimerovy choroby“. The Journal of Neuroscience. 27 (4): 796–807. doi:10.1523 / JNEUROSCI.3501-06.2007. PMC 6672917. PMID 17251419.
- ^ Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM (únor 2009). „Buněčný prionový protein zprostředkovává narušení synaptické plasticity amyloid-beta oligomery“. Příroda. 457 (7233): 1128–32. Bibcode:2009 Natur.457.1128L. doi:10.1038 / nature07761. PMC 2748841. PMID 19242475.
- ^ A b Nikolaev A, McLaughlin T, O'Leary DD, Tessier-Lavigne M (únor 2009). „APP váže DR6 a spouští prořezávání axonů a smrt neuronů prostřednictvím odlišných kaspáz“. Příroda. 457 (7232): 981–89. Bibcode:2009Natur.457..981N. doi:10.1038 / nature07767. PMC 2677572. PMID 19225519.
- ^ Tomiyama T (2010). „Podíl beta-amyloidu na etiologii Alzheimerovy choroby“. Mozkový nerv. 62 (7): 691–699. PMID 20675873.
- ^ Tomiyama T, Nagata T, Shimada H, Teraoka R, Fukushima A, Kanemitsu H, Takuma H, Kuwano R, Imagawa M, Ataka S, Wada Y, Yoshioka E, Nishizaki T, Watanabe Y, Mori H (2008). „Nová varianta amyloidu beta upřednostňující oligomerizaci u demence Alzheimerova typu“. Ann Neurol. 63 (3): 377–387. doi:10.1002 / ana.21321. PMID 18300294. S2CID 42311988.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Goedert M, Spillantini MG, Crowther RA (červenec 1991). "Tau proteiny a neurofibrilární degenerace". Patologie mozku. 1 (4): 279–86. doi:10.1111 / j.1750-3639.1991.tb00671.x. PMID 1669718. S2CID 33331924.
- ^ Iqbal K, Alonso A, Chen S, Chohan MO, El-Akkad E, Gong CX, Khatoon S, Li B, Liu F, Rahman A, Tanimukai H, Grundke-Iqbal I (leden 2005). "Tau patologie u Alzheimerovy choroby a dalších tauopatií". Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1739 (2–3): 198–210. doi:10.1016 / j.bbadis.2004.09.008. PMID 15615638.
- ^ Chun W, Johnson GV (leden 2007). "Úloha tau fosforylace a štěpení při smrti neuronových buněk". Frontiers in Bioscience. 12: 733–56. doi:10.2741/2097. PMID 17127334. S2CID 40048768.
- ^ A b Kamer AR, Craig RG, Dasanayake AP, Brys M, Glodzik-Sobanska L, de Leon MJ (červenec 2008). „Zánět a Alzheimerova choroba: možná role periodontálních chorob“. Alzheimerova choroba a demence. 4 (4): 242–50. doi:10.1016 / j.jalz.2007.08.004. PMID 18631974. S2CID 8633979.
- ^ Collins SM, Surette M, Bercik P (listopad 2012). "Souhra mezi střevní mikroflórou a mozkem". Recenze přírody. Mikrobiologie. 10 (11): 735–42. doi:10.1038 / nrmicro2876. PMID 23000955. S2CID 36411264.
- ^ Deane R, Zlokovic BV (duben 2007). „Role hematoencefalické bariéry v patogenezi Alzheimerovy choroby“. Současný výzkum Alzheimerovy choroby. 4 (2): 191–97. doi:10.2174/156720507780362245. PMID 17430246.
- ^ Miklossy J (srpen 2011). „Alzheimerova choroba - neurospirochetóza. Analýza důkazů podle Kochových a Hillových kritérií“. Journal of Neuroinflammation. 8 (1): 90. doi:10.1186/1742-2094-8-90. PMC 3171359. PMID 21816039.
- ^ Allen, HB (27. června 2016). „Alzheimerova choroba: Posouzení role spirochet, biofilmů, imunitního systému a amyloidu-β s ohledem na potenciální léčbu a prevenci“. Journal of Alzheimer's Disease. 53 (4): 1271–76. doi:10,3233 / JAD-160388. PMC 5008232. PMID 27372648.
- ^ Xu H, Finkelstein DI, Adlard PA (12. června 2014). „Interakce kovů a Apolipoproteinu E při Alzheimerově chorobě“. Frontiers in Aging Neuroscience. 6: 121. doi:10.3389 / fnagi.2014.00121. PMC 4054654. PMID 24971061.
I když stále nevíme, zda je dyshomeostáza kovových iontů přítomná v AD příčinou nebo důsledkem onemocnění, existuje stále více důkazů ukazujících přímou korelaci mezi ionty kovů a klíčovými bílkovinami souvisejícími s AD.
- ^ Su B, Wang X, Nunomura A, Moreira PI, Lee HG, Perry G, Smith MA, Zhu X (prosinec 2008). „Signalizace oxidativního stresu u Alzheimerovy choroby“. Současný výzkum Alzheimerovy choroby. 5 (6): 525–32. doi:10.2174/156720508786898451. PMC 2780015. PMID 19075578.
- ^ Kastenholz B, Garfin DE, Horst J, Nagel KA (2009). "Chaperony rostlinných kovů: nová perspektiva v terapii demence". Amyloid. 16 (2): 81–83. doi:10.1080/13506120902879392. PMID 20536399. S2CID 37490474.
- ^ „Hliník a Alzheimerova choroba“. Fakta o demenci. Alzheimerova společnost. Archivovány od originál dne 27. října 2005. Citováno 14. října 2005.
- ^ Bondy SC (leden 2016). „Nízké hladiny hliníku mohou vést k behaviorálním a morfologickým změnám spojeným s Alzheimerovou chorobou a neurodegenerací související s věkem“. Neurotoxikologie (Vložený rukopis). 52: 222–29. doi:10.1016 / j.neuro.2015.12.002. PMID 26687397.
- ^ Kandimalla R, Vallamkondu J, Corgiat EB, Gill KD (březen 2016). „Porozumění aspektům expozice hliníku při vývoji Alzheimerovy choroby“. Patologie mozku. 26 (2): 139–54. doi:10.1111 / bpa.12333. PMID 26494454. S2CID 40859643.
- ^ Santibáñez M, Bolumar F, García AM (listopad 2007). „Profesní rizikové faktory u Alzheimerovy choroby: přehled hodnotící kvalitu publikovaných epidemiologických studií“. Pracovní a environmentální medicína. 64 (11): 723–32. doi:10.1136 / oem.2006.028209. PMC 2078415. PMID 17525096.
- ^ A b Lidský TI (květen 2014). „Je hypotéza o hliníku mrtvá?“. Journal of Occupational and Environmental Medicine. 56 (5 doplňků): S73–79. doi:10.1097 / jom.0000000000000063. PMC 4131942. PMID 24806729.
- ^ Yegambaram M, Manivannan B, Beach TG, Halden RU (2015). „Role kontaminantů v prostředí v etiologii Alzheimerovy choroby: přehled“. Současný výzkum Alzheimerovy choroby. 12 (2): 116–46. doi:10.2174/1567205012666150204121719. PMC 4428475. PMID 25654508.
- ^ Cataldo JK, Prochaska JJ, Glantz SA (2010). „Kouření cigaret je rizikovým faktorem pro Alzheimerovu chorobu: analýza kontrolující přidružení tabákového průmyslu“. Journal of Alzheimer's Disease. 19 (2): 465–80. doi:10.3233 / JAD-2010-1240. PMC 2906761. PMID 20110594.
- ^ Eikelenboom P, van Exel E, Hoozemans JJ, Veerhuis R, Rozemuller AJ, van Gool WA (2010). „Neuroinflamation - časná událost v historii i patogenezi Alzheimerovy choroby“. Neuro-degenerativní nemoci. 7 (1–3): 38–41. doi:10.1159/000283480. PMID 20160456. S2CID 40048333.
- ^ Moulton PV, Yang W (2012). „Znečištění ovzduší, oxidační stres a Alzheimerova choroba“. Journal of Environmental and Public Health (Posouzení). 2012: 1–9. doi:10.1155/2012/472751. PMC 3317180. PMID 22523504.
- ^ Bartzokis G (srpen 2011). „Alzheimerova choroba jako homeostatické reakce na rozpad myelinu související s věkem“. Neurobiologie stárnutí. 32 (8): 1341–71. doi:10.1016 / j.neurobiolaging.2009.08.007. PMC 3128664. PMID 19775776.
- ^ Cai Z, Xiao M (2016). "Oligodendrocyty a Alzheimerova choroba". International Journal of Neuroscience. 126 (2): 97–104. doi:10.3109/00207454.2015.1025778. PMID 26000818. S2CID 21448714.
- ^ A b C Reisberg B, Franssen EH, Hasan SM a kol. (1999). „Retrogenese: klinické, fyziologické a patologické mechanismy při stárnutí mozku, Alzheimerově chorobě a dalších procesech demence“. Evropský archiv psychiatrie a klinické neurovědy. 249 Suppl 3 (3): 28–36. doi:10.1007 / pl00014170. PMID 10654097. S2CID 23410069.
- ^ Alves GS, Oertel Knöchel V, Knöchel C, Carvalho AF, Pantel J, Engelhardt E, Laks J (2015). „Integrace teorie retrogeneze do patologie Alzheimerovy choroby: pohled z DTI-TBSS vyšetřování mikrostrukturní integrity bílé hmoty“. BioMed Research International. 2015: 291658. doi:10.1155/2015/291658. PMC 4320890. PMID 25685779.
- ^ Brenner Carson, Verna (2015). Péče o Alzheimerovu chorobu. New York: Springer New York Academy of Sciences. s. 1–9. ISBN 978-1-4939-2406-6.
- ^ Zis P, Hadjivassiliou M (únor 2019). „Léčba neurologických projevů citlivosti na lepek a celiakie“. Současné možnosti léčby v neurologii. 21 (3): 10. doi:10.1007 / s11940-019-0552-7. PMID 30806821. S2CID 73466457.
- ^ Makhlouf S, Messelmani M, Zaouali J, Mrissa R (březen 2018). „Kognitivní porucha u celiakie a citlivost na celiakii na lepek: přehled literatury o hlavních kognitivních poruchách, zobrazování a účinku bezlepkové stravy“. Acta Neurologica Belgica (Posouzení). 118 (1): 21–27. doi:10.1007 / s13760-017-0870-z. PMID 29247390. S2CID 3943047.
- ^ Wenk GL (2003). „Neuropatologické změny u Alzheimerovy choroby“. The Journal of Clinical Psychiatry. 64 Suppl 9: 7–10. PMID 12934968.
- ^ Braak H, Del Tredici K (prosinec 2012). „Kde, kdy a v jaké formě začíná sporadická Alzheimerova choroba?“. Aktuální názor na neurologii. 25 (6): 708–14. doi:10.1097 / WCO.0b013e32835a3432. PMID 23160422.
- ^ Desikan RS, Cabral HJ, Hess CP, Dillon WP, Glastonbury CM, Weiner MW, Schmansky NJ, Greve DN, Salat DH, Buckner RL, Fischl B (srpen 2009). „Automatická měření pomocí magnetické rezonance identifikují osoby s mírným kognitivním poškozením a Alzheimerovou chorobou“. Mozek. 132 (Pt 8): 2048–57. doi:10.1093 / brain / awp123. PMC 2714061. PMID 19460794.
- ^ Moan R (20. července 2009). „Software MRI přesně identifikuje preklinickou Alzheimerovu chorobu“. Diagnostické zobrazování. Archivovány od originál dne 16. května 2016. Citováno 7. ledna 2013.
- ^ A b Tiraboschi P, Hansen LA, Thal LJ, Corey-Bloom J (červen 2004). „Význam neuritických plaků a spleti pro vývoj a vývoj AD“. Neurologie. 62 (11): 1984–89. doi:10.1212 / 01.WNL.0000129697.01779.0A. PMID 15184601. S2CID 25017332.
- ^ DeTure, Michael A .; Dickson, Dennis W. (2019). „Neuropatologická diagnóza Alzheimerovy choroby“. Molekulární neurodegenerace. 14 (1): 32. doi:10.1186 / s13024-019-0333-5. ISSN 1750-1326. PMC 6679484. PMID 31375134.
- ^ Bouras C, Hof PR, Giannakopoulos P, Michel JP, Morrison JH (1994). „Regionální distribuce neurofibrilárních spleti a senilních plaků v mozkové kůře starších pacientů: kvantitativní vyhodnocení jednoroční populace pitvy z geriatrické nemocnice“ (PDF). Mozková kůra. 4 (2): 138–50. doi:10.1093 / cercor / 4.2.138. PMID 8038565.
- ^ Kotzbauer PT, Trojanowsk JQ, Lee VM (říjen 2001). "Patologie Lewyho těla u Alzheimerovy choroby". Journal of Molecular Neuroscience. 17 (2): 225–32. doi:10,1385 / JMN: 17: 2: 225. PMID 11816795. S2CID 44407971.
- ^ Hashimoto M, Rockenstein E, Crews L, Masliah E (2003). „Role agregace proteinů při mitochondriální dysfunkci a neurodegeneraci u Alzheimerovy a Parkinsonovy choroby“. Neuromolekulární medicína. 4 (1–2): 21–36. doi:10,1385 / NMM: 4: 1-2: 21. PMID 14528050. S2CID 20760249.
- ^ Priller C, Bauer T, Mitteregger G, Krebs B, Kretzschmar HA, Herms J (červenec 2006). „Tvorba a funkce synapsí je modulována proteinem prekurzoru amyloidu“. The Journal of Neuroscience. 26 (27): 7212–21. doi:10.1523 / JNEUROSCI.1450-06.2006. PMC 6673945. PMID 16822978.
- ^ Turner PR, O'Connor K, Tate WP, Abraham WC (květen 2003). "Role amyloidního prekurzorového proteinu a jeho fragmentů při regulaci nervové aktivity, plasticity a paměti". Pokrok v neurobiologii. 70 (1): 1–32. doi:10.1016 / S0301-0082 (03) 00089-3. PMID 12927332. S2CID 25376584.
- ^ Hooper NM (duben 2005). "Role proteolýzy a lipidových raftů při zpracování amyloidového prekurzorového proteinu a prionového proteinu". Transakce biochemické společnosti. 33 (Pt 2): 335–38. doi:10.1042 / BST0330335. PMID 15787600. S2CID 14269634.
- ^ Ohnishi S, Takano K (březen 2004). "Amyloidové fibrily z hlediska skládání proteinů". Buněčné a molekulární biologické vědy. 61 (5): 511–24. doi:10.1007 / s00018-003-3264-8. PMID 15004691. S2CID 25739126.
- ^ Hernández F, Avila J (září 2007). "Tauopathies". Buněčné a molekulární biologické vědy. 64 (17): 2219–33. doi:10.1007 / s00018-007-7220-x. PMID 17604998.
- ^ Sun W, Samimi H, Gamez M, Zare H, Frost B (srpen 2018). „Patogenní vyčerpání piRNA vyvolané tau podporuje smrt neuronů prostřednictvím dysregulace transponovatelných prvků u neurodegenerativních tauopatií“. Přírodní neurovědy. 21 (8): 1038–48. doi:10.1038 / s41593-018-0194-1. PMC 6095477. PMID 30038280.
- ^ Van Broeck B, Van Broeckhoven C, Kumar-Singh S (2007). „Aktuální poznatky o molekulárních mechanismech Alzheimerovy choroby a jejich důsledcích pro terapeutické přístupy“. Neuro-degenerativní nemoci. 4 (5): 349–65. doi:10.1159/000105156. PMID 17622778. S2CID 7949658.
- ^ Huang Y, Mucke L (březen 2012). „Alzheimerovy mechanismy a terapeutické strategie“. Buňka. 148 (6): 1204–22. doi:10.1016 / j.cell.2012.02.040. PMC 3319071. PMID 22424230.
- ^ Yankner BA, Duffy LK, Kirschner DA (říjen 1990). „Neurotrofické a neurotoxické účinky proteinu amyloidu beta: reverze pomocí tachykininových neuropeptidů“. Věda. 250 (4978): 279–82. Bibcode:1990Sci ... 250..279Y. doi:10.1126 / science.2218531. PMID 2218531.
- ^ Chen X, Yan SD (prosinec 2006). „Mitochondriální abeta: potenciální příčina metabolické dysfunkce u Alzheimerovy choroby“. IUBMB Life. 58 (12): 686–94. doi:10.1080/15216540601047767. PMID 17424907. S2CID 85423830.
- ^ Greig NH, Mattson MP, Perry T, Chan SL, Giordano T, Sambamurti K, Rogers JT, Ovadia H, Lahiri DK (prosinec 2004). „Nové terapeutické strategie a kandidáti na léky na neurodegenerativní onemocnění: inhibitory p53 a TNF-alfa a agonisté receptoru GLP-1“. Annals of the New York Academy of Sciences. 1035: 290–315. doi:10.1196 / annals.1332.018. PMID 15681814. S2CID 84659695.
- ^ Heneka MT, Carson MJ, El Khoury J a kol. (Duben 2015). „Neurozánět u Alzheimerovy choroby“. Lancet. Neurologie. 14 (4): 388–405. doi:10.1016 / S1474-4422 (15) 70016-5. PMC 5909703. PMID 25792098.
- ^ Tapia-Arancibia L, Aliaga E, Silhol M, Arancibia S (listopad 2008). „Nové poznatky o funkci BDNF v mozku při normálním stárnutí a Alzheimerově chorobě“. Recenze výzkumu mozku. 59 (1): 201–20. doi:10.1016 / j.brainresrev.2008.07.007. hdl:10533/142174. PMID 18708092. S2CID 6589846.
- ^ Schindowski K, Belarbi K, Buée L (únor 2008). „Neurotrofické faktory u Alzheimerovy choroby: role axonálního transportu“. Geny, mozek a chování. 7 (Suppl 1): 43–56. doi:10.1111 / j.1601-183X.2007.00378.x. PMC 2228393. PMID 18184369.
- ^ Mendez MF (2006). „Přesná diagnóza demence s časným nástupem“. International Journal of Psychiatry in Medicine. 36 (4): 401–12. doi:10.2190 / Q6J4-R143-P630-KW41. PMID 17407994. S2CID 43715976.
- ^ Klafki HW, Staufenbiel M, Kornhuber J, Wiltfang J (listopad 2006). „Terapeutické přístupy k Alzheimerově chorobě“. Mozek. 129 (Pt 11): 2840–55. doi:10.1093 / brain / awl280. PMID 17018549.
- ^ Demence: Stručná referenční příručka (PDF). London: (UK) Národní institut pro zdraví a klinickou dokonalost. Listopadu 2006. ISBN 978-1-84629-312-2. Archivovány od originál (PDF) dne 27. února 2008. Citováno 22. února 2008.
- ^ Schroeter ML, Stein T, Maslowski N, Neumann J (říjen 2009). „Nervové koreláty Alzheimerovy choroby a mírné kognitivní poruchy: systematická a kvantitativní metaanalýza zahrnující 1351 pacientů“. NeuroImage. 47 (4): 1196–206. doi:10.1016 / j.neuroimage.2009.05.037. PMC 2730171. PMID 19463961.
- ^ A b McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM (červenec 1984). „Klinická diagnóza Alzheimerovy choroby: zpráva pracovní skupiny NINCDS-ADRDA pod záštitou pracovní skupiny ministerstva zdravotnictví a sociálních služeb pro Alzheimerovu chorobu“. Neurologie. 34 (7): 939–44. doi:10.1212 / mn. 34.7.739. PMID 6610841. S2CID 11646075.
- ^ A b Dubois B, Feldman HH, Jacova C a kol. (Srpen 2007). „Výzkumná kritéria pro diagnostiku Alzheimerovy choroby: revize kritérií NINCDS-ADRDA“. Lancet. Neurologie. 6 (8): 734–46. doi:10.1016 / S1474-4422 (07) 70178-3. PMID 17616482. S2CID 7356809.
- ^ Blacker D, Albert MS, Bassett SS, Go RC, Harrell LE, Folstein MF (prosinec 1994). „Spolehlivost a platnost kritérií NINCDS-ADRDA pro Alzheimerovu chorobu. The National Institute of Mental Health Genetics Initiative“. Archivy neurologie. 51 (12): 1198–204. doi:10.1001 / archneur.1994.00540240042014. PMID 7986174.
- ^ Americká psychiatrická asociace (2000). Diagnostický a statistický manuál duševních poruch: DSM-IV-TR (4. vydání, revize textu, ed.). Washington, DC: Americká psychiatrická asociace. ISBN 978-0-89042-025-6.
- ^ Ito N (květen 1996). „[Klinické aspekty demence]“. [Hokkaido Igaku Zasshi] Hokkaido Journal of Medical Science (v japonštině). 71 (3): 315–20. PMID 8752526.
- ^ Tombaugh TN, McIntyre NJ (září 1992). „Mini-mentální vyšetření stavu: komplexní přehled“. Journal of the American Geriatrics Society. 40 (9): 922–35. doi:10.1111 / j.1532-5415.1992.tb01992.x. PMID 1512391. S2CID 25169596.
- ^ Pasquier F (leden 1999). "Včasná diagnóza demence: neuropsychologie". Journal of Neurology. 246 (1): 6–15. doi:10,1007 / s004150050299. PMID 9987708. S2CID 2108587.
- ^ Harvey PD, Moriarty PJ, Kleinman L, Coyne K, Sadowsky CH, Chen M, Mirski DF (2005). „Ověření posouzení demence ošetřovatelem: Stupnice závažnosti demence“. Alzheimerova choroba a související poruchy. 19 (4): 186–94. doi:10.1097 / 01.wad.0000189034.43203.60. PMID 16327345. S2CID 20238911.
- ^ Antoine C, Antoine P, Guermonprez P, Frigard B (2004). „[Povědomí o deficitech a anosognosii u Alzheimerovy choroby]“. L'Encephale (francouzsky). 30 (6): 570–77. doi:10.1016 / S0013-7006 (04) 95472-3. PMID 15738860.
- ^ Cruz VT, Pais J, Teixeira A, Nunes B (2004). „[Počáteční příznaky Alzheimerovy choroby: vnímání pečovatele]“. Acta Medica Portuguesa (v portugalštině). 17 (6): 435–44. PMID 16197855.
- ^ Clarfield AM (říjen 2003). "Klesající prevalence reverzibilních demencí: aktualizovaná metaanalýza". Archiv vnitřního lékařství. 163 (18): 2219–29. doi:10.1001 / archinte.163.18.2219. PMID 14557220.
- ^ Sun X, Steffens DC, Au R, Folstein M, Summergrad P, Yee J, Rosenberg I, Mwamburi DM, Qiu WQ (květen 2008). „Deprese spojená s amyloidy: prodromální deprese Alzheimerovy choroby?“. Archiv obecné psychiatrie. 65 (5): 542–50. doi:10.1001 / archpsyc.65.5.542. PMC 3042807. PMID 18458206.
- ^ Geldmacher DS, Whitehouse PJ (květen 1997). „Diferenciální diagnostika Alzheimerovy choroby“. Neurologie. 48 (5 Suppl 6): S2–9. doi:10.1212 / WNL.48.5_Suppl_6.2S. PMID 9153154. S2CID 30018544.
- ^ Potter GG, Steffens DC (květen 2007). „Příspěvek deprese ke kognitivnímu poškození a demenci u starších dospělých“. Neurolog. 13 (3): 105–17. doi:10.1097 / 01.nrl.0000252947.15389.a9. PMID 17495754. S2CID 24569198.
- ^ Zhang S, Smailagic N, Hyde C, Noel-Storr AH, Takwoingi Y, McShane R, Feng J (červenec 2014). „(11) C-PIB-PET pro včasnou diagnostiku demence a jiných demencí u Alzheimerovy choroby u lidí s mírnou kognitivní poruchou (MCI)“. Cochrane Database of Systematic Reviews (7): CD010386. doi:10.1002 / 14651858.CD010386.pub2. PMC 6464750. PMID 25052054.
- ^ Smailagic N, Vacante M, Hyde C, Martin S, Ukoumunne O, Sachpekidis C (leden 2015). "18F-FDG PET pro včasnou diagnostiku demence Alzheimerovy choroby a dalších demencí u lidí s mírnou kognitivní poruchou (MCI) ". Cochrane Database of Systematic Reviews. 1: CD010632. doi:10.1002 / 14651858.CD010632.pub2. PMC 7081123. PMID 25629415.
- ^ Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD (únor 2008). „Diagnostika a léčba demence: 1. Posouzení rizik a primární prevence Alzheimerovy choroby“. CMAJ. 178 (5): 548–56. doi:10 1503 / cmaj.070796. PMC 2244657. PMID 18299540.
- ^ Rosendorff C, Beeri MS, Silverman JM (2007). "Kardiovaskulární rizikové faktory pro Alzheimerovu chorobu". Americký žurnál geriatrické kardiologie. 16 (3): 143–49. doi:10.1111 / j.1076-7460.2007.06696.x. PMID 17483665.
- ^ Ding J, Davis-Plourde KL, Sedaghat S a kol. (Leden 2020). „Antihypertenzní léky a riziko výskytu demence a Alzheimerovy choroby: metaanalýza údajů jednotlivých účastníků z prospektivních kohortních studií“. Lancet. Neurologie. 19 (1): 61–70. doi:10.1016 / S1474-4422 (19) 30393-X. PMC 7391421. PMID 31706889.
- ^ Reiss AB, Wirkowski E (2007). „Úloha inhibitorů HMG-CoA reduktázy při neurologických poruchách: dosavadní pokrok“. Drogy. 67 (15): 2111–20. doi:10.2165/00003495-200767150-00001. PMID 17927279. S2CID 29107420.
- ^ Kuller LH (srpen 2007). "Statiny a demence". Aktuální zprávy o ateroskleróze. 9 (2): 154–61. doi:10.1007 / s11883-007-0012-9. PMID 17877925. S2CID 20488187.
- ^ McGuinness B, Craig D, Bullock R, Malouf R, Passmore P (červenec 2014). "Statiny pro léčbu demence". Cochrane Database of Systematic Reviews. 7 (7): CD007514. doi:10.1002 / 14651858.CD007514.pub3. PMID 25004278.
- ^ Szekely CA, Town T, Zandi PP (2007). NSAID pro chemoprevenci Alzheimerovy choroby. Subcelulární biochemie. 42. s. 229–48. doi:10.1007/1-4020-5688-5_11. ISBN 978-1-4020-5687-1. PMID 17612054.
- ^ Hoozemans JJ, Veerhuis R, Rozemuller JM, Eikelenboom P (únor 2011). „Uklidnění zaníceného mozku: účinek nesteroidních protizánětlivých léků na patologii Alzheimerovy choroby“. Cíle léků pro CNS a neurologické poruchy. 10 (1): 57–67. doi:10.2174/187152711794488665. PMID 21143138.
- ^ Marjoribanks J, Farquhar C, Roberts H, Lethaby A, Lee J (leden 2017). „Dlouhodobá hormonální terapie pro perimenopauzální a postmenopauzální ženy“. Cochrane Database of Systematic Reviews. 1: CD004143. doi:10.1002 / 14651858.CD004143.pub5. PMC 6465148. PMID 28093732.
- ^ A b Stern Y (červenec 2006). „Kognitivní rezerva a Alzheimerova choroba“. Alzheimerova choroba a související poruchy. 20 (3 doplňky 2): S69–74. doi:10.1097 / 01.wad.0000213815.20177.19. PMID 16917199. S2CID 9827674.
- ^ A b Paradise M, Cooper C, Livingston G (únor 2009). „Systematický přehled vlivu vzdělávání na přežití při Alzheimerově chorobě“. Mezinárodní psychogeriatrie. 21 (1): 25–32. doi:10.1017 / S1041610208008053. PMID 19026089.
- ^ Neergaard L (19. února 2011). „Mluvení dvěma jazyky může Alzheimerovu chorobu oddálit“. Denver Post. Associated Press. Archivovány od originál dne 2. května 2014.
- ^ Cheng ST (září 2016). „Kognitivní rezerva a prevence demence: role fyzických a kognitivních činností“. Aktuální zprávy z psychiatrie. 18 (9): 85. doi:10.1007 / s11920-016-0721-2. PMC 4969323. PMID 27481112.
- ^ Farina N, Rusted J, Tabet N (leden 2014). „Účinek pohybových intervencí na kognitivní výsledek u Alzheimerovy choroby: systematický přehled“. Mezinárodní psychogeriatrie. 26 (1): 9–18. doi:10.1017 / S1041610213001385. PMID 23962667. S2CID 24936334.
- ^ A b C Hu N, Yu JT, Tan L, Wang YL, Sun L, Tan L (2013). „Výživa a riziko Alzheimerovy choroby“. BioMed Research International (Posouzení). 2013: 1–12. doi:10.1155/2013/524820. PMC 3705810. PMID 23865055.
- ^ Solfrizzi V, Panza F, Frisardi V, Seripa D, Logroscino G, Imbimbo BP, Pilotto A (květen 2011). „Dieta a rizikové faktory Alzheimerovy choroby nebo prevence: současné důkazy“. Odborná recenze Neurotherapeutics. 11 (5): 677–708. doi:10.1586 / ern.11.56. PMID 21539488. S2CID 27604317.
- ^ Kanoski SE, Davidson TL (duben 2011). „Západní konzumace stravy a kognitivní poruchy: vazby na hipokampální dysfunkci a obezitu“. Fyziologie a chování (Posouzení). 103 (1): 59–68. doi:10.1016 / j.physbeh.2010.12.003. PMC 3056912. PMID 21167850.
- ^ Solfrizzi V, Capurso C, D'Introno A, Colacicco AM, Santamato A, Ranieri M, Fiore P, Capurso A, Panza F (leden 2008). „Faktory související se životním stylem u syndromů predence a demence“. Odborná recenze Neurotherapeutics. 8 (1): 133–58. doi:10.1586/14737175.8.1.133. PMID 18088206. S2CID 20897989.
- ^ Santos C, Costa J, Santos J, Vaz-Carneiro A, Lunet N (2010). „Příjem kofeinu a demence: systematický přehled a metaanalýza“. Journal of Alzheimer's Disease. 20 Suppl 1: S187–204. doi:10.3233 / JAD-2010-091387. PMID 20182026.
- ^ Nehlig A (březen 2013). „Neuroprotektivní účinky kakaového flavanolu a jeho vliv na kognitivní výkon“. British Journal of Clinical Pharmacology (Posouzení). 75 (3): 716–27. doi:10.1111 / j.1365-2125.2012.04378.x. PMC 3575938. PMID 22775434.
- ^ Stoclet JC, Schini-Kerth V (březen 2011). "[Dietonické flavonoidy a lidské zdraví]". Annales Pharmaceutiques Françaises. 69 (2): 78–90. doi:10.1016 / j.pharma.2010.11.004. PMID 21440100.
- ^ Ono K, Yamada M (duben 2012). "Vitamin A a Alzheimerova choroba". Geriatrie a gerontologie mezinárodní (Posouzení). 12 (2): 180–88. doi:10.1111 / j.1447-0594.2011.00786.x. PMID 22221326. S2CID 205507828.
- ^ Lerner AJ, Gustaw-Rothenberg K, Smyth S, Casadesus G (březen – duben 2012). "Retinoidy pro léčbu Alzheimerovy choroby". Biofaktory. 38 (2): 84–89. doi:10,1002 / biof.196. PMID 22419567. S2CID 27616679.
- ^ Heo JH, Lee KM (březen 2013). „Možná role antioxidačního vitaminu C při léčbě a prevenci Alzheimerovy choroby“. American Journal of Alzheimer's Disease and Other Dementias (Posouzení). 28 (2): 120–25. doi:10.1177/1533317512473193. PMID 23307795. S2CID 27132196.
- ^ Boothby LA, Doering PL (prosinec 2005). "Vitamin C a vitamin E pro Alzheimerovu chorobu". The Annals of Pharmacotherapy. 39 (12): 2073–80. doi:10,1345 / aph. 1E495. PMID 16227450. S2CID 46645284.
- ^ A b Farina N, Llewellyn D, Isaac MG, Tabet N (duben 2017). „Vitamin E pro Alzheimerovu demenci a mírné kognitivní poruchy“. Cochrane Database of Systematic Reviews. 4: CD002854. doi:10.1002 / 14651858.CD002854.pub5. PMC 6478142. PMID 28418065.
- ^ Loef M, Schrauzer GN, Walach H (2011). „Selenium a Alzheimerova choroba: systematický přehled“. Journal of Alzheimer's Disease (Posouzení). 26 (1): 81–104. doi:10.3233 / JAD-2011-110414. PMID 21593562. S2CID 30661765.
- ^ Loef M, von Stillfried N, Walach H (září 2012). „Zinková strava a Alzheimerova choroba: systematický přehled“. Nutriční neurovědy (Posouzení). 15 (5): 2–12. doi:10.1179 / 1476830512Y.0000000010. PMID 22583839. S2CID 23381337.
- ^ Avan A, Hoogenraad TU (2015). „Zinek a měď u Alzheimerovy choroby“. Journal of Alzheimer's Disease (Posouzení). 46 (1): 89–92. doi:10,3233 / JAD-150186. PMID 25835420.
- ^ Malouf R, Grimley Evans J (říjen 2008). „Kyselina listová s vitaminem B12 nebo bez něj pro prevenci a léčbu zdravých starších lidí a lidí s demencí“. Cochrane Database of Systematic Reviews (4): CD004514. doi:10.1002 / 14651858.CD004514.pub2. PMID 18843658.
- ^ Wald DS, Kasturiratne A, Simmonds M (červen 2010). „Vliv kyseliny listové, s jinými vitamíny B nebo bez nich, na kognitivní pokles: metaanalýza randomizovaných studií“. American Journal of Medicine. 123 (6): 522–527.e2. doi:10.1016 / j.amjmed.2010.01.017. PMID 20569758.
- ^ Cunnane SC, Chouinard-Watkins R, Castellano CA, Barberger-Gateau P (leden 2013). „Homeostáza kyseliny dokosahexaenové, stárnutí mozku a Alzheimerova choroba: Můžeme sladit důkazy?“. Prostaglandiny, leukotrieny a esenciální mastné kyseliny. 88 (1): 61–70. doi:10.1016 / j.plefa.2012.04.006. PMID 22575581.
- ^ Burckhardt M, Herke M, Wustmann T, Watzke S, Langer G, Fink A (duben 2016). „Omega-3 mastné kyseliny pro léčbu demence“. Cochrane Database of Systematic Reviews. 4: CD009002. doi:10.1002 / 14651858.CD009002.pub3. PMC 7117565. PMID 27063583.
- ^ Hamaguchi T, Ono K, Yamada M (říjen 2010). „RECENZE: Kurkumin a Alzheimerova choroba“. CNS Neuroscience & Therapeutics (Posouzení). 16 (5): 285–97. doi:10.1111 / j.1755-5949.2010.00147.x. PMC 6493893. PMID 20406252.
- ^ Birks J, Grimley Evans J (leden 2009). „Ginkgo biloba pro kognitivní poruchy a demenci“. Cochrane Database of Systematic Reviews (1): CD003120. doi:10.1002 / 14651858.CD003120.pub3. PMID 19160216.
- ^ Krishnan S, Cairns R, Howard R (duben 2009). Krishnan S (ed.). „Kanabinoidy k léčbě demence“. Cochrane Database of Systematic Reviews (2): CD007204. doi:10.1002 / 14651858.CD007204.pub2. PMC 7197039. PMID 19370677.
- ^ Bilkei-Gorzo A (prosinec 2012). „Endokanabinoidní systém v normálním a patologickém stárnutí mozku“. Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 367 (1607): 3326–41. doi:10.1098 / rstb.2011.0388. PMC 3481530. PMID 23108550.
- ^ A b C Birks JS, Harvey RJ (červen 2018). „Donepezil pro demenci v důsledku Alzheimerovy choroby“. Cochrane Database of Systematic Reviews. 6: CD001190. doi:10.1002 / 14651858.CD001190.pub3. PMC 6513124. PMID 29923184.
- ^ A b Birks JS, Grimley Evans J (Duben 2015). Birks JS (ed.). "Rivastigmin pro Alzheimerovu chorobu". Cochrane Database of Systematic Reviews (4): CD001191. doi:10.1002 / 14651858.CD001191.pub3. PMID 25858345.
- ^ Fink HA, Linskens EJ, MacDonald R a kol. (Květen 2020). „Výhody a poškození léků na předpis a doplňků pro léčbu klinické demence Alzheimerovy choroby“. Annals of Internal Medicine. 172 (10): 656–668. doi:10,7326 / M19-3887. PMID 32340037. S2CID 216595473.
- ^ Geula C, Mesulam MM (1995). "Cholinesterázy a patologie Alzheimerovy choroby". Alzheimerova choroba a související poruchy. 9 Suppl 2: 23–28. doi:10.1097/00002093-199501002-00005. PMID 8534419.
- ^ Stahl SM (listopad 2000). „Nové inhibitory cholinesterázy pro Alzheimerovu chorobu, část 2: ilustrující jejich mechanismy působení“. The Journal of Clinical Psychiatry. 61 (11): 813–14. doi:10.4088 / JCP.v61n1101. PMID 11105732.
- ^ A b Birks J (leden 2006). Birks J. (ed.). "Inhibitory cholinesterázy pro Alzheimerovu chorobu". Cochrane Database of Systematic Reviews (1): CD005593. doi:10.1002 / 14651858.CD005593. PMID 16437532.
- ^ Raschetti R, Albanese E, Vanacore N, Maggini M (listopad 2007). „Inhibitory cholinesterázy u mírných kognitivních poruch: systematický přehled randomizovaných studií“. PLOS Medicine. 4 (11): e338. doi:10.1371 / journal.pmed.0040338. PMC 2082649. PMID 18044984.
- ^ Alldredge BK, Corelli RL, Ernst ME, Guglielmo BJ, Jacobson PA, Kradjan WA, Williams BR (2013). Aplikovaná terapeutika: klinické užívání drog (10. vydání). Baltimore: Wolters Kluwer Health / Lippincott Williams & Wilkins. str. 2385. ISBN 978-1-60913-713-7.
- ^ A b Lipton SA (únor 2006). „Posun paradigmatu v neuroprotekci blokádou NMDA receptorů: memantin a další“. Recenze přírody. Objev drog. 5 (2): 160–70. doi:10.1038 / nrd1958. PMID 16424917. S2CID 21379258.
- ^ "Memantine". Americká národní lékařská knihovna (Medline). 4. ledna 2004. Archivovány od originál dne 22. února 2010. Citováno 3. února 2010.
- ^ McShane R, Westby MJ, Roberts E, Minakaran N, Schneider L, Farrimond LE, Maayan N, Ware J, Debarros J (květen 2019). „Memantin na demenci“. Cochrane Database of Systematic Reviews. 3 (3): CD003154. doi:10.1002 / 14651858.CD003154.pub6. PMC 6425228. PMID 30891742.
- ^ "Informace o předepisování přípravku Namenda" (PDF). Forest Pharmaceuticals. Archivovány od originál (PDF) dne 27. února 2008. Citováno 19. února 2008. (primární zdroj)
- ^ Raina P, Santaguida P, Ismaila A, Patterson C, Cowan D, Levine M, Booker L, Oremus M (březen 2008). „Účinnost inhibitorů cholinesterázy a memantinu při léčbě demence: přezkoumání důkazů pro pokyny klinické praxe“. Annals of Internal Medicine. 148 (5): 379–97. doi:10.7326/0003-4819-148-5-200803040-00009. PMID 18316756. S2CID 22235353.
- ^ Ballard C, Waite J (leden 2006). Ballard CG (ed.). „Účinnost atypických antipsychotik při léčbě agrese a psychózy u Alzheimerovy choroby“. Cochrane Database of Systematic Reviews (1): CD003476. doi:10.1002 / 14651858.CD003476.pub2. PMID 16437455.
- ^ Ballard C, Hanney ML, Theodoulou M, Douglas S, McShane R, Kossakowski K, Gill R, Juszczak E, Yu LM, Jacoby R (únor 2009). „Studie vysazení antipsychotik proti demenci (DART-AD): dlouhodobé sledování randomizované placebem kontrolované studie“. Lancetová neurologie. 8 (2): 151–57. doi:10.1016 / S1474-4422 (08) 70295-3. PMID 19138567. S2CID 23000439. Shrnutí ležel.
- ^ Declercq T, Petrovic M, Azermai M, Vander Stichele R, De Sutter AI, van Driel ML, Christiaens T (březen 2013). „Vysazení versus pokračování chronických antipsychotik na chování a psychologické příznaky u starších lidí s demencí“ (PDF). Cochrane Database of Systematic Reviews. 3 (3): CD007726. doi:10.1002 / 14651858.CD007726.pub2. hdl:1854 / LU-3109108. PMID 23543555.
- ^ A b C d E F G Rabins PV, Blacker D, Rovner BW a kol. (Řídící výbor pro praktické pokyny) (prosinec 2007). „Pravidla praxe Americké psychiatrické asociace pro léčbu pacientů s Alzheimerovou chorobou a jinými demencemi. Druhé vydání“. American Journal of Psychiatry. 164 (12 doplňků): 5–56. PMID 18340692.
- ^ Bottino CM, Carvalho IA, Alvarez AM a kol. (Prosinec 2005). „Kognitivní rehabilitace v kombinaci s medikamentózní léčbou u pacientů s Alzheimerovou chorobou: pilotní studie“. Klinická rehabilitace. 19 (8): 861–69. doi:10.1191 / 0269215505cr911oa. PMID 16323385. S2CID 21290731.
- ^ Doody RS, Stevens JC, Beck C a kol. (Květen 2001). „Praktický parametr: léčba demence (revize založená na důkazech). Zpráva subkomise pro standardy kvality Americké neurologické akademie“. Neurologie. 56 (9): 1154–66. doi:10.1212 / WNL.56.9.1154. PMID 11342679. S2CID 10711725.
- ^ Hermans DG, Htay UH, McShane R (leden 2007). „Nefarmakologické intervence pro putování lidí s demencí v domácím prostředí“. Cochrane Database of Systematic Reviews (1): CD005994. doi:10.1002 / 14651858.CD005994.pub2. PMC 6669244. PMID 17253573.
- ^ Robinson L, Hutchings D, Dickinson HO, Corner L, Beyer F, Finch T, Hughes J, Vanoli A, Ballard C, Bond J (leden 2007). „Účinnost a přijatelnost nefarmakologických intervencí ke snížení putování demencí: systematický přehled“. International Journal of Geriatric Psychiatry. 22 (1): 9–22. doi:10,1002 / gps.1643. PMID 17096455. S2CID 45660235.
- ^ Abraha I, Rimland JM, Trotta FM, Dell'Aquila G, Cruz-Jentoft A, Petrovic M, Gudmundsson A, Soiza R, O'Mahony D, Guaita A, Cherubini A (březen 2017). „Systematický přehled systematických přehledů nefarmakologických intervencí k léčbě poruch chování u starších pacientů s demencí. Série SENATOR-OnTop“. BMJ Otevřeno. 7 (3): e012759. doi:10.1136 / bmjopen-2016-012759. PMC 5372076. PMID 28302633.
- ^ Chung JC, Lai CK, Chung PM, French HP (2002). „Snoezelen pro demenci“. Cochrane Database of Systematic Reviews (4): CD003152. doi:10.1002 / 14651858.CD003152. PMID 12519587.
- ^ Woods B, O'Philbin L, Farrell EM, Spector AE, Orrell M (březen 2018). „Reminiscenční terapie demence“. Cochrane Database of Systematic Reviews. 3: CD001120. doi:10.1002 / 14651858.CD001120.pub3. PMC 6494367. PMID 29493789.
- ^ Zetteler J (listopad 2008). „Účinnost simulované terapie přítomnosti u jedinců s demencí: systematický přehled a metaanalýza“. Stárnutí a duševní zdraví. 12 (6): 779–85. doi:10.1080/13607860802380631. PMID 19023729. S2CID 39529938.
- ^ Neal M, Barton Wright P (2003). Neal M (ed.). "Validační terapie pro demenci". Cochrane Database of Systematic Reviews (3): CD001394. doi:10.1002 / 14651858.CD001394. PMID 12917907.
- ^ Chung JC, Lai CK, Chung PM, French HP (2002). Chung JC (ed.). „Snoezelen pro demenci“. Cochrane Database of Systematic Reviews (4): CD003152. doi:10.1002 / 14651858.CD003152. PMID 12519587. (aktuální od roku 2009)
- ^ Spector A, Thorgrimsen L, Woods B, Royan L, Davies S, Butterworth M, Orrell M (září 2003). „Účinnost programu kognitivní stimulační terapie založeného na důkazech u lidí s demencí: randomizovaná kontrolovaná studie“. British Journal of Psychiatry. 183 (3): 248–54. doi:10.1192 / bjp.183.3.248. PMID 12948999.
- ^ Gitlin LN, Corcoran M, Winter L, Boyce A, Hauck WW (únor 2001). „Randomizovaná, kontrolovaná studie zásahu do domácího prostředí: účinek na účinnost a rozrušení u pečovatelů a na každodenní funkci osob s demencí“. Gerontolog. 41 (1): 4–14. doi:10.1093 / geront / 41.1.4. PMID 11220813.
- ^ Gitlin LN, Hauck WW, Dennis MP, Winter L (březen 2005). „Zachování účinků domácího environmentálního programu budování dovedností pro pečovatele v rodině a jednotlivce s Alzheimerovou chorobou a souvisejícími poruchami“. Časopisy gerontologie. Série A, Biologické vědy a Lékařské vědy. 60 (3): 368–74. doi:10.1093 / gerona / 60.3.368. PMID 15860476.
- ^ „Léčba behaviorálních a psychiatrických příznaků“. Alzheimerova asociace. 2006. Archivovány od originál dne 25. září 2006. Citováno 25. září 2006.
- ^ Dunne TE, Neargarder SA, Cipolloni PB, Cronin-Golomb A (srpen 2004). „Vizuální kontrast zvyšuje příjem potravy a tekutin u pokročilé Alzheimerovy choroby“. Klinická výživa. 23 (4): 533–38. doi:10.1016 / j.clnu.2003.09.015. PMID 15297089.
- ^ Dudek SB (2007). Nutriční základy pro ošetřovatelskou praxi. Hagerstown, Maryland: Lippincott Williams & Wilkins. str. 360. ISBN 978-0-7817-6651-7. Citováno 19. srpna 2008.
- ^ Dennehy C (2006). "Analýza práv pacientů: demence a zavedení PEG". British Journal of Nursing. 15 (1): 18–20. doi:10.12968 / bjon.2006.15.1.20303. PMID 16415742.
- ^ Chernoff R (duben 2006). "Trubice krmení pacientů s demencí". Výživa v klinické praxi. 21 (2): 142–46. doi:10.1177/0115426506021002142. PMID 16556924.
- ^ Gambassi G, Landi F, Lapane KL, Sgadari A, Mor V, Bernabei R (červenec 1999). „Prediktory úmrtnosti u pacientů s Alzheimerovou chorobou žijících v domovech s pečovatelskou službou“. Časopis neurologie, neurochirurgie a psychiatrie. 67 (1): 59–65. doi:10.1136 / jnnp.67.1.59. PMC 1736445. PMID 10369823.
- ^ Lékařské problémy:
- Hlava B (leden 2003). „Paliativní péče o osoby s demencí“. Domácí zdravotní sestra. 21 (1): 53–60, kvíz 61. doi:10.1097/00004045-200301000-00012. PMID 12544465.
- Friedlander AH, Norman DC, Mahler ME, Norman KM, Yagiela JA (září 2006). „Alzheimerova choroba: psychopatologie, lékařská péče a zubní důsledky“. Journal of the American Dental Association. 137 (9): 1240–51. doi:10.14219 / jada.archive.2006.0381. PMID 16946428.
- Belmin J (2007). „Praktické pokyny pro diagnostiku a zvládání úbytku hmotnosti u Alzheimerovy choroby: shoda z hodnocení vhodnosti velkého panelu odborníků“. The Journal of Nutrition, Health & Aging. 11 (1): 33–37. PMID 17315078.
- McCurry SM, Gibbons LE, Logsdon RG, Vitiello M, Teri L (říjen 2003). „Školení pečovatelů o změně postupů hygieny spánku pacientů s demencí: projekt NITE-AD“. Journal of the American Geriatrics Society. 51 (10): 1455–60. doi:10.1046 / j.1532-5415.2003.51466.x. PMID 14511168. S2CID 24065377.
- Perls TT, Herget M (prosinec 1995). „Vyšší míra infekce dýchacích cest na Alzheimerově jednotce speciální péče a úspěšný zásah“. Journal of the American Geriatrics Society. 43 (12): 1341–44. doi:10.1111 / j.1532-5415.1995.tb06611.x. PMID 7490383. S2CID 30067677.
- ^ Shega JW, Levin A, Hougham GW, Cox-Hayley D, Luchins D, Hanrahan P, Stocking C, Sachs GA (duben 2003). „Paliativní excelence v úsilí o Alzheimerovou péči (PEACE): popis programu“. Journal of Paliative Medicine. 6 (2): 315–20. doi:10.1089/109662103764978641. PMID 12854952. S2CID 6072807.
- ^ A b Zanetti O, Solerte SB, Cantoni F (2009). „Očekávaná délka života u Alzheimerovy choroby (AD)“. Archivy gerontologie a geriatrie. 49 Suppl 1: 237–43. doi:10.1016 / j.archger.2009.09.035. PMID 19836639.
- ^ A b Mölsä PK, Marttila RJ, Rinne UK (březen 1995). „Dlouhodobé přežití a prediktory úmrtnosti na Alzheimerovu chorobu a demenci s více infarkty“. Acta Neurologica Scandinavica. 91 (3): 159–64. doi:10.1111 / j.1600-0404.1995.tb00426.x. PMID 7793228. S2CID 19724937.
- ^ Bowen JD, Malter AD, Sheppard L, Kukull WA, McCormick WC, Teri L, Larson EB (srpen 1996). „Prediktory úmrtnosti u pacientů s diagnostikovanou pravděpodobnou Alzheimerovou chorobou“. Neurologie. 47 (2): 433–39. doi:10.1212 / týden 47.2.433. PMID 8757016. S2CID 24961809.
- ^ Larson EB, Shadlen MF, Wang L, McCormick WC, Bowen JD, Teri L, Kukull WA (duben 2004). "Přežití po počáteční diagnóze Alzheimerovy choroby". Annals of Internal Medicine. 140 (7): 501–09. doi:10.7326/0003-4819-140-7-200404060-00008. PMID 15068977. S2CID 27410149.
- ^ Jagger C, Clarke M, Stone A (leden 1995). „Prediktory přežití s Alzheimerovou chorobou: komunitní studie“. Psychologická medicína. 25 (1): 171–77. doi:10.1017 / S0033291700028191. PMID 7792352.
- ^ Dodge HH, Shen C, Pandav R, DeKosky ST, Ganguli M (únor 2003). "Funkční přechody a střední délka života související s Alzheimerovou chorobou". Archivy neurologie. 60 (2): 253–59. doi:10.1001 / archneur.60.2.253. PMID 12580712.
- ^ A b Ganguli M, Dodge HH, Shen C, Pandav RS, DeKosky ST (květen 2005). „Alzheimerova choroba a úmrtnost: patnáctiletá epidemiologická studie“. Archivy neurologie. 62 (5): 779–84. doi:10.1001 / archneur.62.5.779. PMID 15883266.
- ^ A b C Bermejo-Pareja F, Benito-León J, Vega S, Medrano MJ, Román GC (leden 2008). „Výskyt a podtypy demence u tří starších populací ve středním Španělsku“. Časopis neurologických věd. 264 (1–2): 63–72. doi:10.1016 / j.jns.2007.07.021. PMID 17727890. S2CID 34341344.
- ^ A b C Di Carlo A, Baldereschi M, Amaducci L, Lepore V, Bracco L, Maggi S, Bonaiuto S, Perissinotto E, Scarlato G, Farchi G, Inzitari D (leden 2002). „Výskyt demence, Alzheimerovy choroby a vaskulární demence v Itálii. Studie ILSA“. Journal of the American Geriatrics Society. 50 (1): 41–48. doi:10.1046 / j.1532-5415.2002.50006.x. PMID 12028245. S2CID 22576935.
- ^ Andersen K, Launer LJ, Dewey ME a kol. (Prosinec 1999). „Genderové rozdíly ve výskytu AD a vaskulární demence: studie EURODEM. EURODEM Incidence Research Group“. Neurologie. 53 (9): 1992–97. doi:10.1212 / mn.53.9.1992. PMID 10599770. S2CID 22725252.
- ^ Tejada-Vera B. (2013). Úmrtnost na Alzheimerovu chorobu ve Spojených státech: Údaje za roky 2000 a 2010. Hyattsville, MD: Americké ministerstvo zdravotnictví a sociálních služeb, Centra pro kontrolu a prevenci nemocí, Národní středisko pro statistiku ve zdravotnictví.
- ^ 2000 odhady USA:
- Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA (srpen 2003). „Alzheimerova choroba v populaci USA: odhady prevalence na základě sčítání lidu z roku 2000“. Archivy neurologie. 60 (8): 1119–22. doi:10.1001 / archneur.60.8.1119. PMID 12925369.
- „Profily obecných demografických charakteristik, sčítání lidu, domů a bytů v roce 2000, USA“ (PDF). Americký úřad pro sčítání lidu. 2001. Archivovány od originál (PDF) dne 19. srpna 2008. Citováno 27. srpna 2008.
- ^ A b Ferri CP, Prince M, Brayne C, Brodaty H, Fratiglioni L, Ganguli M, Hall K, Hasegawa K, Hendrie H, Huang Y, Jorm A, Mathers C, Menezes PR, Rimmer E, Scazufca M (prosinec 2005). „Globální prevalence demence: studie konsensu v Delphi“. Lanceta. 366 (9503): 2112–17. doi:10.1016 / S0140-6736 (05) 67889-0. PMC 2850264. PMID 16360788.
- ^ Světová zdravotnická organizace (2006). Neurologické poruchy: výzvy v oblasti veřejného zdraví. Švýcarsko: Světová zdravotnická organizace. 204–07. ISBN 978-92-4-156336-9. Archivovány od originál dne 10. února 2010.
- ^ Odhad prevalence 2006:
- Brookmeyer R, Johnson E, Ziegler-Graham K, Arrighi HM (červenec 2007). „Předpověď globální zátěže Alzheimerovou chorobou“. Alzheimerova choroba a demence. 3 (3): 186–91. CiteSeerX 10.1.1.729.847. doi:10.1016 / j.jalz.2007.04.381. PMID 19595937. S2CID 15536204. Archivovány od originál dne 7. prosince 2008. Citováno 18. června 2008.
- „Hlavní body“ (PDF). Perspektivy světové populace: revize z roku 2006. Pracovní dokument č. ESA / P / WP.202. Populační oddělení, ministerstvo ekonomických a sociálních věcí, OSN. 2007. Archivovány od originál (PDF) dne 19. srpna 2008. Citováno 27. srpna 2008.
- ^ Auguste D .:
- Alzheimer A (1907). „Über eine eigenartige Erkrankung der Hirnrinde“ [O zvláštním onemocnění mozkové kůry]. Allgemeine Zeitschrift für Psychiatrie und Psychisch-Gerichtlich Medizin (v němčině). 64 (1–2): 146–48.
- Alzheimer A (1987). Přeložil H. Greenson. „O zvláštním onemocnění mozkové kůry. Alois Alzheimer, 1907 (Přeložil L. Jarvik a H. Greenson)“. Alzheimerova choroba a související poruchy. 1 (1): 3–8. PMID 3331112.
- Ulrike M, Konrad M (2003). Alzheimerova choroba: Život lékaře a kariéra nemoci. New York: Columbia University Press. str.270. ISBN 978-0-231-11896-5.
- ^ Berrios GE (1990). „Alzheimerova choroba: Konceptuální historie“. Int. J. Geriatr. Psychiatrie. 5 (6): 355–65. doi:10,1002 / gps.930050603. S2CID 145155424.
- ^ Kraepelin Emil (2007). Klinická psychiatrie: Učebnice pro studenty a lékaře (dotisk). Přeložil Diefendorf A. Ross. Kessinger Publishing. str. 568. ISBN 978-1-4325-0833-3.
- ^ Katzman R, Terry RD, Bick KL, eds. (1978). Alzheimerova choroba: senilní demence a související poruchy. New York: Raven Press. str. 595. ISBN 978-0-89004-225-0.
- ^ Boller F, Forbes MM (červen 1998). "Historie demence a demence v historii: přehled". Časopis neurologických věd. 158 (2): 125–33. doi:10.1016 / S0022-510X (98) 00128-2. PMID 9702682. S2CID 42399340.
- ^ Amaducci LA, Rocca WA, Schoenberg BS (listopad 1986). „Původ rozdílu mezi Alzheimerovou chorobou a senilní demencí: jak historie může objasnit nosologii“. Neurologie. 36 (11): 1497–9. doi:10.1212 / ml. 36.11.1497. PMID 3531918. S2CID 7689479.
- ^ Allegri RF, Butman J, Arizaga RL, Machnicki G, Serrano C, Taragano FE, Sarasola D, Lon L (srpen 2007). „Ekonomický dopad demence v rozvojových zemích: vyhodnocení nákladů na demenci Alzheimerova typu v Argentině“. Mezinárodní psychogeriatrie. 19 (4): 705–18. doi:10.1017 / S1041610206003784. PMID 16870037. S2CID 41247271.
- ^ Suh GH, Knapp M, Kang CJ (srpen 2006). „Ekonomické náklady na demenci v Koreji, 2002“. International Journal of Geriatric Psychiatry. 21 (8): 722–28. doi:10,1002 / gps.1552. PMID 16858741. S2CID 24138151.
- ^ Wimo A, Jonsson L, Winblad B (2006). „Odhad celosvětové prevalence a přímých nákladů na demenci v roce 2003“. Demence a geriatrické kognitivní poruchy. 21 (3): 175–81. doi:10.1159/000090733. PMID 16401889. S2CID 11304720.
- ^ A b C Moore MJ, Zhu CW, Clipp EC (červenec 2001). „Neformální náklady na péči o demenci: odhady z Národní studie longitudinální péče“. Časopisy gerontologie. Řada B, Psychologické a sociální vědy. 56 (4): S219–28. doi:10.1093 / geronb / 56.4.S219. PMID 11445614.
- ^ Jönsson L, Eriksdotter Jönhagen M, et al. (Květen 2006). „Determinanty nákladů na péči o pacienty s Alzheimerovou chorobou“. International Journal of Geriatric Psychiatry. 21 (5): 449–59. doi:10,1002 / gps.1489. PMID 16676288. S2CID 20193233.
- ^ A b „Studie MetLife o Alzheimerově chorobě: zkušenost s péčí“ (PDF). Institut pro zralý trh MetLife. Srpen 2006. Archivovány od originál (PDF) dne 8. ledna 2011. Citováno 5. února 2011.
- ^ Schneider J, Murray J, Banerjee S, Mann A (srpen 1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I – Factors associated with carer burden". International Journal of Geriatric Psychiatry. 14 (8): 651–61. doi:10.1002/(SICI)1099-1166(199908)14:8<651::AID-GPS992>3.0.CO;2-B. PMID 10489656.
- ^ Murray J, Schneider J, Banerjee S, Mann A (August 1999). "EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II – A qualitative analysis of the experience of caregiving". International Journal of Geriatric Psychiatry. 14 (8): 662–67. doi:10.1002/(SICI)1099-1166(199908)14:8<662::AID-GPS993>3.0.CO;2-4. PMID 10489657.
- ^ A b Zhu CW, Sano M (2006). "Economic considerations in the management of Alzheimer's disease". Klinické intervence při stárnutí. 1 (2): 143–54. doi:10.2147/ciia.2006.1.2.143. PMC 2695165. PMID 18044111.
- ^ Gaugler JE, Kane RL, Kane RA, Newcomer R (April 2005). "Early community-based service utilization and its effects on institutionalization in dementia caregiving". Gerontolog. 45 (2): 177–85. doi:10.1093/geront/45.2.177. PMID 15799982.
- ^ Ritchie K, Lovestone S (November 2002). "The dementias". Lanceta. 360 (9347): 1759–66. doi:10.1016/S0140-6736(02)11667-9. PMID 12480441. S2CID 21404062.
- ^ Brodaty H, Hadzi-Pavlovic D (September 1990). "Psychosocial effects on carers of living with persons with dementia". The Australian and New Zealand Journal of Psychiatry. 24 (3): 351–61. doi:10.3109/00048679009077702. PMID 2241719. S2CID 11788466.
- ^ Donaldson C, Tarrier N, Burns A (April 1998). "Determinants of carer stress in Alzheimer's disease". International Journal of Geriatric Psychiatry. 13 (4): 248–56. doi:10.1002/(SICI)1099-1166(199804)13:4<248::AID-GPS770>3.0.CO;2-0. PMID 9646153.
- ^ Pusey H, Richards D (May 2001). "A systematic review of the effectiveness of psychosocial interventions for carers of people with dementia". Stárnutí a duševní zdraví. 5 (2): 107–19. doi:10.1080/13607860120038302. PMID 11511058. S2CID 32517015.
- ^ Bayley J (2000). Iris: A Memoir of Iris Murdoch. London: Abacus. ISBN 978-0-349-11215-2. OCLC 41960006.
- ^ Sparks N (1996). The notebook. Thorndike, Maine: Thorndike Press. str.268. ISBN 978-0-7862-0821-0.
- ^ "Thanmathra". Webindia123.com. Archivovány od originál dne 6. listopadu 2007. Citováno 24. ledna 2008.
- ^ Ogiwara H (2004). Ashita no Kioku (v japonštině). Tōkyō: Kōbunsha. ISBN 978-4-334-92446-1. OCLC 57352130.
- ^ Munro A (2001). Hateship, Friendship, Courtship, Loveship, Marriage: Stories. New York: A.A. Knopf. ISBN 978-0-375-41300-1. OCLC 46929223.
- ^ "Malcolm and Barbara: A love story". Dfgdocs. Archivovány od originál dne 24. května 2008. Citováno 24. ledna 2008.
- ^ "Malcolm and Barbara: A love story". BBC Cambridgeshire. Archivovány od originál dne 10. listopadu 2012. Citováno 2. března 2008.
- ^ Plunkett J (7 August 2007). "Alzheimer's film-maker to face ITV lawyers". London: Guardian Media. Archivovány od originál dne 15. ledna 2008. Citováno 24. ledna 2008.
- ^ Cummings JL, Morstorf T, Zhong K (July 2014). „Ropovod vývoje léků proti Alzheimerově chorobě: málo kandidátů, časté neúspěchy“. Alzheimer's Research & Therapy. 6 (4): 37. doi:10.1186 / alzrt269. PMC 4095696. PMID 25024750.
- ^ Gutis, Phillip S. (22 March 2019). "An Alzheimer's Drug Trial Gave Me Hope, and Then It Ended". The New York Times. Citováno 25. března 2019.
- ^ Lashuel HA, Hartley DM, Balakhaneh D, Aggarwal A, Teichberg S, Callaway DJ (November 2002). "New class of inhibitors of amyloid-beta fibril formation. Implications for the mechanism of pathogenesis in Alzheimer's disease". The Journal of Biological Chemistry. 277 (45): 42881–90. doi:10.1074/jbc.M206593200. PMID 12167652.
- ^ Dodel R, Neff F, Noelker C, Pul R, Du Y, Bacher M, Oertel W (March 2010). "Intravenous immunoglobulins as a treatment for Alzheimer's disease: rationale and current evidence". Drogy. 70 (5): 513–28. doi:10.2165/11533070-000000000-00000. PMID 20329802. S2CID 40577156. Archivovány od originál dne 17. září 2011.
- ^ Očkování:
- Hawkes CA, McLaurin J (November 2007). "Immunotherapy as treatment for Alzheimer's disease". Odborná recenze Neurotherapeutics. 7 (11): 1535–48. doi:10.1586/14737175.7.11.1535. PMID 17997702. S2CID 41759093.
- Solomon B (June 2007). "Clinical immunologic approaches for the treatment of Alzheimer's disease". Znalecký posudek na vyšetřované léky. 16 (6): 819–28. doi:10.1517/13543784.16.6.819. PMID 17501694. S2CID 45559356.
- Woodhouse A, Dickson TC, Vickers JC (2007). "Vaccination strategies for Alzheimer's disease: A new hope?". Drogy a stárnutí. 24 (2): 107–19. doi:10.2165/00002512-200724020-00003. PMID 17313199. S2CID 28279428.
- ^ "Study Evaluating ACC-001 in Mild to Moderate Alzheimers Disease Subjects". Klinická studie. Americké národní instituty zdraví. 11. března 2008. Archivovány od originál dne 30. července 2013. Citováno 5. června 2008.
- ^ "Study Evaluating Safety, Tolerability, and Immunogenicity of ACC-001 in Subjects with Alzheimer's Disease". Americké národní instituty zdraví. Archivovány od originál dne 29. října 2008. Citováno 5. června 2008.
- ^ "Alzheimer's Disease Vaccine Trial Suspended on Safety Concern". Medpage Today. 18. dubna 2008. Archivovány od originál dne 23. dubna 2008. Citováno 14. června 2008.
- ^ "Bapineuzumab in Patients with Mild to Moderate Alzheimer's Disease/ Apo_e4 Non-carriers" (Klinická studie). Americké národní instituty zdraví. 29. února 2008. Archivovány od originál dne 22. března 2008. Citováno 23. března 2008.
- ^ Sperling RA, Jack CR, Black SE, Frosch MP, Greenberg SM, Hyman BT, Scheltens P, Carrillo MC, Thies W, Bednar MM, Black RS, Brashear HR, Grundman M, Siemers ER, Feldman HH, Schindler RJ (July 2011). "Amyloid-related imaging abnormalities in amyloid-modifying therapeutic trials: recommendations from the Alzheimer's Association Research Roundtable Workgroup". Alzheimerova choroba a demence. 7 (4): 367–85. doi:10.1016/j.jalz.2011.05.2351. PMC 3693547. PMID 21784348.
- ^ "Safety, Tolerability and Efficacy Study to Evaluate Subjects with Mild Cognitive Impairment" (Klinická studie). Americké národní instituty zdraví. 11. března 2008. Archivovány od originál dne 22. října 2008. Citováno 23. března 2008.
- ^ "Study Evaluating the Safety, Tolerability and Efficacy of PBT2 in Patients with Early Alzheimer's Disease" (Klinická studie). Americké národní instituty zdraví. 13. ledna 2008. Archivovány od originál on 31 August 2008. Citováno 23. března 2008.
- ^ Etanercept research:
- Tobinick E (September 2009). "Tumour necrosis factor modulation for treatment of Alzheimer's disease: rationale and current evidence". Léky na CNS. 23 (9): 713–25. doi:10.2165/11310810-000000000-00000. PMID 19689163. S2CID 5267301.
- Tobinick E, Gross H, Weinberger A, Cohen H (April 2006). "TNF-alpha modulation for treatment of Alzheimer's disease: a 6-month pilot study". MedGenMed. 8 (2): 25. PMC 1785182. PMID 16926764.
- Griffin WS (January 2008). "Perispinal etanercept: potential as an Alzheimer therapeutic". Journal of Neuroinflammation. 5: 3. doi:10.1186/1742-2094-5-3. PMC 2241592. PMID 18186919.
- Tobinick E (December 2007). "Perispinal etanercept for treatment of Alzheimer's disease". Současný výzkum Alzheimerovy choroby. 4 (5): 550–52. doi:10.2174/156720507783018217. PMID 18220520.
- Cheng X, Shen Y, Li R (November 2014). "Targeting TNF: a therapeutic strategy for Alzheimer's disease". Drug Discovery Today. 19 (11): 1822–27. doi:10.1016/j.drudis.2014.06.029. PMID 24998784.
- ^ Wischik CM, Bentham P, Wischik DJ, Seng KM (July 2008). "Tau aggregation inhibitor (TAI) therapy with remberTM arrests disease progression in mild and moderate Alzheimer's disease over 50 weeks". Alzheimerova choroba a demence. 4 (4): T167. doi:10.1016/j.jalz.2008.05.438. S2CID 54291555. Citováno 30. července 2008.
- ^ Harrington C, Rickard J, Horsley D (July 2008). "Methylthioninium chloride (MTC) acts as a tau aggregation inhibitor (TAI) in a cellular model and reverses tau pathology in transgenic mouse models of Alzheimer's disease". Alzheimerova choroba a demence. 4 (4): T120–21. doi:10.1016/j.jalz.2008.05.259. S2CID 54427606.
- ^ Doody RS, Gavrilova SI, Sano M, Thomas RG, Aisen PS, Bachurin SO, Seely L, Hung D (July 2008). "Effect of dimebon on cognition, activities of daily living, behaviour, and global function in patients with mild-to-moderate Alzheimer's disease: a randomised, double-blind, placebo-controlled study". Lanceta. 372 (9634): 207–15. doi:10.1016/S0140-6736(08)61074-0. PMID 18640457. S2CID 205951657.
- ^ Bezprozvanny I (October 2010). "The rise and fall of Dimebon". Drogové novinky a perspektivy (Původní článek). 23 (8): 518–23. doi:10.1358/dnp.2010.23.8.1500435. PMC 3922928. PMID 21031168.
- ^ "Pfizer And Medivation announce results from two phase 3 studies in Dimebon (latrepirdine*) Alzheimer's disease clinical development program (NASDAQ:MDVN)" (Tisková zpráva). Archivovány od originál dne 4. září 2012. Citováno 16. listopadu 2012.
- ^ Wendler A, Wehling M (March 2012). "Translatability scoring in drug development: eight case studies". Journal of Translational Medicine. 10 (1): 39. doi:10.1186/1479-5876-10-39. PMC 3330010. PMID 22397594.
- ^ Baddeley TC, McCaffrey J, Storey JM, Cheung JK, Melis V, Horsley D, Harrington CR, Wischik CM (January 2015). "Complex disposition of methylthioninium redox forms determines efficacy in tau aggregation inhibitor therapy for Alzheimer's disease". The Journal of Pharmacology and Experimental Therapeutics. 352 (1): 110–18. doi:10.1124/jpet.114.219352. PMID 25320049. S2CID 206501788.
- ^ Wischik CM, Harrington CR, Storey JM (April 2014). "Tau-aggregation inhibitor therapy for Alzheimer's disease". Biochemická farmakologie. 88 (4): 529–39. doi:10.1016/j.bcp.2013.12.008. PMID 24361915.
- ^ Feuerstein A (14 February 2017). "Merck Alzheimer's Drug Study Halted Early for Futility". New York City: TheStreet, Inc. Archived from originál dne 16. února 2017.Merck Alzheimer's Drug Study Halted Early for Futility Independent study monitors concluded that there was "virtually no chance of finding a positive clinical effect."
- ^ "After A Big Failure, Scientists And Patients Hunt For A New Type Of Alzheimer's Drug". NPR.org. Citováno 17. května 2019.
- ^ Gallagher, James (2 May 2019). "Dementia is 'greatest health challenge'". Citováno 17. května 2019.
- ^ "Biogen Plans Regulatory Filing for Aducanumab in Alzheimer's Disease Based on New Analysis of Larger Dataset from Phase 3 Studies". 22. října 2019.
- ^ Morley JE, Armbrecht HJ, Farr SA, Kumar VB (May 2012). "The senescence accelerated mouse (SAMP8) as a model for oxidative stress and Alzheimer's disease". Biochimica et Biophysica Acta (BBA) - Molekulární základ choroby. 1822 (5): 650–6. doi:10.1016/j.bbadis.2011.11.015. PMID 22142563.
- ^ Marciniak R, Sheardova K, Cermáková P, Hudeček D, Sumec R, Hort J (2014). "Effect of meditation on cognitive functions in context of aging and neurodegenerative diseases". Hranice v behaviorální neurovědě. 8: 17. doi:10.3389/fnbeh.2014.00017. PMC 3903052. PMID 24478663.
- ^ Larouche E, Hudon C, Goulet S (January 2015). "Potential benefits of mindfulness-based interventions in mild cognitive impairment and Alzheimer's disease: an interdisciplinary perspective". Behaviorální výzkum mozku. 276 (276): 199–212. doi:10.1016/j.bbr.2014.05.058. hdl:20.500.11794/39836. PMID 24893317. S2CID 36235259.
- ^ Jaunmuktane Z, Mead S, Ellis M, et al. (Září 2015). "Evidence for human transmission of amyloid-β pathology and cerebral amyloid angiopathy". Příroda. 525 (7568): 247–50. Bibcode:2015Natur.525..247J. doi:10.1038/nature15369. PMID 26354483. S2CID 4465638.
- ^ Abbott A (September 2015). "Autopsies reveal signs of Alzheimer's in growth-hormone patients". Příroda. 525 (7568): 165–66. Bibcode:2015Natur.525..165A. doi:10.1038/525165a. PMID 26354460. S2CID 2512394.
- ^ A b Martin C, Solís L, Concha MI, Otth C (June 2011). "[Herpes simplex virus type 1 as risk factor associated to Alzheimer disease]" [Herpes Simplex Virus Type 1 as Risk Factor Associated to Alzheimer Disease]. Revista Médica de Chile (ve španělštině). 139 (6): 779–86. doi:10.4067/S0034-98872011000600013. PMID 22051760.
- ^ Wozniak MA, Mee AP, Itzhaki RF (January 2009). "Herpes simplex virus type 1 DNA is located within Alzheimer's disease amyloid plaques". The Journal of Pathology (Original study). 217 (1): 131–38. doi:10.1002/path.2449. PMID 18973185. S2CID 5176764.
- ^ Itzhaki RF (2014). "Herpes simplex virus type 1 and Alzheimer's disease: increasing evidence for a major role of the virus". Frontiers in Aging Neuroscience. 6: 202. doi:10.3389/fnagi.2014.00202. PMC 4128394. PMID 25157230.
- ^ Itzhaki RF, Lathe R, Balin BJ, et al. (2016). „Mikroby a Alzheimerova choroba“. Journal of Alzheimer's Disease. 51 (4): 979–84. doi:10,3233 / JAD-160152. PMC 5457904. PMID 26967229. Archivovány od originál dne 10. listopadu 2016.
- ^ Alonso R, Pisa D, Rábano A, Carrasco L (July 2014). "Alzheimer's disease and disseminated mycoses". Evropský žurnál klinické mikrobiologie a infekčních nemocí. 33 (7): 1125–32. doi:10.1007/s10096-013-2045-z. PMID 24452965. S2CID 14780610.
- ^ A b Pisa D, Alonso R, Rábano A, Rodal I, Carrasco L (October 2015). "Different Brain Regions are Infected with Fungi in Alzheimer's Disease". Vědecké zprávy. 5: 15015. Bibcode:2015NatSR...515015P. doi:10.1038/srep15015. PMC 4606562. PMID 26468932.
- ^ "Fungus, the bogeyman". Ekonom. 22. října 2015. Archivovány od originál dne 8. srpna 2017.
- ^ Kumar DK, Choi SH, Washicosky KJ, Eimer WA, Tucker S, Ghofrani J, Lefkowitz A, McColl G, Goldstein LE, Tanzi RE, Moir RD (May 2016). "Amyloid-β peptide protects against microbial infection in mouse and worm models of Alzheimer's disease". Science Translational Medicine. 8 (340): 340ra72. doi:10.1126/scitranslmed.aaf1059. PMC 5505565. PMID 27225182.
- ^ Kolata, Gina (25 May 2016). "Could Alzheimer's Stem From Infections? It Makes Sense, Experts Say". The New York Times. Archivovány od originál dne 4. února 2017.
- ^ "Alzheimer's culprit may fight other diseases". Vědecké zprávy. 16. června 2016. Archivovány od originál dne 26. května 2016.
- ^ Dougall NJ, Bruggink S, Ebmeier KP (2004). "Systematický přehled diagnostické přesnosti 99mTc-HMPAO-SPECT u demence". American Journal of Geriatric Psychiatry. 12 (6): 554–70. doi:10.1176 / appi.ajgp.12.6.554. PMID 15545324.
- ^ Carpenter AP, Pontecorvo MJ, Hefti FF, Skovronsky DM (August 2009). "The use of the exploratory IND in the evaluation and development of 18F-PET radiopharmaceuticals for amyloid imaging in the brain: a review of one company's experience". The Quarterly Journal of Nuclear Medicine and Molecular Imaging. 53 (4): 387–93. PMID 19834448.
- ^ Leung K (8 April 2010). „(E) -4- (2- (6- (2- (2- (2- (18F-fluoroethoxy) ethoxy) ethoxy) pyridin-3-yl) vinyl) -N-methylbenzenamin [[18F] AV-45] ". Molecular Imaging and Contrast Agent Database. Archivovány od originál dne 7. června 2010. Citováno 24. června 2010.
- ^ Rabinovici GD, Jagust WJ (2009). „Amyloidní zobrazování při stárnutí a demenci: testování amyloidové hypotézy in vivo“. Behaviorální neurologie. 21 (1): 117–28. doi:10.1155/2009/609839. PMC 2804478. PMID 19847050. Archivovány od originál dne 30. července 2013.
- ^ O'Brien JT (December 2007). "Role of imaging techniques in the diagnosis of dementia". British Journal of Radiology. 80 Spec No 2 (Spec No 2): S71–77. doi:10.1259/bjr/33117326. PMID 18445747.
- ^ "FDA Panel Recommends Conditional Approval for PET Agent". Zprávy o zobrazovacích technologiích. 21. ledna 2011. Citováno 17. června 2019.
- ^ Clark CM, Schneider JA, Bedell BJ, et al. (Leden 2011). "Use of florbetapir-PET for imaging beta-amyloid pathology". JAMA. 305 (3): 275–83. doi:10.1001/jama.2010.2008. PMC 7041965. PMID 21245183.
- ^ "Amyvid". Community register of medicinal products for human use. European Community. 17. ledna 2013. Citováno 18. dubna 2018.
- ^ Chong MS, Sahadevan S (September 2005). "Preclinical Alzheimer's disease: diagnosis and prediction of progression". Lancet. Neurologie. 4 (9): 576–79. doi:10.1016/s1474-4422(05)70168-x. PMID 16109364. S2CID 45448888.
- ^ A b Sharma N, Singh AN (July 2016). "Exploring Biomarkers for Alzheimer's Disease". Journal of Clinical and Diagnostic Research (Posouzení). 10 (7): KE01–06. doi:10.7860/JCDR/2016/18828.8166. PMC 5020308. PMID 27630867.
- ^ Montagne A, Barnes SR, Sweeney MD, et al. (Leden 2015). "Blood-brain barrier breakdown in the aging human hippocampus". Neuron. 85 (2): 296–302. doi:10.1016/j.neuron.2014.12.032. PMC 4350773. PMID 25611508.
- ^ Nation DA, Sweeney MD, Montagne A, et al. (Únor 2019). "Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction". Přírodní medicína. 25 (2): 270–276. doi:10.1038/s41591-018-0297-y. PMC 6367058. PMID 30643288.
- ^ Montagne A, Nation DA, Sagare AP, et al. (Květen 2020). "APOE4 leads to blood-brain barrier dysfunction predicting cognitive decline". Příroda. 581 (7806): 71–76. Bibcode:2020Natur.581...71M. doi:10.1038/s41586-020-2247-3. PMC 7250000. PMID 32376954.
Další čtení
| Prostředky knihovny o Alzheimerova choroba |
- Irvine K, Laws KR, Gale TM, Kondel TK (2012). "Greater cognitive deterioration in women than men with Alzheimer's disease: a meta analysis". Journal of Clinical and Experimental Neuropsychology (Metaanalýza). 34 (9): 989–98. doi:10.1080/13803395.2012.712676. PMID 22913619. S2CID 28300240.
- Harilal S, Jose J, Parambi DG, Kumar R, Mathew GE, Uddin MS, et al. (Září 2019). "Advancements in nanotherapeutics for Alzheimer's disease: current perspectives". The Journal of Pharmacy and Pharmacology. 71 (9): 1370–1383. doi:10.1111/jphp.13132. PMID 31304982. S2CID 196616758.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
