Dynamin - Dynamin
| Rodina Dynaminů | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura motorické domény bez nukleotidů myosinu II z Dictyostelium discoideum fúzovaný s doménou GTPázy dynaminu I z Rattus norvegicus | |||||||||
| Identifikátory | |||||||||
| Symbol | Dynamin_N | ||||||||
| Pfam | PF00350 | ||||||||
| Pfam klan | CL0023 | ||||||||
| InterPro | IPR001401 | ||||||||
| STRÁNKA | PDOC00362 | ||||||||
| |||||||||
| Centrální region Dynaminu | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura motorické domény myosinu II bez nukleotidů z Dictyostelium discoideum fúzováno s doménou GTPázy dynaminu I z Rattus norvegicus | |||||||||
| Identifikátory | |||||||||
| Symbol | Dynamin_M | ||||||||
| Pfam | PF01031 | ||||||||
| InterPro | IPR000375 | ||||||||
| |||||||||
Dynamin je GTPáza zodpovědný za endocytóza v eukaryotické buňce. Dynamin je součástí „nadrodiny dynaminů“, která zahrnuje klasické dynaminy, proteiny podobné dynaminu, Mx proteiny, OPA, mitofusiny a GBP. Členové rodiny dynaminů jsou zásadně zapojeni do štěpení nově vytvořených vezikuly z membrány jednoho buněčného kompartmentu a jejich cílení a fúze s jiným kompartmentem, a to jak na povrchu buňky (zejména Caveolae internalizace) i na Golgiho aparát.[1][2][3] Členové rodiny Dynamin také hrají roli v mnoha procesech, včetně rozdělení organely,[4] cytokineze a mikrobiální patogen odpor.
Struktura
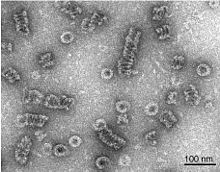
Samotný Dynamin je 96 kDa enzym, a byl poprvé izolován, když se vědci pokoušeli izolovat nové mikrotubul - motory na bázi hovězího mozku. Dynamin byl rozsáhle studován v kontextu Clathrin - potažený vezikul pučící z buněčná membrána.[3][6] Počínaje N-koncem, Dynamin se skládá z domény GTPase připojené k doméně spirálového stonku přes flexibilní oblast krku obsahující Bundle Signaling Element a Doména efektoru GTPázy. Na opačném konci stonkové domény je smyčka, která navazuje na membránovou vazbu Pleckstrinova homologická doména. Protein proteinu se poté smyčí zpět k doméně GTPázy a končí s Prolin bohatá doména který se váže na Homologické domény Src mnoha bílkovin.
Funkce
Během endocytózy zprostředkované klatrinem buněčná membrána invaginuje, aby vytvořila začínající vezikul. Dynamin se váže na krk endocytového váčku a shromažďuje se za něj a vytváří šroubovicový polymer uspořádaný tak, že domény GTPázy dimerizují asymetrickým způsobem přes šroubovicové příčky.[7][8] Polymer stahuje podkladovou membránu Vazba GTP a hydrolýza prostřednictvím konformačních změn vycházejících z pružné oblasti krku, která mění celkovou spirálovou symetrii.[8] Zúžení kolem hrdla vezikul vede k vytvoření stavu hemispenzní membrány, který nakonec vede k štěpení membrány.[2][6][9] Zúžení může být částečně výsledkem krouticí aktivity dynaminu, díky níž je dynamin jediným molekulární motor je známo, že mají kroucení.[10]
Typy
U savců byly identifikovány tři různé geny pro dynamin s klíčovými sekvenčními rozdíly v jejich doménách Pleckstrinovy homologie, které vedly k rozdílům v rozpoznávání lipidových membrán:
- Dynamin I. je vyjádřen v neurony a neuroendokrinní buňky
- Dynamin II je vyjádřen ve většině typů buněk
- Dynamin III je silně vyjádřen v varle, ale je také přítomen v srdce, mozek, a plíce tkáň.[1][6]
Důsledky nemoci
Mutace v Dynamin II Bylo zjištěno, že způsobují dominantní meziprodukt Charcot-Marie-Tooth nemoc.[11]Bylo navrženo, že epileptické encefalopatie způsobující de novo mutace v dynaminu způsobují dysfunkci štěpení vezikul během synaptické vesikulární endocytózy.[12]
Reference
- ^ A b Henley JR, Cao H, McNiven MA (prosinec 1999). "Účast dynaminu v biogenezi cytoplazmatických váčků". FASEB Journal. 13 Suppl 2 (9002): S243-7. doi:10.1096 / fasebj.13.9002.S243. PMID 10619136.
- ^ A b Hinshaw, J. „Výzkumné prohlášení, Jenny E. Hinshaw, Ph.D.“ National Institute of Diabetes & Digestive & Kidney Diseases, Laboratory of Cell Biochemistry and Biology. Zpřístupněno 19. března 2013.
- ^ A b Urrutia R, Henley JR, Cook T, McNiven MA (leden 1997). „Dynaminy: redundantní nebo odlišné funkce pro rozšiřující se rodinu souvisejících GTPáz?“. Sborník Národní akademie věd Spojených států amerických. 94 (2): 377–84. doi:10.1073 / pnas.94.2.377. PMC 34135. PMID 9012790.
- ^ Thoms S, Erdmann R (říjen 2005). "Proteiny související s dynaminem a proteiny Pex11 v dělení a proliferaci peroxisomů". FEBS Journal. 272 (20): 5169–81. doi:10.1111 / j.1742-4658.2005.04939.x. PMID 16218949.
- ^ Hinshaw JE, Schmid SL (březen 1995). „Dynamin se samy sestavuje do kroužků, což naznačuje mechanismus pro pučení obalené vezikuly“. Příroda. 374 (6518): 190–2. doi:10.1038 / 374190a0. PMID 7877694. S2CID 4365628.
- ^ A b C Praefcke GJ, McMahon HT (únor 2004). „Nadrodina dynaminu: univerzální membránová tubulace a štěpné molekuly?“. Nature Reviews Molecular Cell Biology. 5 (2): 133–47. doi:10.1038 / nrm1313. PMID 15040446. S2CID 6305282. Shrnutí ležel – Domovská stránka Dynaminu.
- ^ Sundborger AC, Fang S, Heymann JA, Ray P, Chappie JS, Hinshaw JE (srpen 2014). „Dynaminový mutant definuje superkonstrikční stav prefise“. Zprávy buněk. 8 (3): 734–42. doi:10.1016 / j.celrep.2014.06.054. PMC 4142656. PMID 25088425.
- ^ A b Kong L, Sochacki KA, Wang H, Fang S, Canagarajah B, Kehr AD, Rice WJ, Strub MP, Taraska JW, Hinshaw JE (srpen 2018). „Kryo-EM dynaminového polymeru sestaveného na lipidové membráně“. Příroda. 560 (7717): 258–262. doi:10.1038 / s41586-018-0378-6. PMC 6121775. PMID 30069048.
- ^ Mattila JP, Shnyrova AV, Sundborger AC, Hortelano ER, Fuhrmans M, Neumann S, Müller M, Hinshaw JE, Schmid SL, Frolov VA (srpen 2015). „Hemi-štěpný meziprodukt spojuje dva mechanicky odlišné stupně štěpení membrány“. Příroda. 524 (7563): 109–113. doi:10.1038 / příroda14509. PMC 4529379. PMID 26123023.
- ^ Roux A, Uyhazi K, Frost A, De Camilli P (květen 2006). „Zkroucení dynaminu závislé na GTP implikuje zúžení a napětí v štěpení membrány“. Příroda. 441 (7092): 528–31. doi:10.1038 / nature04718. PMID 16648839. S2CID 4413887.
- ^ Züchner S, Noureddine M, Kennerson M, Verhoeven K, Claeys K, De Jonghe P a kol. (Březen 2005). "Mutace v pleckstrinové homologické doméně dynaminu 2 způsobují dominantní intermediární Charcot-Marie-Toothovu chorobu". Genetika přírody. 37 (3): 289–94. doi:10.1038 / ng1514. PMID 15731758. S2CID 19191581.
- ^ Dhindsa RS, Bradrick SS, Yao X, Heinzen EL, Petrovski S, Krueger BJ, Johnson MR, Frankel WN, Petrou S, Boumil RM, Goldstein DB (červen 2015). "Mutace způsobující epileptickou encefalopatii v DNM1 narušují endocytózu synaptických vezikul". Neurologie. Genetika. 1 (1): e4. doi:10.1212 / 01.NXG.0000464295.65736.da. PMC 4821085. PMID 27066543.
externí odkazy
- Dynaminy v americké národní lékařské knihovně Lékařské předměty (Pletivo)
