Rodina Rho GTPas - Rho family of GTPases
The Rodina Rho GTPas je rodina malých (~ 21 kDa) signalizací G proteiny, a je podčeleď Ras nadčeleď. Členové Rho GTPáza Bylo prokázáno, že rodina reguluje mnoho intracelulárních aspektů aktin dynamiky a nacházejí se ve všech eukaryotických královstvích, včetně kvasinek a některých rostlin. Tři členové rodiny byli podrobně studováni: Cdc42, Rac1, a RhoA. Všechny G proteiny jsou „molekulární přepínače“ a Rho proteiny hrají roli v organela rozvoj, cytoskeletální dynamika, pohyb buněk a další běžné buněčné funkce.[1][2][3][4][5]
Dějiny
Identifikace rodiny Rho GTPas začala v polovině 80. let. Prvním identifikovaným členem Rho byl RhoA, izolovaný náhodně v roce 1985 z nízké přísnosti cDNA promítání.[6] Rac1 a Rac2 byly identifikovány dále, v roce 1989[7] následovaný Cdc42 v roce 1990.[8] Osm dalších savčích členů Rho bylo identifikováno z biologických screeningů až do konce 90. let, což byl zlom v biologii, kde dostupnost úplných genomových sekvencí umožňovala úplnou identifikaci genových rodin. Všechny eukaryotické buňky obsahují Rho GTPázu (od 6 u kvasinek po 20 u savců). U savců je tedy rodina Rho tvořena 20 členy rozdělenými do 8 podskupin: Rho, Rnd, RhoD / F, RhoH, Rac, Cdc42, RhoU / V a RhoBTB.[1]
Již v roce 1990 Paterson et al. začalo vyjadřování aktivovaný Rho protein v Švýcarské fibroblasty 3T3.[9]
V polovině 90. let bylo pozorováno, že proteiny Rho ovlivňují tvorbu buněčných výběžků („procesů“) ve fibroblastech. V článku z roku 1998, Alan Hall, shromáždil důkazy ukazující, že nejen fibroblasty tvoří procesy po aktivaci Rho, ale také prakticky všechny eukaryotické buňky.[10]
Přehledový článek z roku 2006, autor Bement et al. prozkoumal význam prostorových zón aktivace Rho.[11]
Kategorizace
Rodina Rho GTPáz patří do Ras nadčeleď bílkovin, která se skládá z více než 150 odrůd u savců. Rho proteiny někdy označují některé členy rodiny Rho (RhoA, RhoB, a RhoC ) a někdy označuje všechny členy rodiny. Tento článek pojednává o rodině jako celku.
U savců obsahuje rodina Rho 20 členů.[1] Téměř veškerý výzkum zahrnuje tři nejběžnější členy rodiny Rho: Cdc42, Rac1 a RhoA.
| Člen rodiny Rho | Působení na aktinová vlákna |
|---|---|
| Cdc42 | ovlivňuje filopodia |
| Rac1 | ovlivňuje lamellipodia |
| RhoA | ovlivňuje stresová vlákna |
Těchto 20 savčích členů je rozděleno do podrodiny Rac (Rac1, Rac2, Rac3 a RhoG), podrodiny Cdc42 (Cdc42, TC10 / RhoQ, TCL / RhoJ), rodiny RhoUV (RhoV / Chp a RhoU / Wrch-1 /) , Podrodina RhoA (RhoA, RhoB a RhoC), podrodina Rnd (Rnd1 / Rho6, Rnd2 / RhoN a Rnd3 / RhoE), podrodina RhoD (RhoD a RhoF / Rif), RhoBTB (RhoBTB1 & 2) a RhoH / TTF.[1]
| Podtřída | Cytoskeletální účinek | Členové rodiny Rho |
|---|---|---|
| Podtřída Cdc42 | filopodia | Cdc42 |
| RhoQ (TC10) | ||
| RhoJ (TCL) | ||
| RhoUV podtřída | filopodia a lamellipodia | RhoU (Wrch) |
| RhoV (Chp) | ||
| Rac | lamellipodia | Rac1 |
| Rac2 | ||
| Rac3 | ||
| RhoG | ||
| RhoBTB | stabilita bílkovin | RhoBTB1 |
| RhoBTB2 | ||
| RhoBTB3 | ||
| RhoH | Rac agonista? | RhoH |
| Rho (podtřída) | ↑stresová vlákna a ↑fokální adheze | RhoA |
| RhoB | ||
| RhoC | ||
| Rnd | ↓stresová vlákna a ↓fokální adheze | Rnd1 |
| Rnd2 | ||
| Rnd3 (RhoE) | ||
| RhoF | Přeprava vezikul, filopodia | RhoD |
| RhoF (Rif) |
Regulační orgány
Byly identifikovány tři obecné třídy regulátorů signalizace proteinu Rho: faktor výměny guaninového nukleotidu (GEF), Proteiny aktivující GTPázu (GAP) a inhibitory disociace guaninových nukleotidů (GDI).[12] GEF aktivují proteiny Rho katalyzováním výměny GDP za GTP. GAPs řídí schopnost GTPázy hydrolyzovat GTP na HDP, řízení přirozené rychlosti pohybu z aktivní konformace do neaktivní konformace. GDI proteiny tvoří velký komplex s proteinem Rho, pomáhají zabraňovat difúzi uvnitř membrány a do cytosolu, a tak působí jako kotva a umožňují těsnou prostorovou kontrolu aktivace Rho.[12] U člověka 82 GEF (71 Dbl-like [13] a 11 DOCK-like [14]) pozitivně kontrolují aktivitu členů Rho, zatímco 66 proteinů GAP ji kontroluje negativně.[15]
Nedávná práce odhalila další důležité regulační mechanismy: mikroRNA regulovat post-transkripční zpracování mRNA kódujících Rho GTPázu; palmitoylace a nukleární cílení ovlivňují intracelulární distribuci; posttranslační fosforylace, transglutaminace a AMPylace modulují signalizaci Rho GTPázy; a ubikvitinace řídí stabilitu a obrat Rho GTPázového proteinu. Tyto režimy regulace zvyšují složitost signalizační sítě Rho GTPase a umožňují přesnou časoprostorovou kontrolu jednotlivých Rho GTPáz.[16]
Efektory
Každý protein Rho ovlivňuje řadu proteinů po proudu, přičemž všechny mají roli v různých buněčných procesech. Bylo nalezeno více než 60 cílů ze tří běžných Rho GTPáz.[17] Dvě molekuly, které přímo stimulují polymeraci aktinů, jsou proteiny Arp2 / 3 a formany související s diafanem.[18]
| GTPáza | Efektor[2][18] |
|---|---|
| RhoA | Cit, Cnksr1, Diaph1, Diaph2, DgkQ, FlnA, KcnA2, Ktn1, Rtkn1, Rtkn2, Rhpn1, Rhpn2, Itpr1, PlcG1, PI-5-p5K, PLD1, Pkn1, Pkn2, Rock1, Rock2, PrkcA, Ppp1r12A |
| Rac1 | Sra1, IRSp53, PAK1, PAK2, PAK3 |
| Cdc42 | Protein Wiskott-Aldrichova syndromu, N-WASP, IRSp53, Dia2, Dia3, ROCK1, ROCK2, PAK4 |
Funkce
Rho / Rac proteiny se podílejí na široké škále buněčných funkcí, jako je polarita buněk, vezikulární obchodování, buněčný cyklus a transkriptomální dynamika.[2]
Morfologie
Živočišné buňky tvoří mnoho různých tvarů na základě jejich funkce a umístění v těle. Rho proteiny pomáhají buňkám regulovat změny tvaru během celého jejich životního cyklu. Předtím, než buňky mohou podstoupit klíčové procesy, jako je pučení, mitóza nebo pohyb, musí mít nějaký způsob polarita buněk.
Jeden příklad role Rho GTPas v polaritě buněk je vidět v hodně studované kvasinkové buňce. Předtím, než buňka může bud, Cdc42 se používá k lokalizaci oblasti buněčné membrány, která se začne vyklenovat do nové buňky. Když je Cdc42 odstraněn z buňky, výrůstky se stále tvoří, ale neorganizovaným způsobem.[17]
Jednou z nejzřejmějších změn buněčné morfologie řízené proteiny Rho je tvorba lamellipodia a filopodia, promítající procesy, které vypadají jako „prsty“ nebo „nohy“ a často pohánějí buňky nebo růstové kužele přes povrchy. Prakticky všechny eukaryotické buňky tvoří takové procesy po aktivaci Rho.[10] Fibroblasty jako jsou švýcarské buňky 3T3 se často používají ke studiu těchto jevů.
Studijní techniky
Hodně z toho, co je známo o změnách buněčné morfologie a účincích proteinů Rho, pochází z vytvoření konstitutivně aktivní mutované formy proteinu. Mutace klíčové aminokyseliny může změnit konformaci celého proteinu, což způsobí, že trvale přijme konformaci, která se podobá stavu vázanému na GTP.[9] Tento protein nelze normálně inaktivovat hydrolýzou GTP a je tedy „přilepený“. Když je Rho protein aktivovaný tímto způsobem exprimován v buňkách 3T3, následují morfologické změny, jako jsou kontrakce a tvorba filopodií.[9]
Protože Rho proteiny jsou G-proteiny a vázané na plazmatickou membránu, lze jejich polohu snadno ovládat. V každé situaci, ať už jde o hojení ran, cytokineze nebo pučící, lze zobrazit a identifikovat místo aktivace Rho. Pokud je například ve sférické buňce vytvořen kruhový otvor, Cdc42 a další aktivní Rhos jsou vidět v nejvyšší koncentraci po obvodu kruhového poranění.[11] Jedním ze způsobů udržování prostorových zón aktivace je ukotvení k aktinovému cytoskeletu, které brání membránově vázanému proteinu difundovat pryč z oblasti, kde je to nejvíce zapotřebí.[11] Další metodou údržby je vytvoření velkého komplexu, který je odolný proti difúzi a pevněji se váže na membránu než samotný Rho.[11]
Morfogeneze dendritických trnů
Morfogeneze dendritické trny je rozhodující pro indukci dlouhodobé potenciace (LTP).[19][20] Morfologie páteře závisí na stavech aktin, buď v globulárních (G-aktin) nebo vláknitých (F-aktin) formách. Role rodiny Rho GTPáz a její účinky na stabilitu aktin a pohyblivost páteře[21] má důležité důsledky pro paměť. Pokud je dendritická páteř základní jednotkou ukládání informací, musí být omezena schopnost páteře samovolně se vysouvat a zatahovat. Pokud ne, může dojít ke ztrátě informací. Rodina GTPáz Rho významně přispívá k procesu, který stimuluje polymeraci aktinu, což zase zvyšuje velikost a tvar páteře.[22] Velké trny jsou stabilnější než ty menší a mohou být rezistentní vůči modifikaci další synaptickou aktivitou.[23] Protože změny tvaru a velikosti dendritických trnů korelují se silou excitačních synaptických spojení a silně závisí na přestavbě podkladového aktinového cytoskeletu,[24] specifické mechanismy regulace aktinu, a tedy Rho rodina GTPáz, jsou nedílnou součástí tvorby, zrání a plasticita dendritických trnů a učení a paměť.
RhoA cesta
Jednou z hlavních Rho GTPáz zapojených do morfogeneze páteře je RhoA, protein, který také moduluje regulaci a načasování buněčného dělení. V kontextu aktivity v neuronech je RhoA aktivován následujícím způsobem: jakmile vápník vstoupil do buňky NMDA receptory, váže se na klimodulin a aktivuje se CaMKII, což vede k aktivaci RhoA.[22] Aktivace proteinu RhoA aktivuje ROCK, kinázu RhoA, která vede ke stimulaci LIM kináza, což zase inhibuje protein cofilin. Funkcí cofilinu je reorganizace aktinového cytoskeletu buňky; konkrétně depolymerizuje aktinové segmenty a tím inhibuje růst růstových kuželů a opravu axonů.[25]
Studie provedená Murakoshi et al. v roce 2011 zahrnoval Rho GTPasy RhoA a Cdc42 do morfogeneze dendritické páteře. Obě GTPázy byly rychle aktivovány v jednotlivých dendritických trnech pyramidové neurony v oblasti CA1 krysy hipokampus během strukturální plasticity vyvolané dlouhodobými potenciometrickými podněty. Souběžná aktivace RhoA a Cdc42 vedla k přechodnému zvýšení růstu páteře až o 300% po dobu pěti minut, které se rozpadlo na menší, ale trvalý růst po dobu třiceti minut.[22] Aktivace RhoA difundovala kolem okolí páteře podstupující stimulaci a bylo stanoveno, že RhoA je nezbytný pro přechodnou fázi a s největší pravděpodobností i pro trvalou fázi růstu páteře.
Cdc42 cesta
Cdc42 se podílí na mnoha různých funkcích, včetně dendritického růstu, větvení a stability větví.[26] Přítok vápníku do buňky prostřednictvím NMDA receptorů se váže na kalmodulin a aktivuje Ca2 + / kalmodulin-dependentní protein kinázy II (CaMKII). Na druhé straně se aktivuje CaMKII a tím se aktivuje Cdc42, po kterém nedojde k žádné zpětnovazební signalizaci před vápníkem a CaMKII. Pokud je označen zeleným fluorescenčním proteinem se zesíleným monomerem, je vidět, že aktivace Cdc42 je omezena pouze na stimulovanou páteř dendritu. Je to proto, že molekula je během plasticity kontinuálně aktivována a po difúzi z páteře se okamžitě deaktivuje. Přes svou rozčleněnou aktivitu je Cdc42 stále mobilní ze stimulované páteře, stejně jako RhoA. Cdc42 aktivuje PAK, což je protein kináza, která specificky fosforyluje, a proto inaktivuje ADF / kofilin.[27] Inaktivace cofilinu vede ke zvýšené polymeraci aktinu a expanzi objemu páteře. K udržení tohoto zvýšení objemu páteře je nutná aktivace Cdc42.
Pozorované změny strukturní plasticity

Murakoshi, Wang a Yasuda (2011) zkoumali účinky aktivace Rho GTPázy na strukturní plasticitu jednotlivých dendritických trnů a objasnily rozdíly mezi přechodnou a trvalou fází.[22]
Přechodné změny strukturální plasticity
Použití nízkofrekvenčního sledu uvolnění dvou fotonových glutamátů v jedné dendritické páteři může vyvolat rychlou aktivaci jak RhoA, tak Cdc42. Během příštích dvou minut se objem stimulované páteře může rozšířit na 300 procent původní velikosti. Tato změna morfologie páteře je však pouze dočasná; objem páteře klesá po pěti minutách. Podávání C3 transferázy, inhibitoru Rho, nebo glycyl-H1152, inhibitoru Rock, inhibuje přechodnou expanzi páteře, což naznačuje, že pro tento proces je nějakým způsobem vyžadována aktivace dráhy Rho-Rock.[22]
Trvalé změny strukturální plasticity
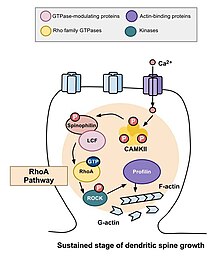
Poté, co dojde k přechodným změnám popsaným výše, objem páteře klesá, dokud není zvýšen o 70 až 80 procent původního objemu. Tato trvalá změna strukturální plasticity bude trvat asi třicet minut. Opět podávání C3 transferázy a Glycyl-H1152 potlačilo tento růst, což naznačuje, že cesta Rho-Rock je nezbytná pro trvalejší zvýšení objemu páteře. Kromě toho podávání vazebné domény Cdc42 Wasp nebo inhibitoru zaměřeného na Pak1 aktivace-3 (IPA3) snižuje tento trvalý růst objemu, což ukazuje, že pro tento růst v objemu páteře je nutná také dráha Cdc42-Pak. To je důležité, protože trvalé změny strukturální plasticity mohou poskytnout mechanismus pro kódování, údržbu a načítání pamětí. Pozorování mohou naznačovat, že Rho GTPasy jsou pro tyto procesy nezbytné.[22]
Hnutí
Kromě tvorby lamellipodií a filopodií řídí intracelulární koncentrace a vzájemná komunikace mezi různými proteiny Rho rozšíření a kontrakce, které způsobují buněčnou lokomoci. Sakumura a kol. navrhl model založený na diferenciálních rovnicích, který pomáhá vysvětlit aktivitu proteinů Rho a jejich vztah k pohybu. Tento model zahrnoval tři proteiny Cdc42, RhoA a Rac. Předpokládalo se, že Cdc42 podporuje prodloužení filopodií a blokuje depolymerizaci aktinu. RhoA byl považován za povzbuzující zatahování aktinu. Rac byl ošetřen tak, aby podporoval extenzi lamellipodií, ale blokoval depolymerizaci aktinu. Tyto tři proteiny, i když byly výrazně zjednodušeny, pokrývaly klíčové kroky buněčné lokomoce. Pomocí různých matematických technik bylo nalezeno řešení diferenciálních rovnic, které popisovaly různé oblasti aktivity založené na intracelulární aktivitě. Článek končí závěrem, který ukazuje, že model předpovídá, že existuje několik prahových koncentrací, které způsobují zajímavé účinky na aktivitu buňky. Pod určitou koncentrací je velmi malá aktivita, která nezpůsobuje prodloužení paží a nohou buňky. Nad určitou koncentrací způsobuje protein Rho sinusovou oscilaci podobně jako prodloužení a kontrakce lamellipodií a filopodií. V podstatě tento model předpovídá, že zvýšení intracelulární koncentrace těchto tří klíčových aktivních proteinů Rho způsobí mimofázovou aktivitu buňky, což má za následek prodloužení a kontrakce, které jsou také mimo fázi.[28]
Hojení ran
Jedním příkladem chování, které je modulováno proteiny Rho GTPázy, je hojení ran. Rány se hojí odlišně mezi mladými kuřaty a dospělými kuřaty. U mladých kuřat se rány hojí stahem, podobně jako tažná šňůrka, která se táhne, aby se zavřel vak. U starších kuřat se buňky pohybují po ráně pohybem. Tvorba aktinu potřebná k uzavření ran u mladých kuřat je řízena proteiny Rho GTPázy, protože po injekci bakteriálního exoenzymu použitého k blokování aktivity rho a rac se aktinové polymery netvoří, a tak hojení zcela selhává.[29]
Polarita buněk
Studie na fibroblastech naznačují pozitivní zpětnou vazbu mezi aktivitou Cdc42 a odtokem H + izoformou Na-H výměníku 1 (NHE1) na přední hraně migrujících buněk. NHE1 zprostředkovaný H + eflux je vyžadován pro vazbu GTP katalyzovanou guaninovým nukleotidovým výměnným faktorem (GEF) na Cdc42, což naznačuje mechanismus pro regulaci polarity touto malou GTPázou v migrujících buňkách.[30]
Fagocytóza
Dalším buněčným chováním ovlivněným proteiny rho je fagocytóza. Stejně jako u většiny ostatních typů modulace buněčné membrány vyžaduje fagocytóza aktinový cytoskelet, aby pohltila další položky. Aktinová vlákna řídí tvorbu fagocytárního kalíšku a aktivní Rac1 a Cdc42 se podílejí na této signální kaskádě.[31]
Mitóza
Dalším důležitým aspektem buněčného chování, o kterém se předpokládá, že zahrnuje signalizaci proteinu rho, je mitóza. Zatímco po letech se předpokládalo, že aktivita rho GTPázy je omezena na polymeraci aktinu, a tedy na cytokineze, ke kterému dochází po mitóze, se objevily nové důkazy, které ukazují určitou aktivitu při tvorbě mikrotubulů a samotném procesu mitózy. Toto téma je stále diskutováno a existují důkazy pro i proti pro důležitost rho v mitóze.[32]
Aplikace
Regenerace nervového systému
Vzhledem k jejich implikacím v buněčné motilitě a tvaru se proteiny Rho staly jasným cílem při studiu růstové kužele ten formulář během axonální generace a regenerace v nervovém systému. Rho proteiny mohou být potenciálním cílem pro dodání do lézí míchy po traumatickém poranění. Po poranění míchy se extracelulární prostor stává inhibicí přirozeného úsilí, které neurony podstupují k regeneraci.
Tyto přirozené snahy zahrnují tvorbu růstového kužele na proximálním konci zraněného axonu. Nově vytvořené růstové kužele se následně pokusí „plazit“ přes lézi. Jsou citlivé na chemické podněty v extracelulárním prostředí. Jedna z mnoha inhibičních podnětů zahrnuje chondroitin sulfát proteoglykany (CSPG). Neurony rostoucí v kultuře získávají větší schopnost procházet oblastmi substrátu potaženého CSPG po expresi konstitutivně aktivního Cdc42 nebo Rac1[33] nebo exprese dominantní negativní formy (inhibice) RhoA[Citace je zapotřebí ]. To je částečně způsobeno tím, že exogenní proteiny Rho řídí buněčnou pohyb navzdory extracelulárním podnětům podporujícím apoptózu a kolaps růstového kužele. Intracelulární modulace proteinů Rho se tak stala předmětem zájmu výzkumu zaměřeného na regeneraci míchy.
Mentální retardace
Dysfunkce Rho proteinů se také podílí na mentální retardace. Mentální retardace v některých případech zahrnuje malformaci dendritické trny, které tvoří postsynaptické spojení mezi nimi neurony. Znetvořené dendritické trny mohou být výsledkem modulace signalizace rho proteinu. Po klonování různých genů se podílelo na X-vázaný mentální retardace, byly identifikovány tři geny, které mají účinky na signalizaci Rho, včetně oligofreninu-1 (protein GAP, který stimuluje aktivitu GTPázy Rac1, Cdc42 a RhoA), PAK3 (podílí se na účinku Rac a Cdc42 na aktinový cytoskelet) a αPIX (GEF, který pomáhá aktivovat Rac1 a Cdc42).[34] Kvůli účinku Rho signalizace na aktinový cytoskelet by genetické poruchy proteinu rho mohly vysvětlit nepravidelnou morfologii neuronových dendritů pozorovanou v některých případech mentální retardace.
Rakovina
Po zjištění, že Ras proteiny jsou mutovány u 30% lidských rakovin, bylo podezření, že mutované proteiny Rho mohou být také zapojeny do reprodukce rakoviny.[12] Od srpna 2007 však nebyly nalezeny žádné onkogenní mutace v proteinech Rho a pouze u jedné bylo zjištěno, že jsou geneticky pozměněny.[12] Abychom vysvětlili roli Rho drah bez mutace, vědci se nyní pro odpovědi obrátili na regulátory aktivity rho a úrovně exprese proteinů Rho.
Jedním ze způsobů, jak vysvětlit změněnou signalizaci v nepřítomnosti mutace, je zvýšená exprese. Nadměrná exprese RhoA, RhoB, RhoC, Rac1, Rac2, Rac3, RhoE, RhoG, RhoH a Cdc42 byla prokázána u různých typů rakoviny.[12] Tato zvýšená přítomnost tolika signálních molekul znamená, že tyto proteiny podporují buněčné funkce, které jsou v rakovinných buňkách příliš aktivní.
Druhým cílem vysvětlujícím úlohu proteinů Rho v rakovině jsou jejich regulační proteiny. Rho proteiny jsou velmi přísně kontrolovány širokou škálou zdrojů a bylo identifikováno více než 60 aktivátorů a 70 inaktivátorů.[17] Bylo prokázáno, že více GAP, GDI a GEF podléhá nadměrné expresi, downregulaci nebo mutaci u různých typů rakoviny.[12] Jakmile je upstream signál změněn, aktivita jeho cílů downstream - tj. Rho proteiny - se změní v aktivitě.
Ellenbroek a kol. nastínil řadu různých účinků aktivace Rho v rakovinných buňkách. Za prvé, při zahájení nádorové modifikace může aktivita Rho potlačit apoptóza a proto přispívají k dlouhověkosti umělých buněk. Poté, co je potlačena přirozená apoptóza, lze pozorovat abnormální růst nádoru prostřednictvím ztráty polarity, ve které proteiny Rho hrají nedílnou roli. Dále může rostoucí hmota napadnout přes své normální hranice změnou adhezních proteinů potenciálně způsobených proteiny Rho.[12] Nakonec po inhibici apoptózy, buněčné polarity a adhezních molekul je rakovinová hmota volná metastázovat a rozšířil se do dalších oblastí těla.
Reference
- ^ A b C d Boureux A, Vignal E, Faure S, Fort P (2007). "Vývoj rodiny Rho ras-like GTPáz v eukaryotech". Mol Biol Evol. 24 (1): 203–16. doi:10.1093 / molbev / msl145. ISSN 0021-9193. PMC 2665304. PMID 17035353.
- ^ A b C Bustelo XR, Sauzeau V, Berenjeno IM (2007). „GTP-vazebné proteiny rodiny Rho / Rac: regulace, efektory a funkce in vivo“. BioEssays. 29 (4): 356–370. doi:10.1002 / bies.20558. PMC 1971132. PMID 17373658.
- ^ Ridley, Anne J (2015). "Rho GTPase signalizace v migraci buněk". Současný názor na buněčnou biologii. 36: 103–112. doi:10.1016 / j.ceb.2015.08.005. PMC 4728192. PMID 26363959.

- ^ Ridley, Anne Jacqueline (2016). „Anne Ridley: Networking with Rho GTPases“. Trendy v buněčné biologii. 26 (7): 465–466. doi:10.1016 / j.tcb.2016.04.005. ISSN 0962-8924. PMID 27166090. (vyžadováno předplatné)
- ^ Heasman, Sarah J .; Ridley, Anne J. (2008). „Savčí Rho GTPasy: nový pohled na jejich funkce ze studií in vivo“. Nature Reviews Molecular Cell Biology. 9 (9): 690–701. doi:10.1038 / nrm2476. PMID 18719708. (vyžadováno předplatné)
- ^ Madaule P .; Axel R. (1985). "Nová genová rodina související s ras". Buňka. 41 (1): 31–40. doi:10.1016/0092-8674(85)90058-3. PMID 3888408.
- ^ Didsbury J, Weber RF, Bokoch GM, Evans T, Snyderman R (1989). „Rac, nová rodina proteinů souvisejících s ras, které jsou substráty botulotoxinu“. J Biol Chem. 264 (28): 16378–82. ISSN 0021-9258. PMID 2674130.
- ^ Munemitsu S, Innis M, Clark R, McCormick F, Ullrich A, Polakis P (1990). „Molekulární klonování a exprese cDNA G25K, lidského homologu genu pro buněčný cyklus kvasinek CDC42“. Mol Cell Biol. 10 (11): 5977–82. doi:10.1128 / MCB.10.11.5977. ISSN 0270-7306. PMC 361395. PMID 2122236.
- ^ A b C Paterson HF, Self AJ, Garrett MD, Just I, Aktories K, hala A (1990). „Mikroinjekce rekombinantního p21 rho indukuje rychlé změny v morfologii buněk“. J Cell Biol. 111 (3): 1001–7. doi:10.1083 / jcb.111.3.1001. PMC 2116288. PMID 2118140.
- ^ A b Hall A. (1998). "Rho GTPázy a aktinový cytoskeleton". Věda. 279 (5350): 509–14. doi:10.1126 / science.279.5350.509. PMID 9438836.
- ^ A b C d Bement WM, Miller AL, von Dassow G (2006). „Zóny aktivity Rho GTPázy a přechodná kontraktilní pole“. BioEssays. 28 (10): 983–93. doi:10.1002 / bies.20477. PMC 4364130. PMID 16998826.
- ^ A b C d E F G Ellenbroek S, Collard J (2007). "RhoGTPázy: funkce a asociace s rakovinou". Metastáza Clin Exp. 24 (8): 657–72. doi:10.1007 / s10585-007-9119-1. PMID 18000759.
- ^ Fort P, Blangy A (2017). „Evoluční krajina rodin RhoGEF podobných Dbl: Přizpůsobení eukaryotických buněk signálům životního prostředí“. Biologie genomu a evoluce. 9 (6): 1471–86. doi:10.1093 / gbe / evx100. PMC 5499878. PMID 28541439.
- ^ Meller N, Merlot S, Guda C (2005). „Proteiny CZH: nová rodina Rho-GEF“. Journal of Cell Science. 118 (21): 4937–46. doi:10.1242 / jcs.02671. PMID 16254241.
- ^ Amin E, Jaiswal M, Derewenda U, Reis K, Nouri K, Koessmeier KT, Aspenström P, Somlyo AV, Dvorsky R, Ahmadian MR (2016). „Dešifrování molekulárních a funkčních základů proteinů rodiny RHOGAP: systematický přístup k selektivní inaktivaci proteinů rodiny Rho“. J Biol Chem. 291 (39): 20353–71. doi:10.1074 / jbc.M116.736967. PMC 5034035. PMID 27481945.
- ^ Meng Liu; Yi Zheng (2012). „Regulace Rho GTPázy pomocí miRNA a kovalentní modifikace“. Trendy v buněčné biologii. 22 (7): 367–373. doi:10.1016 / j.tcb.2012.04.004. PMC 3383930. PMID 22572609.
- ^ A b C Etienne-Manneville S, hala A (2002). "Rho GTPázy v buněčné biologii". Příroda. 420 (6916): 629–35. doi:10.1038 / nature01148. PMID 12478284.
- ^ A b Ridley, AJ; et al. (2006). "Rho GTPázy a dynamika aktinů v membránových výčnělcích a obchodování vezikul". Trends Cell Biol. 16 (10): 522–9. doi:10.1016 / j.tcb.2006.08.006. PMID 16949823.
- ^ Kim, Chong-Hyun; Lisman (1999). „Role aktinového vlákna v synaptickém přenosu a dlouhodobé potenciaci“. Journal of Neuroscience. 19 (11): 4314–4324. doi:10.1523 / JNEUROSCI.19-11-04314.1999. PMID 10341235.
- ^ Krucker, T .; Siggins, G. R .; Halpain, S. (23. května 2000). „Dynamická aktinová vlákna jsou vyžadována pro stabilní dlouhodobou potenciaci (LTP) v oblasti CA1 hipokampu“. Sborník Národní akademie věd. 97 (12): 6856–6861. doi:10.1073 / pnas.100139797. PMC 18765. PMID 10823894.
- ^ Tashiro, Ayumu; Yuste, Rafael (1. července 2004). „Regulace pohyblivosti a stability dendritické páteře pomocí Rac1 a Rho kinázy: důkazy o dvou formách pohyblivosti páteře“. Molekulární a buněčná neurověda. 26 (3): 429–440. doi:10.1016 / j.mcn.2004.04.001. PMID 15234347.
- ^ A b C d E F Murakoshi, Hideji; Wang, Hong; Yasuda, Ryohei (20. března 2011). „Lokální, trvalá aktivace Rho GTPáz během plasticity jednotlivých dendritických trnů“. Příroda. 472 (7341): 100–104. doi:10.1038 / nature09823. PMC 3105377. PMID 21423166.
- ^ Kasai, Haruo; Matsuzaki, Masanori; Noguchi, červen; Yasumatsu, Nobuaki; Nakahara, Hiroyuki (1. července 2003). "Vztahy struktura - stabilita - funkce dendritických trnů". Trendy v neurovědách. 26 (7): 360–368. doi:10.1016 / S0166-2236 (03) 00162-0. PMID 12850432.
- ^ Hotulainen, P .; Hoogenraad, C. C. (10. května 2010). „Actin v dendritických trnech: propojení dynamiky s funkcí“. The Journal of Cell Biology. 189 (4): 619–629. doi:10.1083 / jcb.201003008. PMC 2872912. PMID 20457765.
- ^ Kiss, C .; Li, J .; Szeles, A .; Gizatullin, R.Z .; Kashuba, V.I ..; Lushnikova, T.L .; Protopopov, A.I .; Kelve, M .; Kiss, H .; Kholodnyuk, I.D .; Irnreh, S .; Klein, G .; Zabarovský, ER (1. ledna 1997). "Přiřazení genů ARHA a GPX1 k lidským chromozomovým pásmům 3p21.3 hybridizací in situ a hybridy somatických buněk". Cytogenetický a genomový výzkum. 79 (3–4): 228–230. doi:10.1159/000134729. PMID 9605859.
- ^ Scott, Ethan K .; Reuter, J .; Luo, L. (11. dubna 2003). „Malá GTPáza Cdc42 je vyžadována pro více aspektů dendritické morfogeneze“. Journal of Neuroscience. 28 (8): 3118–3123. doi:10.1523 / JNEUROSCI.23-08-03118.2003. PMC 6742332. PMID 12716918.
- ^ Calabrese, Barbara; Wilson, M.S .; Halpain, S. (1. února 2006). "Vývoj a regulace dendritických páteřních synapsí". Fyziologie. 21 (1): 38–47. doi:10.1152 / fyziol. 00042.2005. PMID 16443821.
- ^ Sakumura Y, Tsukada Y, Yamamoto N, Ishii S (2005). „Molekulární model pro vedení axonů založený na vzájemné komunikaci mezi rho GTPázami“. Biophys J.. 89 (2): 812–22. doi:10.1529 / biophysj.104.055624. PMC 1366631. PMID 15923236.
- ^ Brock J, Midwinter K, Lewis J, Martin P (1996). "Hojení řezné rány v zárodku kuřecího křídla: charakterizace aktinové kabelky a prokázání požadavku na aktivaci Rho". J Cell Biol. 135 (4): 1097–107. doi:10.1083 / jcb.135.4.1097. PMC 2133375. PMID 8922389.
- ^ Frantz, Christian; Karydis, Anastasios; Nalbant, Perihan; Hahn, Klaus M .; Barber, Diane L. (05.11.2007). „Pozitivní zpětná vazba mezi aktivitou Cdc42 a odtokem H + výměníkem Na-H NHE1 pro polaritu migrujících buněk“. The Journal of Cell Biology. 179 (3): 403–410. doi:10.1083 / jcb.200704169. ISSN 0021-9525. PMC 2064788. PMID 17984318.
- ^ Niedergang F, Chavrier P (2005). Regulace fagocytózy Rho GTPázami. Curr Top Microbiol Immunol. Aktuální témata v mikrobiologii a imunologii. 291. 43–60. doi:10.1007/3-540-27511-8_4. ISBN 978-3-540-23865-2. PMID 15981459.
- ^ Narumiya S, Yasuda S (2006). "Rho GTPázy v mitóze zvířecích buněk". Curr Opin Cell Biol. 18 (2): 199–205. doi:10.1016 / j.ceb.2006.02.002. PMID 16487696.
- ^ Jain A, Brady-Kalnay SM, Bellamkonda RV (2004). „Modulace aktivity Rho GTPázy zmírňuje inhibici prodloužení neuritů závislou na chondroitinsulfátu proteoglykanu“. J Neurosci Res. 77 (2): 299–307. doi:10.1002 / jnr.20161. PMID 15211597.
- ^ Ramakers GJ. (2002). "Rho proteiny, mentální retardace a buněčný základ poznání". Trendy Neurosci. 25 (4): 191–9. doi:10.1016 / S0166-2236 (00) 02118-4. PMID 11998687.
Několik mutací v proteinech Rho bylo identifikováno při sekvenování rakoviny ve velkém měřítku. Tyto mutace jsou uvedeny v databázi katalogu somatických mutací (http://www.sanger.ac.uk/genetics/CGP/cosmic/ ). Funkční důsledky těchto mutací nejsou známy.
