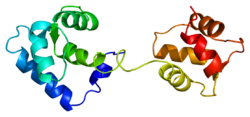Troponin C typ 1 - Troponin C type 1
Troponin C., také známý jako TN-C nebo TnC, je protein který sídlí v troponin komplex na aktin tenká vlákna z pruhovaný sval (srdeční, kostra s rychlým škubáním nebo kostra s pomalým škubáním) a je odpovědná za vazbu vápník k aktivaci svalové kontrakce.[5][6] Troponin C je kódován TNNC1 gen u lidí[7] pro srdeční i pomalý kosterní sval.
Struktura
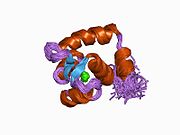
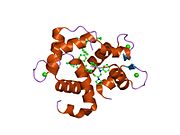
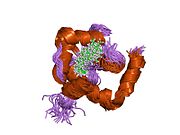
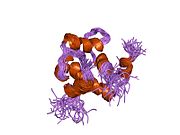
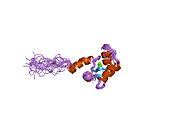
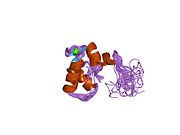
Srdeční troponin C (cTnC) je protein se 161 aminokyselinami[8] organizovány do dvou domén: regulační N-terminál doména (cNTnC, zbytky 1-86), strukturní C-terminál doména (cCTnC, zbytky 93-161) a a flexibilní linker spojení dvou domén (zbytky 87-92).[9] Každá doména obsahuje dvě EF ruce, Ca2+-vázání motivů helix-loop-helix ilustrovaných například proteiny parvalbumin[10] a klimodulin.[11] V cCTnC tvoří dva EF-ruční motivy dva vysoce afinitní Ca2+-závazné stránky.[12] které jsou obsazeny při všech fyziologicky relevantních koncentracích vápníku. Naproti tomu pouze druhá EF ruka v cNTnC váže Ca2+ s nízkou afinitou, zatímco první EF z ruky Ca2+-vázací stránka je nefunkční.[13]
V typickém EF-ručním proteinu, jako je kalmodulin, Ca2+ vazba indukuje konformační přechod uzavřeno-otevřeno a vystavuje velkou hydrofobní náplast v otevřeném stavu.[14] Podobně je regulační doména srdečního troponinu, cNTnC, v uzavřené konformaci ve stavu apo (bez vazby na vápník).[15] Na Ca2+ vazba, cNTnC vstupuje do rychlé rovnováhy mezi uzavřenou a otevřenou formou, nicméně uzavřená forma stále převládá.[9][16][17] Strukturální doména, cCTnC, existuje jako „roztavená globule „ve stavu apo,[18] ale tvoří dobře strukturovanou otevřenou konformaci v Ca2+-vázaný stav. Tyto strukturální rozdíly mění relativní stability apo- a Ca2+-vázané státy, které představují rozdílnou Ca2+-vázací afinity mezi dvěma doménami.
Funkce
V srdečním svalu se cTnC váže na srdeční troponin I (cTnI) a srdeční troponin T (cTnT), zatímco cTnC se váže na pomalý kosterní troponin I (ssTnI) a troponin T (ssTnT) v pomalém kosterním svalu.
Strukturální doména cTnC (cCTnC) je ukotvena k troponinu I a T a tvoří tzv. IT rameno, složené z cTnC93-161, cTnI41-135 a cTnT235-286 (v srdečním komplexu).[19] cCTnC se váže na spirálovitý cTnI41-60 prostřednictvím své velké hydrofobní náplasti stabilizující Ca2+-vázaná otevřená konformace cCTnC a zvyšování její afinity k Ca2+ (od K.d = 40 nM až K.d = 3 nM).[20][21] cTnT235-286 tvoří spirálovitě stočenou cívku s cTnI88-135 který se váže na opačnou stranu cCTnC.[19] IT rameno je ukotveno k tropomyosinu přes sousední segmenty cTnT,[22][23][24] věří se tedy, že se pohybuje jako jednotka spolu s tropomyosinem během srdečního cyklu.[25] V prostředí s nízkým obsahem vápníku přítomném během diastoly (~ 100 nM),[26] tropomyosin je ukotven do „blokované“ polohy podél tenkého vlákna aktinu prostřednictvím vazby inhibitory troponinu I (cTnI128-147) a C-terminál (cTnI160-209) regiony.[27][28] Tím se zabrání křížovému přemostění aktin-myosin a účinně se vypne svalová kontrakce.
Protože cytoplazmatický Ca2+ koncentrace stoupá na ~ 1 μM během systola,[26] Ca.2+ vazba na regulační doménu srdečního troponinu C (cNTnC) je klíčovou událostí, která vede ke svalové kontrakci. Hydrofobní vazba cNTnC na „přepínací“ oblast troponinu I, cTnI148-159, stabilizuje Ca2+-vázaná otevřená konformace cNTnC[29] (zvýšení Ca2+ vazebná afinita cNTnC od přibližně K.d = 5 μM až K.d = 0,8 μM).[30] Tato vazebná událost odstraní sousední inhibiční oblasti cTnI z aktinu a stabilizuje tropomyosin v jeho výchozí „uzavřené“ poloze na tenkém vláknu,[31] což umožňuje postupné přemostění aktin-myosin a svalovou kontrakci. Silná interakce aktin-myosin může dále posunout tenké vlákno do "otevřené" polohy.[32][33]
Fyziologická regulace citlivosti na vápník
Citlivost sarkomeru na vápník, tj. Koncentrace vápníku, při které dochází ke svalové kontrakci, je přímo určena vazebnou afinitou k vápníku cNTnC. Dosud nejsou známy žádné posttranslační modifikace cTnC, které by ovlivňovaly jeho afinitu k vazbě na vápník. Vazba vápníku pomocí cNTnC je však dynamický proces, který může být ovlivněn konformační rovnováhou uzavřeno-otevřeno cNTnC, umístěním domény cNTnC nebo relativní dostupností cTnI.148-159, fyziologický vazebný partner cNTnC. Rovnováhu mezi otevřenými a otevřenými cNTnC lze malými sloučeninami posunout do otevřeného stavu [34](viz část níže o léčivech vázajících troponin). Umístění domény cNTnC může být ovlivněno fosforylací cTnI,[35] z nichž nejdůležitějším místem u lidí je Ser22 / Ser23.[36][37] Dostupnost cTnI148-159 závisí na rovnováze blokovaného-uzavřeného-otevřeného tropomyosinu na aktinu, což může být ovlivněno jakýmikoli interakcemi zahrnujícími tenké vlákno, včetně křížového přemostění aktin-myosin[38] a aktivace závislá na délce [39][40](také známý jako aktivace roztažení nebo Frank Starlingův zákon srdce). Všechny tyto procesy mohou být ovlivněny mutacemi (viz část níže o mutacích způsobujících onemocnění).
Mutace způsobující nemoci
Hypertrofické kardiomyopatie (HCM) je běžný stav (prevalence> 1: 500)[41] charakterizované abnormálním zesílením komorové sval, klasicky v intraventrikulární septální stěna. HCM je popisována jako onemocnění sarkoméra, protože mutace v kontraktilních proteinech sarkomery byly identifikovány asi u poloviny pacientů s HCM. Mutace cTnC, které byly spojeny s HCM, jsou A8V, L29Q, A31S, C84Y, D145E.[42][43][44] Ve všech případech byla mutace identifikována u jednoho pacienta, takže je nutné další genetické testování k potvrzení nebo vyvrácení klinického významu těchto mutací. U většiny těchto mutací (a obecně u mutací tenkých vláken spojených s HCM) bylo pozorováno zvýšení srdeční citlivosti na vápník.[45][46]
Rodinná dilatační kardiomyopatie (DCM) je vzácná příčina systolického srdečního selhání (prevalence 1: 5 000). S DCM je spojena širší škála mutací (včetně některých i jiných než sarkomérních proteinů). Mutace cTnC spojené s DCM jsou dosud Y5H, Q50R, D75Y, M103I, D145E (také asociované s HCM), I148V a G159D.[47][48] Z nich Q50R[49] a G159D[50] spolu s onemocněním u postižených členů rodiny, což zvyšuje důvěru v to, že jde o klinicky významné mutace. Biochemické důsledky mutací spojených s DCM tenkých vláken jsou méně dobře zavedené než pro HCM, i když existují určité náznaky, že některé z mutací ruší účinek destenzibilizace vápníku fosforylací cTnI na Ser22 / 23.[51] Může to být proto, že některé mutace narušují přesné umístění cNTnC pro spuštění svalové kontrakce, když je cTnI nefosforylován.[52]
Léky vázající troponin
Chemické sloučeniny se mohou vázat na troponin C a působit jako aktivátory troponinu (senzibilizátory vápníku) nebo inhibitory troponinu (desenzibilizátory vápníku). Existuje již několik aktivátorů troponinu, které se vážou na rychlý kosterní troponin C, z nichž je tirasemtiv[53] byl testován v několika klinických studiích.[54][55][56] Naproti tomu nejsou známy žádné sloučeniny, které by se s vysokou afinitou vážily na srdeční troponin C. Senzibilizátor vápníku, levosimendan se údajně váže na troponin C, ale byla zjištěna pouze slabá nebo nekonzistentní vazba,[57][58][59] vylučuje jakékoli stanovení struktury. Naproti tomu levosimendan inhibuje fosfodiesterázu typu 3 s nanomolární afinitou,[60] takže jeho biologický cíl je kontroverzní.[61]
Bylo zjištěno, že některé sloučeniny vážou cNTnC s nízkou afinitou a působí jako aktivátory troponinu: DFBP-O[62] (strukturní analog levosimendanu), 4- (4- (2,5-dimethylfenyl) -1-piperazinyl) -3-pyridinamin (NCI147866),[63] a bepridil.[64] Bylo také zjištěno, že antagonista kalmodulinu, W7, se váže na cNTnC a působí jako inhibitor troponinu.[65] Všechny tyto sloučeniny se vážou na hydrofobní náplast v otevřené konformaci cNTnC, přičemž aktivátory troponinu podporují interakci s cTnI switch peptidem a inhibitory troponinu destabilizují interakci.
Řada sloučenin se také může vázat na cCTnC s nízkou afinitou: EMD 57033,[66] resveratrol,[67] bepridil,[68] a EGCG.[69] Všechny tyto sloučeniny jsou známé svou promiskuitou a biologický význam těchto interakcí není znám. Zejména není známo, jak interakce s cCTnC ovlivňuje afinitu cNTnC k vápníku.
Teoreticky by srdeční aktivátor troponinu mohl být užitečný pro zvýšení srdeční kontraktility při léčbě systolického srdečního selhání, zatímco inhibitor troponinu by mohl být použit k upřednostnění relaxace při léčbě diastolického srdečního selhání. K zvrácení dopadu mutací způsobujících kardiomyopatii na tenké vlákno lze také použít modulátory troponinu.
Poznámky
Verze tohoto článku z roku 2015 byla aktualizována externím odborníkem na základě modelu dvojího publikace. Korespondence akademický recenzent článek byl publikován v Gen a lze jej citovat jako: Monica X Li; Peter M Hwang (25. října 2015), „Struktura a funkce srdečního troponinu C (TNNC1): důsledky pro srdeční selhání, kardiomyopatie a léky modulující troponin“, Gen, 571 (2): 153–66, doi:10.1016 / J.GENE.2015.07.074, ISSN 0378-1119, PMC 4567495, PMID 26232335, Wikidata Q28607749 |
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000114854 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000091898 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Schreier T, Kedes L, Gahlmann R (prosinec 1990). "Klonování, strukturní analýza a exprese lidského genu pro pomalý záškub kosterního svalu / srdce pro troponin C". The Journal of Biological Chemistry. 265 (34): 21247–53. PMID 2250022.
- ^ Townsend PJ, Yacoub MH, Barton PJ (červenec 1997). "Přiřazení genu pro lidský srdeční / pomalý kosterní sval pro troponin C (TNNC1) mezi D3S3118 a GCT4B10 na krátkém rameni chromozomu 3 pomocí hybridní analýzy somatických buněk". Annals of Human Genetics. 61 (Pt 4): 375–7. doi:10.1046 / j.1469-1809.1997.6140375.x. PMID 9365790. S2CID 2997137.
- ^ „Entrez Gene: TNNC1 troponin C typ 1 (pomalý)“.
- ^ "Troponin C, pomalé kosterní a srdeční svaly". Srdeční organelární proteinová atlasová znalostní databáze (COPaKB) - informace o proteinech.
- ^ A b Sia SK, Li MX, Spyracopoulos L, Gagné SM, Liu W, Putkey JA, Sykes BD (červenec 1997). „Struktura troponinu C srdečního svalu neočekávaně odhaluje uzavřenou regulační doménu“. The Journal of Biological Chemistry. 272 (29): 18216–21. doi:10.1074 / jbc.272.29.18216. PMID 9218458.
- ^ Kretsinger RH, Nockolds CE (květen 1973). "Protein vázající vápník na vápník. II. Stanovení struktury a obecný popis". The Journal of Biological Chemistry. 248 (9): 3313–26. PMID 4700463.
- ^ Strynadka NC, James MN (červen 1989). "Krystalové struktury proteinů vázajících vápník na spirálu-smyčku-spirálu". Roční přehled biochemie. 58 (1): 951–999. doi:10.1146 / annurev.bi.58.070189.004511. PMID 2673026.
- ^ Li MX, Saude EJ, Wang X, Pearlstone JR, Smillie LB, Sykes BD (červenec 2002). „Kinetické studie vázání peptidu vápníku a srdečního troponinu I na lidský srdeční troponin C pomocí NMR spektroskopie“. Evropský biofyzikální časopis. 31 (4): 245–256. doi:10.1007 / s00249-002-0227-1. PMID 12122471. S2CID 23676865.
- ^ van Eerd JP, Takahashi K (květen 1975). "Aminokyselinová sekvence hovězího srdečního tamponinu-C. Srovnání s králičím kosterním troponinem-C". Sdělení o biochemickém a biofyzikálním výzkumu. 64 (1): 122–7. doi:10.1016 / 0006-291x (75) 90227-2. PMID 1170846.
- ^ Gifford JL, MP Walsh, Vogel HJ (červenec 2007). „Struktury a vazebné vlastnosti kov-ionty motivů EF-hand helix-loop-helix vázajících Ca2 +“. The Biochemical Journal. 405 (2): 199–221. doi:10.1042 / BJ20070255. PMID 17590154. S2CID 11770498.
- ^ Spyracopoulos L, Li MX, Sia SK, Gagné SM, Chandra M, Solaro RJ, Sykes BD (říjen 1997). „Vápníkem indukovaný strukturální přechod v regulační doméně lidského srdečního troponinu C“. Biochemie. 36 (40): 12138–46. doi:10.1021 / bi971223d. PMID 9315850. S2CID 6509305.
- ^ Eichmüller C, Skrynnikov NR (srpen 2005). „Nový experiment s amidovým protonem R1rho umožňuje přesnou charakterizaci konsekční výměny v mikrosekundě v časovém měřítku“. Journal of Biomolecular NMR. 32 (4): 281–293. doi:10.1007 / s10858-005-0658-r. PMID 16211482. S2CID 44304061.
- ^ Cordina NM, Liew CK, Gell DA, Fajer PG, Mackay JP, Brown LJ (březen 2013). "Účinky vazby vápníku a hypertrofická kardiomyopatie A8V mutace na dynamickou rovnováhu mezi uzavřenou a otevřenou konformací regulační N-domény izolovaného srdečního troponinu C". Biochemie. 52 (11): 1950–1962. doi:10.1021 / bi4000172. PMID 23425245.
- ^ Brito RM, Krudy GA, Negele JC, Putkey JA, Rosevear PR (říjen 1993). „Vápník hraje výraznou strukturální roli v N- a C-koncových doménách srdečního troponinu C“. The Journal of Biological Chemistry. 268 (28): 20966–73. PMID 8407932.
- ^ A b Takeda S, Yamashita A, Maeda K, Maéda Y (červenec 2003). "Struktura hlavní domény lidského srdečního troponinu ve formě nasycené Ca (2 +)". Příroda. 424 (6944): 35–41. doi:10.1038 / nature01780. PMID 12840750. S2CID 2174019.
- ^ Johnson JD, Potter JD (červen 1978). "Detekce dvou tříd vazebných míst Ca2 + v troponinu C s cirkulárním dichroismem a tyrosinovou fluorescencí". The Journal of Biological Chemistry. 253 (11): 3775–7. PMID 649605.
- ^ Johnson JD, Collins JH, Robertson SP, Potter JD (říjen 1980). „Studie fluorescenční sondy o vazbě Ca2 + na místa specifická pro Ca2 + srdečního troponinu a troponinu C“. The Journal of Biological Chemistry. 255 (20): 9635–40. PMID 7430090.
- ^ Pearlstone JR, Smillie LB (červen 1981). "Identifikace druhé vazebné oblasti na králičím kosterním troponinu-T pro alfa-tropomyosin". FEBS Dopisy. 128 (1): 119–22. doi:10.1016/0014-5793(81)81095-2. PMID 7274451. S2CID 85355424.
- ^ Jin JP, Chong SM (srpen 2010). "Lokalizace dvou vazebných míst pro tropomyosin troponinu T". Archivy biochemie a biofyziky. 500 (2): 144–150. doi:10.1016 / j.abb.2010.06.001. PMC 2904419. PMID 20529660.
- ^ Tanokura M, Ohtsuki I (květen 1984). „Interakce mezi chymotryptickými subfragmenty troponinu T, tropomyosinem, troponinem I a troponinem C“. Journal of Biochemistry. 95 (5): 1417–21. doi:10.1093 / oxfordjournals.jbchem.a134749. PMID 6746613.
- ^ Sevrieva I, Knowles AC, Kampourakis T, Sun YB (říjen 2014). "Regulační doména troponinu se dynamicky pohybuje během aktivace srdečního svalu". Journal of Molecular and Cellular Cardiology. 75: 181–7. doi:10.1016 / j.yjmcc.2014.07.015. PMC 4169182. PMID 25101951.
- ^ A b Bers DM (srpen 2000). „Toky vápníku podílející se na kontrole kontrakce srdečních myocytů“. Výzkum oběhu. 87 (4): 275–81. doi:10.1161 / 01.res.87.4.275. PMID 10948060.
- ^ Tripet B, Van Eyk JE, Hodges RS (září 1997). „Mapování druhého aktin-tropomyosinu a druhého vazebného místa pro troponin C v C-konci troponinu I a jejich význam v regulaci svalové kontrakce závislé na Ca2 +“. Journal of Molecular Biology. 271 (5): 728–50. doi:10.1006 / jmbi.1997.1200. PMID 9299323.
- ^ Ramos CH (červen 1999). „Mapování subdomén v C-terminální oblasti troponinu I podílející se na jeho vazbě na troponin C a na tenké vlákno“. The Journal of Biological Chemistry. 274 (26): 18189–95. doi:10.1074 / jbc.274.26.18189. PMID 10373418.
- ^ Li MX, Spyracopoulos L, Sykes BD (červen 1999). „Vazba srdečního troponinu-I147-163 indukuje strukturální otvor v lidském srdečním troponinu-C“. Biochemie. 38 (26): 8289–98. doi:10.1021 / bi9901679. PMID 10387074.
- ^ Davis JP, Norman C, Kobayashi T, Solaro RJ, Swartz DR, Tikunova SB (květen 2007). "Účinky tenkých a silných vláknitých proteinů na vazbu vápníku a výměnu se srdečním troponinem C". Biofyzikální deník. 92 (9): 3195–3206. doi:10.1529 / biophysj.106.095406. PMC 1852344. PMID 17293397.
- ^ von der Ecken J, Müller M, Lehman W, Manstein DJ, Penczek PA, Raunser S (březen 2015). "Struktura komplexu F-aktin-tropomyosin". Příroda. 519 (7541): 114–117. doi:10.1038 / příroda14033. PMC 4477711. PMID 25470062.
- ^ Behrmann E, Müller M, Penczek PA, Mannherz HG, Manstein DJ, Raunser S (červenec 2012). "Struktura komplexu přísnosti aktin-tropomyosin-myosin". Buňka. 150 (2): 327–38. doi:10.1016 / j.cell.2012.05.037. PMC 4163373. PMID 22817895.
- ^ von der Ecken J, Heissler SM, Pathan-Chhatbar S, Manstein DJ, Raunser S (červen 2016). „Kryo-EM struktura lidského cytoplazmatického komplexu aktomyosinů s téměř atomovým rozlišením“. Příroda. 534 (7609): 724–28. doi:10.1038 / příroda18295. PMID 27324845. S2CID 4472407.
- ^ Hwang PM, Sykes BD (duben 2015). "Zaměření sarkomeru na opravu funkce svalů". Recenze přírody. Objev drog. 14 (5): 313–28. doi:10.1038 / nrd4554. PMID 25881969. S2CID 21888079.
- ^ Hwang PM, Cai F, Pineda-Sanabria SE, Corson DC, Sykes BD (říjen 2014). „Srdečně specifická N-koncová oblast troponinu I umisťuje regulační doménu troponinu C“. Sborník Národní akademie věd Spojených států amerických. 111 (40): 14412–14417. doi:10.1073 / pnas.1410775111. PMC 4210035. PMID 25246568.
- ^ Zhang J, Guy MJ, Norman HS, Chen YC, Xu Q, Dong X, Guner H, Wang S, Kohmoto T, Young KH, Moss RL, Ge Y (září 2011). „Kvantitativní proteomika shora dolů identifikovala fosforylaci srdečního troponinu I jako kandidátského biomarkeru pro chronické srdeční selhání“. Journal of Proteome Research. 10 (9): 4054–65. doi:10,1021 / pr200258m. PMC 3170873. PMID 21751783.
- ^ Kobayashi T, Yang X, Walker LA, Van Breemen RB, Solaro RJ (leden 2005). „Nerovnovážná izoelektrická fokusační metoda pro stanovení stavů fosforylace srdečního troponinu I: identifikace Ser-23 a Ser-24 jako významných míst fosforylace proteinovou kinázou C“. Journal of Molecular and Cellular Cardiology. 38 (1): 213–8. doi:10.1016 / j.yjmcc.2004.10.014. PMID 15623438.
- ^ Rieck DC, Li KL, Ouyang Y, Solaro RJ, Dong WJ (září 2013). „Strukturální základ pro senzibilizaci Ca (2+) in situ srdečního troponinu C pozitivní zpětnou vazbou od sirosgenerujících myosinových křížových můstků“. Archivy biochemie a biofyziky. 537 (2): 198–209. doi:10.1016 / j.abb.2013.07.013. PMC 3836555. PMID 23896515.
- ^ Wijnker PJ, Sequeira V, Foster DB, Li Y, Dos Remedios CG, Murphy AM, Stienen GJ, van der Velden J (duben 2014). „Aktivace závislá na délce je modulována bisfosforylací srdečního troponinu I na Ser23 a Ser24, ale nikoli fosforylací Thr143“. American Journal of Physiology. Fyziologie srdce a oběhu. 306 (8): H1171–81. doi:10.1152 / ajpheart.00580.2013. PMC 3989756. PMID 24585778.
- ^ Wijnker PJ, Sequeira V, Witjas-Paalberends ER, Foster DB, dos Remedios CG, Murphy AM, Stienen GJ, van der Velden J (červenec 2014). „Fosforylace míst proteinkinázy C Ser42 / 44 snižuje Ca (2 +) - citlivost a otupuje zvýšenou délkově závislou aktivaci v reakci na protein kinázu A v lidských kardiomyocytech“. Archivy biochemie a biofyziky. 554: 11–21. doi:10.1016 / j.abb.2014.04.017. PMC 4121669. PMID 24814372.
- ^ Semsarian C, Ingles J, Maron MS, Maron BJ (březen 2015). „Nové pohledy na prevalenci hypertrofické kardiomyopatie“. Journal of the American College of Cardiology. 65 (12): 1249–1254. doi:10.1016 / j.jacc.2015.01.019. PMID 25814232.
- ^ Parvatiyar MS, Landstrom AP, Figueiredo-Freitas C, Potter JD, Ackerman MJ, Pinto JR (září 2012). „Mutace v TNNC1 kódovaném srdečním troponinu C, TNNC1-A31S, predisponuje k hypertrofické kardiomyopatii a ventrikulární fibrilaci“. The Journal of Biological Chemistry. 287 (38): 31845–55. doi:10.1074 / jbc.M112.377713. PMC 3442518. PMID 22815480.
- ^ Landstrom AP, Parvatiyar MS, Pinto JR, Marquardt ML, Bos JM, Tester DJ, Ommen SR, Potter JD, Ackerman MJ (srpen 2008). „Molekulární a funkční charakterizace nových mutací citlivosti na hypertrofickou kardiomyopatii v troponinu C kódovaném TNNC1“. Journal of Molecular and Cellular Cardiology. 45 (2): 281–288. doi:10.1016 / j.yjmcc.2008.05.003. PMC 2627482. PMID 18572189.
- ^ Hoffmann B, Schmidt-Traub H, Perrot A, Osterziel KJ, Gessner R (červen 2001). "První mutace srdečního troponinu C, L29Q, u pacienta s hypertrofickou kardiomyopatií". Lidská mutace. 17 (6): 524. doi:10,1002 / humu.1143. PMID 11385718. S2CID 28579333.
- ^ Willott RH, Gomes AV, Chang AN, Parvatiyar MS, Pinto JR, Potter JD (květen 2010). „Mutace v troponinu, které způsobují HCM, DCM A RCM: co se můžeme dozvědět o funkci tenkých vláken?“. Journal of Molecular and Cellular Cardiology. 48 (5): 882–892. doi:10.1016 / j.yjmcc.2009.10.031. PMID 19914256.
- ^ Chang AN, Parvatiyar MS, Potter JD (duben 2008). „Troponin a kardiomyopatie“. Sdělení o biochemickém a biofyzikálním výzkumu. 369 (1): 74–81. doi:10.1016 / j.bbrc.2007.12.081. PMID 18157941.
- ^ Lim CC, Yang H, Yang M, Wang CK, Shi J, Berg EA, Pimentel DR, Gwathmey JK, Hajjar RJ, Helmes M, Costello CE, Huo S, Liao R (květen 2008). „Nový mutantní srdeční troponin C narušuje molekulární pohyby kritické pro afinitu vázání vápníku a kontraktilitu kardiomyocytů“. Biofyzikální deník. 94 (9): 3577–89. doi:10.1529 / biophysj.107.112896. PMC 2292379. PMID 18212018.
- ^ Hershberger RE, Norton N, Morales A, Li D, Siegfried JD, Gonzalez-Quintana J (duben 2010). "Kódující sekvence vzácných variant identifikovaných v MYBPC3, MYH6, TPM1, TNNC1 a TNNI3 od 312 pacientů s familiární nebo idiopatickou dilatační kardiomyopatií". Oběh: Kardiovaskulární genetika. 3 (2): 155–161. doi:10.1161 / CIRCGENETICS.109.912345. PMC 2908892. PMID 20215591.
- ^ van Spaendonck-Zwarts KY, van Tintelen JP, van Veldhuisen DJ, van der Werf R, Jongbloed JD, Paulus WJ, Dooijes D, van den Berg MP (květen 2010). „Peripartální kardiomyopatie jako součást familiární dilatační kardiomyopatie“. Oběh. 121 (20): 2169–2175. doi:10.1161 / CIRCULATIONAHA.109.929646. PMID 20458010.
- ^ Mogensen J, Murphy RT, Shaw T, Bahl A, Redwood C, Watkins H, Burke M, Elliott PM, McKenna WJ (listopad 2004). „Těžká exprese srdečních mutací troponinu C a T u pacientů s idiopatickou dilatovanou kardiomyopatií“. Journal of the American College of Cardiology. 44 (10): 2033–2040. doi:10.1016 / j.jacc.2004.08.027. PMID 15542288.
- ^ Memo M, Leung MC, Ward DG, dos Remedios C, Morimoto S, Zhang L, Ravenscroft G, McNamara E, Nowak KJ, Marston SB, Messer AE (červenec 2013). „Familiární dilatované kardiomyopatie mutace odpojují fosforylaci troponinu I ze změn citlivosti myofibrilárního Ca²" “. Kardiovaskulární výzkum. 99 (1): 65–73. doi:10.1093 / cvr / cvt071. PMID 23539503.
- ^ Hwang PM, Cai F, Pineda-Sanabria SE, Corson DC, Sykes BD (říjen 2014). „Srdečně specifická N-koncová oblast troponinu I umisťuje regulační doménu troponinu C“. Sborník Národní akademie věd Spojených států amerických. 111 (40): 14412–14417. doi:10.1073 / pnas.1410775111. PMC 4210035. PMID 25246568.
- ^ Russell AJ, Hartman JJ, Hinken AC, Muci AR, Kawas R, Driscoll L, Godinez G, Lee KH, Marquez D, Browne WF, Chen MM, Clarke D, Collibee SE, Garard M, Hansen R, Jia Z, Lu PP , Rodriguez H, Saikali KG, Schaletzky J, Vijayakumar V, Albertus DL, Claflin DR, Morgans DJ, Morgan BP, Malik FI (březen 2012). „Aktivace troponinu rychlého kosterního svalu jako potenciální terapeutický přístup k léčbě neuromuskulárních onemocnění“. Přírodní medicína. 18 (3): 452–455. doi:10,1038 / nm. 2618. PMC 3296825. PMID 22344294.
- ^ Shefner JM, Wolff AA, Meng L (prosinec 2013). "Vztah mezi koncentrací tirasemtivu v séru a funkčními výsledky u pacientů s ALS". Amyotrofická laterální skleróza a frontotemporální degenerace. 14 (7–8): 582–5. doi:10.3109/21678421.2013.817587. PMID 23952600. S2CID 25563161.
- ^ Bauer TA, Wolff AA, Hirsch AT, Meng LL, Rogers K, Malik FI, Hiatt WR (květen 2014). „Účinek tirasemtivu, selektivního aktivátoru komplexu troponinů rychlého kosterního svalstva, u pacientů s onemocněním periferních tepen“. Cévní medicína. 19 (4): 297–306. doi:10.1177 / 1358863X14534516. PMID 24872402. S2CID 25185883.
- ^ Sanders DB, Rosenfeld J, Dimachkie MM, Meng L, Malik FI, Andrews J, Barohn R, Corse A, Deboo A, Felice K, Harati Y, Heiman-Patterson T, Howard JF, Jackson C, Juel V, Katz J, Lee J, Massey J, McVey A, Mozaffar T, Pasnoor M, Small G, So Y, Wang AK, Weinberg D, Wolff AA (duben 2015). „Dvojitě zaslepená, randomizovaná, placebem kontrolovaná studie hodnotící účinnost, bezpečnost a snášenlivost jednotlivých dávek tirasemtivu u pacientů s myasthenia gravis pozitivní na protilátky vázající se na acetylcholinový receptor“. Neuroterapeutika. 12 (2): 455–60. doi:10.1007 / s13311-015-0345-r. PMC 4404445. PMID 25742919.
- ^ Sorsa T, Pollesello P, Permi P, Drakenberg T, Kilpeläinen I (září 2003). "Interakce levosimendanu se srdečním troponinem C v přítomnosti peptidů srdečního troponinu I". Journal of Molecular and Cellular Cardiology. 35 (9): 1055–61. doi:10.1016 / s0022-2828 (03) 00178-0. PMID 12967628.
- ^ Robertson IM, Baryshnikova OK, Li MX, Sykes BD (červenec 2008). „Definování vazebného místa levosimendanu a jeho analogů v regulačním srdečním komplexu troponin C-troponin I“. Biochemie. 47 (28): 7485–95. doi:10.1021 / bi800438k. PMC 2652250. PMID 18570382.
- ^ Kleerekoper Q, Putkey JA (srpen 1999). "Vazba léčiva na srdeční troponin C". The Journal of Biological Chemistry. 274 (34): 23932–9. doi:10.1074 / jbc.274.34.23932. PMID 10446160.
- ^ Szilágyi S, Pollesello P, Levijoki J, Kaheinen P, Haikala H, Edes I, Papp Z (únor 2004). „Účinky levosimendanu a OR-1896 na izolované srdce, přípravky o velikosti myocytů a fosfodiesterázové enzymy morčete“. European Journal of Pharmacology. 486 (1): 67–74. doi:10.1016 / j.ejphar.2003.12.005. PMID 14751410.
- ^ Ørstavik Ø, Manfra O, Andressen KW, Andersen GØ, Skomedal T, Osnes JB, Levy FO, Krobert KA (2015). „Inotropní účinek aktivního metabolitu levosimendanu, OR-1896, je zprostředkován inhibicí PDE3 v komorovém myokardu potkanů.“. PLOS ONE. 10 (3): e0115547. doi:10.1371 / journal.pone.0115547. PMC 4349697. PMID 25738589.
- ^ Robertson IM, Sun YB, Li MX, Sykes BD (prosinec 2010). „Strukturální a funkční perspektiva do mechanismu senzitizátorů Ca2 +, které se zaměřují na srdeční komplex troponinů“. Journal of Molecular and Cellular Cardiology. 49 (6): 1031–41. doi:10.1016 / j.yjmcc.2010.08.019. PMC 2975748. PMID 20801130.
- ^ Lindert S, Li MX, Sykes BD, McCammon JA (únor 2015). „Počítačem podporovaný přístup k objevování léků zjišťuje senzibilizátor vápníku srdečního troponinu“. Chemická biologie a design léčiv. 85 (2): 99–106. doi:10.1111 / cbdd.12381. PMC 4456024. PMID 24954187.
- ^ Wang X, Li MX, Sykes BD (srpen 2002). "Struktura regulační N-domény lidského srdečního troponinu C v komplexu s lidským srdečním troponinem I147-163 a bepridilem". The Journal of Biological Chemistry. 277 (34): 31124–33. doi:10,1074 / jbc.M203896200. PMID 12060657.
- ^ Oleszczuk M, Robertson IM, Li MX, Sykes BD (květen 2010). „Struktura řešení regulační domény lidského srdečního troponinu C v komplexu s přepínací oblastí srdečního troponinu I a W7: základ W7 jako inhibitoru kontrakce srdečního svalu“. Journal of Molecular and Cellular Cardiology. 48 (5): 925–33. doi:10.1016 / j.yjmcc.2010.01.016. PMC 2854253. PMID 20116385.
- ^ Wang X, Li MX, Spyracopoulos L, Beier N, Chandra M, Solaro RJ, Sykes BD (červenec 2001). "Struktura C-domény lidského srdečního troponinu C v komplexu s Ca2 + senzibilizujícím lékem EMD 57033". The Journal of Biological Chemistry. 276 (27): 25456–66. doi:10,1074 / jbc.M102418200. PMID 11320096.
- ^ Pineda-Sanabria SE, Robertson IM, Sykes BD (březen 2011). "Struktura trans-resveratrolu v komplexu se srdečním regulačním proteinem troponinem C". Biochemie. 50 (8): 1309–20. doi:10.1021 / bi101985j. PMC 3043152. PMID 21226534.
- ^ Li Y, Love ML, Putkey JA, Cohen C (květen 2000). „Bepridil otevírá regulační N-terminální lalok srdečního troponinu C“. Sborník Národní akademie věd Spojených států amerických. 97 (10): 5140–5. doi:10.1073 / pnas.090098997. PMC 25795. PMID 10792039.
- ^ Robertson IM, Li MX, Sykes BD (srpen 2009). „Struktura roztoku lidského srdečního troponinu C v komplexu s polyfenolem zeleného čaje, (-) - epigalokatechinem 3-gallátem“. The Journal of Biological Chemistry. 284 (34): 23012–23. doi:10.1074 / jbc.M109.021352. PMC 2755708. PMID 19542563.
externí odkazy
- Hmotnostní spektrometrie charakterizace lidského TNNC1 na COPaKB.[1]
- Přehled GeneReviews / NIH / NCBI / UW o familiární hypertrofické kardiomyopatii - přehled
- Přehled všech strukturálních informací dostupných v PDB pro UniProt: P63316 (Troponin C, pomalé kosterní a srdeční svaly) na PDBe-KB.
- ^ Zong NC, Li H, Li H, Lam MP, Jimenez RC, Kim CS, Deng N, Kim AK, Choi JH, Zelaya I, Liem D, Meyer D, Odeberg J, Fang C, Lu HJ, Xu T, Weiss J , Duan H, Uhlen M, Yates JR, Apweiler R, Ge J, Hermjakob H, Ping P (říjen 2013). „Integrace biologie a medicíny srdečních proteomů pomocí specializované znalostní databáze“. Výzkum oběhu. 113 (9): 1043–53. doi:10.1161 / CIRCRESAHA.113.301151. PMC 4076475. PMID 23965338.