Kinesin - Kinesin
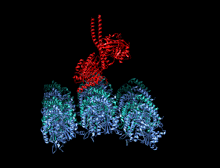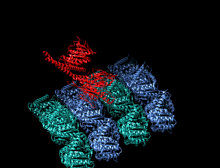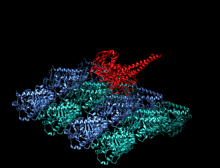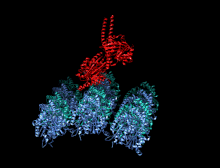

A kinesin je protein patřící do třídy motorické proteiny nalezen v eukaryotický buňky.
Kinesins postupovat mikrotubul (MT) vlákna a jsou poháněna hydrolýzou adenosintrifosfát (ATP) (tedy kinesiny jsou ATPázy ), typ enzymu. Aktivní pohyb kinesinů podporuje několik buněčných funkcí včetně mitóza, redukční dělení buněk a přeprava celulárního nákladu, například v axonální transport. Většina kinesinů kráčí směrem k plusovému konci mikrotubulu, který ve většině buněk znamená transport nákladu, jako jsou proteinové a membránové komponenty, ze středu buňky k periferii.[1] Tato forma dopravy je známá jako anterográdní doprava. V porovnání, dyneiny jsou motorické proteiny, které se pohybují směrem k minusovému konci mikrotubulu retrográdní doprava.
Objev
Kinesiny byly objeveny v roce 1985 na základě jejich motility v cytoplazmě extrudované z obřího axonu chobotnice.[2]
Ukázalo se, že jsou to anterográdní intracelulární transportní motory založené na MT.[3] Zakládající člen této nadčeledi, kinesin-1, byl izolován jako a heterotetramerní rychlý axonální transportní motor organel sestávající ze 2 identických motorických podjednotek (KHC) a 2 "lehkých řetězců" (KLC) prostřednictvím afinitní purifikace mikrotubulů z extraktů neuronových buněk.[4] Následně byl z extraktů vajíčka / embrya echinoderm purifikován odlišný, heterotrimerický plus-end zaměřený motor na bázi MT s názvem kinesin-2, sestávající ze 2 odlišných motorických podjednotek souvisejících s KHC a doplňkové podjednotky "KAP"[5] a je nejlépe známý svou rolí v transportu proteinových komplexů (částice IFT) podél axonémů během cilium biogeneze.[6] Molekulárně genetické a genomické přístupy vedly k poznání, že kinesiny tvoří rozmanitou nadrodinu motorů, které jsou odpovědné za mnohočetné intracelulární motilitní události v eukaryotických buňkách.[7][8][9][10] Například genomy savců kódují více než 40 kinesinových proteinů,[11] uspořádány do nejméně 14 rodin pojmenovaných kinesin-1 až kinesin-14.[12]
Struktura
Celková struktura
Členové nadrodiny kinesinů se liší tvarem, ale prototypový motor kinesin-1 se skládá ze dvou molekul Kinesin Heavy Chain (KHC), které tvoří dimer bílkovin (pár molekul), který váže dva lehké řetězce (KLC), které jsou jedinečné pro různé náklady.
Těžký řetězec kinesinu-1 zahrnuje globulár hlava (motorická doména) na aminoterminálním konci připojeném prostřednictvím krátkého, flexibilního linkeru na krku k stonek - dlouhá centrální alfa-šroubovice svinutá cívka doména - která končí v karboxylovém konci ocas doména, která se sdružuje s lehkými řetězci. Stonky dvou KHC se proplétají a tvoří a svinutá cívka který řídí dimerizaci dvou KHC. Ve většině případů se přepravovaný náklad váže na lehké řetězy kinesinu na TPR motiv sekvence KLC, ale v některých případech se náklad váže na C-koncové domény těžkých řetězců.[13]
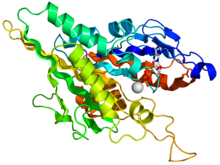
Kinesinová motorická doména
| Kinesinová motorická doména | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikátory | |||||||||
| Symbol | Kinezinová motorická doména | ||||||||
| Pfam | PF00225 | ||||||||
| InterPro | IPR001752 | ||||||||
| CHYTRÝ | SM00129 | ||||||||
| STRÁNKA | PS50067 | ||||||||
| SCOP2 | 1bg2 / Rozsah / SUPFAM | ||||||||
| CDD | cd00106 | ||||||||
| |||||||||
Hlava je podpisem kinesinu a jeho aminokyselinová sekvence je mezi různými kinesiny dobře zachována. Každá hlava má dvě samostatné vazebná místa: jeden pro mikrotubuly a druhý pro ATP. ATP vazba a hydrolýza stejně jako ADP uvolnění změnilo konformaci domén vázajících mikrotubuly a orientaci krční spojky vzhledem k hlavě; to má za následek pohyb kinesinu. Několik konstrukčních prvků v hlavě, včetně centrálního beta-list doména a domény Switch I a II byly implikovány jako zprostředkovávající interakce mezi dvěma vazebnými místy a doménou krku. Kinesiny jsou strukturně příbuzné G proteiny, které hydrolyzují GTP místo ATP. Mezi těmito dvěma rodinami je sdíleno několik strukturálních prvků, zejména doména Switch I a Switch II.

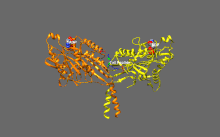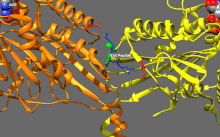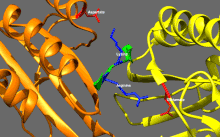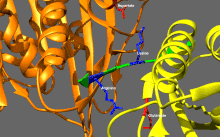
Základní regulace kinesinu
Kinesiny mají tendenci mít nízkou bazální enzymatickou aktivitu, která se stává významnou při aktivaci mikrotubulů.[16] Kromě toho může být mnoho členů nadrodiny kinesinů samoinhibováno vazbou ocasní domény na motorickou doménu.[17] Takovou autoinhibici lze poté zmírnit pomocí další regulace, jako je vázání na náklad nebo adaptéry nákladu.[18][19]
Nákladní doprava
V buňce malé molekuly, jako jsou plyny a glukóza, šířit tam, kde jsou potřeba. Velké molekuly syntetizované v těle buňky, intracelulární složky jako např vezikuly a organely jako např mitochondrie jsou příliš velké (a cytosol příliš přeplněný), než aby se mohl dostat do svých cílů. Motorické proteiny plní roli při přepravě velkého nákladu kolem buňky do požadovaných cílů. Kinesiny jsou motorické proteiny, které transportují takový náklad jednosměrnou chůzí mikrotubul sleduje hydrolyzování jedné molekuly adenosintrifosfát (ATP) v každém kroku.[20] Předpokládalo se, že ATP hydrolýza poháněl každý krok, uvolněná energie poháněla hlavu dopředu k dalšímu vazebnému místu.[21] Bylo však navrženo, aby hlava difundovala dopředu a síla vázání k mikrotubulu je to, co táhne náklad.[22] Kromě virů, například HIV, využívají kinesiny k tomu, aby po shromáždění umožnily přesazování virových částic.[23]
Existují významné důkazy o tom, že náklady in-vivo jsou přepravovány více motory.[24][25][26][27]
Směr pohybu
Motorické proteiny cestují určitým směrem podél mikrotubulu. Mikrotubuly jsou polární; To znamená, že hlavy se vážou na mikrotubuly pouze v jedné orientaci, zatímco vazba ATP dává každému kroku jeho směr procesem známým jako zip linker na krk.[28]
Již dříve bylo známo, že kinesin pohybuje nákladem směrem k plusovému (+) konci mikrotubulu, známému také jako anterográdní transport / ortogradní transport.[29] Nedávno však bylo objeveno, že v nadějných kvasinkových buňkách se kinesin Cin8 (člen rodiny Kinesin-5) může pohybovat také směrem k minus konci, nebo retrográdní transport. To znamená, že tyto jedinečné kvasinkové kinesinové homotetramery mají novou schopnost se pohybovat obousměrně.[30][31][32] Ukázalo se, že se Kinesin zatím pohybuje pouze směrem k minusovému konci, když je ve skupině, přičemž motory klouzají v antiparalelním směru ve snaze oddělit mikrotubuly.[33] Tato duální směrovost byla pozorována za stejných podmínek, kdy se volné molekuly Cin8 pohybují směrem k minusovému konci, ale zesíťující Cin8 se pohybuje směrem k plusovým koncům každého zesítěného mikrotubulu. Jedna konkrétní studie testovala rychlost, s jakou se motory Cin8 pohybovaly, jejich výsledky poskytly rozsah asi 25-55 nm / s ve směru k vřetenovým pólům.[34] Na individuální bázi bylo zjištěno, že při měnících se iontových podmínkách mohou motory Cin8 dosáhnout rychlosti až 380 nm / s.[34] Navrhuje se, že obousměrnost kvasnicových motorů kinesin-5, jako jsou Cin8 a Cut7, je výsledkem propojení s jinými motory Cin8 a pomáhá plnit roli dyneinu v začínajících kvasnicích, na rozdíl od lidského homologu těchto motorů, plus režie Eg5.[35] Tento objev v proteinech rodiny kinesin-14 (jako napřDrosophila melanogaster NCD, pučící droždí KAR3 aArabidopsis thaliana ATK5) umožňuje kinesinu kráčet opačným směrem, směrem k mínus konci mikrotubulů.[36] To není typické pro kinesin, spíše výjimka z normálního směru pohybu.

Další typ motorického proteinu, známý jakodyneiny, posuňte se směrem k minusovému konci mikrotubulu. Přepravují tedy náklad z okraje buňky směrem do středu. Příkladem toho by mohl být transport z terminálních boutonů neuronového axonu do těla buňky (soma). Toto je známé jakoretrográdní doprava.
Navrhované mechanismy pohybu
Kinesin dosahuje transportu „chůzí“ po mikrotubulu. Pro tento pohyb byly navrženy dva mechanismy.
- V mechanismu „předání rukou“ kinezinové hlavy přecházejí kolem sebe a střídají polohu olova.
- V mechanismu „palcového červa“ vždy vede jedna kinezinová hlava, která se posune o krok dopředu, než ji zadní hlava dohoní.
Navzdory některým přetrvávajícím polemikám rostoucí experimentální důkazy ukazují na mechanismus předání jako na pravděpodobnější.[37][38]
Vazba ATP a hydrolýza způsobují, že kinesin cestuje přes „houpací mechanismus“ kolem otočného bodu.[39][40] Tento houpací mechanismus odpovídá za pozorování, že vazba ATP na stav bez navázání na nukleotidy a mikrotubuly vede k naklonění motorické domény kinesinu vzhledem k mikrotubulům. Kriticky, před tímto nakloněním není spojovací část krku schopna přijmout svoji konformaci s hlavou ukotvenou směrem k motoru. Naklonění vyvolané ATP poskytuje příležitost pro spojku krku zakotvit do této konformace směřující dopředu. Tento model je založen na CRYO-EM modelech struktury kinesinu vázaných na mikrotubule, které představují počáteční a konečný stav procesu, ale nemohou vyřešit přesné podrobnosti přechodu mezi strukturami.
Teoretické modelování
Byla navržena řada teoretických modelů molekulárního motorického proteinu kinesinu.[41][42][43] V teoretických výzkumech se setkáváme s mnoha výzvami vzhledem k přetrvávajícím nejistotám ohledně rolí proteinových struktur, přesnému způsobu transformace energie z ATP na mechanickou práci a rolím, které hrají tepelné výkyvy. Jedná se o poměrně aktivní oblast výzkumu. Je zapotřebí zejména přístupů, které lépe vytvoří vazbu s molekulární architekturou proteinu a daty získanými z experimentálních výzkumů.
Dynamika jedné molekuly je již dobře popsána[44] ale zdá se, že tyto stroje v nano měřítku obvykle pracují ve velkých týmech. Nedávný experimentální výzkum ukázal, že kinesiny se při pohybu po mikrotubulích vzájemně ovlivňují,[45][46] interakce jsou na krátkou vzdálenost a slabě atraktivní (1,6 ± 0,5 K.BT). Jeden model, který byl vyvinut, bere v úvahu tyto částicové interakce,[44] kde se dynamické rychlosti odpovídajícím způsobem mění s energií interakce. Pokud je energie pozitivní, rychlost vytváření vazeb (q) bude vyšší, zatímco rychlost rozbití vazeb (r) bude nižší. Lze pochopit, že rychlost vstupu a výstupu v mikrotubulu bude také změněna energií (viz obrázek 1 v odkazu 30). Pokud je obsazeno druhé místo, bude rychlost vstupu α * q a pokud je obsazeno místo předposlední, bude rychlost výstupu β * r. Tento teoretický přístup souhlasí s výsledky simulací Monte Carlo pro tento model, zejména pro omezující případ velmi velké negativní energie. Normální zcela asymetrický jednoduchý proces vylučování výsledků (nebo TASEP) lze obnovit z tohoto modelu, čímž se energie rovná nule.
Mitóza
V posledních letech bylo zjištěno, že molekulární motory na bázi mikrotubulů (včetně řady kinesinů) mají roli v mitóza (buněčné dělení). Kinesiny jsou důležité pro správnou délku vřetena a podílejí se na posouvání mikrotubulů od sebe uvnitř vřetena během prometafáze a metafáze, stejně jako depolymerace mikrotubulů minus končí v centrosomech během anafáze.[47] Konkrétně proteiny rodiny Kinesin-5 působí uvnitř vřetena a posouvají mikrotubuly od sebe, zatímco Kinesin 13 rodina působí na depolymerizaci mikrotubulů.
Členové superrodiny Kinesin
Mezi členy nadrodiny lidských kinesinů patří následující proteiny, které jsou ve standardizované nomenklatuře vyvinuté komunitou výzkumníků kinesinu uspořádány do 14 rodin pojmenovaných kinesin-1 až kinesin-14:[12]
- 1A - KIF1A, 1B - KIF1B, 1C - KIF1C = kinesin-3
- 2A - KIF2A, 2C - KIF2C = kinesin-13
- 3B - KIF3B nebo 3C - KIF3C , 3A - KIF3A = kinesin-2
- 4A - KIF4A, 4B - KIF4B = kinesin-4
- 5A - KIF5A, 5B - KIF5B, 5C - KIF5C = kinesin-1
- 6 – KIF6 = kinesin-9
- 7 – KIF7 = kinesin-4
- 9 – KIF9 = kinesin-9
- 11 – KIF11 = kinesin-5
- 12 – KIF12 = kinesin-12
- 13A - KIF13A, 13B - KIF13B = kinesin-3
- 14 – KIF14 = kinesin-3
- 15 – KIF15 = kinesin-12
- 16B - KIF16B = kinesin-3
- 17 – KIF17 = kinesin-2
- 18A - KIF18A, 18B - KIF18B = kinesin-8
- 19 – KIF19 = kinesin-8
- 20A - KIF20A, 20B - KIF20B = kinesin-6
- 21A - KIF21A, 21B - KIF21B = kinesin-4
- 22 – KIF22 = kinesin-10
- 23 – KIF23 = kinesin-6
- 24 – KIF24 = kinesin-13
- 25 – KIF25 = kinesin-14
- 26A - KIF26A, 26B - KIF26B = kinesin-11
- 27 – KIF27 = kinesin-4
- C1 - KIFC1, C2 - KIFC2, C3 - KIFC3 = kinesin-14
lehké řetězce kinesin-1:
protein spojený s kinesin-2:
- KIFAP3 (také známý jako KAP-1, KAP3)
Viz také
- Axonální doprava
- Dynein
- Intraflagelární transport podél řasy
- Kinesin 8
- Kinesin 13
- KRP
- Molekulární motor
- Transport vícemotorovými proteiny
Reference
- ^ Berg J, Tymoczko JL, Stryer L (2002). „Kinesin a Dynein se pohybují podél mikrotubulů“. Biochemie. 5. vydání.
- ^ Endow SA, Kull FJ, Liu H (říjen 2010). "Kinesins na první pohled". Journal of Cell Science. 123 (Pt 20): 3420–4. doi:10.1242 / jcs.064113. PMID 20930137.
- ^ Vale RD (únor 2003). "Sada nástrojů pro molekulární motor pro intracelulární transport". Buňka. 112 (4): 467–80. doi:10.1016 / S0092-8674 (03) 00111-9. PMID 12600311. S2CID 15100327.
- ^ Vale RD, Reese TS, Sheetz MP (srpen 1985). „Identifikace nového proteinu generujícího sílu, kinesinu, který se podílí na motilitě založené na mikrotubulích“. Buňka. 42 (1): 39–50. doi:10.1016 / S0092-8674 (85) 80099-4. PMC 2851632. PMID 3926325.
- ^ Cole DG, Chinn SW, Wedaman KP, Hall K, Vuong T, Scholey JM (listopad 1993). "Nový heterotrimerický protein související s kinesinem purifikovaný z vajec mořského ježka". Příroda. 366 (6452): 268–70. Bibcode:1993 Natur.366..268C. doi:10.1038 / 366268a0. PMID 8232586. S2CID 4367715.
- ^ Rosenbaum JL, Witman GB (listopad 2002). "Intraflagellar transport". Recenze přírody. Molekulární buněčná biologie. 3 (11): 813–25. doi:10.1038 / nrm952. PMID 12415299. S2CID 12130216.
- ^ Yang JT, Laymon RA, Goldstein LS (březen 1989). „Třídoménová struktura těžkého řetězce kinesinu odhalená sekvencí DNA a analýzou vazby mikrotubulů“. Buňka. 56 (5): 879–89. doi:10.1016/0092-8674(89)90692-2. PMID 2522352. S2CID 44318695.
- ^ Aizawa H, Sekine Y, Takemura R, Zhang Z, Nangaku M, Hirokawa N (prosinec 1992). "Rodina Kinesinů v myší centrální nervové soustavě". The Journal of Cell Biology. 119 (5): 1287–96. doi:10.1083 / jcb.119.5.1287. PMC 2289715. PMID 1447303.
- ^ Enos AP, Morris NR (březen 1990). „Mutace genu, který kóduje protein podobný kinesinu, blokuje jaderné dělení v A. nidulans“. Buňka. 60 (6): 1019–27. doi:10.1016 / 0092-8674 (90) 90350-N. PMID 2138511. S2CID 27420513.
- ^ Meluh PB, Rose MD (březen 1990). "KAR3, gen související s kinesinem požadovaný pro jadernou fúzi kvasinek". Buňka. 60 (6): 1029–41. doi:10.1016 / 0092-8674 (90) 90351-E. PMID 2138512. S2CID 19660190.
- ^ Hirokawa N, Noda Y, Tanaka Y, Niwa S (říjen 2009). "Kinesin superrodiny motorické proteiny a intracelulární transport". Recenze přírody. Molekulární buněčná biologie. 10 (10): 682–96. doi:10.1038 / nrm2774. PMID 19773780. S2CID 18129292.
- ^ A b Lawrence CJ, Dawe RK, Christie KR, Cleveland DW, Dawson SC, Endow SA, Goldstein LS, Goodson HV, Hirokawa N, Howard J, Malmberg RL, McIntosh JR, Miki H, Mitchison TJ, Okada Y, Reddy AS, Saxton WM , Schliwa M, Scholey JM, Vale RD, Walczak CE, Wordeman L (říjen 2004). „Standardizovaná nomenklatura kinesinu“. The Journal of Cell Biology. 167 (1): 19–22. doi:10.1083 / jcb.200408113. PMC 2041940. PMID 15479732.
- ^ Hirokawa N, Pfister KK, Yorifuji H, Wagner MC, Brady ST, Bloom GS (březen 1989). "Submolekulární domény hovězího mozkového kinesinu identifikované elektronovou mikroskopií a dekorací monoklonální protilátky". Buňka. 56 (5): 867–78. doi:10.1016/0092-8674(89)90691-0. PMID 2522351. S2CID 731898.
- ^ PDB: 1BG2; Kull FJ, Sablin EP, Lau R, Fletterick RJ, Vale RD (duben 1996). „Krystalová struktura kinezinové motorické domény odhaluje strukturní podobnost s myosinem“. Příroda. 380 (6574): 550–5. Bibcode:1996 Natur.380..550J. doi:10.1038 / 380550a0. PMC 2851642. PMID 8606779.
- ^ A b Kaan HY, Hackney DD, Kozielski F (srpen 2011). „Struktura komplexu kinesin-1 motor-ocas odhaluje mechanismus autoinhibice“. Věda. 333 (6044): 883–5. Bibcode:2011Sci ... 333..883K. doi:10.1126 / science.1204824. PMC 3339660. PMID 21836017.
- ^ Stewart RJ, Thaler JP, Goldstein LS (červen 1993). „Směr pohybu mikrotubulů je vnitřní vlastností motorických domén těžkého řetězce kinesinu a proteinu Drosophila ncd“. Sborník Národní akademie věd Spojených států amerických. 90 (11): 5209–13. Bibcode:1993PNAS ... 90.5209S. doi:10.1073 / pnas.90.11.5209. PMC 46685. PMID 8506368.
- ^ Verhey KJ, Hammond JW (listopad 2009). "Řízení dopravy: regulace kinezinových motorů". Recenze přírody. Molekulární buněčná biologie. 10 (11): 765–77. doi:10.1038 / nrm2782. PMID 19851335. S2CID 10713993.
- ^ Siddiqui N, Zwetsloot AJ, Bachmann A, Roth D, Hussain H, Brandt J a kol. (Červen 2019). „PTPN21 a Hook3 uvolňují autoinhibici KIF1C a aktivují intracelulární transport“. Příroda komunikace. 10 (1): 2693. Bibcode:2019NatCo..10.2693S. doi:10.1038 / s41467-019-10644-9. PMC 6584639. PMID 31217419.
- ^ Blasius TL, Cai D, Jih GT, Toret CP, Verhey KJ (leden 2007). „Dva vazební partneři spolupracují na aktivaci molekulárního motoru Kinesin-1“. The Journal of Cell Biology. 176 (1): 11–7. doi:10.1083 / jcb.200605099. PMC 2063617. PMID 17200414.
- ^ Schnitzer MJ, Block SM (červenec 1997). "Kinesin hydrolyzuje jeden ATP na krok 8 nm". Příroda. 388 (6640): 386–90. Bibcode:1997 Natur.388..386S. doi:10.1038/41111. PMID 9237757. S2CID 4363000.
- ^ Vale RD, Milligan RA (duben 2000). „Způsob, jakým se věci pohybují: pohled pod kapotu proteinů molekulárních motorů“. Věda. 288 (5463): 88–95. Bibcode:2000Sci ... 288 ... 88V. doi:10.1126 / science.288.5463.88. PMID 10753125.
- ^ Mather WH, Fox RF (říjen 2006). „Kinesinův předpjatý krokový mechanismus: zesílení zipu spojky krku“. Biofyzikální deník. 91 (7): 2416–26. Bibcode:2006 BpJ .... 91,2416 mil. doi:10.1529 / biophysj.106.087049. PMC 1562392. PMID 16844749.
- ^ Gaudin R, de Alencar BC, Jouve M, Bèrre S, Le Bouder E, Schindler M, Varthaman A, Gobert FX, Benaroch P (říjen 2012). „Kritická role kinesinu KIF3A v životním cyklu HIV u primárních lidských makrofágů“. The Journal of Cell Biology. 199 (3): 467–79. doi:10.1083 / jcb.201201144. PMC 3483138. PMID 23091068.
- ^ Gross SP, Vershinin M, Shubeita GT (červen 2007). „Nákladní doprava: dva motory jsou někdy lepší než jeden“. Aktuální biologie. 17 (12): R478–86. doi:10.1016 / j.cub.2007.04.025. PMID 17580082. S2CID 8791125.
- ^ Hancock WO (srpen 2008). Msgstr "Intracelulární transport: kinesiny spolupracují". Aktuální biologie. 18 (16): R715–7. doi:10.1016 / j.cub.2008.07.068. PMID 18727910. S2CID 7540556.
- ^ Kunwar A, Vershinin M, Xu J, Gross SP (srpen 2008). „Krokování, tenzní hradlo a neočekávaná křivka síla-rychlost pro transport založený na více motorech“. Aktuální biologie. 18 (16): 1173–83. doi:10.1016 / j.cub.2008.07.027. PMC 3385514. PMID 18701289.
- ^ Klumpp S, Lipowsky R (listopad 2005). „Kooperativní nákladní doprava několika molekulárními motory“. Sborník Národní akademie věd Spojených států amerických. 102 (48): 17284–9. arXiv:q-bio / 0512011. Bibcode:2005PNAS..10217284K. doi:10.1073 / pnas.0507363102. PMC 1283533. PMID 16287974.
- ^ Rice S, Lin AW, Safer D, Hart CL, Naber N, Carragher BO, Cain SM, Pechatnikova E, Wilson-Kubalek EM, Whittaker M, Pate E, Cooke R, Taylor EW, Milligan RA, Vale RD (prosinec 1999) . "Strukturální změna v motorickém proteinu kinesinu, který řídí motilitu". Příroda. 402 (6763): 778–84. Bibcode:1999 Natur.402..778R. doi:10.1038/45483. PMID 10617199. S2CID 573909.
- ^ Lodish H, Berk A, Zipursky SL, Matsudaira P, Baltimore D, Darnell J (2000). „Kinesin, Dynein a intracelulární transport“. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Roostalu J, Hentrich C, Bieling P, Telley IA, Schiebel E, Surrey T (duben 2011). "Směrové přepínání kinesinu Cin8 prostřednictvím motorové spojky". Věda. 332 (6025): 94–9. Bibcode:2011Sci ... 332 ... 94R. doi:10.1126 / science.1199945. PMID 21350123. S2CID 90739364.
- ^ Fallesen T, Roostalu J, Duellberg C, Pruessner G, Surrey T (listopad 2017). „Soubory obousměrného kinezinu Cin8 produkují aditivní síly v obou směrech pohybu“. Biofyzikální deník. 113 (9): 2055–2067. Bibcode:2017BpJ ... 113.2055F. doi:10.1016 / j.bpj.2017.09.006. PMC 5685778. PMID 29117528.
- ^ Edamatsu M (březen 2014). „Obousměrná pohyblivost štěpných kvasinek kinesin-5, Cut7“. Sdělení o biochemickém a biofyzikálním výzkumu. 446 (1): 231–4. doi:10.1016 / j.bbrc.2014.02.106. PMID 24589736.
- ^ Roostalu J, Hentrich C, Bieling P, Telley IA, Schiebel E, Surrey T (duben 2011). "Směrové přepínání kinesinu Cin8 prostřednictvím motorové spojky". Věda. 332 (6025): 94–9. Bibcode:2011Sci ... 332 ... 94R. doi:10.1126 / science.1199945. PMID 21350123. S2CID 90739364.
- ^ A b Gerson-Gurwitz A, Thiede C, Movshovich N, Fridman V, Podolskaya M, Danieli T a kol. (Listopad 2011). „Směrovost jednotlivých motorů kinesin-5 Cin8 je modulována smyčkou 8, iontovou silou a geometrií mikrotubulů“. Časopis EMBO. 30 (24): 4942–54. doi:10.1038 / emboj.2011.403. PMC 3243633. PMID 22101328.
- ^ Valentine MT, Fordyce PM, Block SM (prosinec 2006). „Např. Eg5!“. Buněčné dělení. 1 (1): 31. doi:10.1186/1747-1028-1-31. PMC 1716758. PMID 17173688.
- ^ Ambrose JC, Li W, Marcus A, Ma H, Cyr R (duben 2005). „Kinesin zaměřený na mínus konec s aktivitou sledovacího proteinu na konci je zapojen do morfogeneze vřetena“. Molekulární biologie buňky. 16 (4): 1584–92. doi:10.1091 / mbc.e04-10-0935. PMC 1073643. PMID 15659646.
- ^ Yildiz A, Tomishige M, Vale RD, Selvin PR (leden 2004). „Kinesin jde ruku v ruce“. Věda. 303 (5658): 676–8. Bibcode:2004Sci ... 303..676Y. doi:10.1126 / science.1093753. PMID 14684828. S2CID 30529199.
- ^ Asbury CL (únor 2005). „Kinesin: nejmenší dvojnože na světě“. Současný názor na buněčnou biologii. 17 (1): 89–97. doi:10.1016 / j.ceb.2004.12.002. PMID 15661524.
- ^ Sindelar CV, Downing KH (březen 2010). "Mechanismus na atomové úrovni pro aktivaci kinezinových molekulárních motorů". Sborník Národní akademie věd Spojených států amerických. 107 (9): 4111–6. Bibcode:2010PNAS..107.4111S. doi:10.1073 / pnas.0911208107. PMC 2840164. PMID 20160108.
- ^ Laické shrnutí (18. února 2010). „Nejmenší motor života, nákladní nosič buněk, se pohybuje jako houpačka“. PhysOrg.com. Citováno 31. května 2013.
- ^ Atzberger PJ, Peskin CS (leden 2006). „Brownianův model dynamiky kinesinu ve třech rozměrech zahrnující profil prodloužení síly spirálového nákladního postroje“. Bulletin of Mathematical Biology. 68 (1): 131–60. arXiv:0910.5753. doi:10.1007 / s11538-005-9003-6. PMID 16794924. S2CID 13534734.
- ^ Peskin CS, Oster G (duben 1995). „Koordinovaná hydrolýza vysvětluje mechanické chování kinesinu“. Biofyzikální deník. 68 (4 doplňky): 202S – 210S, diskuse 210S – 211S. PMC 1281917. PMID 7787069.
- ^ Mogilner A, Fisher AJ, Baskin RJ (červenec 2001). "Strukturální změny v krční spojce kinesinu vysvětlují závislost zatížení mechanického cyklu motoru". Journal of Theoretical Biology. 211 (2): 143–57. doi:10.1006 / jtbi.2001.2336. PMID 11419956.
- ^ A b Celis-Garza D, Teimouri H, Kolomeisky AB (2015). "Korelace a symetrie interakcí ovlivňují kolektivní dynamiku molekulárních motorů". Journal of Statistical Mechanics: Theory and Experiment. 2015 (4): P04013. arXiv:1503.00633. Bibcode:2015JSMTE..04..013C. doi:10.1088 / 1742-5468 / 2015/04 / p04013. S2CID 14002728.
- ^ Seitz A, Surrey T (leden 2006). „Procesivní pohyb jednotlivých kinesinů na přeplněných mikrotubulích vizualizovaných pomocí kvantových teček“. Časopis EMBO. 25 (2): 267–77. doi:10.1038 / sj.emboj.7600937. PMC 1383520. PMID 16407972.
- ^ Vilfan A, Frey E, Schwabl F, Thormählen M, Song YH, Mandelkow E (říjen 2001). "Dynamika a kooperativita dekorace mikrotubulů motorickým proteinem kinesin". Journal of Molecular Biology. 312 (5): 1011–26. doi:10.1006 / jmbi.2001.5020. PMID 11580246.
- ^ Goshima G, Vale RD (srpen 2005). "Dynamika závislá na buněčném cyklu a regulace mitotických kinesinů v buňkách Drosophila S2". Molekulární biologie buňky. 16 (8): 3896–907. doi:10,1091 / mbc.E05-02-0118. PMC 1182325. PMID 15958489.
Další čtení
- Lawrence CJ, Dawe RK, Christie KR, Cleveland DW, Dawson SC, Endow SA, Goldstein LS, Goodson HV, Hirokawa N, Howard J, Malmberg RL, McIntosh JR, Miki H, Mitchison TJ, Okada Y, Reddy AS, Saxton WM , Schliwa M, Scholey JM, Vale RD, Walczak CE, Wordeman L (říjen 2004). „Standardizovaná nomenklatura kinesinu“. The Journal of Cell Biology. 167 (1): 19–22. doi:10.1083 / jcb.200408113. PMC 2041940. PMID 15479732.
externí odkazy
- MBInfo - Kinesin přepravuje náklad podél mikrotubulů
- Animovaný model chůze kinesinem
- Seminář Rona Valea: „Molekulární motorické proteiny“
- Animace pohybu kinesinu Knihovna obrázků ASCB
- Murphy, V.F. (2004-05-12). „Pohyb založený na mikrotubulích“. tissue.medicalengineer.co.uk. Archivovány od originál dne 22.07.2007. Citováno 2015-12-10.
- The Inner Life of a Cell, 3D animace představující Kinesin transportující váček
- Domovská stránka Kinesin
- Kinesin v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- ES 3.6.4.4
- ES 3.6.4.5
- Struktury 3D elektronové mikroskopie kinesinu z EM Data Bank (EMDB)

