ATPáza vodíku draselného - Hydrogen potassium ATPase
| ATPáza, výměna H + / K +, alfa polypeptid | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | ATP4A | ||||||
| Gen NCBI | 495 | ||||||
| HGNC | 819 | ||||||
| OMIM | 137216 | ||||||
| RefSeq | NM_000704 | ||||||
| UniProt | P20648 | ||||||
| Další údaje | |||||||
| EC číslo | 7.2.2.19 | ||||||
| Místo | Chr. 19 q13.1 | ||||||
| |||||||
| ATPáza, výměna H + / K +, beta polypeptid | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Symbol | ATP4B | ||||||
| Gen NCBI | 496 | ||||||
| HGNC | 820 | ||||||
| OMIM | 137217 | ||||||
| RefSeq | NM_000705 | ||||||
| UniProt | P51164 | ||||||
| Další údaje | |||||||
| EC číslo | 7.2.2.19 | ||||||
| Místo | Chr. 13 q34 | ||||||
| |||||||
Žaludeční vodíková draselná ATPáza, také známý jako H+/ K.+ ATPáza, je enzym který okyseluje žaludek.[1] Je členem ATPázy typu P., také známý jako E.1-E2 ATPázy kvůli svým dvěma stavům.[2]
Biologická funkce a umístění
Vodík draslíku v žaludku ATPáza nebo H+/ K.+ ATPáza je protonová pumpa z žaludek. Vyměňuje draslík ze střeva lumen s cytoplazmatický hydronium[2] a je enzym primárně zodpovědný za okyselení obsahu žaludku a aktivaci trávicího enzymu pepsin[3] (vidět žaludeční kyselina ).
H+/ K.+ ATPáza se nachází v parietální buňky, které jsou vysoce specializované epiteliální buňky umístěné ve vnitřní buněčné výstelce žaludku nazývané žaludek sliznice. Parietální buňky mají rozsáhlý sekreční membránový systém a H+/ K.+ ATPáza je hlavní proteinovou složkou těchto membrán. Malé množství H+/ K.+ ATPáza se také nachází v ledvinná dřeň.[2]
Geny a struktura bílkovin
H+/ K.+ ATPáza je heterodimerní protein, produkt 2 genů. Gen ATP4A[4] kóduje H+/ K.+ ATPáza α podjednotka, a je ~ 1 000-aminokyselinový protein, který obsahuje katalytická místa enzymu a tvoří póry přes buněčnou membránu, která umožňuje transport iontů. Hydroniové ionty se vážou na dvě aktivní místa přítomná v podjednotce α.[5] Α podjednotka má také fosforylační místo (Asp385).[6] Gen ATP4B[7] kóduje p podjednotku H+/ K.+ ATPáza, což je ~ 300-aminokyselinový protein s N-koncovou cytoplazmatickou doménou s 36 aminokyselinami, jedinou transmembránovou doménou a vysoce glykosylovanou extracelulární doménou.
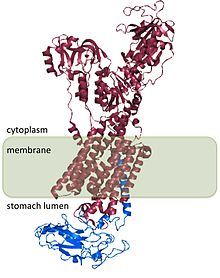
H+/ K.+ ATPáza β podjednotka stabilizuje H+/ K.+ ATPáza α podjednotka a je vyžadována pro funkci enzymu. Podjednotka β zabraňuje zpětnému chodu čerpadla,[8] a také se zdá, že obsahuje signály, které směrují heterodimer na membránové destinace v buňce, i když některé z těchto signálů jsou podřízeny signálům nalezeným v H+/ K.+ ATPáza α podjednotka.
Struktura H+/ K.+ ATPáza byla stanovena pro lidi, psy, prasata, krysy a králíky a je 98% homologní u všech druhů.[2]
Enzymový mechanismus a aktivita
H+/ K.+ ATPáza je P.2-typ ATPase, člen eukaryotické třídy ATPázy typu P..[9] Jako Ca2+ a Na+/ K.+ ATPázy, H.+/ K.+ ATPáza funguje jako α, β protomer.[10] Na rozdíl od jiných eukaryotických ATPáz je H+/ K.+ ATPáza je elektroneutrální a transportuje jeden proton do lumen žaludku na draslík získaný z lumen žaludku.[9] Jako iontové čerpadlo H+/ K.+ ATPáza je schopna transportovat ionty proti koncentračnímu gradientu pomocí energie získané z hydrolýzy ATP. Stejně jako všechny ATPázy typu P se přenáší fosfátová skupina adenosintrifosfát (ATP) do H+/ K.+ ATPáza během transportního cyklu. Tento přenos fosfátů zajišťuje konformační změnu enzymu, který pomáhá řídit transport iontů.
ATPáza vodíku draselného je aktivována nepřímo gastrin to způsobuje ECL buňky uvolnit histamin.[11] Histamin se váže na receptory H2 parietální buňky a aktivuje a cesta závislá na cAMP což způsobí, že se enzym přestěhuje z cytoplazmatických tubulárních membrán do hluboce složených kanálků stimulované parietální buňky.[2] Jakmile je lokalizován, enzym střídá dvě konformace, E1 a E2, aby transportoval ionty přes membránu.

Konformace E1 váže fosfát z ATP a hydroniového iontu na cytoplazmatické straně. Enzym se poté změní na konformaci E2, což umožňuje uvolňování hydronia v lumen. Konformace E2 váže draslík a vrací se do konformace E1 za uvolnění fosfátu a K.+ do cytoplazmy, kde lze hydrolyzovat další ATP, aby se cyklus opakoval.[2] Podjednotka β brání tomu, aby se konformace E2-P vrátila zpět do konformace E1-P, čímž je protonové čerpání jednosměrné.[8] Počet transportovaných iontů na ATP se pohybuje od 2H+/ 2 tis+ až 1H+/ 1 tis+v závislosti na pH žaludku.[12]
Relevance a inhibice nemoci
Inhibice vodíkové draselné pumpy ke snížení kyselosti žaludku byla nejběžnější metodou léčby nemocí včetně gastroezofageální refluxní choroba (GERD / GORD) a peptický vřed nemoc (PUD).[13] Snížení kyselosti zmírňuje příznaky nemoci, ale neléčí skutečnou příčinu GERD (abnormální relaxace jícnového svěrače) nebo PUD (Helicobacter pylori a NSAID ).[14]
K inhibici H byly použity tři třídy léčiv+/ K.+ ATPázy. H2- antagonisté receptoru, jako cimetidin (Tagamet), inhibují signální dráhu, která vede k aktivaci ATPázy. Tento typ inhibitoru je účinný při léčbě vředů, ale nebrání jim v tvorbě a u pacientů se na ně přibližně po jednom týdnu vyvine tolerance, což vede k 50% snížení účinnosti.[15] Inhibitory protonové pumpy (PPI) byly později vyvinuty, počínaje timoprazolem v roce 1975.[15] PPI jsou aktivovány kyselinou proléčiva které inhibují ATPázu vodíku a draslíku kovalentní vazbou na aktivní pumpy.[16] Aktuální PPI se líbí Omeprazol mají krátký poločas přibližně 90 minut.[17] Antagonisté kyselinové pumpy (APA) nebo blokátory kyselin kompetitivní o draslík (PCAB) jsou třetím typem inhibitoru, který blokuje sekreci kyseliny vazbou na K+ Aktivní stránky.[15] APA poskytují rychlejší inhibici než PPI, protože nevyžadují aktivaci kyselinou. Revaprazan byl prvním APA klinicky používaným ve východní Asii a vyvíjejí se další APA, protože se zdá, že poskytují lepší kontrolu kyselin v klinických studiích.[17]
Inaktivace protonové pumpy může také vést ke zdravotním problémům. Studie na myších od Kriega a kol.[18] zjistili, že mutace p-podjednotky pumpy vedla k achlorhydria, což vede k problémům s absorpcí železa, což vede k nedostatku železa a anémie. Užívání PPI nekoreluje se zvýšeným rizikem anémie, takže H+/ K.+ Má se za to, že ATPáza podporuje vstřebávání železa, ale není nutně nutná.[18]
Současná asociace demence a PPI byla dokumentována v Německu a ve výzkumných článcích označujících, jak deriváty benzimidazolu, Astemizol (AST) a Lansoprazol (LNS) interagují s anomálními agregáty proteinu tau (neurofibrilární spleti).[19][20][21] Současné teorie zahrnují neselektivní blokádu sodno-draselných pump v mozku, která způsobuje osmotickou nerovnováhu nebo otoky v buňkách. [stanovisko autora] Interakce PPI s jinými léky ovlivňujícími sodno-draselnou pumpu, např. digoxin, warfarin atd., byla dobře zdokumentována.[22]Paměť byla spojována s astrocyty a alfa3 podjednotka adenosinového receptoru nalezená v pumpách vodík / sodík-draslík může být ústředním bodem demence.[23][24][25]Chronické užívání PPI může způsobit down regulaci alfa3 podjednotky zvyšující poškození astrocytů.[26]Osteopetróza prostřednictvím genu TCIRG1 má silnou souvislost s pre-senilní demencí.[27][28]
Viz také
Reference
- ^ Sakai, Hideki; Fujii, Takuto; Takeguchi, Noriaki (2016). „Kapitola 13. Proton-draselné (H + / K +) ATPázy: vlastnosti a role ve zdraví a nemocech“. V Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel (eds.). Ionty alkalických kovů: jejich role v životě. Kovové ionty v biologických vědách. 16. Springer. 459–483. doi:10.1007/978-4-319-21756-7_13 (neaktivní 2020-10-04).CS1 maint: DOI neaktivní od října 2020 (odkaz)
- ^ A b C d E F G Shin, J. M .; Munson, K .; Vagin, O .; Sachs, G. (2009). "Žaludeční HK-ATPáza: struktura, funkce a inhibice". Archiv Pflügers: European Journal of Physiology. 457 (3): 609–622. doi:10.1007 / s00424-008-0495-4. PMC 3079481. PMID 18536934.
- ^ Berg, J. M .; Tymoczko, J.L .; Stryer, L. (2012). Biochemie (7. vydání). New York: W.H. Freeman a společnost.
- ^ ATP4A ATPáza H + / K + transportující alfa podjednotku
- ^ Chourasia, M .; Sastry, G. M .; Dobře. G. N. (2005). "Protonová vazebná místa a konformační analýza H + K + -ATPázy". Sdělení o biochemickém a biofyzikálním výzkumu. 336 (3): 961–966. doi:10.1016 / j.bbrc.2005.08.205. PMID 16157306.
- ^ Scheirlinckx, F .; Raussens, V .; Ruysschaert, J.-M .; Goormaghtigh, E. (2004). "Konformační změny v žaludeční H + / K + -ATPáze monitorované pomocí diferenční Fourierovy transformace infračervené spektroskopie a výměny vodík / deuterium". Biochemical Journal (Pt 1 ed.). 382 (Pt 1): 121–129. doi:10.1042 / BJ20040277. PMC 1133922. PMID 15096097.
- ^ ATP4B ATPáza H + / K + transportující beta podjednotku
- ^ A b Abe, K .; Tani, K .; Nishizawa, T .; Fujiyoshi, Y. (2009). "Inter-podjednotková interakce žaludeční H+, K.+-ATPase zabraňuje zpětné reakci transportního cyklu ". Časopis EMBO. 28 (11): 1637–1643. doi:10.1038 / emboj.2009.102. PMC 2693145. PMID 19387495.
- ^ A b Shin, J. M .; Sachs, G. (2009). „Ion Motive ATPases: P-type ATPases“. eLS. doi:10.1002 / 9780470015902.a0001379.pub2. ISBN 978-0470016176.
- ^ Dach, I .; Olesen, C .; Signor, L .; Nissen, P .; le Maire, M .; Møller, J. V .; Ebel, C. (2012). „Aktivní detergent solubilizovaný H+, K.+-ATPase je monomer “. The Journal of Biological Chemistry. 287 (50): 41963–41978. doi:10.1074 / jbc.M112.398768. PMC 3516743. PMID 23055529.
- ^ Prinz, C .; Kajimura, M .; Scott, D .; Helander, H .; Shin, J .; Besancon, M .; Bamberg, K .; Hersey, S .; Sachs, G. (1992). "Sekrece kyseliny a H, K ATPáza žaludku". Yale Journal of Biology and Medicine. 65 (6): 577–596. PMC 2589780. PMID 1341065.
- ^ Abe, K .; Tani, K .; Friedrich, T .; Fujiyoshi, Y. (2012). "Kryo-EM struktura žaludeční H +, K + -ATPázy s jediným obsazeným kationovým vazebným místem". Sborník Národní akademie věd Spojených států amerických. 109 (45): 18401–18406. doi:10.1073 / pnas.1212294109. PMC 3494912. PMID 23091039.
- ^ Shin, J. M .; Vagin, O .; Munson, K .; Kidd, M .; Modlin, I. M .; Sachs, G. (2008). "Molekulární mechanismy v terapii chorob souvisejících s kyselinami". Buněčné a molekulární biologické vědy. 65 (2): 264–281. doi:10.1007 / s00018-007-7249-x. PMC 3081136. PMID 17928953.
- ^ Yeomans, N. D. (2011). „The ulcer detuths: The pátrání po příčině peptických vředů“. Journal of Gastroenterology and Hepatology. 26: 35–41. doi:10.1111 / j.1440-1746.2010.06537.x. PMID 21199512. S2CID 42592868.
- ^ A b C Sachs, G .; Shin, J. M .; Vagin, O .; Lambrecht, N .; Yakubov, I .; Munson, K. (2007). „Žaludeční H, K ATPáza jako drogový cíl: minulost, současnost a budoucnost“. Journal of Clinical Gastroenterology. 41 (Suppl 2): S226 – S242. doi:10.1097 / MCG.0b013e31803233b7. PMC 2860960. PMID 17575528.
- ^ Shin J. M .; Sachs G. (2008). "Farmakologie inhibitorů protonové pumpy". Aktuální gastroenterologické zprávy. 10 (6): 528–534. doi:10.1007 / s11894-008-0098-4. PMC 2855237. PMID 19006606.
- ^ A b Shin, J. M .; Sachs, G. (2009). "Dlouhodobé inhibitory žaludeční H, K-ATPázy". Odborný přehled klinické farmakologie. 2 (5): 461–468. doi:10.1586 / ecp.09.33. PMC 2995460. PMID 21132072.
- ^ A b Krieg L .; Milstein O .; Krebs, P .; Xia, Y .; Beutler B .; Du, X. (2011). „Mutace žaludeční vodíkové a draselné podjednotky alfa-ATPasy způsobuje u myší anémii z nedostatku železa“. Krev. 118 (24): 6418–6425. doi:10.1182 / krev-2011-04-350082. PMC 3236123. PMID 21976678.
- ^ Gomm W, von Holt K, Thomé F, Broich K, Maier W, Fink A, Doblhammer G, Haenisch B (2016). „Sdružení inhibitorů protonové pumpy s rizikem demence: analýza údajů o farmakoepidemiologických tvrzeních“. JAMA Neurol. 73 (4): 410–416. doi:10.1001 / jamaneurol.2015.4791. PMID 26882076.
- ^ Rojo LE, Alzate-Morales J, Saavedra IN, Davies P, Maccioni RB (2010). „Selektivní interakce lansoprazolu a astemizolu s tau polymery: potenciální nové klinické využití v diagnostice Alzheimerovy choroby“. J Alzheimers Dis. 19 (2): 573–89. doi:10.3233 / JAD-2010-1262. PMC 2951486. PMID 20110603.
- ^ Fawaz MV, Brooks AF, Rodnick ME, Carpenter GM, Shao X, Desmond TJ, Sherman P, Quesada CA, Hockley BG, Kilbourn MR, Albin RL, Frey KA, Scott PJ (2014). „Vysoce afinitní radiofarmaka založená na lansoprazolu pro zobrazování PET agregovaného tau u Alzheimerovy choroby a progresivní supranukleární obrny: syntéza, preklinické hodnocení a výběr olova“. ACS Chem Neurosci. 5 (8): 718–30. doi:10.1021 / cn500103u. PMC 4140593. PMID 24896980. EPUB 2014 16. června.
- ^ Trifirò G, Corrao S, Alacqua M, Moretti S, Tari M, Caputi AP, Arcoraci V (2006). „Riziko interakce s inhibitory protonové pumpy v obecné praxi: významná neshoda mezi různými informačními zdroji souvisejícími s drogami“. Br J Clin Pharmacol. 62 (5): 582–90. doi:10.1111 / j.1365-2125.2006.02687.x. PMC 1885178. PMID 16822281.
- ^ Björklund O, Shang M, Tonazzini I, Daré E, Fredholm BB (2008). „Adenosinové receptory A1 a A3 chrání astrocyty před hypoxickým poškozením“. Eur J Pharmacol. 596 (1–3): 6–13. doi:10.1016 / j.ejphar.2008.08.002. PMID 18727925. EPUB 2008 13. srpna.
- ^ Carmona MA, Murai KK, Wang L, Roberts AJ, Pasquale EB (2009). „Glial ephrin-A3 reguluje morfologii dendritické páteře hipokampu a transport glutamátu“. Proc Natl Acad Sci U S A. 106 (30): 12524–12529. doi:10.1073 / pnas.0903328106. PMC 2718351. PMID 19592509.
- ^ Ben Haim L, Carrillo-de Sauvage MA, Ceyzériat K, Escartin C (2015). „Nepolapitelná role reaktivních astrocytů u neurodegenerativních onemocnění“. Neurosci přední buňky. 9: 278. doi:10.3389 / fncel.2015.00278. PMC 4522610. PMID 26283915. eCollection 2015
- ^ Gessi S, Merighi S, Stefanelli A, Fazzi D, Varani K, Borea PA (2013). „A (1) a A (3) adenosinové receptory inhibují LPS indukovanou hypoxií indukovatelnou akumulaci faktoru 1 v myších astrocytech“. Pharmacol Res. 76: 157–70. doi:10.1016 / j.phrs.2013.08.002. PMID 23969284. EPUB 2013 19. srpna.
- ^ „TCIRG1“. Genetická domácí reference.
- ^ Kaifu T, Nakahara J, Inui M, Mishima K, Momiyama T, Kaji M, Sugahara A, Koito H, Ujike-Asai A, Nakamura A, Kanazawa K, Tan-Takeuchi K, Iwasaki K, Yokoyama WM, Kudo A, Fujiwara M, Asou H, Takai T (2003). „Osteopetróza a thalamová hypomyelinóza se synaptickou degenerací u myší s deficitem DAP12“. J Clin Invest. 111 (3): 323–32. doi:10,1172 / JCI16923. PMC 151867. PMID 12569157.
externí odkazy
- Yao X, Forte JG (2003). "Buněčná biologie sekrece kyseliny parietální buňkou". Annu. Physiol. 65: 103–31. doi:10.1146 / annurev.physiol.65.072302.114200. PMID 12500969.
- Kühlbrandt W (duben 2004). "Biologie, struktura a mechanismus ATPáz typu P". Nat. Rev. Mol. Cell Biol. 5 (4): 282–95. doi:10.1038 / nrm1354. PMID 15071553. S2CID 24927167.
- Dunbar LA, Caplan MJ (srpen 2001). „Ionové pumpy v polarizovaných buňkách: třídění a regulace Na+, K.+- a H+, K.+-ATPázy “. J. Biol. Chem. 276 (32): 29617–20. doi:10,1074 / jbc.R100023200. PMID 11404365.
- Sachs G, Shin JM, Briving C, Wallmark B, Hersey S (1995). „Farmakologie pumpy žaludeční kyseliny: H+, K.+ ATPáza ". Annu. Pharmacol. Toxicol. 35: 277–305. doi:10.1146 / annurev.pa.35.040195.001425. PMID 7598495.
- Draslík + vodík + ATPáza v americké národní lékařské knihovně Lékařské předměty (Pletivo)
