Doména proteinkinázy - Protein kinase domain
| Doména proteinkinázy | |||||||||
|---|---|---|---|---|---|---|---|---|---|
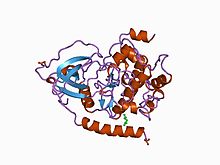 Struktura katalytické podjednotky cAMP-dependentní protein kinázy.[1] | |||||||||
| Identifikátory | |||||||||
| Symbol | Pkinase | ||||||||
| Pfam | PF00069 | ||||||||
| InterPro | IPR000719 | ||||||||
| CHYTRÝ | TyrKc | ||||||||
| STRÁNKA | PDOC00100 | ||||||||
| SCOP2 | 1 apm / Rozsah / SUPFAM | ||||||||
| OPM nadčeleď | 186 | ||||||||
| CDD | cd00180 | ||||||||
| Membranome | 3 | ||||||||
| |||||||||
The doména proteinkinázy je strukturálně konzervovaný proteinová doména obsahující katalytickou funkci proteinové kinázy.[2][3][4] Proteinové kinázy jsou skupinou enzymy které přesouvají fosfátovou skupinu na proteiny v procesu zvaném fosforylace. Funguje to jako vypínač pro mnoho buněčných procesů, včetně metabolismu, transkripce, progrese buněčného cyklu, přeskupení cytoskeletu a buněčného pohybu, apoptózy a diferenciace. Fungují také v embryonálním vývoji, fyziologických reakcích a v nervovém a imunitním systému. Abnormální fosforylace způsobuje mnoho lidských onemocnění, včetně rakoviny, a léky, které ovlivňují fosforylaci, mohou tyto nemoci léčit.[5]
Proteinové kinázy mají katalytickou podjednotku, která přenáší gama fosfát z nukleosid trifosfátů (často ATP ) na jeden nebo více aminokyselinových zbytků v postranním řetězci proteinového substrátu, což vede ke konformační změně ovlivňující funkci proteinu. Tyto enzymy spadají do dvou širokých tříd charakterizovaných s ohledem na specificitu substrátu: specifické pro serin / threonin a specifické pro tyrosin.[6]
Funkce
Protein kináza funkce byla evolučně konzervována z Escherichia coli na Homo sapiens. Proteinové kinázy hrají roli v mnoha buněčných procesech, včetně dělení, proliferace, apoptózy a diferenciace.[7] Fosforylace obvykle vede k funkční změně cílového proteinu změnou aktivity enzymu, buněčného umístění nebo asociace s jinými proteiny.
Struktura
Katalytické podjednotky proteinových kináz jsou vysoce konzervované a bylo vyřešeno několik struktur,[8] což vede k velkým obrazovkám k vývoji kinázově specifických inhibitorů pro léčbu řady nemocí.[9]
Eukaryotické proteinové kinázy[2][3][10][11] jsou enzymy, které patří do velmi rozsáhlé rodiny proteinů, které sdílejí konzervované katalytické jádro společné jak s serin / threoninovými, tak s tyrosinovými proteinovými kinázami. V katalytické doméně proteinových kináz existuje řada konzervovaných oblastí. V N-terminálním konci katalytické domény je úsek zbytků bohatých na glycin v blízkosti zbytku lysinu, u kterého bylo prokázáno, že se účastní ATP vazby. Ve střední části katalytické domény je konzervovaný zbytek kyseliny asparagové, který je důležitý pro katalytickou aktivitu enzymu.[12]
Příklady
Následuje seznam lidských proteinů obsahujících doménu proteinkinázy:[13]
AAK1 ; AATK ; ABL1 ; ABL2 ; ACVR1 ; ACVR1B ; ACVR1C ; ACVR2A ; ACVR2B ; ACVRL1 ; AKT1 ; AKT2 ; AKT3 ; ALK ; AMHR2 ; ANKK1 ; ARAF ; AURKA ; AURKB ; AURKC ; AXL ; BLK ; BMP2K ; BMPR1A ; BMPR1B ; BMPR2 ; BMX ; BRAF ; BRSK1 ; BRSK2 ; BTK ; BUB1 ; BUB1B ; CAMK1 ; CAMK1D ; CAMK1G ; CAMK2A ; CAMK2B ; CAMK2D ; CAMK2G ; CAMK4 ; CAMKK1 ; CAMKK2 ; CAMKV ; SUD ; CDC42BPA ; CDC42BPB ; CDC42BPG ; CDC7 ; CDK1 ; CDK10 ; CDK11A ; CDK11B ; CDK12 ; CDK13 ; CDK14 ; CDK15 ; CDK16 ; CDK17 ; CDK18 ; CDK19 ; CDK2 ; CDK20 ; CDK3 ; CDK4 ; CDK5 ; CDK6 ; CDK7 ; CDK8 ; CDK9 ; CDKL1 ; CDKL2 ; CDKL3 ; CDKL4 ; CDKL5 ; CHEK1 ; CHEK2 ; CHUK ; CIT ; CLK1 ; CLK2 ; CLK3 ; CLK4 ; CSF1R ; CSK ; CSNK1A1 ; CSNK1A1L ; CSNK1D ; CSNK1E ; CSNK1G1 ; CSNK1G2 ; CSNK1G3 ; CSNK2A1 ; CSNK2A2 ; CSNK2A3 ; DAPK1 ; DAPK2 ; DAPK3 ; DCLK1 ; DCLK2 ; DCLK3 ; DDR1 ; DDR2 ; DMPK ; DSTYK ; DYRK1A ; DYRK1B ; DYRK2 ; DYRK3 ; DYRK4 ; EGFR ; EIF2AK1 ; EIF2AK2 ; EIF2AK3 ; EIF2AK4 ; EPHA1 ; EPHA10 ; EPHA2 ; EPHA3 ; EPHA4 ; EPHA5 ; EPHA6 ; EPHA7 ; EPHA8 ; EPHB1 ; EPHB2 ; EPHB3 ; EPHB4 ; EPHB6 ; ERBB2 ; ERBB3 ; ERBB4 ; ERN1 ; ERN2 ; FER ; FES ; FGFR1 ; FGFR2 ; FGFR3 ; FGFR4 ; FGR ; FLT1 ; FLT3 ; FLT4 ; FRK ; FYN ; GAK ; GRK1 ; GRK2 ; GRK3 ; GRK4 ; GRK5 ; GRK6 ; GRK7 ; GSG2 ; GSK3A ; GSK3B ; GUCY2C ; GUCY2D ; GUCY2F ; HCK ; HIPK1 ; HIPK2 ; HIPK3 ; HIPK4 ; HUNK; ICK ; IGF1R ; IKBKB ; IKBKE ; ILK ; INSR ; INSRR ; IRAK1 ; IRAK2 ; IRAK3 ; IRAK4 ; ITK ; JAK1 ; JAK2 ; JAK3 ; KALRN ; KDR ; SADA ; KSR1 ; KSR2 ; LATS1 ; LATS2 ; LCK ; LIMK1 ; LIMK2 ; LMTK2 ; LMTK3 ; LRRK1 ; LRRK2 ; LTK ; LYN ; MAK ; MAP2K1 ; MAP2K2 ; MAP2K3 ; MAP2K4 ; MAP2K5 ; MAP2K6 ; MAP2K7 ; MAP3K1 ; MAP3K10 ; MAP3K11 ; MAP3K12 ; MAP3K13 ; MAP3K14 ; MAP3K15 ; MAP3K19 ; MAP3K2 ; MAP3K20 ; MAP3K21 ; MAP3K3 ; MAP3K4 ; MAP3K5 ; MAP3K6 ; MAP3K7 ; MAP3K8 ; MAP3K9 ; MAP4K1 ; MAP4K2 ; MAP4K3 ; MAP4K4 ; MAP4K5 ; MAPK1 ; MAPK10 ; MAPK11 ; MAPK12 ; MAPK13 ; MAPK14 ; MAPK15 ; MAPK3 ; MAPK4 ; MAPK6 ; MAPK7 ; MAPK8 ; MAPK9 ; MAPKAPK2 ; MAPKAPK3 ; MAPKAPK5 ; ZNAČKA 1 ; ZNAČKA2 ; ZNAČKA 3 ; ZNAČKA4 ; MAST1 ; MAST2 ; MAST3 ; MAST4 ; MASTL ; MATK ; MELK ; MERTK ; SE SETKAL ; MINK1 ; MKNK1 ; MKNK2 ; MLKL ; MOK ; MOS ; MST1R ; PIŽMO ; MYLK ; MYLK2 ; MYLK3 ; MYLK4 ; MYO3A ; MYO3B ; NEK1 ; NEK10 ; NEK11 ; NEK2 ; NEK3 ; NEK4 ; NEK5 ; NEK6 ; NEK7 ; NEK8 ; NEK9 ; NIM1K ; NLK ; NPR1 ; NPR2 ; NRBP1 ; NRBP2 ; NRK ; NTRK1 ; NTRK2 ; NTRK3 ; NUAK1 ; NUAK2 ; OBSCN ; OXSR1 ; PAK1 ; PAK2 ; PAK3 ; PAK4 ; PAK5 ; PAK6 ; PAN3 ; PASK ; PBK ; PDGFRA ; PDGFRB ; PDIK1L ; PDPK1 ; PDPK2P ; PEAK1 ; PEAK3 ; PHKG1 ; PHKG2 ; PIK3R4 ; PIM1 ; PIM2 ; PIM3 ; PINK1 ; PKDCC ; PKMYT1 ; PKN1 ; PKN2 ; PKN3 ; PLK1 ; PLK2 ; PLK3 ; PLK4 ; PLK5 ; PNCK ; POMK ; PRKAA1 ; PRKAA2 ; PRKACA ; PRKACB ; PRKACG ; PRKCA ; PRKCB ; PRKCD ; PRKCE ; PRKCG ; PRKCH ; PRKCI ; PRKCQ ; PRKCZ ; PRKD1 ; PRKD2 ; PRKD3 ; PRKG1 ; PRKG2 ; PRKX ; PRKY ; PRPF4B ; PSKH1 ; PSKH2 ; PTK2 ; PTK2B ; PTK6 ; PTK7 ; PXK ; RAF1 ; RET ; RIOK1 ; RIOK2 ; RIOK3 ; RIPK1 ; RIPK2 ; RIPK3 ; RIPK4 ; RNASEL ; ROCK1 ; ROCK2 ; ROR1 ; ROR2 ; ROS1 ; RPS6KA1 ; RPS6KA2 ; RPS6KA3 ; RPS6KA4 ; RPS6KA5 ; RPS6KA6 ; RPS6KB1 ; RPS6KB2 ; RPS6KC1 ; RPS6KL1 ; RSKR ; RYK ; SBK1 ; SBK2 ; SBK3 ; SCYL1 ; SCYL2 ; SCYL3 ; SGK1 ; SGK2 ; SGK223 ; SGK3 ; SIK1 ; SIK1B ; SIK2 ; SIK3 ; SLK ; SNRK ; SPEG ; SRC ; SRMS ; SRPK1 ; SRPK2 ; SRPK3 ; STK10 ; STK11 ; STK16 ; STK17A ; STK17B ; STK24 ; STK25 ; STK26 ; STK3 ; STK31 ; STK32A ; STK32B ; STK32C ; STK33 ; STK35 ; STK36 ; STK38 ; STK38L ; STK39 ; STK4 ; STK40 ; STKLD1 ; STRADA ; STRADB ; STYK1 ; SYK ; TAOK1 ; TAOK2 ; TAOK3 ; TBCK ; TBK1 ; TEC ; TEK ; TESK1 ; TESK2 ; TEX14 ; TGFBR1 ; TGFBR2 ; TIE1 ; TLK1 ; TLK2 ; TNIK ; TNK1 ; TNK2 ; TNNI3K ; TP53RK ; TRIB1 ; TRIB2 ; TRIB3 ; TRIO ; TSSK1B ; TSSK2 ; TSSK3 ; TSSK4 ; TSSK6 ; TTBK1 ; TTBK2 ; TTK ; TTN ; TXK ; TYK2 ; TYRO3 ; UHMK1 ; ULK1 ; ULK2 ; ULK3 ; ULK4 ; VRK1 ; VRK2 ; VRK3 ; WEE1 ; WEE2 ; WNK1 ; WNK2 ; WNK3 ; WNK4 ; ANO 1 ; ZAP70
Reference
- ^ Knighton DR, Bell SM, Zheng J a kol. (Květen 1993). „2.0 Rafinovaná krystalová struktura katalytické podjednotky cAMP-dependentní proteinkinázy v komplexu s peptidovým inhibitorem a detergentem“. Acta Crystallogr. D. 49 (Pt 3): 357–61. doi:10.1107 / S0907444993000502. PMID 15299526.
- ^ A b Hanks SK, Quinn AM (1991). "Databáze sekvencí katalytických domén proteinových kináz: Identifikace konzervovaných znaků primární struktury a klasifikace členů rodiny". Pervitin Enzymol. Metody v enzymologii. 200: 38–62. doi:10.1016 / 0076-6879 (91) 00126-H. ISBN 978-0-12-182101-2. PMID 1956325.
- ^ A b Hanks SK, Hunter T (květen 1995). "Proteinové kinázy 6. Nadčeleď eukaryotických proteinových kináz: struktura a klasifikace kinázové (katalytické) domény". FASEB J.. 9 (8): 576–96. doi:10.1096 / fasebj.9.8.7768349. PMID 7768349.
- ^ Scheeff ED, Bourne PE (říjen 2005). „Strukturální vývoj nadrodiny podobné proteinkináze“. PLOS Comput. Biol. 1 (5): e49. doi:10.1371 / journal.pcbi.0010049. PMC 1261164. PMID 16244704.
- ^ Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (prosinec 2002). "Protein kinázový doplněk lidského genomu". Věda. 298 (5600): 1912–1934. doi:10.1126 / science.1075762. PMID 12471243. S2CID 26554314.
- ^ Hunter T, Hanks SK, Quinn AM (1988). "Rodina proteinových kináz: konzervované rysy a odvozená fylogeneze katalytických domén". Věda. 241 (4861): 42–51. doi:10.1126 / science.3291115. PMID 3291115.
- ^ Manning G, Plowman GD, Hunter T, Sudarsanam S (říjen 2002). "Vývoj signalizace proteinkinázy z kvasinek na člověka". Trends Biochem. Sci. 27 (10): 514–20. doi:10.1016 / S0968-0004 (02) 02179-5. PMID 12368087.
- ^ Stout TJ, Foster PG, Matthews DJ (2004). „Vysoko výkonná strukturní biologie při objevování léků: proteinové kinázy“. Curr. Pharm. Des. 10 (10): 1069–82. doi:10.2174/1381612043452695. PMID 15078142. Archivovány od originál dne 9. prosince 2012. Citováno 12. května 2020.
- ^ Li B, Liu Y, Uno T, Gray N (srpen 2004). „Vytváření chemické rozmanitosti pro cílení na proteinové kinázy“. Hřeben. Chem. Obrazovka s vysokou propustností. 7 (5): 453–72. doi:10.2174/1386207043328580. PMID 15320712. Archivovány od originál dne 14. dubna 2013.
- ^ Hanks SK (2003). „Genomická analýza nadrodiny eukaryotických proteinových kináz: perspektiva“. Genome Biol. 4 (5): 111. doi:10.1186 / gb-2003-4-5-111. PMC 156577. PMID 12734000.
- ^ Hunter T (1991). "Klasifikace proteinových kináz". Pervitin Enzymol. Metody v enzymologii. 200: 3–37. doi:10.1016 / 0076-6879 (91) 00125-G. ISBN 978-0-12-182101-2. PMID 1835513.
- ^ Knighton DR, Zheng JH, Ten Eyck LF, Ashford VA, Xuong NH, Taylor SS, Sowadski JM (červenec 1991). "Krystalová struktura katalytické podjednotky cyklické adenosinmonofosfát-dependentní protein kinázy". Věda. 253 (5018): 407–14. doi:10.1126 / science.1862342. PMID 1862342.
- ^ "Lidské a myší proteinové kinázy: klasifikace a index". pkinfam.txt. Konsorcium UniProt. Citováno 10. června 2019.
