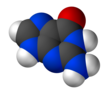
Guanine - Guanine
 | |||
| |||
| Jména | |||
|---|---|---|---|
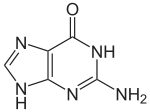
| Název IUPAC 2-amino-9H-purin-6 (1H)-jeden | |||
| Ostatní jména 1,9-dihydro-6H-purin-6-on, 2-amino-6-hydroxypurin, 2-aminohypoxanthin, Guanine | |||
| Identifikátory | |||
3D model (JSmol ) |
| ||
| 147911 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Informační karta ECHA | 100.000.727 | ||
| Číslo ES |
| ||
| 431879 | |||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C5H5N5Ó | |||
| Molární hmotnost | 151,13 g / mol | ||
| Vzhled | Bílá amorfní pevná látka. | ||
| Hustota | 2,200 g / cm3 (vypočteno) | ||
| Bod tání | 360 ° C (680 ° F; 633 K) se rozkládá | ||
| Bod varu | Vznešené | ||
| Nerozpustný. | |||
| Kyselost (strK.A) | 3,3 (amid), 9,2 (sekundární), 12,3 (primární)[1] | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Dráždivý | ||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | Nehořlavé | ||
| Související sloučeniny | |||
Související sloučeniny | Cytosin; Adenin; Tymin; Uracil | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Guanine (/ˈɡwɑːnɪn/; nebo G, Gua) je jedním ze čtyř hlavních nukleové báze nalezen v nukleové kyseliny DNA a RNA, ostatní jsou adenin, cytosin, a tymin (uracil v RNA). v DNA, guanin je spárován s cytosinem. Guanin nukleosid je nazýván guanosin.
Se vzorcem C.5H5N5O, guanin je derivát purin, skládající se z taveného pyrimidin -imidazol kruhový systém s konjugovanými dvojnými vazbami. Toto nenasycené uspořádání znamená bicyklická molekula je rovinný.
Vlastnosti
Guanin je spolu s adeninem a cytosinem přítomen jak v DNA, tak v RNA, zatímco tymin je obvykle vidět pouze v DNA a uracil pouze v RNA. Guanine má dva tautomerní formuláře, hlavní keto forma (viz obrázky) a vzácná forma enol.
Po třech se váže na cytosin Vodíkové vazby. V cytosinu působí aminoskupina jako donor vodíkové vazby a C-2 karbonyl a N-3 amin jako akceptory vodíkové vazby. Guanin má C-6 karbonylovou skupinu, která působí jako akceptor vodíkové vazby, zatímco skupina na N-1 a aminoskupina na C-2 působí jako donory vodíkové vazby.
Guanin může být hydrolyzovaný se silnou kyselinou až glycin, amoniak, oxid uhličitý, a kysličník uhelnatý. Nejprve dostane guanin deaktivován stát se xanthin.[2] Guanin oxiduje snadněji než adenin, další purinová derivátová báze v DNA. Jeho vysoká teplota tání 350 ° C odráží intermolekulární vodíkovou vazbu mezi oxo a aminoskupinami v molekulách v krystalu. Díky této intermolekulární vazbě je guanin relativně nerozpustný ve vodě, ale je rozpustný ve zředěných kyselinách a zásadách.
Dějiny
První izolaci guaninu ohlásil německý chemik v roce 1844 Julius Bodo Unger (1819–1885), který jej získal jako minerál vytvořený z výkalů mořských ptáků, který je známý jako guano a který byl používán jako zdroj hnojiva; guanin byl pojmenován v roce 1846.[3] V letech 1882 až 1906 Fischer určil strukturu a také to ukázal kyselina močová lze převést na guanin.[4]
Syntéza
Stopové množství guaninové formy podle polymerizace z kyanid amonný (NH
4CN). Dva experimenty provedené Levy et al. ukázalo, že zahřívání 10 mol·L−1 NH
4CN při 80 ° C po dobu 24 hodin poskytl výtěžek 0,0007%, při použití 0,1 mol·L−1 NH
4CN zmrazený na -20 ° C po dobu 25 let poskytl 0,0035% výtěžek. Tyto výsledky naznačují, že guanin by mohl vzniknout ve zmrzlých oblastech primitivní Země. V roce 1984 Yuasa ohlásil 0,00017% výtěžek guaninu po elektrickém výboji NH
3, CH
4, C
2H
6a 50 ml vody, následovaná následnou kyselou hydrolýzou. Není však známo, zda přítomnost guaninu nebyla pouze výsledným kontaminantem reakce.[5]
- 10NH3 + 2CH4 + 4 ° C2H6 + 2 hodiny2O → 2C5H8N5O (guanin) + 25H2
A Fischer-Tropsch syntéza může být také použita k vytvoření guaninu spolu s adenin, uracil, a tymin. Zahřívání ekvimolární plynné směsi CO, H2a NH3 na 700 ° C po dobu 15 až 24 minut, následované rychlým ochlazením a následným trvalým ohřevem na 100 až 200 ° C po dobu 16 až 44 hodin s katalyzátorem z oxidu hlinitého, čímž se získá guanin a uracil:
- 10CO + H2 + 10NH3 → 2C5H8N5O (guanin) + 8H2Ó
Další možná abiotická cesta byla prozkoumána zhášením 90% N2–10% CO – H2Vysokoteplotní plazma směsi plynů.[6]
Traubeho syntéza zahrnuje zahřívání 2,4,5-triamino-1,6-dihydro-6-oxypyrimidinu (jako síranu) s kyselina mravenčí několik hodin.
Biosyntéza
Guanin není syntetizován de novo místo toho je rozdělen od složitější molekuly, guanosin enzymem guanosin fosforyláza:
- guanosin + fosfát guanin + alfa-D-ribóza-1-fosfát
Další události a biologické použití
Slovo guanin pochází ze španělského výpůjčního slova guano ("trus ptáků / netopýrů"), který sám pochází z Kečuánština slovo wanu, což znamená „trus“. Jako Oxfordský anglický slovník konstatuje, že guanin je „bílá amorfní látka získaná hojně z guana, která tvoří složku výkalů ptáků“.[7]
V roce 1656 v Paříži vytáhl pan Jaquin z váhy ryb Alburnus alburnus takzvaná „perlová esence“,[8] což je krystalický guanin.[9] V kosmetickém průmyslu se krystalický guanin používá jako přísada do různých produktů (např. Šamponů), kde poskytuje perleť duhové účinek. Používá se také v kovových barvách a simulovaných perlách a plastech. Poskytuje třpytivý lesk očnímu stínu a lak na nehty. Ošetření obličeje pomocí trusu neboli guana od japonských slavíků bylo používáno v Japonsku i jinde, údajně proto, že guanin v trus vytváří jasný, „jasný“ odstín pleti[10] po kterých uživatelé touží. Krystaly guaninu jsou kosočtverečné destičky složené z několika průhledných vrstev, ale mají vysoký index lomu, který částečně odráží a přenáší světlo z vrstvy do vrstvy, čímž vytváří perleťový lesk. Může být aplikován stříkáním, barvením nebo máčením. Může dráždit oči. Jeho alternativy jsou slída, umělá perla (z mletých granátů),[11] a hliník a bronz částice.
Guanin má velmi širokou škálu biologických použití, která zahrnují řadu funkcí, které se liší jak složitostí, tak univerzálností. Mezi ně patří mimo jiné maskování, zobrazování a vidění.[12]
Pavouci, štíři a někteří obojživelníci přeměňují amoniak jako produkt metabolismu bílkovin v buňkách na guanin, protože se může vylučovat s minimální ztrátou vody.[12]
Guanin se také nachází ve specializovaných kožních buňkách nazývaných ryby iridocyty (např jeseter ),[13][12] stejně jako přítomnost v reflexních usazeninách očí hlubinné ryby a nějaký plazi, jako krokodýli.[13]
Dne 8. srpna 2011 byla vydána zpráva založená na NASA studuje s meteority nalezený na Zemi, byl publikován a navrhuje stavební kameny DNA a RNA (guanin, adenin a související organické molekuly ) mohly být vytvořeny mimozemšťany ve vesmíru.[14][15][16]
Viz také
Reference
- ^ Dawson, R.M.C. a kol., Data pro biochemický výzkum, Oxford, Clarendon Press, 1959.
- ^ Angstadt. „Puriny a pyrimidiny“. Citováno 2008-03-27. Citovat deník vyžaduje
| deník =(Pomoc) - ^ Guaninu poprvé izoloval v roce 1844 Julius Bodo Unger (1819–1885), student Prof. Heinrich Gustav Magnus. Vidět:
- Paul O. P. Ts'o, Základní principy v chemii nukleových kyselin, sv. 1 (New York, New York: Academic Press, 1974), strana 7.
- Magnus (1844) „Ueber das Vorkommen von Xanthicoxyd im Guano“ (O výskytu oxidu xanthového v guanu), Annalen der Chemie und Pharmacie, 51 : 395-397.
- B. Unger (1846) „Bemerkungen zu obiger Notiz“ (Komentáře k výše uvedenému oznámení), Annalen der Chemie und Pharmacie, 58 : 18-20. Ze strany 20: „… Desshalb möchte ich den Namen Guanin vorschlagen, welcher an seine Herkunft erinnert. “ (... proto bych chtěl navrhnout jméno guanin, což připomíná jeho původ.)
- B. Unger (1846) „Das Guanin und seine Verbindungen“ (Guanin a jeho sloučeniny), Annalen der Chemie und Pharmacie, 59 : 58-68.
- ^ "Emil Fischer - životopisný".
- ^ Levy, Matthew; Stanley L. Miller; John Oró (srpen 1999). "Výroba guaninu z polymerací NH4CN". Journal of Molecular Evolution. 49 (2): 165–8. Bibcode:1999JMolE..49..165L. doi:10.1007 / PL00006539. PMID 10441668. - cituje papír Yuasa a uvádí možnost kontaminace v reakci.
- ^ Miyakawa, S; Murasawa, K .; Kobayashi, K .; Sawaoka, AB. (Prosinec 2000). "Abiotická syntéza guaninu s vysokoteplotní plazmou". Orig Life Evol Biosph. 30 (6): 557–66. Bibcode:2000OLEB ... 30..557M. doi:10.1023 / A: 1026587607264. PMID 11196576.
- ^ OED. „guanin“ a také „guano“.
- ^ Johann Rudolf von Wagner, Ferdinand Fischer a L. Gautier, Traité de chimie industrielle (Pojednání o průmyslové chemii), 4. vydání, (Paris, France: Masson & Co., 1903), sv. 2, str. 64–65.
- ^ V roce 1861 francouzský chemik Charles-Louis Barreswil (1817–1870) zjistili, že „perlovou esencí“ byl guanin. Viz: Barreswil (1861) „Sur le blanc d'ablette qui sert à la fabrication des perles fausses“ (Na bílé abletě, která se používá při výrobě imitací perel), Comptes rendus, 53 : 246.
- ^ Whitworth, Melissa (2008-10-16). „Gejša obličeje,„ nejnovější tajemství krásy “Victorie Beckhamové, přivedená k masám“. Životní styl. Telegrafovat. Citováno 2008-11-20.
- ^ „Jak se vyrábí perly ... umělé, falešné, imitace, simulace nebo umělé“. Citovat deník vyžaduje
| deník =(Pomoc) - ^ A b C Gur, Dvir; Palmer, Benjamin A .; Weiner, Steve; Addadi, Lia (2017). „Světelná manipulace krystaly guaninu v organismech: biogenní rozptyly, zrcadla, vícevrstvé reflektory a fotonické krystaly“. Pokročilé funkční materiály. 27 (6): 1603514. doi:10.1002 / adfm.201603514.
- ^ A b Fox, D.L. (1979). Biochromie, přirozené zabarvení živých věcí. University of California Press. ISBN 978-0-520-03699-4.
- ^ Callahan; Smith, K.E .; Cleaves, H.J .; Ruzica, J .; Stern, J.C .; Glavin, D.P .; House, C.H .; Dworkin, J.P. (11. srpna 2011). „Uhlíkaté meteority obsahují širokou škálu mimozemských nukleobází“. Proc. Natl. Acad. Sci. USA. PNAS. 108 (34): 13995–8. Bibcode:2011PNAS..10813995C. doi:10.1073 / pnas.1106493108. PMC 3161613. PMID 21836052. Citováno 2011-08-15.
- ^ Steigerwald, John (8. srpna 2011). „Výzkumníci NASA: Stavební bloky DNA lze vyrobit ve vesmíru“. NASA. Citováno 2011-08-10.
- ^ Zaměstnanci ScienceDaily (9. srpna 2011). „Stavební bloky DNA lze vyrobit ve vesmíru, navrhuje NASA Evidence“. ScienceDaily. Citováno 2011-08-09.
externí odkazy
- Guanine MS Spectrum
- Guanine na chemicalland21.com