Karboanhydráza - Carbonic anhydrase - Wikipedia
| Uhličitan dehydratáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
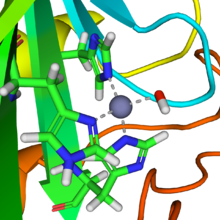
 Pás karet diagram lidské karboanhydrázy II, se zinkovým iontem viditelným ve středu | |||||||||
| Identifikátory | |||||||||
| EC číslo | 4.2.1.1 | ||||||||
| Číslo CAS | 9001-03-0 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Karboanhydráza eukaryotického typu | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | Carb_anhydráza | ||||||||
| Pfam | PF00194 | ||||||||
| InterPro | IPR001148 | ||||||||
| STRÁNKA | PDOC00146 | ||||||||
| SCOP2 | 1může / Rozsah / SUPFAM | ||||||||
| Membranome | 333 | ||||||||
| |||||||||
The karboanhydrázy (nebo uhličitan dehydratázy) tvoří rodinu enzymy že katalyzovat interkonverze mezi oxid uhličitý a voda a oddělit ionty kyselina uhličitá (tj. hydrogenuhličitan a vodíkové ionty ).[1] The Aktivní stránky většiny karboanhydráz obsahuje a zinek ion. Proto jsou klasifikovány jako metaloenzymy. Enzym udržuje acidobazická rovnováha a pomáhá transportovat oxid uhličitý.[2]
Uhlíková anhydráza pomáhá udržovat acidobazická homeostáza, regulovat pH a rovnováha tekutin. V závislosti na jeho poloze se role enzymu mírně mění. Například karboanhydráza produkuje kyselinu ve sliznici žaludku. V ledvinách ovlivňuje kontrola hydrogenuhličitanových iontů obsah vody v buňce. Kontrola iontů hydrogenuhličitanu také ovlivňuje obsah vody v očích. Inhibitory karboanhydrázy se používají k léčbě glaukomu, nadměrného hromadění vody v očích. Blokování tohoto enzymu posune rovnováhu tekutin v očích pacienta, aby se snížilo hromadění tekutin a tím se uvolnil tlak.[2][3]
The Bohrův efekt je způsob, jak popsat hemoglobinovou vazebnou afinitu ke kyslíku. Bohrův efekt popsal Christian Bohr v roce 1904 a odkazuje na posun křivky disociace kyslíku, který je způsoben změnou koncentrace oxidu uhličitého nebo změnou pH. Zvýšení v podstatě oxidu uhličitého vede ke snížení pH krve, což snižuje vazbu kyslíku a hemoglobinu.[4] Opak je pravdou, když pokles koncentrace oxidu uhličitého zvyšuje pH krve, což zvyšuje rychlost vázání kyslíku a hemoglobinu. Vztah Bohrova jevu k karboanhydrázě je jednoduchý: karboanhydráza urychluje reakci oxidu uhličitého reagujícího s vodou za vzniku vodíkových protonů a hydrogenuhličitanových iontů.
K popisu rovnováhy v reakci s karboanhydrázou je použit Le Chatelierův princip. Tkáně jsou kyselější než plíce, protože oxid uhličitý se produkuje buněčným dýcháním a reaguje s vodou v tkáních za vzniku vodíkových protonů. Protože je koncentrace oxidu uhličitého vyšší, rovnováha se posune doprava, na stranu hydrogenuhličitanu. Opak je vidět v plicích, kde se uvolňuje oxid uhličitý, takže jeho koncentrace je nižší, takže rovnováha se posune doleva směrem k oxidu uhličitému, aby se pokusila zvýšit jeho koncentraci.[5]

Pozadí
Enzym je známý jako látka, která působí jako katalyzátor v živých organismech, což pomáhá urychlit chemické reakce.[6] Karboanhydráza je jedním důležitým enzymem, který se nachází v červených krvinkách, žaludeční sliznici, pankreatických buňkách a dokonce i v renálních tubulech. Jedná se o velmi starý enzym, který byl objeven v roce 1932 a byl rozdělen do tří obecných tříd.[7] První třída je alfa-karboanhydráza, která se nachází v savcích, druhá třída je beta-karboanhydráza, která se nachází v bakteriích a rostlinách, a nakonec třetí třída, která je gama-karboanhydráza, která se nachází v methanogenových bakteriích v horkých pramenech.[8] Všechny tři třídy karboanhydrázy mají stejné aktivní místo s kovovým středem Zn, nejsou si však navzájem strukturně podobné. Hlavní úlohou karboanhydrázy u lidí je katalyzovat přeměnu oxidu uhličitého na kyselinu uhličitou a zpět. Může však také pomoci s CO2 transport v krvi, což zase pomáhá dýchání. Může dokonce fungovat při tvorbě kyseliny chlorovodíkové v žaludku.[6] Proto role karboanhydrázy závisí na tom, kde se v těle nachází.
Reakce
Reakce, která ukazuje katalýzu karboanhydrázy v našich tkáních, je: CO2 + H2Ó H2CO3 H+ + HCO3−. Katalyzaci karboanhydrázy v plicích ukazuje: H+ + HCO3− H2CO3 CO2 + H2O. Důvodem, proč jsou reakce v opačném směru pro tkáně a plíce, jsou různé hladiny pH, které se v nich nacházejí. Bez katalyzátoru karboanhydrázy je reakce velmi pomalá, avšak u katalyzátoru je reakce 107 krát rychlejší.
Reakce katalyzovaná karboanhydrázou je:
- HCO3− + H+ CO2 + H2Ó
Kyselina uhličitá má pKA kolem 6,36 (přesná hodnota závisí na médiu), takže při pH 7 je protonováno malé procento hydrogenuhličitanu.
Karboanhydráza je jedním z nejrychlejších enzymů a její rychlost je obvykle omezena difúze míra jeho substráty. Typické katalytické rychlosti různých forem tohoto enzymu se pohybují mezi 104 a 106 reakce za sekundu.[9]
Nekatalyzovaná reverzní reakce je relativně pomalá (kinetika v 15sekundovém rozsahu). To je důvod, proč se sýtený nápoj při otevírání nádoby okamžitě neodplyní; při kontaktu s karboanhydrázou obsaženou ve slinách se však v ústech rychle odplyní.[10]
Anhydráza je definována jako enzym, který katalyzuje odstranění molekuly vody ze sloučeniny, a tak právě tato „obrácená“ reakce dává názvu uhličitanhydrázu, protože odstraňuje molekulu vody z kyseliny uhličité.
V plicích přeměňuje karboanhydráza bikarbonát na oxid uhličitý, který je vhodný k výdechu.
Mechanismus
A zinek protetická skupina v enzymu je koordinován ve třech polohách pomocí histidin postranní řetězy. Čtvrtá koordinační pozice je obsazena voda. Čtvrtý histidin je blízko vodního ligandu, což usnadňuje tvorbu Zn-OH centra, které váže CO2 za vzniku hydrogenuhličitanu zinečnatého.[11] Konstrukt je příkladem obecné kyseliny - obecné zásady katalýza (viz článek "Kyselá katalýza "). Aktivní místo také obsahuje kapsu vhodnou pro oxid uhličitý, čímž se přibližuje ke skupině hydroxidu.
Rodiny

Karboanhydráza byla původně nalezena v červených krvinkách krav.[2]
Rozeznáváno je alespoň pět odlišných rodin CA: α, β, γ, δ a ζ. Tyto rodiny nemají žádné významné aminokyselinová sekvence podobnost a ve většině případů je považována za příklad konvergentní evoluce. Α-CA se vyskytují u lidí.
α-CA
Obratlovci, řasy a nějaký bakterie mít tuto rodinu CA.
Enzymy CA nalezené v savci jsou rozděleny do čtyř širokých podskupin,[12] které se zase skládají z několika izoforem:
- the cytosolický CA (CA-I, CA-II, CA-III, CA-VII a CA XIII) (CA1, CA2, CA3, CA7, CA13 )
- mitochondriální CA (CA-VA a CA-VB) (CA5A, CA5B )
- vylučované CA (CA-VI) (CA6 )
- CA spojené s membránou (CA-IV, CA-IX, CA-XII, CA-XIV a CA-XV) (CA4, CA9, CA12, CA14 )
Existují tři další „acatalytic“ lidské izoformy karboanhydrázy (CA-VIII, CA-X, a CA-XI ) (CA8, CA10, CA11 ), jejichž funkce zůstávají nejasné.[13]

| Isoform | Gen | Molekulová hmotnost[15] | Umístění (buňka) | Místo (tkáň)[15] | Specifická aktivita lidských enzymů (kromě myši CA XV) (s−1)[16] | Citlivost na sulfonamidy (acetazolamid v této tabulce) KJá (nM)[16] |
|---|---|---|---|---|---|---|
| CA-I | CA1 | 29 kDa | cytosol | červená krvinka a GI trakt | 2.0 × 105 | 250 |
| CA-II | CA2 | 29 kDa | cytosol | téměř všudypřítomný | 1.4 × 106 | 12 |
| CA-III | CA3 | 29 kDa | cytosol | 8% rozpustného proteinu v typu I. sval | 1.3 × 104 | 240000 |
| CA-IV | CA4 | 35 kDa | extracelulární GPI - propojené | GI trakt, ledviny endotel | 1.1 × 106 | 74 |
| CA-VA | CA5A | 34,7 kDa (předpokládané) | mitochondrie | játra | 2.9 × 105 | 63 |
| CA-VB | CA5B | 36,4 kDa (předpokládané) | mitochondrie | široce distribuován | 9.5 × 105 | 54 |
| CA-VI | CA6 | 39–42 kDa | sekretářka | sliny a mléko | 3.4 × 105 | 11 |
| CA-VII | CA7 | 29 kDa | cytosol | široce distribuován | 9.5 × 105 | 2.5 |
| CA-IX | CA9 | 54, 58 kDa | buněčná membrána - přidružené | normální GI trakt, několik druhů rakoviny | 1.1 × 106 | 16 |
| CA-XII | CA12 | 44 kDa | extracelulárně umístěn Aktivní stránky | ledviny jisté rakoviny | 4.2 × 105 | 5.7 |
| CA-XIII[17] | CA13 | 29 kDa | cytosol | široce distribuován | 1.5 × 105 | 16 |
| CA-XIV | CA14 | 54 kDa | extracelulárně umístěn Aktivní stránky | ledviny, srdce, kosterní sval, mozek | 3.1 × 105 | 41 |
| CA-XV[18] | CA15 | 34–36 kDa | extracelulární GPI - propojené | ledviny, není exprimován v lidských tkáních | 4.7 × 105 | 72 |
β-CA
Většina prokaryotický a zasadit chloroplast CA patří do rodiny beta. Dva podpisové vzory pro tuto rodinu byly identifikovány:
- C- [SA] -D-S-R- [LIVM] -x- [AP]
- [EQ] - [YF] -A- [LIVM] -x (2) - [LIVM] -x (4) - [LIVMF] (3) -x-G-H-x (2) -C-G
y-CA
Gama třída CA pochází z methanogeny, bakterie produkující metan které rostou v horkých pramenech.
5-CA
Třída delta CA byla popsána v rozsivky. Rozdíl v této třídě CA má v poslední době[19] přijít v úvahu, nicméně.
ζ-CA
Třída zeta certifikačních autorit se vyskytuje výhradně v bakterie za pár chemolithotrophs a námořní sinice které obsahují cso-karboxysomy.[20] Nedávné trojrozměrné analýzy[19] naznačují, že ζ-CA má určitou strukturní podobnost s β-CA, zejména v blízkosti místa iontů kovů. Tyto dvě formy tedy mohou být vzdáleně příbuzné, i když jsou podkladové aminokyselinová sekvence se od té doby značně rozcházely.
η-CA
Rodina eta CA byla nedávno nalezena v organismech rodu Plasmodium. Jedná se o skupinu enzymů, o nichž se dříve myslelo, že patří do alfa skupiny CA, avšak bylo prokázáno, že η-CA mají jedinečné vlastnosti, jako je jejich koordinační vzorec kovových iontů.[21]
ι-CA
Třída iota je nejnovější popsaná třída certifikačních autorit. Bylo objeveno v mořské rozsivce Thalassiosira pseudonana, a je rozšířený mezi mořským fytoplanktonem.[22] V rozsivkách je pro CO zásadní ι-CA2-koncentrační mechanismy a - na rozdíl od jiných tříd CA - to může použít mangan místo zinku jako kovového kofaktoru.[22] Homology ι-CA byly také potvrzeny u gramnegativních bakterií, kde mohou být přítomny jako proteinový homodimer.[23]
Struktura a funkce
V přírodě se vyskytuje několik forem karboanhydrázy. V nejlépe studovaných α-karboanhydráza forma přítomná ve zvířatech, je iont zinku koordinován pomocí imidazol kroužky po 3 histidin zbytky, His94, His96 a His119.[Citace je zapotřebí ]
Primární funkcí enzymu u zvířat je přeměna oxidu uhličitého a hydrogenuhličitanu na udržení acidobazická rovnováha v krvi a dalších tkáních a napomáhat transportu oxidu uhličitého z tkání.
U savců existuje nejméně 14 různých izoforem. Rostliny obsahovat jinou formu zvanou β-karboanhydráza, který je z evolučního hlediska zřetelným enzymem, ale účastní se stejné reakce a ve svém aktivním místě také používá iont zinku. V rostlinách pomáhá karboanhydráza zvyšovat koncentraci CO2 v rámci chloroplast aby se zvýšila rychlost karboxylace enzymu RuBisCO. To je reakce, která integruje CO2 do organický uhlík cukry během fotosyntéza a může používat pouze CO2 forma uhlíku, ne kyselina uhličitá nebo hydrogenuhličitan.[Citace je zapotřebí ]
Uhličitá anhydráza obsahující kadmium
Marine rozsivky Bylo zjištěno, že exprimují novou formu ζ karboanhydrázy. T. weissflogii, druh fytoplankton společné mnoha mořským ekosystémům, bylo zjištěno, že obsahuje karboanhydrázu s a kadmium ionty místo zinku.[24] Dříve se věřilo, že kadmium je toxický kov bez jakékoli biologické funkce. Zdá se však, že tento druh fytoplanktonu se přizpůsobil nízké hladině zinku v oceánu pomocí kadmia, když není dostatek zinku.[25] Koncentrace kadmia v mořské vodě je sice také nízká (asi 1x10−16 molární ), existuje možnost ochrany obou kovů v závislosti na tom, který je v danou chvíli k dispozici. Tento typ karboanhydrázy je proto kambialistický, což znamená, že může vyměňovat kov ve svém aktivním místě s jinými kovy (jmenovitě se zinkem a kadmiem).[26]
Podobnosti s jinými karboanhydrázami
Mechanismus přeměny oxidu uhličitého a vody na hydrogenuhličitan a proton je v podstatě stejný jako u jiných karboanhydrázy (CDCA).[27] Navíc, stejně jako ostatní karboanhydrázy, CDCA zajišťuje, aby reakce probíhala téměř stejně rychle jako rychlost difúze jejích substrátů, a může být inhibována sulfonamid a sulfamát deriváty.[27]
Rozdíly od jiných karboanhydráz
Na rozdíl od většiny ostatních uhličitých anhydráz není kovový aktivní iont vázán třemi zbytky histidinu a hydroxidovým iontem. Místo toho je vázán dvěma cystein zbytky, jeden zbytek histidinu a hydroxidový iont, který je charakteristický pro β-CA.[27][28] Vzhledem k tomu, že kadmium je a měkká kyselina, bude to pevněji svázáno měkká základna ligandy.[26] The síra atomy na cysteinových zbytcích jsou měkké báze, a tak se kadmium váže pevněji, než by to činil dusík na histidinových zbytcích. CDCA má také trojrozměrnou skládací strukturu, která je na rozdíl od jakékoli jiné karboanhydrázy, a jeho aminokyselinová sekvence je odlišná od ostatních karboanhydráz.[27] Je to monomer se třemi doménami, z nichž každá je shodná v aminokyselinové sekvenci a každá obsahuje aktivní místo s kovovým iontem.[28]
Dalším klíčovým rozdílem mezi CDCA a ostatními karboanhydrázami je to, že CDCA má mechanismus pro přepínání iontu kadmia na iont zinku v případě, že se zinek stane dostupnějším pro fytoplankton než kadmium. Aktivní místo CDCA je v podstatě „bráněno“ řetězcem devíti aminokyseliny s glycin zbytky na pozicích 1 a 9. Normálně tato brána zůstává zavřená a ion kadmia je uvězněn uvnitř. Kvůli flexibilitě a poloze glycinových zbytků však lze tuto bránu otevřít, aby se odstranil iont kadmia. Poté lze na místo umístit zinkový iont a brána se za ním zavře.[27] Jako hraniční kyselina, zinek se nebude vážit tak pevně na cysteinové ligandy jako kadmium, ale enzym bude stále aktivní a přiměřeně účinný. Kov v aktivním místě lze přepínat mezi zinkem a kadmiem v závislosti na tom, který je v té době hojnější. Pravděpodobně je to schopnost CDCA využívat kadmium nebo zinek T. weissflogii výhoda přežití.[25]
Přeprava kadmia
Kadmium je stále považováno za smrtelné pro fytoplankton ve vysokých množstvích. Studie to ukázaly T. weissflogii má počáteční toxickou reakci na kadmium, když je mu vystaven. Toxicita kovu je snížena transkripcí a translací fytochelatina, což jsou bílkoviny, které mohou vázat a transportovat kadmium. Jakmile je kadmium vázáno na fytochelatinu, již není toxické a lze jej bezpečně transportovat do enzymu CDCA.[24] Rovněž se ukázalo, že absorpce kadmia fytochelatinou vede k významnému zvýšení exprese CDCA.[24]
Proteiny podobné CDCA
Další fytoplankton z různých vodních zdrojů byl testován na přítomnost CDCA. Bylo zjištěno, že mnoho z nich obsahuje proteiny, které jsou homologní s CDCA nalezeným v T. weissflogii.[24] Patří sem druhy z Great Bay, New Jersey stejně jako v Tichý oceán blízko rovník. U všech testovaných druhů vykazovaly proteiny podobné CDCA vysokou hladinu exprese i při vysokých koncentracích zinku a v nepřítomnosti kadmia.[24] Podobnost mezi těmito proteiny a CDCA vyjádřená T. weissflogii různé, ale vždy byly alespoň na 67% podobné.[24]
Zachycování a sekvestrace uhlíku
Uhlíková anhydráza by se v zásadě mohla ukázat jako relevantní pro zachycování uhlíku. Některé karboanhydrázy vydrží teploty až 107 ° C a extrémní zásaditost (pH> 10).[29] Pilotní provoz se stabilnějším CA na proudu spalin, který sestával z 12–13% molárního složení CO₂, měl během 60 hodin dobu zachycení 63,6% bez výrazných účinků na výkonnost enzymu. CA byla umístěna do roztoku N-methyldiethanolamin (MDEA), kde sloužila ke zvýšení koncentračního rozdílu (hnací síly) CO2 mezi proudem spalin elektrárny a kapalnou fází v stykači kapalina-plyn.[29]
Viz také
Reference
- ^ Badger MR, Price GD (1994). "Úloha karboanhydrázy ve fotosyntéze". Annu. Rev. Plant Physiol. Plant Mol. Biol. 45: 369–392. doi:10.1146 / annurev.pp.45.060194.002101.
- ^ A b C "PDB101: Molekula měsíce: karboanhydráza". RCSB: PDB-101. Citováno 3. prosince 2018.
- ^ Supuran CT (27. května 2004). Karboanhydrázy: Katalytické a inhibiční mechanismy, distribuce a fyziologické role. Taylor & Francis. doi:10.1201/9780203475300-5 (neaktivní 11. listopadu 2020). ISBN 9780203475300.CS1 maint: DOI neaktivní od listopadu 2020 (odkaz)
- ^ "Bohrův efekt". www.pathwaymedicine.org. Citováno 23. listopadu 2019.
- ^ „Le Chatelierův princip“. www.chemguide.co.uk. Citováno 23. listopadu 2019.
- ^ A b "Britannica Dictionary".
- ^ Maren TH (říjen 1967). "Karboanhydráza: chemie, fyziologie a inhibice". Fyziologické recenze. 47 (4): 595–781. doi:10.1152 / fyzrev.1967.47.4.595. PMID 4964060. S2CID 19954840.
- ^ Biologická anorganická chemie. Struktura a reaktivita. část IX.1.3.1. p. 180.
- ^ Lindskog S (1997). "Struktura a mechanismus karboanhydrázy". Farmakologie a terapeutika. 74 (1): 1–20. doi:10.1016 / S0163-7258 (96) 00198-2. PMID 9336012.
- ^ Thatcher BJ, Doherty AE, Orvisky E, Martin BM, Henkin RI (září 1998). „Gustin z lidských slin ve slinách je karboanhydráza VI“. Sdělení o biochemickém a biofyzikálním výzkumu. 250 (3): 635–41. doi:10.1006 / bbrc.1998.9356. PMID 9784398.
- ^ Parkin G (únor 2004). "Syntetické analogy relevantní pro strukturu a funkci enzymů zinku". Chemické recenze. 104 (2): 699–767. doi:10.1021 / cr0206263. PMID 14871139. S2CID 9857226.
- ^ Breton S (červenec 2001). "Buněčná fyziologie karboanhydráz". JOP. 2 (4 doplňky): 159–64. PMID 11875253.
- ^ Lovejoy DA, Hewett-Emmett D, Porter CA, Cepoi D, Sheffield A, Vale WW, Tashian RE (prosinec 1998). „Evolučně konzervativní,„ acatalytický “protein XI související s karboanhydrázou obsahuje sekvenční motiv přítomný v neuropeptidovém sauvaginu: lidský gen CA-RP XI (CA11) je vložen mezi klastr sekrečního genu a gen DBP v 19q13.3“. Genomika. 54 (3): 484–93. doi:10.1006 / geno.1998.5585. PMID 9878252.
- ^ Boriack-Sjodin PA, Zeitlin S, Chen HH, Crenshaw L, Gross S, Dantanarayana A, et al. (Prosinec 1998). "Strukturní analýza vazby inhibitoru na lidskou karboanhydrázu II". Věda o bílkovinách. 7 (12): 2483–9. doi:10.1002 / pro.5560071201. PMC 2143894. PMID 9865942.
- ^ A b Pokud není uvedeno jinak: Boron WF (2005). Lékařská fyziologie: buněčný a molekulární přístup. Elsevier / Saunders. ISBN 978-1-4160-2328-9. Stránka 638
- ^ A b Hilvo M, Baranauskiene L, Salzano AM, Scaloni A, Matulis D, Innocenti A a kol. (Říjen 2008). „Biochemická charakterizace CA IX, jednoho z nejaktivnějších izozymů karboanhydrázy“. The Journal of Biological Chemistry. 283 (41): 27799–809. doi:10,1074 / jbc.M800938200. PMID 18703501.
- ^ Lehtonen J, Shen B, Vihinen M, Casini A, Scozzafava A, Supuran CT a kol. (Leden 2004). „Charakterizace CA XIII, nového člena rodiny izozymů karboanhydrázy“. The Journal of Biological Chemistry. 279 (4): 2719–27. doi:10,1074 / jbc.M308984200. PMID 14600151.
- ^ Hilvo M, Tolvanen M, Clark A, Shen B, Shah GN, Waheed A a kol. (Listopad 2005). „Charakterizace CA XV, nová forma karboanhydrázy zakotvená v GPI“. The Biochemical Journal. 392 (Pt 1): 83–92. doi:10.1042 / BJ20051102. PMC 1317667. PMID 16083424.
- ^ A b Sawaya MR, Cannon GC, Heinhorst S, Tanaka S, Williams EB, Yeates TO, Kerfeld CA (březen 2006). „Struktura beta-karboanhydrázy z karboxysomálního obalu odhaluje odlišnou podtřídu s jedním aktivním místem za cenu dvou“. The Journal of Biological Chemistry. 281 (11): 7546–55. doi:10,1074 / jbc.M510464200. PMID 16407248.
- ^ Takže AK, Espie GS, Williams EB, Shively JM, Heinhorst S, Cannon GC (únor 2004). „Nová evoluční linie karboanhydrázy (třída epsilon) je součástí pláště karboxysomu“. Journal of Bacteriology. 186 (3): 623–30. doi:10.1128 / JB.186.3.623-630.2004. PMC 321498. PMID 14729686.
- ^ Del Prete S, Vullo D, Fisher GM, Andrews KT, Poulsen SA, Capasso C, Supuran CT (září 2014). „Objev nové rodiny karboanhydráz v patogenu malárie Plasmodium falciparum - η-karboanhydrázy“. Dopisy o bioorganické a léčivé chemii. 24 (18): 4389–4396. doi:10.1016 / j.bmcl.2014.08.015. hdl:10072/63103. PMID 25168745.
- ^ A b Jensen EL, Clement R, Kosta A, Maberly SC, Gontero B (srpen 2019). „Nová rozšířená podtřída karboanhydrázy v mořském fytoplanktonu“. Časopis ISME. 13 (8): 2094–2106. doi:10.1038 / s41396-019-0426-8. PMC 6776030. PMID 31024153.
- ^ Del Prete S, Nocentini A, Supuran CT, Capasso C (prosinec 2020). „Burkholderia Territorii“. Journal of Enzyme Inhibition and Medicinal Chemistry. 35 (1): 1060–1068. doi:10.1080/14756366.2020.1755852. PMC 7191908. PMID 32314608.
- ^ A b C d E F Park H, McGinn PJ, More FM (19. května 2008). "Vyjádření kadmiumkarbonátanhydrázy rozsivek v mořské vodě". Vodní mikrobiální ekologie. 51: 183–193. doi:10,3 354 / ame01192.
- ^ A b Lane TW, Saito MA, George GN, Pickering IJ, Prince RC, Morel FM (květen 2005). "Biochemie: enzym kadmia z mořské rozsivky". Příroda. 435 (7038): 42. Bibcode:2005 Natur.435 ... 42L. doi:10.1038 / 435042a. PMID 15875011. S2CID 52819760.
- ^ A b Bertini I, Gray H, Stiefel E, Valentine J (2007). Biologická anorganická chemie: Struktura a reaktivita (První vydání). Sausalito, Kalifornie: University Science Books. ISBN 978-1-891389-43-6.
- ^ A b C d E Sigel A, Sigel H, Sigel RK (2013). Kadmium od toxicity po zásadní. Dordrecht: Springer. ISBN 978-94-007-5179-8.
- ^ A b Xu Y, Feng L, Jeffrey PD, Shi Y, Morel FM (březen 2008). "Struktura a výměna kovů v kadmium-karboanhydrázě mořských rozsivek". Příroda. 452 (7183): 56–61. Bibcode:2008Natur.452 ... 56X. doi:10.1038 / nature06636. PMID 18322527. S2CID 4420280.
- ^ A b Alvizo O, Nguyen LJ, Savile CK, Bresson JA, Lakhapatri SL, Solis EO a kol. (Listopad 2014). „Cílený vývoj ultrastabilní karboanhydrázy pro vysoce efektivní zachycování uhlíku ze spalin“. Sborník Národní akademie věd Spojených států amerických. 111 (46): 16436–41. Bibcode:2014PNAS..11116436A. doi:10.1073 / pnas.1411461111. PMC 4246266. PMID 25368146.
Další čtení
- Lyall V, Alam RI, Phan DQ, Ereso GL, Phan TH, Malik SA a kol. (Září 2001). „Pokles intracelulárního pH buněčného receptoru chuťových receptorů je bezprostředním stimulem transdukce kyselé chuti“. American Journal of Physiology. Fyziologie buněk. 281 (3): C1005-13. doi:10.1152 / ajpcell.2001.281.3.C1005. PMID 11502578.