Kabozantinib - Cabozantinib
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Cabometyx, Cometriq, Cabozanix a další[1] |
| Ostatní jména | XL184, BMS907351 |
| AHFS /Drugs.com | Monografie |
| MedlinePlus | a613015 |
| Licenční údaje |
|
| Těhotenství kategorie | |
| Trasy z správa | Pusou |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Vazba na bílkoviny | ≥99.7% |
| Metabolismus | Játra (CYP3A4 - zprostředkovaný) |
| Odstranění poločas rozpadu | 55 hodin |
| Vylučování | Výkaly (54%), moč (27%) |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.221.147 |
| Chemické a fyzikální údaje | |
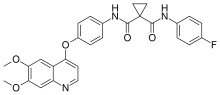
| Vzorec | C28H24FN3Ó5 |
| Molární hmotnost | 501.514 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
Kabozantinib, prodávané pod obchodními názvy Cometriq a Cabometyx mimo jiné je lék používaný k léčbě medulární rakovina štítné žlázy, karcinom ledvin, a hepatocelulární karcinom. Je to malá molekula inhibitor tyrosin kináz c-Met a VEGFR2, a také inhibuje AXL a RET. To bylo objeveno a vyvinuto Exelixis Inc.
V listopadu 2012 byl kabozantinib (Cometriq) ve formě tobolek schválen USA Úřad pro kontrolu potravin a léčiv (FDA) pod názvem Cometriq pro léčbu pacientů s medulární rakovina štítné žlázy.[9][10] Formulář tobolky byl v Evropské unii schválen pro stejný účel v roce 2014.[7]
V dubnu 2016 FDA udělil souhlas s uvedením tabletové formulace (Cabometyx) na trh pro léčbu druhé linie rakovina ledvin[11][12] a totéž bylo schváleno v Evropské unii v září téhož roku.[8]
Značky Cometriq a Cabometyx mají různé složení a nejsou zaměnitelné.[13]
Lékařské použití
Cabozantinib se používá ve dvou formách. Od roku 2012 se k léčbě používá tobolková forma medulární rakovina štítné žlázy[6][4] a tabletová forma se používá od roku 2016 jako léčba druhé linie pro karcinom ledvin.[5][3]
Kontraindikace
Cabozantinib nebyl testován u těhotných žen; způsobuje poškození plodů u hlodavců. Těhotné ženy by neměly užívat tento lék a ženy by neměly otěhotnět během užívání. Není známo, zda se kabozantinib vylučuje do mateřského mléka.[4][3]
Lék by měl být používán s opatrností u lidí s anamnézou problémů se srdečním rytmem, včetně dlouhého QT intervalu.[3]
Nepříznivé účinky
V USA má tobolková formulace (Cometriq) a varování černé skříňky rizika díry tvořící se v žaludku nebo střevech stejně jako formace píštěle (tunely mezi GI traktem a kůží).[6] Černá skříňka také varuje před rizikem nekontrolovaného krvácení.[6] Na tyto účinky upozorňuje také tabletová formulace (Cabometyx).[5][3]
Štítky také varují před rizikem tvorby sraženin a způsobením infarktu nebo mrtvice, včetně vysokého krevního tlaku hypertenzní krize, osteonekróza čelisti, silný průjem, kůže se sesunula z dlaní a chodidel, syndrom s bolestmi hlavy, zmatením, ztrátou zraku a záchvaty a bílkoviny objevující se v moči.[6][5][4][3]
Mezi velmi časté nežádoucí účinky (více než 10% lidí) patří snížená chuť k jídlu; nízká hladina vápníku, draslíku, fosfátu a hořčíku; vysoký bilirubin úrovně; zkreslený vkus, bolest hlavy a závratě; vysoký krevní tlak; zkreslený sluch, bolesti uší a bolest v krku; průjem, nevolnost, zácpa, zvracení, bolest žaludku a podráždění žaludku a zánět úst a rtů a pocit pálení v ústech; kůže odlupující se na dlaních a chodidlech, změny barvy vlasů a vypadávání vlasů, vyrážka, suchá kůže a červená kůže; bolesti kloubů a svalové křeče; únava a slabost; ztráta váhy, zvýšené transaminázy, vyšší hladiny cholesterolu a ztráta červených a bílých krvinek.[3]
Mezi běžné nežádoucí účinky (mezi 1% a 10% lidí) patří abscesy (uvnitř těla, na kůži a na kůži zubů), zápal plic, zanícené vlasové folikuly, plísňové infekce, nízká hladina štítné žlázy, dehydratace, ztráta albumin úzkost, deprese a zmatenost, periferní neuropatie, brnění a třes, tinnitus, fibrilace síní, nízký krevní tlak, zablokované žíly, bledost, zimnice, píštěle tvořící se v průdušnici a jícnu, krevní sraženiny v plicích a krvácení do dýchací cesty, perforace GI, krvácení do žaludku a střev, pankreatitida, hemoroidy, anální trhlina, anální zánět, žlučové kameny, tvrdé výrůstky kůže, akné, puchýře, abnormální růst vlasů, ztráta barvy kůže a odlupování kůže, bolest na hrudi, krev nebo bílkoviny v moči, rány, které se nehojí dobře, a otoky obličeje.[3]
Interakce
Je třeba se vyvarovat grapefruitu a grapefruitového džusu, protože mohou zvýšit koncentraci léčiva v krvi.[3]
Cabozantinib je substrátem CYP3A4 a protein spojený s rezistencí na více léků 2; léky, které inhibují tyto enzymy, zvýší poločas rozpadu cabozantinibu a potenciálně zvýšit jeho nepříznivé účinky; léky, které je aktivují, mohou způsobit, že kabozantinib bude méně účinný.[3]
Inhibuje to P-glykoprotein, tak se změní dostupnost dalších léků, které závisí na tomto transportéru.[3]
Farmakologie
Inhibuje následující receptorové tyrosinkinázy: MET (protein receptoru pro růstový faktor hepatocytů) a VEGFR, RET, receptor GAS6 (AXL), KIT) a tyrosinkináza-3 podobná Fms (FLT3).[3]
Dějiny
Cabozantinib byl udělen lék na vzácná onemocnění stav v USA Úřad pro kontrolu potravin a léčiv (FDA) v listopadu 2010,[14] a v únoru 2017.[15]
Exelixis podal a nová aplikace léku s FDA v první polovině roku 2012,[16] a 29. listopadu 2012 bylo kabozantinibu ve formě tobolek uděleno schválení USA FDA pod názvem Cometriq pro léčbu pacientů s medulární rakovina štítné žlázy.[9][10] Formulář tobolky byl v Evropské unii schválen pro stejný účel v roce 2014.[7]
V březnu 2016 společnost Exelixis získala licenci na Ipsen celosvětová práva (mimo USA, Kanadu a Japonsko) na prodej kabozantinibu.[17]
Výsledky studie fáze III společnosti Exelixis týkající se testování léku na rakovinu ledvin zveřejněné v NEJM v roce 2015.[18] V dubnu 2016 FDA udělil souhlas s uvedením tabletové formulace na trh pro léčbu druhé linie rakovina ledvin[11][12] a totéž bylo schváleno v Evropské unii v září téhož roku.[8]
V prosinci 2017 FDA udělila schválení cabozantinibu (Cabometyx, Exelixis, Inc.) k léčbě lidí s pokročilým karcinomem ledvin (RCC).[13] Schválení bylo založeno na datech z CABOSUN (NCT01835158), randomizované, otevřené multicentrické studie fáze II u 157 účastníků s dříve neléčeným RCC se středním a nízkým rizikem.[13]
V lednu 2019 schválila FDA kabozantinib (Cabometyx, Exelixis, Inc.) pro lidi s hepatocelulárním karcinomem (HCC), kteří byli dříve léčeni sorafenib.[19] Schválení bylo založeno na CELESTIAL (NCT01908426), randomizované (2: 1), dvojitě zaslepené, placebem kontrolované, multicentrické studii u účastníků s HCC, kteří dříve dostávali sorafenib a měli Porucha funkce jater Child Pugh třídy A..
Společnost a kultura
Názvy značek
v Bangladéš pod obchodním názvem Cabozanix.[Citace je zapotřebí ]
Reference
- ^ „Cabozantinib international“. Drugs.com. 2. listopadu 2020. Citováno 11. listopadu 2020.
- ^ A b „Užívání kabozantinibu během těhotenství“. Drugs.com. 30. března 2020. Citováno 23. září 2020.
- ^ A b C d E F G h i j k l „Tableta kabozantinibu (Cabometyx) UK Souhrn údajů o přípravku“. UK Electronic Medicines Compendium. Září 2016.
- ^ A b C d „Tobolka kabozantinibu (Cometriq) UK Souhrn údajů o přípravku (SPC) - (eMC)“. UK Electronic Medicines Compendium. Listopad 2016.
- ^ A b C d „Cabometyx- cabozantinib tableta“. DailyMed. 21. července 2020. Citováno 23. září 2020.
- ^ A b C d E "Cometriq - kabozantinibová souprava Cometriq - kabozantinib kapsle". DailyMed. 11. února 2020. Citováno 23. září 2020.
- ^ A b C „Cometriq EPAR“. Evropská agentura pro léčivé přípravky (EMA). Citováno 23. září 2020.
- ^ A b C "Cabometyx EPAR". Evropská agentura pro léčivé přípravky (EMA). Citováno 23. září 2020.
- ^ A b „FDA schvaluje Cometriq k léčbě vzácného typu rakoviny štítné žlázy“ (Tisková zpráva). NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 29. listopadu 2012. Archivovány od originál 7. července 2014.
- ^ A b „Balíček pro schválení léků: Cometriq (kabozantinib) kapsle NDA # 203756“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). Citováno 23. září 2020. Shrnutí ležel (PDF).
- ^ A b "Cabozantinib (Cabometyx)". NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 25. dubna 2016. Citováno 23. září 2020.
- ^ A b „Cabometyx (cabozantinib) tablety“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 12. ledna 2018. Citováno 23. září 2020.
- ^ A b C „FDA uděluje společnosti Cabometyx pravidelný souhlas s léčbou první linie u“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 19. prosince 2017. Citováno 23. září 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ „Cabozantinib pro označení léčivých přípravků pro vzácná onemocnění a schválení“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 29. listopadu 2010. Citováno 11. listopadu 2020.
- ^ „Hledat označení a schválení léčivých přípravků pro vzácná onemocnění“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 2. března 2017. Citováno 11. listopadu 2020.
- ^ „Lék na rakovinu štítné žlázy kabozantinib prodlužuje PFS“. Archivovány od originál dne 02.04.2012. Citováno 24. října 2011.
- ^ Garde D (1. března 2016). „Ipsen sází až 855 mil. USD na jednou selhávající lék na rakovinu společnosti Exelixis“. FierceBiotech.
- ^ Choueiri TK, Escudier B, Powles T, Mainwaring PN, Rini BI, Donskov F a kol. (Listopad 2015). „Cabozantinib versus everolimus u pokročilého karcinomu z ledvinových buněk“. The New England Journal of Medicine. 373 (19): 1814–23. doi:10.1056 / nejmoa1510016. PMC 5024539. PMID 26406150.
- ^ „FDA schvaluje kabozantinib pro hepatocelulární karcinom“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 14. ledna 2019. Citováno 23. září 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
externí odkazy
- "Cabozantinib". Informační portál o drogách. Americká národní lékařská knihovna.
- "Cabozantinib s-malát". Informační portál o drogách. Americká národní lékařská knihovna.
- "Cabozantinib s-malát". NCI Drug Dictionary. Národní onkologický institut.
- "Cabozantinib (rakovina jater a ledvin)". MedlinePlus.
- Číslo klinického hodnocení NCT01835158 pro „Cabozantinib-s-malát nebo sunitinib malát při léčbě pacientů s dříve neléčeným lokálně pokročilým nebo metastatickým karcinomem ledvin“ na ClinicalTrials.gov
- Číslo klinického hodnocení NCT01908426 pro „Studie kabozantinibu (XL184) vs placebo u subjektů s hepatocelulárním karcinomem, kteří již dříve dostávali sorafenib (CELESTIAL)“ na ClinicalTrials.gov
