Glukóza-6-fosfát izomeráza - Glucose-6-phosphate isomerase
| Glukóza-6-fosfát izomeráza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
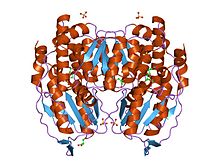
 Dimer glukóza-6-fosfát izomerázy, králík | |||||||||
| Identifikátory | |||||||||
| EC číslo | 5.3.1.9 | ||||||||
| Číslo CAS | 9001-41-6 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| C-koncová oblast bakteriální izomerázy fosfoglukózy | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 krystalová struktura fosfoglukózy / fosfomanózy izomerázy z pyrobaculum aerophilum v komplexu s fruktóza 6-fosfátem | |||||||||
| Identifikátory | |||||||||
| Symbol | bact-PGI_C | ||||||||
| Pfam | PF10432 | ||||||||
| InterPro | IPR019490 | ||||||||
| CDD | cd05016 | ||||||||
| |||||||||
| Fosfoglukóza izomery | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Symbol | CHZO | ||||||||
| Pfam | PF00342 | ||||||||
| SCOP2 | 1pgi / Rozsah / SUPFAM | ||||||||
| CDD | cd05015 | ||||||||
| |||||||||
Glukóza-6-fosfát izomeráza (GPI), alternativně známý jako fosfoglukózaizomeráza / fosfoglukoizomeráza (CHZO) nebo fosfohexóza izomeráza (PHI), je enzym že u lidí je kódován GPI gen na chromozomu 19.[5] Tento gen kóduje člena rodiny proteinů glukózo-fosfát-izomerázového proteinu. Kódovaný protein byl identifikován jako měsíční protein na základě jeho schopnosti vykonávat mechanicky odlišné funkce. V cytoplazma, genový produkt funguje jako glykolytický enzym (glukóza-6-fosfát izomeráza), který se vzájemně mění glukóza-6-fosfát (G6P) a fruktóza-6-fosfát (F6P). Extracelulárně kódovaný protein (označovaný také jako neuroleukin) funguje jako neurotrofický faktor, který podporuje přežití motorických neuronů a senzorických neuronů, a jako lymfokin, který indukuje imunoglobulin vylučování. Kódovaný protein se také označuje jako faktor autokrinní motility (AMF) na základě další funkce jako a nádor - vylučováno cytokin a angiogenní faktor. Vady tohoto genu jsou příčinou nesferocytické hemolytické anémie a závažný nedostatek enzymů může být spojen s hydropsem fetalis, okamžitou smrtí novorozence a neurologickým poškozením. Alternativní sestřih má za následek více variant přepisu. [poskytl RefSeq, leden 2014][6]
Struktura
Funkční GPI je 64-kDa dimer složený ze dvou identických monomerů.[7][8] Oba monomery interagují zejména skrze dva výčnělky v objetí. Aktivní místo každého monomeru je tvořeno rozštěpem mezi dvěma doménami a dimerním rozhraním.[7]
Monomery GPI jsou vyrobeny ze dvou domén, jedné ze dvou samostatných segmentů nazývaných velká doména a druhé ze segmentu mezi nimi, který se nazývá malá doména.[9] Dvě domény jsou sendviče αβα, přičemž malá doména obsahuje pětivláknový β-list obklopený α-šroubovicemi, zatímco velká doména má šestivláknový β-list.[7] Velká doména, která se nachází na N-terminál a C-terminál každého monomeru také obsahují „ramenovité“ výčnělky.[9][10] Několik zbytky v malé doméně slouží k vazbě fosfátu, zatímco jiné zbytky, zejména His388, z velké a C-koncové domény jsou zásadní pro krok otevření cukerného kruhu katalyzovaný tímto enzymem. Protože k izomerační aktivitě dochází na rozhraní dimeru, je dimerní struktura tohoto enzymu kritická pro jeho katalytickou funkci.[10]
Předpokládá se, že serinová fosforylace tohoto proteinu vyvolává konformační změnu jeho sekreční formy.[8]
Mechanismus
Mechanismus, který GPI používá k interkonverzi 6-fosfátu glukózy a 6-fosfátu fruktózy (aldóza na ketózu), se skládá ze tří hlavních kroků: otevření glukózového kruhu, izomerace glukózy na fruktózu prostřednictvím enediolového meziproduktu a uzavření fruktózového kruhu.[11]
Izomerizace glukózy
| D-Glukóza | Fosfoglukóza izomeráza | D-Fruktóza | |
 |  | ||
 | |||
| Fosfoglukóza izomeráza | |||
| α-D-Glukóza 6-fosfát | Fosfoglukóza izomeráza | β-D-Fruktóza 6-fosfát | |
 |  | ||
 | |||
| Fosfoglukóza izomeráza | |||
Sloučenina C00668 na KEGG Databáze cest. Enzym 5.3.1.9 na KEGG Databáze cest. Sloučenina C05345 na KEGG Databáze cest. Reakce R00771 na KEGG Databáze cest.
Glukóza-6-fosfát se váže na GPI ve své pyranózové formě. Kruh je otevřen v „push-pull“ mechanismu pomocí His388, který protonuje kyslík C5, a Lys518, který deprotonuje hydroxylovou skupinu C1. Tím se vytvoří aldóza s otevřeným řetězcem. Poté se substrát otáčí kolem vazby C3-C4, aby se umístil pro izomeraci. V tomto okamžiku Glu357 deprotonuje C2 za vzniku a cis-endiolátový meziprodukt stabilizovaný Arg272. K dokončení izomerizace Glu357 daruje svůj proton C1, hydroxylová skupina C2 ztrácí svůj proton a tvoří se ketóza-fruktóza-6-fosfát s otevřeným řetězcem. Nakonec je kruh uzavřen opětovným otáčením substrátu kolem vazby C3-C4 a deprotonací hydroxyskupiny C5 pomocí Lys518.[12]
Funkce
Tento gen patří do rodiny GPI.[6] Protein kódovaný tímto genem je dimerní enzym, který katalyzuje reverzibilní izomerizaci G6P a F6P.[13][14] Protože reakce je reverzibilní, její směr je určen koncentracemi G6P a F6P.[10]
glukóza-6-fosfát ↔ fruktóza 6-fosfát
Protein má různé funkce uvnitř i vně buňky. V cytoplazma, do kterého je protein zapojen glykolýza a glukoneogeneze, stejně jako pentózo-fosfátová cesta.[10] Mimo buňku funguje jako a neurotrofický faktor pro spinální a senzorické neurony, tzv neuroleukin.[14] Stejný protein je také vylučován rakovina buňky, kde se to nazývá faktor autokrinní motility[15] a stimuluje metastáza.[16] Je také známo, že mimobuněčný GPI funguje jako faktor zrání.[10][14]
Neuroleukin
Ačkoli byla technologie klonování původně považována za samostatné proteiny, prokázala, že GPI je téměř totožný s proteinem neuroleukin.[17] Neuroleukin je a neurotrofický faktor pro spinální a senzorické neurony. Nachází se ve velkém množství ve svalech, mozku, srdci a ledvinách.[18] Neuroleukin také působí jako a lymfokin vylučované T buňkami stimulovanými lektinem. Indukuje sekreci imunoglobulinu v B buňky jako součást odpovědi, která aktivuje buňky vylučující protilátky.[19]
Faktor autokrinní motility
Klonovací experimenty také odhalily, že GPI je identický s proteinem známým jako faktor autokrinní motility (AMF).[20] AMF produkovaný a vylučovaný rakovinnými buňkami a stimuluje buněčný růst a motilitu jako a růstový faktor.[21] Předpokládá se, že AMF hraje klíčovou roli v rakovině metastáza aktivací MAPK /ERK nebo PI3K /AKT cesty.[22][23][24] V dráze PI3K / AKT interaguje AMF s gp78 /AMFR regulovat ER uvolňování vápníku, a proto chrání před apoptóza v reakci na stres ER.[22]
Prokaryotická bifunkční glukóza-6-fosfát izomeráza
V některých archaea a bakterie aktivita glukózo-6-fosfát izomerázy nastává prostřednictvím bifunkční skupiny enzym který také vystavuje fosfomanóza izomeráza (PMI) aktivita. Ačkoli s tím úzce nesouvisí eukaryotický GPI, bifunkční enzym je dostatečně podobný, že sekvence zahrnuje shluk threoniny a seriny který tvoří místo vázající cukerný fosfát v konvenčním GPI. Předpokládá se, že enzym používá totéž katalytické mechanismy pro oba glukóza otevření kruhu a izomerizace pro interkonverzi G6P na F6P.[25]
Klinický význam
Nedostatek GPI je zodpovědný za 4% hemolytické anémie kvůli nedostatkům glykolytických enzymů.[13][14][26][27] V poslední době bylo zjištěno několik případů nedostatku GPI.[28]
Jako prognostik byly použity zvýšené hladiny GPI v séru biomarker pro kolorektální, prsa, plíce, ledviny, gastrointestinální, a další rakoviny.[8][14] Jako AMF se GPI připisuje regulace migrace buněk během invaze a metastáza.[8] Jedna studie ukázala, že vnější vrstvy nádor prsu sféroidy (BTS) vylučují GPI, které indukuje přechod mezi epitelem a mezenchymem (EMT), invaze a metastázy v BTS. Bylo zjištěno, že inhibitory GPI ERI4P a 6PG blokují metastázy BTS, ale ne BTS glykolýzu nebo životaschopnost fibroblastů. Kromě toho je GPI vylučován výhradně nádorovými buňkami a nikoli normálními buňkami. Z těchto důvodů mohou být inhibitory GPI bezpečnějším a cílenějším přístupem k léčbě rakoviny.[29] GPI se také účastní a Pozitivní zpětná vazba smyčka s HER2, hlavní terapeutický cíl pro rakovinu prsu, protože GPI zvyšuje expresi HER2 a nadměrná exprese HER2 zvyšuje expresi GPI atd. Výsledkem je, že aktivita GPI pravděpodobně uděluje rezistenci v buňkách rakoviny prsu proti terapiím založeným na HER2 Herceptin / Trastuzumab a měl by být považován za další cíl při léčbě pacientů.[24]
Viz také
- Fruktóza-1-fosfát-aldoláza enzym, který přeměňuje fruktózu na glukózu
Interakce
GPI je známo komunikovat s:
Interaktivní mapa cest
Kliknutím na geny, proteiny a metabolity níže můžete odkazovat na příslušné články.[§ 1]
- ^ Interaktivní mapu cest lze upravit na WikiPathways: „GlycolysisGluconeogenesis_WP534“.
Reference
- ^ A b C ENSG00000105220 GRCh38: Vydání souboru 89: ENSG00000282019, ENSG00000105220 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000036427 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „UniProtKB: P06744 (G6PI_HUMAN)“.
- ^ A b „Entrez Gene: GPI glukóza fosfát izomeráza“.
- ^ A b C Jeffery CJ, Bahnson BJ, Chien W, Ringe D, Petsko GA (únor 2000). „Krystalová struktura králičí fosfoglukózoisomerázy, glykolytického enzymu, který září jako neuroleukin, autokrinní faktor motility a diferenciační mediátor“. Biochemie. 39 (5): 955–64. doi:10,1021 / bi991604m. PMID 10653639.
- ^ A b C d Haga A, Niinaka Y, Raz A (2000). „Fosfohexóza-izomeráza / faktor autokrinní motility / neuroleukin / faktor zrání je multifunkční fosfoprotein“. Biochim. Biophys. Acta. 1480 (1–2): 235–44. doi:10.1016 / s0167-4838 (00) 00075-3. PMID 11004567.
- ^ A b Sun YJ, Chou CC, Chen WS, Wu RT, Meng M, Hsiao CD (květen 1999). „Krystalová struktura multifunkčního proteinu: fosfoglukózaizomeráza / faktor autokrinní motility / neuroleukin“. Proc Natl Acad Sci U S A. 96 (10): 5412–5417. doi:10.1073 / pnas.96.10.5412. PMC 21873. PMID 10318897.
- ^ A b C d E Cordeiro, AT; Godoi, PH; Silva, CH; Garratt, RC; Oliva, G; Thiemann, OH (21. února 2003). "Krystalová struktura lidské fosfoglukózy isomerázy a analýza počátečních katalytických kroků". Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1645 (2): 117–22. doi:10.1016 / s1570-9639 (02) 00464-8. PMID 12573240.
- ^ Přečtěte si J, Pearce J, Li X, Muirhead H, Chirgwin J, Davies C (červen 2001). „Krystalová struktura lidské fosfoglukózoisomerázy při rozlišení 1,6 A: důsledky pro katalytický mechanismus, aktivitu cytokinů a hemolytickou anémii“. J Mol Biol. 309 (2): 447–63. doi:10.1006 / jmbi.2001.4680. PMID 11371164.
- ^ Graham Solomons JT, Zimmerly EM, Burns S, Krishnamurthy N, Swan MK, Krings S, Muirhead H, Chirgwin J, Davies C (září 2004). „Krystalová struktura myší fosfoglukózoisomerázy v rozlišení 1,6 A a její komplex s 6-fosfátem glukózy odhaluje katalytický mechanismus otevírání cukrového kruhu.“ J Mol Biol. 342 (3): 847–60. doi:10.1016 / j.jmb.2004.07.085. PMID 15342241.
- ^ A b Kugler W, Lakomek M (březen 2000). "Nedostatek glukóza-6-fosfát izomerázy". Osvědčené postupy a výzkum Klinická hematologie. 13 (1): 89–101. doi:10.1053 / beha.1999.0059. PMID 10916680.
- ^ A b C d E Somarowthu, S; Brodkin, HR; D'Aquino, JA; Ringe, D; Ondrechen, MJ; Beuning, PJ (1. listopadu 2011). „Příběh dvou izomeráz: kompaktní versus prodloužená aktivní místa v ketosteroidové izomeráze a fosfoglukózoizomeráze“. Biochemie. 50 (43): 9283–95. doi:10.1021 / bi201089v. PMID 21970785.
- ^ Dobashi Y, Watanabe H, Sato Y a kol. (Prosinec 2006). "Diferenciální exprese a patologický význam exprese faktoru autokrinní motility / glukóza-6-fosfát izomerázy v lidských karcinomech plic". J. Pathol. 210 (4): 431–40. doi:10.1002 / cesta.2069. PMID 17029220. S2CID 39800980.
- ^ Watanabe H, Takehana K, Date M, Shinozaki T, Raz A (1. července 1996). „Faktorem autokrinní motility nádorových buněk je polypeptid neuroleukin / fosfohexóza-izomeráza“. Cancer Res. 56 (13): 2960–3. PMID 8674049.
- ^ Chaput M, Claes V, Portetelle D, Cludts I, Cravador A, Burny A, Gras H, Tartar A (březen 1988). „Neurotrofický faktor neuroleukin je z 90% homologní s fosfohexózo-izomerázou.“ Příroda. 332 (6163): 454–5. doi:10.1038 / 332454a0. PMID 3352744. S2CID 4260489.
- ^ Gurney ME, Heinrich SP, Lee MR, Yin HS (říjen 1986). „Molekulární klonování a exprese neuroleukinu, neurotrofního faktoru pro spinální a senzorické neurony“. Věda. 234 (4776): 566–74. doi:10.1126 / science.3764429. PMID 3764429.
- ^ Gurney ME, Apatoff BR, Spear GT, Baumel MJ, Antel JP, Bania MB, Reder AT (říjen 1986). „Neuroleukin: produkt lymfokinu z lektinem stimulovaných T buněk“. Věda. 234 (4776): 574–81. doi:10.1126 / science.3020690. PMID 3020690.
- ^ Watanabe H, Takehana K, Date M, Shinozaki T, Raz A (červenec 1996). „Faktorem autokrinní motility nádorových buněk je polypeptid neuroleukin / fosfohexóza-izomeráza“. Cancer Res. 56 (13): 2960–3. PMID 8674049.
- ^ Silletti S, Raz A (červenec 1993). „Faktor autokrinní motility je růstový faktor“. Biochem Biophys Res Commun. 194 (1): 454–5. doi:10.1006 / bbrc.1993.1840. PMID 8392842.
- ^ A b C Fu, M; Li, L; Albrecht, T; Johnson, JD; Kojic, LD; Nabi, IR (červen 2011). „Autokrinní faktor motility / fosfoglukózaizomeráza reguluje stres ER a buněčnou smrt prostřednictvím kontroly uvolňování ER vápníku“. Smrt buněk a diferenciace. 18 (6): 1057–70. doi:10.1038 / cdd.2010.181. PMC 3131941. PMID 21252914.
- ^ Liotta LA, Mandler R, Murano G, Katz DA, Gordon RK, Chiang PK, Schiffmann E (květen 1986). "Faktor autokrinní motility nádorových buněk". Proc Natl Acad Sci U S A. 83 (10): 3302–6. doi:10.1073 / pnas.83.10.3302. PMC 323501. PMID 3085086.
- ^ A b C d Kho, DH; Nangia-Makker, P; Balan, V; Hogan, V; Tait, L; Wang, Y; Raz, A (15. února 2013). „Faktor autokrinní motility podporuje štěpení a signalizaci HER2 v buňkách rakoviny prsu“. Výzkum rakoviny. 73 (4): 1411–9. doi:10.1158 / 0008-5472.can-12-2149. PMC 3577983. PMID 23248119.
- ^ Swan MK, Hansen T, Schonheit P, Davies C (září 2004). „Nová fosfoglukózaizomeráza (PGI) / fosfomanóza-izomeráza z crenarchaeon Pyrobaculum aerophilum je členem nadrodiny PGI: strukturální důkazy při rozlišení 1,16-A“. J. Biol. Chem. 279 (38): 39838–45. doi:10,1074 / jbc.M406855200. PMID 15252053.
- ^ Walker JI, Layton DM, Bellingham AJ, Morgan MJ, Faik P (březen 1993). "Abnormality sekvence DNA v deficitu lidské glukózy 6-fosfát izomerázy". Hučení. Mol. Genet. 2 (3): 327–9. doi:10,1093 / hmg / 2,3,327. PMID 8499925.
- ^ Kanno H, Fujii H, Hirono A, Ishida Y, Ohga S, Fukumoto Y, Matsuzawa K, Ogawa S, Miwa S (září 1996). „Molekulární analýza deficitu glukózo-fosfát-izomerázy spojená s dědičnou hemolytickou anémií“. Krev. 88 (6): 2321–5. doi:10.1182 / krev.V88.6.2321.bloodjournal8862321. PMID 8822954.
- ^ „Nedostatek GPI“.
- ^ Gallardo-Pérez, JC; Rivero-Segura, NA; Marín-Hernández, A; Moreno-Sánchez, R; Rodríguez-Enríquez, S (červen 2014). „Inhibice GPI / AMF blokuje vývoj metastatického fenotypu zralých vícebuněčných nádorových sféroidů“. Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 1843 (6): 1043–53. doi:10.1016 / j.bbamcr.2014.01.013. PMID 24440856.
Další čtení
- Walker JI, Faik P, Morgan MJ (1990). "Charakterizace 5 'konce genu pro lidskou glukózo-fosfátovou izomerázu (GPI)". Genomika. 7 (4): 638–43. doi:10.1016 / 0888-7543 (90) 90212-D. PMID 2387591.
- Brownstein BH, Silverman GA, Little RD a kol. (1989). „Izolace lidských genů s jednou kopií z knihovny klonů umělých chromozomů kvasinek“. Věda. 244 (4910): 1348–51. doi:10.1126 / science.2544027. PMID 2544027.
- Mizrachi Y (1989). „Neurotrofická aktivita monomerní glukofosfoizomerázy byla blokována virem lidské imunodeficience (HIV-1) a peptidy z HIV-1 obalového glykoproteinu.“ J. Neurosci. Res. 23 (2): 217–24. doi:10.1002 / jnr.490230212. PMID 2547084. S2CID 42567893.
- Gurney ME, Apatoff BR, Spear GT a kol. (1986). „Neuroleukin: produkt lymfokinu z lektinem stimulovaných T buněk“. Věda. 234 (4776): 574–81. doi:10.1126 / science.3020690. PMID 3020690.
- Faik P, Walker JI, Redmill AA, Morgan MJ (1988). „Myší glukóza-6-fosfát izomeráza a neuroleukin mají identické 3 'sekvence“. Příroda. 332 (6163): 455–7. doi:10.1038 / 332455a0. PMID 3352745. S2CID 4306026.
- Zanella A, Izzo C, Rebulla P a kol. (1981). "První stabilní varianta erytrocytové glukózo-fosfátové izomerázy spojené s těžkou hemolytickou anémií". Dopoledne. J. Hematol. 9 (1): 1–11. doi:10.1002 / ajh.2830090102. PMID 7435496. S2CID 10479146.
- Faik P, Walker JI, Morgan MJ (1994). "Identifikace nové tandemově opakované sekvence přítomné v intronu genu pro fosfátovou izomerázu (GPI) u myší a lidí". Genomika. 21 (1): 122–7. doi:10.1006 / geno.1994.1233. PMID 7545951.
- Xu W, Beutler E (1995). „Charakterizace genových mutací pro nedostatek lidské glukózo-fosfátové izomerázy spojený s chronickou hemolytickou anémií“. J. Clin. Investovat. 94 (6): 2326–9. doi:10,1172 / JCI117597. PMC 330061. PMID 7989588.
- Xu W, Lee P, Beutler E (1996). "Lidská glukóza fosfát izomeráza: mapování exonu a genová struktura". Genomika. 29 (3): 732–9. doi:10.1006 / geno.1995.9944. PMID 8575767.
- Baronciani L, Zanella A, Bianchi P a kol. (1996). „Studie molekulárních defektů u pacientů s deficitem glukózo-fosfátové izomerázy postižených chronickou hemolytickou anémií“. Krev. 88 (6): 2306–10. doi:10.1182 / krev.V88.6.2306.bloodjournal8862306. PMID 8822952.
- Beutler E, West C, Britton HA a kol. (1998). „Mutace deficitu glukózafosfát izomerázy (GPI) spojené s dědičnou nesferocytovou hemolytickou anémií (HNSHA).“ Blood Cells Mol. Dis. 23 (3): 402–9. doi:10,1006 / bcmd.1997.0157. PMID 9446754.
- Kanno H, Fujii H, Miwa S (1998). "Exprese a enzymatická charakterizace variant lidské glukózo-fosfátové izomerázy (GPI) způsobujících nedostatek GPI". Blood Cells Mol. Dis. 24 (1): 54–61. doi:10,1006 / bcmd.1998.0170. PMID 9616041.
- Kugler W, Breme K, Laspe P a kol. (1998). „Molekulární podstata neurologické dysfunkce spojená s hemolytickou anémií při nedostatku lidské glukóza-6-fosfát-izomerázy (GPI)“. Hučení. Genet. 103 (4): 450–4. doi:10,1007 / s004390050849. PMID 9856489. S2CID 8313584.
- Belyaeva OV, Balanovsky OP, Ashworth LK a kol. (1999). "Jemné mapování polymorfního CA opakovacího markeru na lidský chromozom 19 a jeho použití v populačních studiích". Gen. 230 (2): 259–66. doi:10.1016 / S0378-1119 (99) 00056-6. PMID 10216265.
- Yakirevich E, Naot Y (2000). "Klonování glukózo-fosfátizomerázového / neuroleukinového spermatického antigenu zapojeného do aglutinace spermií". Biol. Reprod. 62 (4): 1016–23. doi:10.1095 / biolreprod62.4.1016. PMID 10727272.
- Haga A, Niinaka Y, Raz A (2000). „Fosfohexóza-izomeráza / faktor autokrinní motility / neuroleukin / faktor zrání je multifunkční fosfoprotein“. Biochim. Biophys. Acta. 1480 (1–2): 235–44. doi:10.1016 / s0167-4838 (00) 00075-3. PMID 11004567.
externí odkazy
ATP ADP ATP ADP + + 2 ×  2 ×  2 × 3-fosfoglycerát 2 ×  2 × 2-fosfoglycerát 2 ×  2 × Fosfoenolpyruvát 2 ×  ADP ATP 2 × Pyruvát 2 × |

























