Tivozanib - Tivozanib
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Fotivda |
| Ostatní jména | AV-951 |
| AHFS /Drugs.com | Informace o drogách ve Velké Británii |
| Trasy z správa | Pusou |
| ATC kód | |
| Právní status | |
| Právní status |
|
| Farmakokinetické data | |
| Vazba na bílkoviny | >99% |
| Odstranění poločas rozpadu | 4,5–5,1 dne |
| Vylučování | 79% fekálie, 12% moči |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Chemické a fyzikální údaje | |
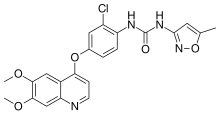
| Vzorec | C22H19ClN4Ó5 |
| Molární hmotnost | 454.87 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
Tivozanib (jméno výrobku Fotivda) je ústní VEGF receptor tyrosinkináza inhibitor. Dokončilo vyšetřování fáze 3 pro léčbu pacientů první linie (dosud neléčených) u pacientů s karcinom ledvin.[1] Výsledky této studie první linie nevedly k USA FDA schválení, ale tivozanib byl schválen Evropská agentura pro léčivé přípravky (EMA) v srpnu 2017.[2]
Kontraindikace
Tivozanib nesmí být kombinován s Třezalka tečkovaná, induktor jaterního enzymu CYP3A4 (viz interakce níže). Nemělo by se užívat během těhotenství tak, jak je teratogenní embryotoxické a fetotoxické u potkanů.[3]
Nepříznivé účinky
Nejčastějšími vedlejšími účinky ve studiích byly hypertenze (vysoký krevní tlak u 48% pacientů), dysfonie (chraplavý hlas, 27%), únava a průjem (oba 26%). A hypertenzní krize se vyskytly u 1% pacientů.[3]
Interakce
Podání jedné dávky tivozanibu s rifampicin, silný induktor enzymu CYP3A4, štěpí biologický poločas a celková expozice (AUC ) tivozanibu na polovinu, ale nemá žádný relevantní vliv na nejvyšší koncentrace v krvi. Kombinace s ketokonazol, silný inhibitor CYP3A4, nemá žádné relevantní účinky. Klinický význam těchto nálezů není znám.[3]
Farmakologie
Mechanismus účinku
A chinolin močovina derivát, tivozanib potlačuje angiogeneze tím, že je selektivně inhibiční proti vaskulární endoteliální růstový faktor.[4] Byl vyvinut společností AVEO Pharmaceuticals.[5] Je navržen tak, aby inhiboval všechny tři receptory VEGF.[6]
Farmakokinetika
Po podání tivozanibu ústy, nejvyšší krevní sérum úrovní je dosaženo po 2 až 24 hodinách. Celková AUC je nezávislá na příjmu potravy. V krevním řečišti je vázáno více než 99% látky plazmatické proteiny, převážně albumin. Ačkoli enzymy CYP3A4 a CYP1A1 a několik UGT jsou schopné metabolizovat léčivo, více než 90% cirkuluje v nezměněné formě. Metabolity jsou demetylace, hydroxylace a N-oxidace výrobky a glukuronidy.[3]
Biologický poločas je 4,5 až 5,1 dne; 79% se vylučuje prostřednictvím fekálie, většinou beze změny a 12% močí, zcela beze změny.[3]
Chemie
Tivozanib se používá ve formě hydrochlorid monohydrát, což je bílý až světle hnědý prášek. Je prakticky nerozpustný ve vodě a má nízkou rozpustnost v vodný kyseliny, ethanol a methanolu. Není hygroskopický a ne opticky aktivní.[7]
Klinické testy
Výsledky fáze III u pokročilého karcinomu ledvinových buněk naznačují 30% nebo 3měsíční medián přežití bez progrese ve srovnání s sorafenib ale vykazovaly nižší celkovou míru přežití experimentální paže než kontrolní paže.[6][8] The Úřad pro kontrolu potravin a léčiv Poradní výbor pro onkologické léky hlasoval v květnu 2013 13 ku 1 proti doporučení schválení tivozanibu pro karcinom ledvinových buněk. Výbor cítil, že lék nevykazoval příznivý poměr rizik a přínosů, a zpochybnil vybavení koncepce studie, která umožňovala pacientům s kontrolní skupinou, kteří užívali sorafenib k přechodu na tivozanib po progresi onemocnění, ale nikoli k pacientům v experimentálním rameni s použitím tivozanibu k přechodu na sorafenib. The aplikace byl formálně zamítnut FDA v červnu 2013 s tím, že schválení bude vyžadovat další klinické studie.[8]
V roce 2016 společnost AVEO Oncology zveřejnila údaje ve spojení se zasedáním ASCO, které ukazují vliv geografického umístění na celkové přežití ve studii fáze III.[9]
V roce 2016 společnost AVEO Oncology oznámila zahájení druhé klinické studie fáze III u pacientů s pokročilou RCC třetí linie.[10]
V roce 2016 EUSA Pharma a AVEO Oncology oznámily, že tivozanib byl předložen k posouzení Evropské agentuře pro léčivé přípravky centralizovaným postupem. [11]
V červnu 2017 vědecký výbor EMA doporučil ke schválení tivozanib v Evropě, přičemž schválení se očekává v září.[12]
V srpnu 2017 Evropská komise (EK) formálně schválila tivozanib v Evropě.[13]
Reference
- ^ Tivozanib je v současné době hodnocen v klíčové studii fáze 3 TIVO-3, randomizované, kontrolované, multicentrické, otevřené studii srovnávající tivozanib se sorafenibem u subjektů s pokročilým refrakterním RCC. Schválení FDA se očekává v roce 2018. Studie tivozanibu (AV-951), perorálního inhibitoru tyrosinkinázy receptoru VEGF, při léčbě karcinomu ledvinových buněk, clintrials.gov
- ^ http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/004131/human_med_002146.jsp&mid=WC0b01ac058001d124.
- ^ A b C d E "Fotivda: EPAR - Informace o produktu" (PDF). Evropská agentura pro léčivé přípravky. 2017-11-22.
- ^ Campas, C., Bolos, J., Castaner, R (2009). "Tivozanib". Drugs Fut. 34 (10): 793. doi:10.1358 / dof.2009.034.10.1417872.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Lék proti rakovině ledvin Aveo vykazuje úspěch; Sdílí nahoru „John Kell, Dow Jones Newswires[mrtvý odkaz ]
- ^ A b „Výsledky fáze III vedly Aveo a Astellas k plánování regulačních podání pro tivozanib“. 3. ledna 2012.
- ^ „Fotivda: EPAR - Veřejná hodnotící zpráva“ (PDF). Evropská agentura pro léčivé přípravky. 2017-11-22.
- ^ A b „FDA odmítá lék na rakovinu ledvin tivozanib“. MedPage Today. 30. června 2013.
- ^ http://meetinglibrary.asco.org/content/165081-176
- ^ „Archivovaná kopie“. Archivovány od originál dne 06.06.2016. Citováno 2016-07-08.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ „Archivovaná kopie“ (PDF). Archivovány od originál (PDF) dne 2016-04-29. Citováno 2016-07-08.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ „AVEO Pharma vzrostla o 48% na doporučení evropského schválení svého léku na rakovinu“. Sledování trhu. 28. června 2017. Citováno 28. června 2017.
- ^ „AVEO Oncology ohlašuje Fotivda (tivozanib) schválený v Evropské unii pro léčbu pokročilého karcinomu ledvinových buněk“ (PDF). AVEO onkologie. 28. srpna 2017. Archivovány od originál (PDF) 21. června 2019. Citováno 9. února 2018.
