Neurodegenerace spojená s pantothenátkinázou - Pantothenate kinase-associated neurodegeneration
| Neurodegenerace spojená s pantothenátkinázou | |
|---|---|
| Ostatní jména | Neurodegenerace s akumulací železa v mozku 1 |
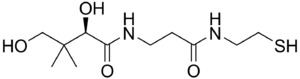 | |
| Pantetheine | |
| Specialita | Neurologie |
| Příznaky | Dystonie, parkinsonismus, demence |
| Obvyklý nástup | Méně než 10 let (klasická), nad 10 let (atypická) |
| Typy | Klasické, atypické |
| Příčiny | PANK2 mutace |
| Frekvence | 1–3 na 1 milion lidí |
Neurodegenerace spojená s pantothenátkinázou (PKAN), dříve nazývaný Hallervorden – Spatzův syndrom[1], je genetický degenerativní onemocnění z mozek to může vést k parkinsonismus, dystonie, demence a nakonec smrt. Neurodegenerace v PKAN je doprovázena nadbytkem žehlička který se postupně hromadí v mozku.
Příznaky a symptomy
Příznaky obvykle začínají v dětství a jsou progresivní, často končí smrtí v rané dospělosti. Příznaky PKAN začínají před středním dětstvím a nejčastěji jsou pozorovány před deseti lety. Mezi příznaky patří:
- dystonie (opakované nekontrolovatelné svalové kontrakce, které mohou způsobit trhání nebo kroucení určitých svalových skupin)
- dysfagie & dysartrie kvůli svalovým skupinám zapojeným do řeči
- tuhost / ztuhlost končetin
- třes
- svíjející se pohyby
- demence
- spasticita
- slabost
- záchvaty (vzácný)
- chůze prstem
- retinitis pigmentosa, další degenerativní onemocnění, které postihuje jednotlivce sítnice, často způsobující změnu barvy sítnice a postupné zhoršování sítnice při prvním vyvolání Noční slepota a později vedlo k úplné ztrátě zraku.
25% jedinců pociťuje neobvyklou formu PKAN, která se vyvíjí po 10 letech a sleduje pomalejší a postupnější tempo zhoršování než u pacientů před 10 lety. Tito jedinci čelí významným deficitům řeči i psychiatrickým poruchám a poruchám chování.
Jako progresivní degenerativní onemocnění nervů vede PKAN k časné nehybnosti a často k úmrtí v raném dospělosti. Smrt nastává předčasně kvůli infekcím, jako je zápal plic, a nemoc sama o sobě technicky neomezuje život.
Genetika
PKAN je autosomální recesivní porucha. Oba rodiče postiženého dítěte musí být heterozygotní nosiče nemoci, a proto musí nést jeden mutant alela. Jelikož se jedná o autozomální poruchu, ty heterozygotní protože porucha nemusí vykazovat žádné atypické vlastnosti, které jsou považovány za sugestivní pro tuto poruchu, byly však hlášeny případy složená heterozygotnost ve kterém se u heterozygotních jedinců vyvine klasická forma onemocnění.[2][3]
Porucha je způsobena mutantem PANK2 gen nacházející se na chromozomální místo: 20p13-p12.3. PANK2 je zodpovědný za kódování proteinu Pantothenát kináza 2. PANK2 kóduje enzym pantothenátkinázu a mutace v genu vedou k vrozené chybě metabolismu vitaminu B5 (pantothenát). Vitamin B5 je nezbytný pro produkci koenzymu A v buňkách. Narušení tohoto enzymu ovlivňuje energetický a lipidový metabolismus a může vést k akumulaci potenciálně škodlivých sloučenin v mozku, včetně železa.
PANK2 kóduje transkript 1,85 kB, který je odvozen ze sedmi exonů pokrývajících celkovou vzdálenost přibližně 3,5 MB genomové DNA. Gen PANK2 také kóduje 50,5 kDaprotein to je funkční pantothenát kináza, základní regulace enzym v koenzym A (CoA) biosyntéza a katalyzování fosforylace pantothenátu (vitamin B5 ), N-pantothenoyl-cystein a pantethein (OMIM).
Mutantní proteiny kódované genem PANK2 jsou často způsobeny nulovou nebo missense mutace nejvíce pozoruhodně 7bp delece v PANK2 gen sekvence kódování.
Tato porucha byla hlášena ve specifických komunitách na základě manželství uvnitř komunity, kde oba rodiče dítěte nesou stejnou mutaci. Jedna z hlášených komunit je Agrawal (Agarwal) Společenství se sídlem zejména v severní části Indie. Známá mutace v komunitě Agarwal je patogenní mutace 1c.215_216insA v genu PANK2. To je také v některých laboratořích kódováno jako chr20: 3870292-3870293insA. Výsledkem je posun snímků a předčasné zkrácení aminokyselin 47 proteinu za kodonem 183 (p.Arg183GlufsTer47; ENST00000316562).[4][5]
Diagnóza
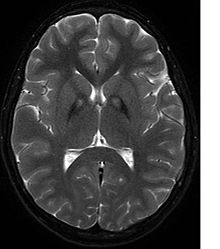
Neurologické vyšetření by prokázalo svalovou rigiditu; slabost; a neobvyklé polohy, pohyby a třes. Pokud jsou postiženi i další členové rodiny, může to pomoci při stanovení diagnózy. Genetické testy mohou potvrdit abnormální gen způsobující onemocnění. Tento test však ještě není široce dostupný. Je třeba vyloučit další pohybové poruchy a nemoci. Jedinci vykazující některý z výše uvedených příznaků jsou často testováni pomocí MRI (Magnetic Resonance Imaging) pro řadu neuro-souvisejících poruch. MRI obvykle ukazuje usazeniny železa v bazální ganglia. Vývoj diagnostických kritérií pokračuje v naději na další oddělení PKAN od jiných forem neurodegenerativních onemocnění představujících NBIA.
Neuropatologie
Mikroskopické vlastnosti PKAN zahrnují vysokou hladinu železa v globus pallidus a pars reticulata z substantia nigra, evidentní jako charakteristické rezavě hnědé zbarvení[6] ve vzoru zvaném znamení tygra[7]; lipofuscin a neuromelanin koncentrované v oblastech akumulujících železo; oválné, neuklizené struktury představující oteklé axony, jejichž cytoplazma bobtná s vakuoly, označované jako sféroidy, Axon Schollennebo neuroaxonální dystrofie; a Lewy těla.[6]
Léčba
Bylo prokázáno, že fosfopantothenát léčí PKAN u člověka a také u myšího modelu onemocnění. Pantethin (předchůdce pantethein ) byl studován a prokázáno, že je účinný u myší a a ovocný let model nemoci.[8][9][10][11]
Prognóza
Míra přežití u pacientů s diagnostikovaným typickým PKAN a neléčených je 11,18 roku se standardní odchylkou 7,8 roku. Byla provedena studie uvádějící dobré výsledky u jednoho pacienta s pozdním nástupem PKAN.[10]
Epidemiologie
Prevalence údaje týkající se této poruchy zůstávají neúplné, odhaduje se však, že touto poruchou bude postiženo kdekoli mezi 1 z 1 000 000 až 3 z 1 000 000 jedinců (na základě pozorovaných případů v populaci), ale opět je to pouze odhad, protože onemocnění tak vzácné, že je obtížné statisticky a přesně zjistit.
Dějiny
PKAN poprvé popsal Hallervorden a Spatz (1922). Jejich objev přinesla diagnóza rodiny 12, ve které pět sester vykazovalo progresivně rostoucí demenci a dysartrii. Pitvy odhalily hnědé zbarvení v různých oblastech mozku (zvláště zajímavé byly oblasti globus pallidus a substantia nigra). Další vyšetřování a popis přinesl Meyer (1958), který diagnostikoval 30 samostatných případů PKAN. Po Meyerovi (1958) následovali Elejalde a kol. (1978), kteří popsali 5 postižených členů rodiny a vyslovili hypotézu, že porucha pocházela z centra Evropa, podložil svou hypotézu klinickou a genetickou analýzou. Další šetření a postřehy poskytli Malmstrom-Groth a Kristensson (1982)[12] a Jankovic a kol. (1985).[13]
Diagnóza PKAN zasáhla milník s dostupností MRI, stejně jako podrobné popisy těchto MRI poskytnuté Littrupem a Gebarskim (1985),[14] Tanfani a kol. (1987),[15] Sethi a kol. (1988),[16] Angelini a kol. (1992),[17] Casteels a kol. (1994),[18] a Malandrini et al. (1995).[19] Gen byl lokalizován do chromozomu 20p Taylorem a kol. (1996) [20] který navrhl, že tato porucha by měla být označována jako neurodegenerace s akumulací železa v mozku (NBIA1), aby se zabránilo nežádoucím eponymům[21] Hallervorden-Spatz. Toto onemocnění bylo Zhou et al. Přejmenováno na „neurodegenerace spojená s pantothenátkinázou“ nebo PKAN. (2001)[2] který navrhl jméno, aby se vyhnul dezinterpretaci a lépe odrážel skutečnou podstatu poruchy. Nejnověji Pellecchia et al. (2005) publikovali zprávu 16 pacientů postižených PKAN, potvrzenou genetickou analýzou.[22]
Reference
- ^ Harper, Peter S (1996). „Pojmenování syndromů a neetických aktivit: případ Hallervordena a Spatze“. Lancet. 348 (9036): 1224–1225. doi:10.1016 / S0140-6736 (96) 05222-1. ISSN 0140-6736.
- ^ A b Zhou B, Westaway SK, Levinson B, Johnson MA, Gitschier J, Hayflick SJ (2001). „Nový gen pantothenátkinázy (PANK2) je defektní u Hallervorden-Spatzova syndromu“. Nat. Genet. 28 (4): 345–9. doi:10.1038 / ng572. PMID 11479594.
- ^ Bei-sha, Tang; et al. (2005). „Nové složené heterozygotní mutace v genu PANK2 u čínského pacienta s atypickou neurodegenerací spojenou s pantothenátkinázou“. Poruchy pohybu. 20 (7): 819–21. doi:10,1002 / mds.20408. PMC 2105744. PMID 15747360.
- ^ „PANK2_Agarwal“.
- ^ http://www.britannica.com/bps/additionalcontent/18/27764296/Founder-mutation-in-the-PANK-gene-of-Agrawal-children-with-Neurodegeneration-with-Brain-Iron-accumulation-NBIA
- ^ A b Hanna, Philip A. „Neurodegenerace spojená s pantothenátkinázou (PKAN)“. Medscape. Citováno 6. března 2020.
- ^ „Neurodegenerace spojená s pantothenátkinázou“. Genetická domácí reference. Národní institut zdraví Národní lékařská knihovna. Citováno 6. března 2020.
- ^ Brunetti D, Dusi S, Giordano C, Lamperti C, Morbin M, Fugnanesi V, Marchet S, Fagiolari G, Sibon O, Moggio M, d'Amati G, Tiranti V (2014). „Léčba pantethinem je účinná při obnově fenotypu nemoci vyvolaného ketogenní dietou v myším modelu neurodegenerace spojené s pantothenátkinázou“. Mozek. 137 (Pt 1): 57–68. doi:10.1093 / mozek / awt325. PMC 3891449. PMID 24316510.
- ^ Rana A, Seinen E, Siudeja K, Muntendam R, Srinivasan B, van der Want JJ, Hayflick S, Reijngoud DJ, Kayser O, Sibon OC (2010). „Pantethin zachraňuje model Drosophila pro neurodegeneraci spojenou s pantothenátkinázou“. Proc Natl Acad Sci U S A. 107 (15): 6988–93. Bibcode:2010PNAS..107.6988R. doi:10.1073 / pnas.0912105107. PMC 2872433. PMID 20351285.
- ^ A b Christou YP, Tanteles GA, Kkolou E, Ormiston A, Konstantopoulos K, Beconi M, Marshall RD, Plotkin H, Kleopa KA (2017). „Open-Label Fosmetpantotenate, a Phosphopantothenate Replacement Therapy in a Single Patient with Atypical PKAN“. Případ Rep Neurol Med. 2017: 3247034. doi:10.1155/2017/3247034. PMC 5439260. PMID 28567317.
- ^ Zano SP, Pate C, Frank M, Rock CO, Jackowski S (2015). „Oprava genetického deficitu pantothenátkinázy 1 pomocí substituční terapie fosfopantothenátem“. Mol Genet Metab. 116 (4): 281–8. doi:10.1016 / j.ymgme.2015.10.011. PMC 4764103. PMID 26549575.
- ^ Malmström-Groth AG, Kristensson K (1982). „Neuroaxonální dystrofie v dětství. Zpráva o dvou sekundárních bratrancích s PKAN a případ Seitelbergerovy choroby“. Acta Paediatrica Scandinavica. 71 (6): 1045–9. doi:10.1111 / j.1651-2227.1982.tb09574.x. PMID 7158329.
- ^ Jankovic J, Kirkpatrick JB, Blomquist KA, Langlais PJ, Bird ED (únor 1985). "Pozdní nástup Hallervorden-Spatzovy choroby projevující se jako familiární parkinsonismus". Neurologie. 35 (2): 227–34. doi:10.1159/000153550. PMID 3969211.
- ^ Jankovic J, Kirkpatrick JB, Blomquist KA, Langlais PJ, Bird ED (1985). "Pozdní nástup Hallervorden-Spatzovy choroby projevující se jako familiární parkinsonismus". Neurologie. 35 (2): 227–34. doi:10.1159/000153550. PMID 3969211.
- ^ Tanfani G, Mascalchi M, Dal Pozzo GC, Taverni N, Saia A, Trevisan C (1987). „MR zobrazování v případě Hallervorden-Spatzovy choroby“. Journal of Computer Assisted Tomography. 11 (6): 1057–8. doi:10.1097/00004728-198711000-00027. PMID 3680689.
- ^ Sethi KD, Adams RJ, Loring DW, el Gammal T (1988). „Hallervorden-Spatzův syndrom: korelace klinické a magnetické rezonance“. Ann. Neurol. 24 (5): 692–4. doi:10,1002 / analog. 410240519. PMID 3202617.
- ^ Angelini L, Nardocci N, Rumi V, Zorzi C, Strada L, Savoiardo M (1992). „Hallervorden-Spatzova choroba: klinická a MRI studie 11 případů diagnostikovaných v životě“. J. Neurol. 239 (8): 417–25. doi:10.1007 / BF00856805. PMID 1447570.
- ^ Casteels I, Spileers W, Swinnen T a kol. (1994). „Optická atrofie jako známka v Hallervorden-Spatzově syndromu“. Neuropediatrie. 25 (5): 265–7. doi:10.1055 / s-2008-1073034. PMID 7885538.
- ^ Malandrini A, Bonuccelli U, Parrotta E, Ceravolo R, Berti G, Guazzi GC (1995). „Myopatická účast ve dvou případech Hallervorden-Spatzovy choroby“. Brain Dev. 17 (4): 286–90. doi:10.1016 / 0387-7604 (95) 00039-E. PMID 7503394.
- ^ Taylor TD, Litt M, Kramer P, Pandolfo M, Angelini L, Nardocci N, Davis S, Pineda M, Hattori H, Flett PJ, Cilio MR, Bertini E, Hayflick SJ (1996). „Homozygotní mapování Hallervorden-Spatzova syndromu na chromozom 20p12.3-p13“. Nat. Genet. 14 (4): 479–81. doi:10.1038 / ng1296-479. PMID 8944032.
- ^ Julius Hallervorden a Hugo Spatz byli členy nacistické strany a v lékařském výzkumu používali popravené politické vězně
- ^ Pellecchia MT, Valente EM, Cif L a kol. (2005). „Rozmanitý fenotyp a genotyp neurodegenerace spojené s pantothenátkinázou“. Neurologie. 64 (10): 1810–2. doi:10.1212 / 01.WNL.0000161843.52641.EC. PMID 15911822.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
