Gama sekretáza - Gamma secretase
| Gama-sekretáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
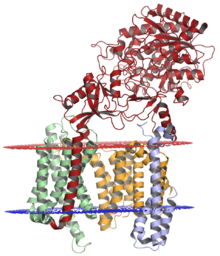 Komplex gama sekretázy s nikarin (Červené), presenilin-1 (oranžový), PEN-2 (modrá) a APH-1 (zelená); lumenální membrána zobrazena červeně a cytoplazmatická membrána zobrazena modře. Strukturu vyřešil kryo-elektronová mikroskopie.[1] | |||||||||
| Identifikátory | |||||||||
| Symbol | Gama-sekretáza | ||||||||
| Pfam | PF05450 | ||||||||
| InterPro | IPR008710 | ||||||||
| OPM nadčeleď | 244 | ||||||||
| OPM protein | 5fn5 | ||||||||
| Membranome | 155 | ||||||||
| |||||||||
Gama sekretáza je více podjednotka proteáza komplex, sám o sobě integrální membránový protein, který štěpí jednoprůchod transmembránové proteiny na zbytcích v transmembránové doméně. Proteázy tohoto typu jsou známé jako intramembránové proteázy. Nejznámějším substrátem gama sekretázy je amyloidový prekurzorový protein, velký integrální membránový protein, který je po štěpení gama a beta sekretáza, produkuje krátký 37-43[je nutné ověření ] aminokyselina peptid volala amyloid beta jehož nenormálně složený fibrilární forma je primární složkou amyloidové plaky nalezené v mozku Alzheimerova choroba pacientů. Gama sekretáza je také kritická při souvisejícím zpracování několika dalších integrálních membránových proteinů typu I, jako je např Zářez,[2] ErbB4,[3] E-kadherin,[4] N-kadherin,[5] ephrin-B2,[6] nebo CD44.[7]
Podjednotky a montáž
Komplex gama sekretázy se skládá ze čtyř jednotlivých proteinů: PSEN1 (presenilin-1),[8] nikarin, APH-1 (přední defekt hltanu 1) a PEN-2 (zesilovač presenilinu 2).[9] Nedávné důkazy naznačují, že pátý protein, známý jako CD147, je nepodstatným regulátorem komplexu, jehož absence zvyšuje aktivitu.[10][11] Presenilin, an aspartylproteáza, je katalytické podjednotka; mutace v genu presenilinu se ukázaly jako hlavní genetický rizikový faktor pro Alzheimerovu chorobu [12] a moduluje aktivitu imunitních buněk.[13] U lidí byly v souboru identifikovány dvě formy presenilinu a dvě formy APH-1 genom; jeden z APH homology lze také vyjádřit ve dvou izoformách pomocí alternativní sestřih, což vede k nejméně šesti různým možným komplexům gama sekretázy, které mohou mít specificitu tkáňového nebo buněčného typu.[14]
Proteiny v komplexu gama sekretázy jsou silně modifikovány proteolýza během montáže a zrání komplexu; požadovaný aktivační krok je v autokatalytickém štěpení presenilinu na N- a C-terminální fragmenty. Primární úlohou Nicastrinu je udržovat stabilitu sestaveného komplexu a regulovat intracelulární přenos bílkovin.[15] PEN-2 se asociuje s komplexem prostřednictvím vazby na transmembránovou doménu presenilinu[16] a kromě jiných možných rolí pomáhá stabilizovat komplex poté, co aktivovaná presolilinová proteolýza N-terminál a C-terminál fragmenty.[17] APH-1, který je vyžadován pro proteolytickou aktivitu, se váže na komplex prostřednictvím a konzervovaný alfa šroubovice interakce motiv a pomáhá při zahájení montáže předčasných komponent.[18]
Nedávný výzkum ukázal, že interakce komplexu gama sekretázy s Protein aktivující y-sekretázu usnadňuje štěpení gama amyloidový prekurzorový protein do p-amyloid.[19]
Mobilní obchodování
Předpokládá se, že komplex gama sekretázy se shromažďuje a zrání prostřednictvím proteolýzy na počátku endoplazmatické retikulum.[20] Komplexy jsou poté transportovány do pozdního ER, kde interagují s a štěpí své substrátové proteiny.[21] Komplexy gama sekretázy byly také pozorovány lokalizované na mitochondrie, kde mohou hrát roli při propagaci apoptóza.[22]
Funkce
Gama sekretáza je vnitřní proteáza, která se štěpí v její membránově se rozkládající doméně Podklad bílkoviny, včetně amyloidový prekurzorový protein (APP) a Zářez. K rozpoznávání substrátu dochází prostřednictvím vazby nikodinové ektodomény na N-konec cíle, která je poté předávána prostřednictvím špatně pochopeného procesu mezi dvěma fragmenty presenilinu k voda -obsahující Aktivní stránky kde katalytické aspartát zbytek se nachází. Aktivní místo musí pro provádění obsahovat vodu hydrolýza v rámci hydrofobní prostředí uvnitř interiéru buněčná membrána, i když to není dobře pochopeno, jak voda a proton dochází k výměně a zatím ne Rentgenová krystalografie struktura gama sekretázy je k dispozici.[23] Nízké rozlišení elektronová mikroskopie Rekonstrukce umožnily vizualizaci předpokládaných vnitřních pórů asi 2 nanometrů.[24] V roce 2014 byla trojrozměrná struktura intaktního lidského komplexu gama-sekretázy stanovena pomocí kryo-elektronová mikroskopie analýza jedné částice při rozlišení 4,5 angstromu[25] a v roce 2015 byla hlášena kryo-EM struktura s atomovým rozlišením (3,4 angstromu).[1]
Komplex gama sekretázy je mezi proteázami neobvyklý v tom, že má „nedbalé“ štěpné místo na C-terminálním místě v amyloid beta generace; gama sekretáza může štěpit APP v kterémkoli z více míst za vzniku peptidu různé délky, nejtypičtěji od 39 do 42 aminokyselin, s Ap40 nejběžnější izoformou a Ap42 nejcitlivější na konformační změny vedoucí k amyloid fibrillogeneze. Některé mutace jak v APP, tak v obou typech lidského presenilinu jsou spojeny se zvýšenou produkcí Ap42 a časným nástupem genetické formy familiární Alzheimerova choroba.[26] Ačkoli starší údaje naznačují, že různé formy komplexu gama sekretázy mohou být odlišně zodpovědné za generování různých izoforem beta amyloidu,[27] současné důkazy naznačují, že C-konec amyloidu beta je produkován řadou štěpení jednoho zbytku stejným komplexem gama sekretázy.[28][29][30] Dřívější štěpná místa produkují peptidy o délce 46 (zeta-štěpení) a 49 (epsilon-štěpení).[29]
Viz také
- DAPT (chemický), inhibitor y-sekretázy
Reference
- ^ A b Bai, Xiao-chen; Yan, Chuangye; Yang, Guanghui; Lu, Peilong; Ma, Dan; Slunce, Linfeng; Zhou, Rui; Scheres, Sjors H. W.; Shi, Yigong (17. srpna 2015). „Atomová struktura lidské γ-sekretázy“. Příroda. 525 (7568): 212–217. doi:10.1038 / příroda14892. PMC 4568306. PMID 26280335.
- ^ De Strooper B, Annaert W, Cupers P, Saftig P, Craessaerts K, Mumm JS, Schroeter EH, Schrijvers V, Wolfe MS, Ray WJ, Goate A, Kopan R (1999). „Proteáza podobná gama-sekretáze závislá na presenilin-1 zprostředkovává uvolňování intracelulární domény Notch“. Příroda. 398 (6727): 518–22. doi:10.1038/19083. PMID 10206645.
- ^ Ni CY, Murphy MP, Golde TE, Carpenter G (2001). „Štěpení gama-sekretázou a nukleární lokalizace receptorové tyrosinkinázy ErbB-4“. Věda. 294 (5549): 2179–81. doi:10.1126 / science.1065412. PMID 11679632.
- ^ Marambaud P, Shioi J, Serban G, Georgakopoulos A, Sarner S, Nagy V, Baki L, Wen P, Efthimiopoulos S, Shao Z, Wisniewski T, Robakis NK (2002). „Štěpení presenilin-1 / gama-sekretáza uvolňuje intracelulární doménu E-kadherinu a reguluje demontáž spojů adherenů“. EMBO J.. 21 (8): 1948–56. doi:10.1093 / emboj / 21.8.1948. PMC 125968. PMID 11953314.
- ^ Marambaud P, Wen PH, Dutt A, Shioi J, Takashima A, Siman R, Robakis NK (2003). „Transkripční represor vázající CBP produkovaný štěpením N-kadherinu PS1 / epsilon je inhibován mutacemi PS1 FAD“. Buňka. 114 (5): 635–45. doi:10.1016 / j.cell.2003.08.008. PMID 13678586.
- ^ Georgakopoulos A, Litterst C, Ghersi E, Baki L, Xu C, Serban G, Robakis NK (2006). „Zpracování ephrinB metaloproteinázou / presenilinem 1 reguluje fosforylaci a signalizaci Src vyvolanou EphB“. EMBO J.. 25 (6): 1242–52. doi:10.1038 / sj.emboj.7601031. PMC 1422162. PMID 16511561.
- ^ Lammich S, Okochi M, Takeda M, Kaether C, Capell A, Zimmer AK, Edbauer D, Walter J, Steiner H, Haass C (2002). „Intramembránová proteolýza CD44 závislá na presenilinu vede k uvolnění jeho intracelulární domény a sekreci peptidu podobného Abeta“. J Biol Chem. 277 (47): 44754–9. doi:10,1074 / jbc.M206872200. PMID 12223485.
- ^ Sobhanifar, S; Schneider, B; Löhr, F; Gottstein, D; Ikeya, T; Mlynarczyk, K; Pulawski, W; Ghoshdastider, U; Kolinski, M; Filipek, S; Güntert, P; Bernhard, F; Dötsch, V (25. května 2010). „Strukturální výzkum C-koncového katalytického fragmentu presenilinu 1“. Sborník Národní akademie věd Spojených států amerických. 107 (21): 9644–9. doi:10.1073 / pnas.1000778107. PMC 2906861. PMID 20445084.
- ^ Kaether C, Haass C, Steiner H (2006). „Sestavení, obchodování a funkce gama-sekretázy“ (PDF). Neurodegener Dis. 3 (4–5): 275–83. doi:10.1159/000095267. PMID 17047368.
- ^ Zhou S, Zhou H, Walian PJ, Jap BK (duben 2006). „Objev a role CD147 jako podjednotky komplexu gama-sekretázy“. Perspektiva drogových zpráv. 19 (3): 133–8. doi:10.1358 / dnp.2006.19.3.985932. PMID 16804564.
- ^ Zhou S, Zhou H, Walian PJ, Jap BK (květen 2005). „CD147 je regulační podjednotka komplexu γ-sekretázy při výrobě amyloidního β-peptidu Alzheimerovy choroby“. Proc. Natl. Acad. Sci. USA. 102 (21): 7499–504. doi:10.1073 / pnas.0502768102. PMC 1103709. PMID 15890777.
- ^ Chen F, Hasegawa H, Schmitt-Ulms G, Kawarai T, Bohm C, Katayama T, Gu Y, Sanjo N, Glista M, Rogaeva E, Wakutani Y, Pardossi-Piquard R, Ruan X, Tandon A, Checler F, Marambaud P, Hansen K, Westaway D, St George-Hyslop P, Fraser P (duben 2006). „TMP21 je složka komplexu presenilinu, která moduluje aktivitu gama-sekretázy, ale nikoli aktivitu epsilon-sekretázy“. Příroda. 440 (7088): 1208–12. doi:10.1038 / nature04667. PMID 16641999.
- ^ Farfara D, Trudler D, Segev-Amzaled N, Galron R, Stein R, Frenkel D (listopad 2010). „složka g sekretázy presenilin je důležitá pro clearance mikroglií b-amyloidů“. Annals of Neurology. 69 (1): 170–80. doi:10.1002 / ana.22191. PMID 21280087.
- ^ Shirotani K, Edbauer D, Prokop S, Haass C, Steiner H (2004). "Identifikace odlišných komplexů gama-sekretázy s různými variantami APH-1". J Biol Chem. 279 (40): 41340–5. doi:10,1074 / jbc.M405768200. PMID 15286082.
- ^ Zhang YW, Luo WJ, Wang H, Lin P, Vetrivel KS, Liao F, Li F, Wong PC, Farquhar MG, Thinakaran G, Xu H (duben 2005). „Nicastrin je kritický pro stabilitu a obchodování, ale nikoli pro asociaci s jinými složkami presenilinu / y-sekretázy“. J. Biol. Chem. 280 (17): 17020–6. doi:10,1074 / jbc.M409467200. PMC 1201533. PMID 15711015.
- ^ Watanabe N, Tomita T, Sato C, Kitamura T, Morohashi Y, Iwatsubo T (prosinec 2005). „Pen-2 je začleněn do komplexu gama-sekretázy vazbou na transmembránovou doménu 4 presenilinu 1“. J. Biol. Chem. 280 (51): 41967–75. doi:10,1074 / jbc.M509066200. PMID 16234244.
- ^ Prokop S, Shirotani K, Edbauer D, Haass C, Steiner H (květen 2004). „Požadavek PEN-2 na stabilizaci heterodimeru presenilinového N- / C-terminálního fragmentu v komplexu gama-sekretázy“. J. Biol. Chem. 279 (22): 23255–61. doi:10,1074 / jbc.M401789200. PMID 15039426.
- ^ Lee SF, Shah S, Yu C, Wigley WC, Li H, Lim M, Pedersen K, Han W, Thomas P, Lundkvist J, Hao YH, Yu G (únor 2004). „Zachovaný motiv GXXXG v APH-1 je zásadní pro sestavení a aktivitu komplexu gama-sekretázy“. J. Biol. Chem. 279 (6): 4144–52. doi:10,1074 / jbc.M309745200. PMID 14627705.
- ^ He G, Luo W, Li P, Remmers C, Netzer WJ, Hendrick J, Bettayeb K, Flajolet M, Gorelick F, Wennogle LP, Greengard P (září 2010). „Protein aktivující gama-sekretázu, terapeutický cíl pro Alzheimerovu chorobu“. Příroda. 467 (2): 95–98. doi:10.1038 / nature09325. PMC 2936959. PMID 20811458. Shrnutí ležel – New York Times.
- ^ Capell A, Beher D, Prokop S, Steiner H, Kaether C, Shearman MS, Haass C (únor 2005). „Sestava komplexu gama-sekretázy v rané sekreční cestě“. J. Biol. Chem. 280 (8): 6471–8. doi:10,1074 / jbc.M409106200. PMID 15591316.
- ^ Kim SH, Yin YI, Li YM, Sisodia SS (listopad 2004). „Důkazy, že k sestavení aktivního komplexu gama-sekretázy dochází v časných kompartmentech sekreční dráhy“. J. Biol. Chem. 279 (47): 48615–9. doi:10.1074 / jbc.C400396200. PMID 15456788.
- ^ Hansson CA, Frykman S, Farmery MR, Tjernberg LO, Nilsberth C, Pursglove SE, Ito A, Winblad B, Cowburn RF, Thyberg J, Ankarcrona M (prosinec 2004). „Nicastrin, presenilin, APH-1 a PEN-2 tvoří aktivní komplexy gama-sekretázy v mitochondriích“. J. Biol. Chem. 279 (49): 51654–60. doi:10,1074 / jbc.M404500200. PMID 15456764.
- ^ Wolfe MS (červenec 2006). "Komplex gama-sekretázy: membránově zabudovaný proteolytický celek". Biochemie. 45 (26): 7931–9. doi:10.1021 / bi060799c. PMID 16800619.
- ^ Lazarov VK, Fraering PC, Ye W, Wolfe MS, Selkoe DJ, Li H (květen 2006). „Elektronová mikroskopická struktura čištěné aktivní y-sekretázy odhaluje vodnou intramembránovou komoru a dva póry“. Proc. Natl. Acad. Sci. USA. 103 (18): 6889–94. doi:10.1073 / pnas.0602321103. PMC 1458989. PMID 16636269.
- ^ Lu P, Bai XC, Ma D, Xie T, Yan C, Sun L, Yang G, Zhao Y, Zhou R, Scheres SH, Shi Y (srpen 2014). „Trojrozměrná struktura lidské γ-sekretázy“. Příroda. 512 (7513): 166–170. doi:10.1038 / příroda13567. PMC 4134323. PMID 25043039.
- ^ Wiley JC, Hudson M, Kanning KC, Schecterson LC, Bothwell M (září 2005). „Mutace familiární Alzheimerovy choroby inhibují uvolňování beta-amyloidového prekurzorového proteinu karboxy-terminálního fragmentu zprostředkované gama-sekretázou“. J. Neurochem. 94 (5): 1189–201. doi:10.1111 / j.1471-4159.2005.03266.x. PMID 15992373.
- ^ Jankowsky JL, Fadale DJ, Anderson J, Xu GM, Gonzales V, Jenkins NA, Copeland NG, Lee MK, Younkin LH, Wagner SL, Younkin SG, Borchelt DR (leden 2004). „Mutantní preseniliny specificky zvyšují hladiny 42 zbytkového beta-amyloidního peptidu in vivo: důkazy pro zvýšení 42-specifické gama sekretázy“. Hučení. Mol. Genet. 13 (2): 159–70. doi:10,1093 / hmg / ddh019. PMID 14645205.
- ^ Zhao G, Tan J, Mao G, Cui MZ, Xu X (březen 2007). "Stejná gama-sekretáza odpovídá za více intramembránových štěpení APP". J. Neurochem. 100 (5): 1234–46. doi:10.1111 / j.1471-4159.2006.04302.x. PMID 17241131.
- ^ A b Zhang, H; Ma, Q; Zhang, YW; Xu, H (leden 2012). „Proteolytické zpracování Alzheimerova β-amyloidového prekurzorového proteinu“. Journal of Neurochemistry. 120 Suppl 1: 9–21. doi:10.1111 / j.1471-4159.2011.07519.x. PMC 3254787. PMID 22122372.
- ^ Haass, C; Kaether, C; Thinakaran, G; Sisodia, S (květen 2012). „Obchodování a proteolytické zpracování APP“. Perspektivy Cold Spring Harbor v medicíně. 2 (5): a006270. doi:10.1101 / cshperspect.a006270. PMC 3331683. PMID 22553493.
