Amyloid beta - Amyloid beta
| Amyloid beta peptid (beta-APP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
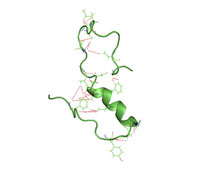 Částečně složená struktura amyloidu beta (1 40) ve vodném prostředí (pdb 2 lfm)[1] | |||||||||
| Identifikátory | |||||||||
| Symbol | APLIKACE | ||||||||
| Pfam | PF03494 | ||||||||
| InterPro | IPR013803 | ||||||||
| SCOP2 | 2 lfm / Rozsah / SUPFAM | ||||||||
| TCDB | 1.C.50 | ||||||||
| OPM nadčeleď | 304 | ||||||||
| OPM protein | 2y3k | ||||||||
| Membranome | 45 | ||||||||
| |||||||||
| prekurzorový protein amyloid beta (A4) (peptidáza nexin-II, Alzheimerova choroba) | |||||||
|---|---|---|---|---|---|---|---|
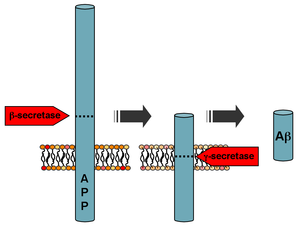 Zpracování amyloidního prekurzorového proteinu | |||||||
| Identifikátory | |||||||
| Symbol | APLIKACE | ||||||
| Alt. symboly | AD1 | ||||||
| Gen NCBI | 351 | ||||||
| HGNC | 620 | ||||||
| OMIM | 104760 | ||||||
| RefSeq | NM_000484 | ||||||
| UniProt | P05067 | ||||||
| Další údaje | |||||||
| Místo | Chr. 21 q21.2 | ||||||
| |||||||
Amyloid beta (Ap nebo Abeta) označuje peptidy 36–43 aminokyseliny které jsou hlavní součástí amyloidové plaky nalezené v mozku lidí s Alzheimerova choroba.[2] Peptidy pocházejí z amyloidový prekurzorový protein (APP), kterou štěpí beta sekretáza a gama sekretáza čímž se získá Ap. Molekuly Ap se mohou agregovat za vzniku pružného rozpustného oligomery které mohou existovat v několika formách. Nyní se věří, že určité nesprávně složené oligomery (známé jako „semena“) mohou přimět jiné molekuly Ap, aby také získaly nesprávně složenou oligomerní formu, což vede k řetězové reakci podobné prion infekce. Oligomery jsou toxické nervové buňky.[3] Další protein podílející se na Alzheimerově chorobě, tau protein, také tvoří takové prionové špatně složené oligomery a existují určité důkazy, že nesprávně složená Ap může vyvolat nesprávné složení tau.[4][5]
Studie naznačuje, že APP a jeho amyloidní potenciál má starověký původ, jehož počátky se datují již dříve deuterostomy.[6]
Normální funkce
Normální funkce Ap není dobře známa.[7] Ačkoli některé studie na zvířatech ukázaly, že nepřítomnost Ap nevede k zjevné ztrátě fyziologické funkce,[8][9] bylo objeveno několik potenciálních aktivit pro Ap, včetně aktivace kináza enzymy,[10][11] ochrana proti oxidační stres,[12][13] regulace cholesterol doprava,[14][15] funguje jako transkripční faktor,[16][17] a antimikrobiální aktivita (potenciálně spojená s pro-zánětlivé aktivita).[18][19][20]
The glymfatický systém čistí metabolický odpad z mozku savců, zejména beta amyloidů.[21] Mnoho proteáz bylo skutečně implikováno jak genetickými, tak biochemickými studiemi jako zodpovědné za rozpoznávání a degradaci beta amyloidů; mezi ně patří enzym degradující inzulin.[22] a pre-sekvenční proteáza[23] Rychlost odstraňování se během spánku výrazně zvyšuje.[24] Význam lymfatického systému v clearance Ap u Alzheimerovy choroby však není znám.[25]
Sdružení nemocí
Ap je hlavní složkou amyloidové plaky, extracelulární depozity nalezené v mozky lidí s Alzheimerovou chorobou).[26] Podobné plaky se objevují v některých variantách Demence s Lewyho tělísky a v myositida s inkluzním tělem (svalové onemocnění), zatímco Ap může také tvořit agregáty, které pokrývají mozkové krevní cévy cerebrální amyloidová angiopatie. Plaky jsou složeny ze spleti pravidelně uspořádaných fibrilárních agregátů nazývaných amyloidní vlákna,[27] A proteinový záhyb sdíleny jinými peptidy, jako je priony spojené s nemocemi nesprávného skládání bílkovin.
Alzheimerova choroba
Výzkum naznačuje, že rozpustné oligomerní formy peptidu mohou být původci Alzheimerovy choroby.[28][29] Obecně se věří, že Ap oligomery jsou nejtoxičtější.[30] The hypotéza iontového kanálu předpokládá, že oligomery rozpustné nefibrilární Ap tvoří membránu iontové kanály umožňující neregulované vápník příliv do neuronů[31] které jsou základem rozrušeného iontu vápníku homeostáza a apoptóza u Alzheimerovy choroby.[32][33] Výpočtové studie prokázaly, že také Ap peptidy zabudované do membrány jako monomery s převládající spirálovou konfigurací mohou oligomerizovat[34] a nakonec vytvoří kanály, jejichž stabilita a konformace citlivě korelují se současnou přítomností a uspořádáním cholesterolu.[35] Řada genetických, buněčných biologických, biochemických studií a studií na zvířatech podporuje koncept, že Ap hraje ústřední roli ve vývoji patologie Alzheimerovy choroby.[36][37]
Mozek Ap je zvýšený u lidí se sporadickou Alzheimerovou chorobou. Ap je hlavní složkou mozku parenchymální a vaskulární amyloid; přispívá k cerebrovaskulárním lézím a je neurotoxický.[36][37][38][39] Není vyřešeno, jak se Ap hromadí v centrálním nervovém systému a následně iniciuje onemocnění buněk. Někteří vědci zjistili, že Ap oligomery indukují některé příznaky Alzheimerovy choroby tím, že soutěží s inzulínem o vazebná místa na inzulínovém receptoru, což zhoršuje metabolismus glukózy v mozku.[40] Významné úsilí bylo zaměřeno na mechanismy odpovědné za produkci Ap, včetně proteolytických enzymů gama- a p-sekretáz, které generují Ap z jeho prekurzorového proteinu APP (amyloidový prekurzorový protein).[41][42][43][44] Ap cirkuluje v plazmě, mozkomíšním moku (CSF) a mozkové intersticiální tekutině (ISF) hlavně jako rozpustný Ap40[36][45] Senilní plaky obsahují jak Ap40, tak Ap42,[46] zatímco vaskulární amyloid je převážně kratší Ap40. V obou lézích bylo nalezeno několik sekvencí Ap.[47][48][49] Generování Ap v centrálním nervovém systému může probíhat v neuronálních axonálních membránách po APP zprostředkovaném axonálním transportu p-sekretázy a presenilinu-1.[50]
Zvýšení buď celkové hladiny Ap nebo relativní koncentrace jak Ap40, tak Ap42 (kde první je více koncentrovaný v cerebrovaskulárních placích a druhý v neuritický desky)[51] byly zapleteny do patogeneze familiární i sporadické Alzheimerovy choroby. Díky své hydrofobnější povaze je Ap42 nejvíce amyloidogenní formou peptidu. Je však známo, že centrální sekvence KLVFFAE tvoří sám amyloid a pravděpodobně tvoří jádro fibrily.[Citace je zapotřebí ] Jedna studie dále korelovala hladiny Ap42 v mozku nejen s nástupem Alzheimerovy choroby, ale také snížila tlak mozkomíšního moku, což naznačuje, že v patologii může hrát roli nahromadění nebo neschopnost vyčistit fragmenty Ap42.[52]
„amyloidová hypotéza „že plaky jsou odpovědné za patologii Alzheimerovy choroby, většina vědců akceptuje, ale není přesvědčivě stanovena. Alternativní hypotézou je, že amyloid oligomery spíše než plaky jsou zodpovědné za onemocnění.[30][53] Myši, které jsou geneticky upraveny tak, aby exprimovaly oligomery, ale ne plaky (APPE693Q) vyvinout nemoc. Kromě toho myši, které jsou navíc konstruovány pro přeměnu oligomerů na plaky (APPE693Q X PS1 AE9), nejsou o nic více narušeni než myši pouze s oligomerem.[54] Intracelulární depozity tau protein jsou také pozorovány u nemoci a mohou být také implikovány, stejně jako agregace alfa synuklein.
Rakovina
Zatímco Ap byl zapojen do rakovina vývoje, což si vyžádalo studie různých druhů rakoviny k objasnění podstaty možných účinků, jsou výsledky do značné míry neprůkazné. Hladiny Ap byly hodnoceny ve vztahu k řadě rakovin, včetně jícnu, kolorektální, plíce, a jaterní, v reakci na pozorované snížení rizika rozvoje Alzheimerovy choroby u osob, které tyto rakoviny přežily. Ukázalo se, že všechny druhy rakoviny jsou pozitivně spojeny se zvýšenými hladinami Ap, zejména rakoviny jater.[55] Tento směr sdružení však dosud nebyl stanoven. Studie zaměřené na lidské buněčné linie rakoviny prsu dále prokázaly, že tyto rakovinné buňky vykazují zvýšenou hladinu exprese prekurzorového proteinu amyloidu.[56]
Downův syndrom
Dospělí s Downův syndrom došlo k akumulaci amyloidu ve spojení s důkazy o Alzheimerově chorobě, včetně poklesu kognitivních funkcí, paměti, jemných motorických pohybů, výkonných funkcí a visuospatálních dovedností.[57]
Formace
Ap se vytváří po sobě výstřih z amyloidový prekurzorový protein (APP), a transmembránový glykoprotein neurčené funkce. APP může být štěpen pomocí proteolytický enzymy α-, β- a y-sekretáza; Ap protein je generován postupným působením β a γ sekretáz. Γ sekretáza, která produkuje C-terminál konec peptidu Ap se štěpí v transmembránové oblasti APP a může generovat řadu izoforem 30-51 aminokyselina zbytky na délku.[58] Nejběžnější izoformy jsou Ap40 a Ap42; delší forma se obvykle vyrábí štěpením, ke kterému dochází v endoplazmatické retikulum, zatímco kratší forma se vytváří štěpením v trans-Golgi síť.[59]
Genetika
Autosomálně dominantní mutace v APP způsobují dědičný Alzheimerova choroba s časným nástupem (familiární AD). Tato forma AD nepředstavuje více než 10% všech případů a drtivá většina AD není doprovázena takovými mutacemi.[60] Je však pravděpodobné, že familiární Alzheimerova choroba bude způsobena změnami proteolytický zpracovává se.
Gen pro prekurzorový protein amyloidu je lokalizován na chromozom 21, a podle toho lidé s Downův syndrom mají velmi vysoký výskyt Alzheimerovy choroby.[61]
Struktura a toxicita
Amyloid beta je obecně považován za vnitřně nestrukturovaný, což znamená, že v řešení nezíská jedinečný terciár složit ale spíše vyplňuje soubor struktur. Nelze jej tedy krystalizovat a pochází většina strukturálních znalostí o amyloidu beta NMR a molekulární dynamika. Časné modely 26-aminokyselinového polypeptidu odvozeného z NMR z amyloidu beta (Ap 10-35) vykazují zhroucení cívka struktura postrádá význam sekundární struktura obsah.[62] Nejnovější (2012) NMR struktura (Ap 1-40) má však významnou sekundární a terciární strukturu.[1] Výměna replik studie molekulární dynamiky naznačují, že amyloid beta může skutečně naplnit několik diskrétních strukturních stavů;[63] novější studie statistickou analýzou identifikovaly množství diskrétních konformačních shluků.[64] Podle NMR řízených simulací se zdá, že amyloid beta 1-40 a amyloid beta 1-42 vykazují velmi odlišné konformační stavy,[65] přičemž C-konec amyloidu beta 1-42 je strukturovanější než C-konec fragmentu 1-40.
Nízkoteplotní a málo solné podmínky umožnily izolovat pentamerní diskovité oligomery bez beta struktury.[66] Naproti tomu se zdá, že rozpustné oligomery připravené v přítomnosti detergentů mají podstatný obsah beta listu se smíšeným paralelním a antiparalelním charakterem, odlišným od fibril;[67] výpočetní studie naznačují antiparalelní motiv beta-turn-beta místo pro oligomery zalité v membráně.[68]
Navrhované mechanismy, kterými může amyloid beta poškodit a způsobit smrt neuronů, zahrnují tvorbu reaktivní formy kyslíku během procesu jeho vlastní agregace. Pokud k tomu dojde in vitro na membráně neuronů, způsobí to peroxidace lipidů a vznik toxického aldehydu 4-hydroxynonenal což zase zhoršuje funkci iontomotorických ATPáz, transportéry glukózy a transportéry glutamátu. Výsledkem je, že amyloid beta podporuje depolarizaci synaptické membrány, nadměrný příliv vápníku a mitochondriální poškození.[69] Agregace peptidu amyloid-beta narušují membrány in vitro.[70]
Intervenční strategie
Výzkumníci Alzheimerovy choroby identifikovali několik strategií jako možných intervencí proti amyloidu:[71]
- β-sekretáza inhibitory. Tyto práce blokují první štěpení APP uvnitř buňky v endoplazmatickém retikulu.
- y-sekretáza inhibitory (např. semagacestat ). Tyto práce blokují druhé štěpení APP v buněčné membráně a zastaví tak následnou tvorbu Ap a jeho toxických fragmentů.
- Selektivní Ap42 snižující látky (např. tarenflurbil ). Ty modulují y-sekretázu ke snížení Ap42 výroba ve prospěch jiných (kratších) Aβ verzí.
β- a γ-sekretáza jsou zodpovědné za tvorbu Ap z uvolňování intracelulární domény APP, což znamená, že sloučeniny, které mohou částečně inhibovat aktivitu buď β- a y-sekretázy, jsou velmi žádané. K zahájení částečné inhibice β- a γ-sekretázy je zapotřebí sloučenina, která může blokovat velké aktivní místo aspartylproteáz a přitom je schopna obejít hematoencefalickou bariéru. K dnešnímu dni se lidskému testování vyhnulo kvůli obavám, že by mohlo interferovat se signalizací prostřednictvím proteinů Notch a jiných buněčných povrchových receptorů.[Citace je zapotřebí ]
- Imunoterapie. To stimuluje imunitní systém hostitele k rozpoznání a napadení Ap, nebo poskytnutí protilátek, které buď zabraňují ukládání plaků, nebo zlepšují clearance plaků nebo Ap oligomerů. Oligomerizace je chemický proces, který převádí jednotlivé molekuly na řetězec skládající se z konečného počtu molekul. Příkladem prevence oligomerizace Ap je aktivní nebo pasivní imunizace Ap. V tomto procesu se protilátky proti Ap používají ke snížení hladin mozkových plaků. Toho je dosaženo podporou mikrogliální clearance a / nebo redistribucí peptidu z mozku do systémového oběhu. Protilátky zaměřené na Ap, které v současné době v klinických studiích zahrnovaly aducanumab, bapineuzumab, crenezumab, gantenerumab, gantenerumab, a solanezumab.[72][73] Mezi vakcíny proti beta-amyloidu, které jsou v současné době v klinických studiích, patří 106 CAD a UB-311.[72] Recenze literatury však vyvolaly otázky týkající se celkové účinnosti imunoterapie. Jedna taková studie hodnotící deset protilátek anti-Ab42 ukázala minimální kognitivní ochranu a výsledky v každé studii, protože příznaky byly v době aplikace příliš daleko na to, aby byly užitečné. Pro aplikaci u těch, kteří jsou presymptomatičtí, je stále zapotřebí dalšího vývoje
posoudit jejich účinnost časně do progrese onemocnění.[74]
- Antiagregační látky[75] jako apomorfin nebo karbenoxolon. Ten se běžně používá jako léčba peptických vředů, ale také vykazuje neuroprotektivní vlastnosti, které zlepšují kognitivní funkce, jako je verbální plynulost a konsolidace paměti. Vazbou s vysokou afinitou na fragmenty Ap42, primárně prostřednictvím vodíkové vazby, karbenoxolon zachycuje peptidy dříve, než se mohou agregovat dohromady, čímž je činí inertními, stejně jako destabilizuje již vytvořené agregáty a pomáhá je vyčistit.[76] Toto je běžný mechanismus působení antiagregačních látek jako celku.[77]
- Studie srovnávající syntetický a rekombinantní Ap42 v testech měření rychlosti fibrilace, homogenity fibril a buněčné toxicity ukázalo, že rekombinantní Ap42 měl rychlejší rychlost fibrilace a větší toxicitu než syntetický peptid amyloid beta 1-42.[78][79]
- Modulační homeostáza cholesterolu přinesla výsledky, které ukazují, že chronické užívání léků snižujících hladinu cholesterolu, jako jsou statiny, je spojeno s nižším výskytem AD. U APP geneticky modifikovaných myší bylo prokázáno, že léky snižující hladinu cholesterolu snižují celkovou patologii. I když je mechanismus špatně pochopen, zdá se, že léky snižující hladinu cholesterolu mají přímý účinek na zpracování APP.[80][81]
- Memantin je lék na Alzheimerovu chorobu, který získal široké schválení. Je to nekonkurenční N-methyl-D-aspartát (NMDA ) blokátor kanálů. Vazbou na NMDA receptor s vyšší afinitou než ionty Mg2 + je memantin schopen inhibovat prodloužený příliv iontů Ca2 +, zejména z extrasynaptických receptorů, což tvoří základ neuronální excitotoxicity. Jedná se o možnost léčby pacientů se středně těžkou až těžkou Alzheimerovou chorobou (mírný účinek). Studie ukázala, že 20 mg / den zlepšilo poznání, funkční schopnosti a symptomy chování.[82]
- Norvaline je kandidátským lékem pro léčbu Alzheimerovy choroby. Je to argináza inhibitor, který snadno prochází hematoencefalickou bariérou a snižuje ztrátu argininu v mozku. Depozice amyloidu beta je spojena s deprivací L-argininu a neurodegenerací. Myši ošetřené přípravkem Norvaline zlepšily prostorovou paměť, zvýšily proteiny související s neuroplasticitou a snížily beta amyloid.[83]
Měření beta amyloidu

Zobrazovací sloučeniny, zejména Pittsburghská sloučenina B, (6-OH-BTA-1, a thioflavin ), se mohou selektivně vázat na amyloid beta in vitro a in vivo. Tato technika v kombinaci s PET zobrazování, se používá k zobrazení oblastí usazenin plaku u pacientů s Alzheimerovou chorobou.[84]
Post mortem nebo v biopsiích tkáně
Amyloid beta lze měřit semikvantitativně pomocí imunobarvení, což také umožňuje určit polohu. Amyloid beta může být primárně vaskulární, jako v cerebrální amyloidová angiopatie, nebo v senilní plaky v bílá hmota.[85]
Jedna citlivá metoda je ELISA což je imunosorbentní test, který využívá pár protilátky které rozpoznávají amyloid beta.[86][87]
Mikroskopie atomové síly, který dokáže vizualizovat molekulární povrchy v nanoměřítku, lze použít ke stanovení agregačního stavu amyloidu beta in vitro.[88]
Duální polarizační interferometrie je optická technika, která může měřit časná stádia agregace měřením velikosti a hustoty molekul, jak se fibrily prodlužují.[89][90] Tyto agregační procesy lze také studovat na lipidových dvouvrstvých konstruktech.[91]
Viz také
Reference
- ^ A b Vivekanandan S, Brender JR, Lee SY, Ramamoorthy A (červenec 2011). „Částečně složená struktura amyloidu-beta (1–40) ve vodném prostředí“. Sdělení o biochemickém a biofyzikálním výzkumu. 411 (2): 312–6. doi:10.1016 / j.bbrc.2011.06.133. PMC 3148408. PMID 21726530.
- ^ Hamley IW (říjen 2012). „Amyloid beta peptid: perspektiva chemika. Role v Alzheimerově chorobě a fibrilaci“ (PDF). Chemické recenze. 112 (10): 5147–92. doi:10.1021 / cr3000994. PMID 22813427.
- ^ Haass C, Selkoe DJ (únor 2007). „Rozpustné proteinové oligomery v neurodegeneraci: poučení z Alzheimerova amyloidního beta-peptidu“. Recenze přírody. Molekulární buněčná biologie. 8 (2): 101–12. doi:10.1038 / nrm2101. PMID 17245412. S2CID 32991755.
- ^ Nussbaum JM, Seward ME, Bloom GS (leden – únor 2013). „Alzheimerova choroba: příběh o dvou prionech“. Prion. 7 (1): 14–9. doi:10,4161 / pri.22118. PMC 3609044. PMID 22965142.
- ^ Pulawski W, Ghoshdastider U, Andrisano V, Filipek S (duben 2012). „Všudypřítomné amyloidy“. Aplikovaná biochemie a biotechnologie. 166 (7): 1626–43. doi:10.1007 / s12010-012-9549-3. PMC 3324686. PMID 22350870.
- ^ Tharp WG, Sarkar IN (duben 2013). "Počátky amyloidu-β". BMC Genomics. 14 (1): 290. doi:10.1186/1471-2164-14-290. PMC 3660159. PMID 23627794.
- ^ Hiltunen M, van Groen T, Jolkkonen J (2009). „Funkční role prekurzoru proteinu amyloid-beta a peptidů amyloid-beta: důkazy z experimentálních studií“. Journal of Alzheimer's Disease. 18 (2): 401–12. doi:10.3233 / JAD-2009-1154. PMID 19584429.
- ^ Sadigh-Eteghad S, Talebi M, Farhoudi M, EJ Golzari S, Sabermarouf B, Mahmoudi J (2014). „Beta-amyloid vykazuje antagonistické účinky na alfa 7 nikotinových acetylcholinových receptorech řízeným způsobem“. Journal of Medical Hypotheses and Ideas. 8 (2): 48–52. doi:10.1016 / j.jmhi.2014.01.001.
- ^ Luo Y, Bolon B, Damore MA, Fitzpatrick D, Liu H, Zhang J a kol. (Říjen 2003). „BACE1 (beta-sekretáza) knockoutované myši nezískávají kompenzační změny genové exprese ani se u nich v průběhu času nevyvíjejí nervové léze“. Neurobiologie nemocí. 14 (1): 81–8. doi:10.1016 / S0969-9961 (03) 00104-9. PMID 13678669. S2CID 8367440.
- ^ Bogoyevitch MA, Boehm I, Oakley A, Ketterman AJ, Barr RK (březen 2004). „Cílení na kaskádu JNK MAPK pro inhibici: základní vědecký a terapeutický potenciál“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1697 (1–2): 89–101. doi:10.1016 / j.bbapap.2003.11.016. PMID 15023353.
- ^ Tabaton M, Zhu X, Perry G, Smith MA, Giliberto L (leden 2010). „Signální účinek amyloidu-beta (42) na zpracování AβPP“. Experimentální neurologie. 221 (1): 18–25. doi:10.1016 / j.expneurol.2009.09.002. PMC 2812589. PMID 19747481.
- ^ Zou K, Gong JS, Yanagisawa K, Michikawa M (červen 2002). „Nová funkce monomerního amyloidu beta-proteinu sloužícího jako antioxidační molekula proti oxidačnímu poškození vyvolanému kovem“. The Journal of Neuroscience. 22 (12): 4833–41. doi:10.1523 / JNEUROSCI.22-12-04833.2002. PMC 6757724. PMID 12077180.
- ^ Baruch-Suchodolsky R, Fischer B (květen 2009). „Abeta40, ať už rozpustný nebo agregovaný, je pozoruhodně silným antioxidantem v bezbuněčných oxidačních systémech“. Biochemie. 48 (20): 4354–70. doi:10.1021 / bi802361k. PMID 19320465.
- ^ Yao ZX, Papadopoulos V (říjen 2002). „Funkce beta-amyloidu v transportu cholesterolu: vede k neurotoxicitě“. FASEB Journal. 16 (12): 1677–9. doi:10.1096 / fj.02-0285fje. PMID 12206998. S2CID 17813857.
- ^ Igbavboa U, Sun GY, Weisman GA, He Y, Wood WG (srpen 2009). „Amyloid beta-protein stimuluje přenos cholesterolu a kaveolinu-1 z plazmatické membrány do komplexu Golgi v primárních myších astrocytech“. Neurovědy. 162 (2): 328–38. doi:10.1016 / j.neuroscience.2009.04.049. PMC 3083247. PMID 19401218.
- ^ Maloney B, Lahiri DK (listopad 2011). „Alzheimerův amyloid β-peptid (Ap) váže specifickou doménu interagující s DNA Ap (Ap) v promotorech APP, BACE1 a APOE způsobem specifickým pro sekvenci: charakterizuje nový regulační motiv.“. Gen. 488 (1–2): 1–12. doi:10.1016 / j.gene.2011.06.004. PMC 3381326. PMID 21699964.
- ^ Bailey JA, Maloney B, Ge YW, Lahiri DK (listopad 2011). „Funkční aktivita nové Alzheimerovy amyloidové β-peptidové interagující domény (AβID) v promotorových sekvencích APP a BACE1 a implikace v aktivaci apoptotických genů a v amyloidogenezi“. Gen. 488 (1–2): 13–22. doi:10.1016 / j.gene.2011.06.017. PMC 3372404. PMID 21708232.
- ^ Kagan BL, Jang H, Capone R, Teran Arce F, Ramachandran S, Lal R, Nussinov R (duben 2012). "Antimikrobiální vlastnosti amyloidních peptidů". Molekulární farmaceutika. 9 (4): 708–17. doi:10,1021 / mp200419b. PMC 3297685. PMID 22081976.
- ^ Schluesener HJ, Su Y, Ebrahimi A, Pouladsaz D (červen 2012). "Antimikrobiální peptidy v mozku: neuropeptidy a amyloid". Frontiers in Bioscience. 4 (4): 1375–80. doi:10,2741 / S339. PMID 22652879.
- ^ Li H, Liu CC, Zheng H, Huang TY (2018). „Amyloid, tau, infekce patogeny a antimikrobiální ochrana u Alzheimerovy choroby - konformní, nekonformní a realistické vyhlídky na patogenezi AD“. Translační neurodegenerace. 7: 34. doi:10.1186 / s40035-018-0139-3. PMC 6306008. PMID 30603085.
- ^ Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA a kol. (Srpen 2012). „Paravaskulární dráha usnadňuje tok mozkomíšního parenchymu mozkem a clearance intersticiálních látek, včetně amyloidu β“. Science Translational Medicine. 4 (147): 147ra111. doi:10.1126 / scitranslmed.3003748. PMC 3551275. PMID 22896675.
- ^ Shen Y, Joachimiak A, Rosner MR, Tang WJ (říjen 2006). „Struktury lidského enzymu degradujícího inzulín odhalují nový mechanismus rozpoznávání substrátu“. Příroda. 443 (7113): 870–4. Bibcode:2006 Natur.443..870S. doi:10.1038 / nature05143. PMC 3366509. PMID 17051221.
- ^ King JV, Liang WG, Scherpelz KP, Schilling AB, Meredith SC, Tang WJ (červenec 2014). „Molekulární podstata rozpoznávání a degradace substrátu proteázou lidské presekvence“. Struktura. 22 (7): 996–1007. doi:10.1016 / j.str.2014.05.003. PMC 4128088. PMID 24931469.
- ^ Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M a kol. (Říjen 2013). „Spánek řídí clearance metabolitů z mozku dospělých“. Věda. 342 (6156): 373–7. Bibcode:2013Sci ... 342..373X. doi:10.1126 / science.1241224. PMC 3880190. PMID 24136970.
- ^ Tarasoff-Conway JM, Carare RO, Osorio RS, Glodzik L, Butler T, Fieremans E a kol. (Srpen 2015). „Systémy klírensu v mozku - důsledky Alzheimerovy choroby“. Recenze přírody. Neurologie. 11 (8): 457–70. doi:10.1038 / nrneurol.2015.119. PMC 4694579. PMID 26195256.
- ^ Sadigh-Eteghad S, Sabermarouf B, Majdi A, Talebi M, Farhoudi M, Mahmoudi J (2014). „Amyloid-beta: klíčový faktor Alzheimerovy choroby“. Lékařské zásady a praxe. 24 (1): 1–10. doi:10.1159/000369101. PMC 5588216. PMID 25471398.
- ^ Parker MH, Reitz AB (2000). „Sestava agregátů β-amyloidů na molekulární úrovni“. Chemtracts-Organic Chemistry. 13 (1): 51–56.
- ^ Shankar GM, Li S, Mehta TH, Garcia-Munoz A, Shepardson NE, Smith I a kol. (Srpen 2008). „Dimery amyloidu-beta proteinu izolované přímo z mozku Alzheimerovy choroby zhoršují synaptickou plasticitu a paměť“. Přírodní medicína. 14 (8): 837–42. doi:10,1038 / nm1782. PMC 2772133. PMID 18568035. Shrnutí ležel – Fox News.
- ^ Prelli F, Castaño E, Glenner GG, Frangione B (srpen 1988). "Rozdíly mezi cévním a plakovým jádrem amyloidu u Alzheimerovy choroby". Journal of Neurochemistry. 51 (2): 648–51. doi:10.1111 / j.1471-4159.1988.tb01087.x. PMID 3292706. S2CID 39952611.
- ^ A b Zhao LN, Long H, Mu Y, Chew LY (2012). „Toxicita amyloidních β oligomerů“. International Journal of Molecular Sciences. 13 (6): 7303–27. doi:10,3390 / ijms13067303. PMC 3397527. PMID 22837695.
- ^ Arispe N, Rojas E, Pollard HB (leden 1993). "Alzheimerova choroba amyloid beta protein tvoří vápníkové kanály v dvojvrstvých membránách: blokáda tromethaminem a hliníkem". Sborník Národní akademie věd Spojených států amerických. 90 (2): 567–71. Bibcode:1993PNAS ... 90..567A. doi:10.1073 / pnas.90.2.567. PMC 45704. PMID 8380642.
- ^ Abramov AY, Canevari L, Duchen MR (prosinec 2004). "Vápníkové signály indukované amyloidním beta peptidem a jejich důsledky pro neurony a astrocyty v kultuře". Biochimica et Biophysica Acta (BBA) - výzkum molekulárních buněk. 8. evropské sympozium o vápníku. 1742 (1–3): 81–7. doi:10.1016 / j.bbamcr.2004.09.006. PMID 15590058.
- ^ Ekinci FJ, Linsley MD, Shea TB (březen 2000). „Příliv vápníku vyvolaný beta-amyloidy indukuje apoptózu v kultuře spíše oxidačním stresem než fosforylací tau“. Výzkum mozku. Molekulární výzkum mozku. 76 (2): 389–95. doi:10.1016 / S0169-328X (00) 00025-5. PMID 10762716.
- ^ Pannuzzo M, Milardi D, Raudino A, Karttunen M, La Rosa C (červen 2013). „Analytický model a víceúrovňové simulace agregace peptidů Ap v lipidových membránách: směrem ke sjednocujícímu popisu konformačních přechodů, oligomerizace a poškození membrány“. Fyzikální chemie Chemická fyzika. 15 (23): 8940–51. Bibcode:2013PCCP ... 15,8940P. doi:10.1039 / c3cp44539a. PMID 23588697.
- ^ Pannuzzo M (červen 2016). „O fyziologické / patologické souvislosti mezi peptidem Ap, cholesterolem, ionty vápníku a membránovou deformací: Studie molekulární dynamiky“. Biochimica et Biophysica Acta (BBA) - Biomembrány. 1858 (6): 1380–9. doi:10.1016 / j.bbamem.2016.03.018. PMID 27003127.
- ^ A b C Ghiso J, Frangione B (prosinec 2002). „Amyloidóza a Alzheimerova choroba“. Pokročilé recenze dodávek drog. 54 (12): 1539–51. doi:10.1016 / S0169-409X (02) 00149-7. PMID 12453671.
- ^ A b Selkoe DJ (říjen 2001). "Vymazání mozkových amyloidních pavučin". Neuron. 32 (2): 177–80. doi:10.1016 / S0896-6273 (01) 00475-5. PMID 11683988. S2CID 17860343.
- ^ Hardy J, Duff K, Hardy KG, Perez-Tur J, Hutton M (září 1998). „Genetická disekce Alzheimerovy choroby a souvisejících demencí: amyloid a jeho vztah k tau“. Přírodní neurovědy. 1 (5): 355–8. doi:10.1038/1565. PMID 10196523. S2CID 52807658.
- ^ Růže AD (únor 1998). „Alzheimerova choroba: model genových mutací a polymorfismů náchylnosti ke komplexním psychiatrickým onemocněním“. American Journal of Medical Genetics. 81 (1): 49–57. doi:10.1002 / (SICI) 1096-8628 (19980207) 81: 1 <49 :: AID-AJMG10> 3.0.CO; 2-W. PMID 9514588.
- ^ Xie L, Helmerhorst E, Taddei K, Plewright B, Van Bronswijk W, Martins R (květen 2002). „Alzheimerovy beta-amyloidové peptidy soutěží o vazbu inzulínu na inzulinový receptor“. The Journal of Neuroscience. 22 (10): RC221. doi:10.1523 / JNEUROSCI.22-10-j0001.2002. PMC 6757630. PMID 12006603.
- ^ Ray WJ, Yao M, Mumm J, Schroeter EH, Saftig P, Wolfe M a kol. (Prosinec 1999). „Presenilin-1 se podílí na proteolýze Notch podobné gama-sekretáze“. The Journal of Biological Chemistry. 274 (51): 36801–7. doi:10.1074 / jbc.274.51.36801. PMID 10593990.
- ^ Roberts SB (prosinec 2002). "Inhibitory gama-sekretázy a Alzheimerova choroba". Pokročilé recenze dodávek drog. 54 (12): 1579–88. doi:10.1016 / S0169-409X (02) 00155-2. PMID 12453675.
- ^ Vassar R, Bennett BD, Babu-Khan S, Kahn S, Mendiaz EA, Denis P a kol. (Říjen 1999). „Štěpení beta-sekretázy z Alzheimerova amyloidního prekurzorového proteinu transmembránovou aspartátovou proteázou BACE“. Věda. 286 (5440): 735–41. doi:10.1126 / science.286.5440.735. PMID 10531052.
- ^ Vassar R (prosinec 2002). „Beta-sekretáza (BACE) jako lékový cíl pro Alzheimerovu chorobu“. Pokročilé recenze dodávek drog. 54 (12): 1589–602. doi:10.1016 / S0169-409X (02) 00157-6. PMID 12453676.
- ^ Zlokovic BV, Frangione B (2003). Hypotéza transportní clearance u Alzheimerovy choroby a potenciální terapeutické důsledky. Landes Bioscience. str. 114–122.
- ^ Masters CL, Simms G, Weinman NA, Multhaup G, McDonald BL, Beyreuther K (červen 1985). „Amyloidový základní protein plaku u Alzheimerovy choroby a Downova syndromu“. Sborník Národní akademie věd Spojených států amerických. 82 (12): 4245–9. Bibcode:1985PNAS ... 82,4245M. doi:10.1073 / pnas.82.12.4245. PMC 397973. PMID 3159021.
- ^ Castaño EM, Prelli F, Soto C, Beavis R, Matsubara E, Shoji M, Frangione B (prosinec 1996). „Délka amyloidu-beta při dědičném mozkovém krvácení s amyloidózou, holandského typu. Důsledky pro roli amyloidu-beta 1-42 při Alzheimerově chorobě“. The Journal of Biological Chemistry. 271 (50): 32185–91. doi:10.1074 / jbc.271.50.32185. PMID 8943274.
- ^ Roher AE, Lowenson JD, Clarke S, Woods AS, Cotter RJ, Gowing E, Ball MJ (listopad 1993). „beta-amyloid- (1–42) je hlavní složkou cerebrovaskulárních amyloidových depozit: důsledky pro patologii Alzheimerovy choroby“. Sborník Národní akademie věd Spojených států amerických. 90 (22): 10836–40. Bibcode:1993PNAS ... 9010836R. doi:10.1073 / pnas.90.22.10836. PMC 47873. PMID 8248178.
- ^ Shinkai Y, Yoshimura M, Ito Y, Odaka A, Suzuki N, Yanagisawa K, Ihara Y (září 1995). „Amyloidní beta-proteiny 1-40 a 1-42 (43) v rozpustné frakci extra- a intrakraniálních krevních cév“. Annals of Neurology. 38 (3): 421–8. doi:10,1002 / analog. 410380312. PMID 7668828. S2CID 24568952.
- ^ Kamal A, Almenar-Queralt A, LeBlanc JF, Roberts EA, Goldstein LS (prosinec 2001). „Kinesinem zprostředkovaný axonální transport membránového kompartmentu obsahujícího beta-sekretázu a presenilin-1 vyžaduje APP“. Příroda. 414 (6864): 643–8. Bibcode:2001 Natur.414..643K. doi:10.1038 / 414643a. PMID 11740561. S2CID 4421228.
- ^ Lue LF, Kuo YM, Roher AE, Brachova L, Shen Y, Sue L a kol. (Září 1999). „Koncentrace rozpustného peptidu amyloidu beta jako prediktor synaptické změny u Alzheimerovy choroby“. American Journal of Pathology. 155 (3): 853–62. doi:10.1016 / S0002-9440 (10) 65184-X. PMC 1866907. PMID 10487842.
- ^ Schirinzi T, Di Lazzaro G, Sancesario GM, Colona VL, Scaricamazza E, Mercuri NB a kol. (Prosinec 2017). „Úrovně tlaku amyloidu-beta-42 a tlaku v likvoru přímo souvisejí s pacienty s Alzheimerovou chorobou.“ Journal of Neural Transmission. 124 (12): 1621–1625. doi:10.1007 / s00702-017-1786-8. PMID 28866757. S2CID 22267507.
- ^ Kayed R, Head E, Thompson JL, McIntire TM, Milton SC, Cotman CW, Glabe CG (duben 2003). "Společná struktura rozpustných amyloidových oligomerů implikuje společný mechanismus patogeneze". Věda. 300 (5618): 486–9. Bibcode:2003Sci ... 300..486K. doi:10.1126 / science.1079469. hdl:2027.42/150615. PMID 12702875. S2CID 29614957.
- ^ Gandy S, Simon AJ, Steele JW, Lublin AL, Lah JJ, Walker LC a kol. (Srpen 2010). „Dny do kritéria jako indikátor toxicity spojené s lidskými Alzheimerovými amyloid-beta oligomery“. Annals of Neurology. 68 (2): 220–30. doi:10.1002 / ana.22052. PMC 3094694. PMID 20641005. Shrnutí ležel – Objev a vývoj drog.
- ^ Jin WS, Bu XL, Liu YH, Shen LL, Zhuang ZQ, Jiao SS a kol. (Únor 2017). „Plazmatické hladiny amyloidu-beta u pacientů s různými typy rakoviny“. Výzkum neurotoxicity. 31 (2): 283–288. doi:10.1007 / s12640-016-9682-9. PMID 27913965. S2CID 3795042.
- ^ Lim S, Yoo BK, Kim HS, Gilmore HL, Lee Y, Lee HP a kol. (Prosinec 2014). „Amyloid-β prekurzorový protein podporuje buněčnou proliferaci a motilitu pokročilého karcinomu prsu“. Rakovina BMC. 14: 928. doi:10.1186/1471-2407-14-928. PMC 4295427. PMID 25491510.
- ^ Hartley SL, Handen BL, Devenny D, Mihaila I, Hardison R, Lao PJ a kol. (Říjen 2017). „Kognitivní pokles a akumulace amyloidu-β v mozku během 3 let u dospělých s Downovým syndromem“. Neurobiologie stárnutí. 58: 68–76. doi:10.1016 / j.neurobiolaging.2017.05.019. PMC 5581712. PMID 28715661.
- ^ Olsson F, Schmidt S, Althoff V, Munter LM, Jin S, Rosqvist S a kol. (Leden 2014). „Charakterizace mezikroků při produkci amyloidu beta (Aβ) za téměř nativních podmínek“. The Journal of Biological Chemistry. 289 (3): 1540–50. doi:10.1074 / jbc.M113.498246. PMC 3894335. PMID 24225948.
- ^ Hartmann T, Bieger SC, Brühl B, Tienari PJ, Ida N, Allsop D a kol. (Září 1997). „Zřetelná místa intracelulární produkce pro amyloidní peptidy Alzheimerovy choroby A beta40 / 42“. Přírodní medicína. 3 (9): 1016–20. doi:10,1038 / nm0997-1016. PMID 9288729. S2CID 8390460.
- ^ Alzheimerova asociace (březen 2008). „Fakta a čísla o Alzheimerově chorobě z roku 2008“. Alzheimerova choroba a demence. 4 (2): 110–33. doi:10.1016 / j.jalz.2008.02.005. PMID 18631956. S2CID 43750218.
- ^ Glenner GG, Wong CW (srpen 1984). „Alzheimerova choroba a Downov syndrom: sdílení jedinečného proteinu cerebrovaskulárních amyloidních fibril“. Sdělení o biochemickém a biofyzikálním výzkumu. 122 (3): 1131–5. doi:10.1016 / 0006-291X (84) 91209-9. PMID 6236805.
- ^ Zhang S, Iwata K, Lachenmann MJ, Peng JW, Li S, Stimson ER a kol. (Červen 2000). „Alzheimerův peptid beta přijímá kolapsovou strukturu cívky ve vodě“. Journal of Structural Biology. 130 (2–3): 130–41. doi:10.1006 / jsbi.2000.4288. PMID 10940221.
- ^ Yang M, Teplow DB (prosinec 2008). „Skládání monomerů amyloidního beta-proteinu: povrchy s volnou energií odhalují rozdíly specifické pro aloformu“. Journal of Molecular Biology. 384 (2): 450–64. doi:10.1016 / j.jmb.2008.09.039. PMC 2673916. PMID 18835397.
- ^ Sgourakis NG, Merced-Serrano M, Boutsidis C, Drineas P, Du Z, Wang C, Garcia AE (leden 2011). „Atomová úroveň charakterizace souboru monomeru Ap (1–42) ve vodě pomocí nestranných simulací molekulární dynamiky a spektrálních algoritmů“. Journal of Molecular Biology. 405 (2): 570–83. doi:10.1016 / j.jmb.2010.10.015. PMC 3060569. PMID 21056574.
- ^ Sgourakis NG, Yan Y, McCallum SA, Wang C, Garcia AE (květen 2007). „Alzheimerovy peptidy Abeta40 a 42 přijímají odlišné konformace ve vodě: kombinovaná studie MD / NMR“. Journal of Molecular Biology. 368 (5): 1448–57. doi:10.1016 / j.jmb.2007.02.093. PMC 1978067. PMID 17397862.
- ^ Ahmed M, Davis J, Aucoin D, Sato T, Ahuja S, Aimoto S a kol. (Květen 2010). "Strukturální přeměna neurotoxických amyloid-beta (1-42) oligomerů na fibrily". Přírodní strukturní a molekulární biologie. 17 (5): 561–7. doi:10.1038 / nsmb.1799. PMC 2922021. PMID 20383142.
- ^ Yu L, Edalji R, Harlan JE, Holzman TF, Lopez AP, Labkovsky B a kol. (Březen 2009). "Strukturální charakterizace rozpustného amyloidního beta-peptidového oligomeru". Biochemie. 48 (9): 1870–7. doi:10.1021 / bi802046n. PMID 19216516.
- ^ Strodel B, Lee JW, Whittleston CS, Wales DJ (září 2010). "Transmembránové struktury pro Alzheimerovy Ap (1-42) oligomery". Journal of the American Chemical Society. 132 (38): 13300–12. doi:10.1021 / ja103725c. PMID 20822103.
- ^ Mattson MP (srpen 2004). „Cesty k Alzheimerově chorobě a od ní“. Příroda. 430 (7000): 631–9. Bibcode:2004 Natur.430..631M. doi:10.1038 / nature02621. PMC 3091392. PMID 15295589.
- ^ Flagmeier P, De S, Wirthensohn DC, Lee SF, Vincke C, Muyldermans S, et al. (Červen 2017). „Přítok 2+ do lipidových váčků indukovaných agregáty proteinů“. Angewandte Chemie. 56 (27): 7750–7754. doi:10.1002 / anie.201700966. PMC 5615231. PMID 28474754.
- ^ Citron M (září 2004). „Strategie pro modifikaci nemoci u Alzheimerovy choroby“. Recenze přírody. Neurovědy. 5 (9): 677–85. doi:10.1038 / nrn1495. PMID 15322526. S2CID 29556449.
- ^ A b Cummings J, Lee G, Mortsdorf T, Ritter A, Zhong K (září 2017). „Ropovod pro vývoj léků na Alzheimerovu chorobu: 2017“. Posouzení. Alzheimerova choroba a demence. 3 (3): 367–384. doi:10.1016 / j.trci.2017.05.002. PMC 5651419. PMID 29067343.
- ^ Schilling S, Rahfeld JU, Lues I, Lemere CA (květen 2018). „Pasivní imunoterapie beta: současné úspěchy a budoucí perspektivy“. Posouzení. Molekuly. 23 (5): 1068. doi:10,3390 / molekuly23051068. PMC 6099643. PMID 29751505.
- ^ Wang Y, Yan T, Lu H, Yin W, Lin B, Fan W a kol. (2017). „Poučení z anti-amyloid-β imunoterapie u Alzheimerovy choroby: Cíl na pohyblivý cíl“. Posouzení. Neuro-degenerativní nemoci. 17 (6): 242–250. doi:10.1159/000478741. PMID 28787714. S2CID 1772982.
- ^ Lashuel HA, Hartley DM, Balakhaneh D, Aggarwal A, Teichberg S, Callaway DJ (listopad 2002). "Nová třída inhibitorů tvorby amyloid-beta fibril. Důsledky pro mechanismus patogeneze u Alzheimerovy choroby". The Journal of Biological Chemistry. 277 (45): 42881–90. doi:10,1074 / jbc.M206593200. PMID 12167652.
- ^ Sharma S, Nehru B, Saini A (září 2017). „Inhibice Alzheimerovy amyloid-beta agregace in-vitro karbenoxolonem: Pohled na mechanismus účinku“. hlavní. Neurochemistry International. 108: 481–493. doi:10.1016 / j.neuint.2017.06.011. PMID 28652220. S2CID 4817028.
- ^ Parker MH, Chen R, Conway KA, Lee DH, Luo C, Boyd RE a kol. (Listopad 2002). „Syntéza (-) - 5,8-dihydroxy-3R-methyl-2R- (dipropylamino) -1,2,3,4-tetrahydronaftalenu: inhibitor agregace beta-amyloidu (1-42)“. Bioorganická a léčivá chemie. 10 (11): 3565–9. doi:10.1016 / S0968-0896 (02) 00251-1. PMID 12213471.
- ^ Finder VH, Vodopivec I, Nitsch RM, Glockshuber R (únor 2010). „Rekombinantní amyloid-beta peptid Abeta1-42 agreguje rychleji a je neurotoxičtější než syntetický Abeta1-42.“ Journal of Molecular Biology. 396 (1): 9–18. doi:10.1016 / j.jmb.2009.12.016. PMID 20026079.
- ^ "Skupenství". Přírodní neurovědy. 14 (4): 399. dubna 2011. doi:10.1038 / nn0411-399. PMID 21445061.
- ^ Refolo LM, Pappolla MA, LaFrancois J, Malester B, Schmidt SD, Thomas-Bryant T a kol. (Říjen 2001). „Lék snižující hladinu cholesterolu snižuje beta-amyloidní patologii u transgenního myšího modelu Alzheimerovy choroby“. Neurobiologie nemocí. 8 (5): 890–9. doi:10.1006 / nbdi.2001.0422. PMID 11592856. S2CID 22995780.
- ^ Lee JY, Cole TB, Palmiter RD, Suh SW, Koh JY (květen 2002). „Příspěvek synaptickým zinkem k tvorbě plaků odlišných od pohlaví u lidských švédských mutantních APP transgenních myší“. Sborník Národní akademie věd Spojených států amerických. 99 (11): 7705–10. Bibcode:2002PNAS ... 99.7705L. doi:10.1073 / pnas.092034699. PMC 124328. PMID 12032347.
- ^ Schneider JS, Pioli EY, Jianzhong Y, Li Q, Bezard E (duben 2013). "Účinky memantinu a galantaminu na kognitivní výkon u starých makaků rhesus". Neurobiologie stárnutí. 34 (4): 1126–32. doi:10.1016 / j.neurobiolaging.2012.10.020. PMID 23158762. S2CID 31131701.
- ^ Polis B, Srikanth KD, Elliott E, Gil-Henn H, Samson AO (říjen 2018). „L-norvalin zvrací kognitivní pokles a synaptickou ztrátu u myšího modelu Alzheimerovy choroby“. Neuroterapeutika. 15 (4): 1036–1054. doi:10.1007 / s13311-018-0669-5. PMC 6277292. PMID 30288668.
- ^ Heurling K, Leuzy A, Zimmer ER, Lubberink M, Nordberg A (únor 2016). „Imaging β-amyloid using [(18) F] flutemetamol pozitronová emisní tomografie: od dozimetrie po klinickou diagnózu“. Evropský žurnál nukleární medicíny a molekulárního zobrazování. 43 (2): 362–373. doi:10.1007 / s00259-015-3208-1. PMID 26440450. S2CID 2695342.
- ^ Ito H, Shimada H, Shinotoh H, Takano H, Sasaki T, Nogami T a kol. (Červen 2014). „Kvantitativní analýza depozice amyloidů u Alzheimerovy choroby pomocí PET a radiotraceru ¹¹C-AZD2184“. Journal of Nuclear Medicine. 55 (6): 932–8. doi:10,2967 / jnumed.113.133793. PMID 24732152.
- ^ Schmidt SD, Nixon RA, Mathews PM (2012). Tissue processing prior to analysis of Alzheimer's disease associated proteins and metabolites, including Aβ. Metody v molekulární biologii. 849. pp. 493–506. doi:10.1007/978-1-61779-551-0_33. ISBN 978-1-61779-550-3. PMID 22528111.
- ^ Schmidt SD, Mazzella MJ, Nixon RA, Mathews PM (2012). "Aβ measurement by enzyme-linked immunosorbent assay". Amyloid Proteins. Metody v molekulární biologii. 849. pp. 507–27. doi:10.1007/978-1-61779-551-0_34. ISBN 978-1-61779-550-3. PMID 22528112.
- ^ Stine WB, Dahlgren KN, Krafft GA, LaDu MJ (March 2003). "In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis". The Journal of Biological Chemistry. 278 (13): 11612–22. doi:10.1074/jbc.M210207200. PMID 12499373.
- ^ Gengler S, Gault VA, Harriott P, Hölscher C (June 2007). "Impairments of hippocampal synaptic plasticity induced by aggregated beta-amyloid (25-35) are dependent on stimulation-protocol and genetic background". Experimentální výzkum mozku. 179 (4): 621–30. doi:10.1007/s00221-006-0819-6. PMID 17171334. S2CID 41040399.
- ^ Rekas A, Jankova L, Thorn DC, Cappai R, Carver JA (December 2007). "Monitoring the prevention of amyloid fibril formation by alpha-crystallin. Temperature dependence and the nature of the aggregating species". FEBS Journal. 274 (24): 6290–304. doi:10.1111/j.1742-4658.2007.06144.x. PMID 18005258. S2CID 85794556.
- ^ Sanghera N, Swann MJ, Ronan G, Pinheiro TJ (October 2009). "Insight into early events in the aggregation of the prion protein on lipid membranes". Biochimica et Biophysica Acta (BBA) - Biomembrány. 1788 (10): 2245–51. doi:10.1016/j.bbamem.2009.08.005. PMID 19703409.
