Imunoterapie - Immunotherapy
tento článek potřebuje víc lékařské odkazy pro ověření nebo se příliš spoléhá na primární zdroje. (Dubna 2018) |
tento článek příliš spoléhá na Reference na primární zdroje. (Dubna 2018) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| Imunoterapie | |
|---|---|
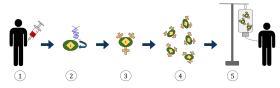 Výše uvedený diagram představuje proces terapie T-buňkami s chimérickým antigenním receptorem (CAR), jedná se o metodu imunoterapie, která je rostoucí praxí v léčbě rakoviny. Konečným výsledkem by měla být produkce vybavených T-buněk, které dokážou rozpoznat a bojovat proti infikovaným rakovinným buňkám v těle.
| |
| Pletivo | D007167 |
| Kód OPS-301 | 8-03 |
Imunoterapie nebo biologická terapie je léčba choroba aktivací nebo potlačením imunitní systém. Imunoterapie určené k vyvolání nebo zesílení imunitní odpovědi jsou klasifikovány jako aktivační imunoterapie, zatímco imunoterapie, které snižují nebo potlačují, jsou klasifikovány jako potlačení imunoterapie.
V posledních letech se imunoterapie stala velkým zájmem vědců, lékařů a farmaceutické společnosti, zejména ve svém příslibu léčit různé formy rakovina.[1][2][3]
Imunomodulační režimy mají často méně vedlejších účinků než stávající léky, včetně menšího potenciálu pro tvorbu odpor při léčbě mikrobiálních onemocnění.[4]
Buněčné imunoterapie jsou účinné u některých druhů rakoviny. Imunitní efektorové buňky, jako jsou lymfocyty, makrofágy, dendritické buňky, přirozené zabijácké buňky (NK Cell), cytotoxické T lymfocyty (CTL) atd., Spolupracují na obraně těla proti rakovině zaměřením na abnormální antigeny exprimované na povrchu nádorových buněk.
Terapie, jako je faktor stimulující kolonie granulocytů (G-CSF), interferony, imichimod a frakce buněčných membrán z bakterie mají licenci pro lékařské použití. Další včetně IL-2, IL-7, IL-12, rozličný chemokiny, syntetické cytosin fosfát-guanosin (CpG) oligodeoxynukleotidy a glukany jsou zapojeni do klinických a předklinických studií.
Imunomodulátory
Imunomodulátory jsou aktivními látkami imunoterapie. Jedná se o pestrou škálu rekombinantních, syntetických a přírodních přípravků.
| Třída | Příklad agentů |
|---|---|
| Interleukiny | IL-2, IL-7, IL-12 |
| Cytokiny | Interferony, G-CSF |
| Chemokiny | CCL3, CCL26, CXCL7 |
| Imunomodulační imidové léky (IMiDs) | thalidomid a jeho analogy (lenalidomid, pomalidomid, a apremilast ) |
| jiný | cytosin fosfát-guanosin, oligodeoxynukleotidy, glukany |
Aktivační imunoterapie
Rakovina
Léčba rakoviny byla dříve zaměřena na zabíjení nebo odstraňování rakovinných buněk a nádorů chemoterapií nebo chirurgickým zákrokem nebo ozařováním. Tato léčba může být velmi účinná a v mnoha případech se stále používá. V roce 2018 Nobelova cena ve fyziologii nebo medicíně byla udělena James P. Allison a Tasuku Honjo „Za objev léčby rakoviny inhibicí negativní imunitní regulace.“ Rakovinová imunoterapie se pokouší stimulovat imunitní systém zničit nádory. Používají se různé strategie nebo procházejí výzkumem a testováním. Byly hlášeny randomizované kontrolované studie u různých druhů rakoviny, které vedly k významnému zvýšení přežití a období bez onemocnění[2] a jeho účinnost se zvýší o 20–30%, když se buněčná imunoterapie kombinuje s konvenčními léčebnými metodami.[2]
Jednou z nejstarších forem imunoterapie rakoviny je použití BCG vakcína, který měl původně očkovat proti tuberkulóza a později bylo zjištěno, že jsou užitečné při léčbě rakovina močového měchýře.[5] BCG imunoterapie indukuje lokální i systémové imunitní odpovědi. Mechanismy, kterými imunoterapie BCG zprostředkovává imunitu proti nádorům, byly široce studovány, ale stále ještě nejsou zcela známy.[6]
Použití monoklonální protilátky v léčbě rakoviny byl poprvé představen v roce 1997 s rituximab, anti-CD20 protilátka pro léčbu B buněčného lymfomu.[7] Od té doby bylo schváleno několik monoklonálních protilátek pro léčbu různých hematologických malignit i pro solidní nádory.[8][9]
Těžba G-CSF lymfocyty z krve a expandováním in vitro proti nádorovému antigenu před opětovným vstřikováním buněk vhodným stimulačním cytokiny. Buňky pak ničí nádorové buňky, které exprimují antigen.[Citace je zapotřebí ]Při místní imunoterapii se používá krém na posílení imunity (imichimod ) který vyrábí interferon, což způsobilo zabijáka příjemce T buňky zničit bradavice,[10] aktinické keratózy, bazocelulární rakovina, vaginální intraepiteliální neoplazie,[11] rakovina dlaždicových buněk,[12][13] kožní lymfom,[14] a povrchový maligní melanom.[15] Injekční imunoterapie („intralezionální“ nebo „intratumorální“) používá příušnice, kandidózu, vakcínu proti HPV[16][17] nebo trichofytin antigen injekce k léčbě bradavic (tumory indukované HPV).
Adoptivní přenos buněk byl testován na plíce [18] a další rakoviny, s největším úspěchem dosaženým v melanom.
Plnění nebo očkování pomocí dendritických buněk
Dendritické buňky (DC) lze stimulovat k aktivaci a cytotoxický reakce na antigen. Dendritické buňky, typ buňka prezentující antigen, jsou získány od osoby, která potřebuje imunoterapii. Tyto buňky jsou poté buď pulzovány antigenem nebo lyzátem nádoru nebo transfektovaný s virový vektor, což jim způsobilo zobrazení antigenu. Po transfuzi osobě tyto aktivované buňky prezentují antigen efektorovým lymfocytům (Pomocné T buňky CD4 + cytotoxický CD8 + T buňky a B buňky ). Tím se iniciuje cytotoxická reakce proti nádorovým buňkám exprimujícím antigen (proti kterým byla nyní aktivována adaptivní odpověď). The vakcína proti rakovině Sipuleucel-T je jedním příkladem tohoto přístupu.[19]
Současné přístupy k Vakcinace na bázi DC jsou založeny hlavně na zatížení antigenu in vitro-generované DC z monocyty nebo CD34 + buňky, jejich aktivace pomocí různých TLR ligandy, cytokin kombinace a jejich vstřikování zpět pacientům. The in vivo přístupy cílení zahrnují podávání specifických cytokinů (např. Flt3L, GM-CSF ) a cílení DC s protilátkami na lektinové receptory typu C nebo agonistickými protilátkami (např.CD40 ), které jsou konjugovány s požadovaným antigenem. Budoucí přístup může cílit na podmnožiny DC na základě jejich konkrétně vyjádřeného Lektinové receptory typu C. nebo chemokinové receptory. Dalším potenciálním přístupem je generace geneticky upravených DC indukované pluripotentní kmenové buňky a použití neoantigen zatížené DC pro vyvolání lepšího klinického výsledku.[20]
Adoptivní přenos T-buněk
Adoptivní přenos buněk in vitro kultivuje autologní, extrahované T buňky pro pozdější transfuzi.[21]
Alternativně, Geneticky upravené T buňky jsou vytvořeny sklizením T buněk a poté infikováním T buněk a retrovirus který obsahuje kopii a Receptor T buněk (TCR) gen, který se specializuje na rozpoznávání nádorových antigenů. Virus integruje receptor do T buněk genom. Buňky jsou nespecificky expandovány a / nebo stimulovány. Buňky jsou poté znovu infuzovány a produkují imunitní odpověď proti nádorovým buňkám.[22] Tato technika byla testována na refrakterním stadiu IV metastatických melanomů[21] a pokročilí rakovina kůže.[23][24][25]
Bez ohledu na to, zda jsou T buňky geneticky upraveny nebo ne, před reinfuzí je nutná lymfodeplece příjemce k eliminaci regulačních T buněk i nemodifikovaných endogenních lymfocytů, které soutěží s přenesenými buňkami o homeostatické cytokiny.[21][26][27][28] Lymfodplnění lze dosáhnout pomocí myeloablativní chemoterapie, ke které lze pro větší účinek přidat celkové ozáření těla.[29] Přenášené buňky se násobily in vivo a přetrvával v periferní krvi u mnoha lidí, někdy představoval úrovně 75% všech CD8+ T buňky 6–12 měsíců po infuzi.[30] Od roku 2012[Aktualizace], klinické studie pro metastatický melanom probíhaly na více místech.[31] Klinické odpovědi na adoptivní přenos T buněk byly pozorovány u pacientů s metastatickým melanomem rezistentním na více imunoterapií.[32]
Inhibitory kontrolního bodu
Anti-PD-1 / PD-L1 a anti-CTLA-4 protilátky jsou dva typy inhibitorů kontrolních bodů, které jsou v současné době k dispozici pacientům. Schválení anti-cytotoxického proteinu spojeného s T-lymfocyty 4 (CTLA-4 ) a anti-programovaný protein buněčné smrti 1 (PD-1 ) protilátky pro humánní použití již vedly k významnému zlepšení výsledků onemocnění u různých druhů rakoviny.[33]
Ačkoli tyto molekuly byly původně objeveny jako molekuly hrající roli v Aktivace T buněk nebo apoptóza, následný předklinický výzkum ukázal jejich důležitou roli při udržování periferní imunitní tolerance.[34]
Inhibitory imunitního kontrolního bodu jsou schváleny k léčbě některých pacientů s různými typy rakoviny, včetně melanomu, rakovina prsu, rakovina močového měchýře, rakovina děložního hrdla, rakovina tlustého střeva, rakovina hlavy a krku nebo Hodgkinův lymfom.[35]
Tyto terapie způsobily revoluci imunoterapie proti rakovině jak se ukázalo poprvé za mnoho let výzkumu metastáz melanom, který je považován za jeden z nejvíce imunogenní lidské rakoviny, zlepšení celkového přežití, s rostoucí skupinou pacientů těžících dlouhodobě z této léčby.[34]
Léčba posílení imunity
Autologní terapie zvyšující imunitu používat vlastní periferní krev člověka přirozené zabijácké buňky jsou expandovány cytotoxické T lymfocyty, epiteliální buňky a další relevantní imunitní buňky in vitro a poté znovu nalít.[36] Terapie byla testována proti Hepatitida C.,[37][38][39] Syndrom chronické únavy[40][41] a HHV6 infekce.[42]
Potlačování imunoterapií
Potlačení imunity tlumí abnormální imunitní odpověď v autoimunitní onemocnění nebo snižuje normální imunitní odpověď aby se zabránilo odmítnutí z transplantovaný orgány nebo buňky.
Imunosupresivní léky
Imunosupresivní léky pomáhat řídit transplantaci orgánů a autoimunitní onemocnění. Imunitní reakce závisí na proliferaci lymfocytů. Cytostatika jsou imunosupresivní. Glukokortikoidy jsou poněkud specifičtějšími inhibitory aktivace lymfocytů, zatímco inhibitory imunofiliny konkrétněji cílit na aktivaci T lymfocytů. Imunosupresivní protilátky cílové kroky v imunitní odpovědi. Jiné léky modulují imunitní odpovědi a lze je použít k vyvolání imunitní regulace. V předklinické studii bylo pozorováno, že regulace imunitního systému malými imunosupresivními molekulami, jako je vitamin D a dexamethason, podávané v režimu nízkých dávek a subkutánně, může být užitečné při prevenci nebo léčbě chronického zánětu.[43]
Imunitní tolerance
Tělo přirozeně nespustí útok imunitního systému na své vlastní tkáně. Modely se obecně identifikují CD4 + T-buňky ve středu autoimunitní odpověď. Ztráta tolerance T-buněk pak uvolní B-buňky a další imunitní efektorové buňky do cílové tkáně. Ideál tolerogenní terapie zacílí na konkrétní klon (y) T-buněk koordinující autoimunitní útok.[44]
Imunitní tolerance terapie se snaží obnovit imunitní systém tak, aby tělo přestalo mylně útočit na své vlastní orgány nebo buňky autoimunitní onemocnění nebo přijímá cizí tkáň v transplantace orgánů.[45] Posledním terapeutickým přístupem je infuze regulační imunitní buňky do příjemců transplantátu. Přenos regulačních imunitních buněk má potenciál inhibovat aktivitu efektoru.[46][47]
Vytváření imunitní tolerance snižuje nebo eliminuje potřebu celoživotní imunosuprese a doprovodných vedlejších účinků. Bylo testováno na transplantacích, rehumatoidní artritida, cukrovka 1. typu a další autoimunitní poruchy.
| Modalita | Detaily | ||
| Není specifické pro antigen | • Monoklonální protilátky | Vyčerpání Anti-CD52 Anti-CD4 Anti-LFA2 | Bez vyčerpání Anti-CD4 Anti-CD3 Anti-LFA-1 CTLA4-Ig Anti-CD25 |
| • Transplantace hematopoetických kmenových buněk | Nemyeloablativní | Myeloablativní | |
| • Transplantace mezenchymálních kmenových buněk | |||
| • Regulační terapie T buňkami | Není specifické pro antigen | Specifické pro antigeny | |
| • Nízká dávka IL-2 k expanzi regulačních T buněk | |||
| • Manipulace s mikrobiomy | |||
| Specifické pro antigeny | • Peptidová terapie | Subkutánní, intradermální, slizniční (orální, inhalační) Tolerogenní dendritické buňky, liposomy a nanočástice | |
| • Změněné peptidové ligandy | |||
Alergie
K léčbě lze také použít imunoterapii alergie. Zatímco léčba alergií (např antihistaminika nebo kortikosteroidy ) léčí alergické příznaky, imunoterapie může snížit citlivost na alergeny, což snižuje jeho závažnost.
Imunoterapie může mít dlouhodobé výhody.[50] Imunoterapie je u některých lidí částečně účinná a u jiných neúčinná, ale alergikům nabízí šanci zmírnit nebo zastavit jejich příznaky.
Terapie je indikována u lidí, kteří jsou extrémně alergičtí nebo se nemohou vyhnout konkrétním alergeny.
Zprostředkovaná IgE alergie na jídlo je globální zdravotní problém, který postihuje miliony osob a ovlivňuje všechny aspekty života pacienta.[51] Slibným přístupem k léčbě potravinových alergií je použití orální imunoterapie (OIT). OIT spočívá v postupném vystavení rostoucímu množství alergenu, což může vést k tomu, že většina subjektů toleruje dávky jídla dostatečné k prevenci reakce při náhodné expozici.[52] Dávky se časem zvyšují, protože osoba je znecitlivěná. Tato technika byla testována na kojencích, aby se zabránilo alergii na arašídy.[53]
Alergenově specifická imunoterapie (ASIT) se stal zlatým standardem pro kauzální léčbu alergických onemocnění zprostředkovaných IgE pro širokou škálu alergenů. Lze čekat zvědavě na nový vývoj, který dále prohloubí naše chápání alergických mechanismů a zlepší ASIT pro další generace pacientů a lékařů.[54]
Helminthické terapie
Bič ova (Trichuris suis) a Měchovec (Necator americanus) byly testovány na imunologická onemocnění a alergie. Helminthická terapie byla zkoumána jako léčba relabujících remitencí roztroušená skleróza[55] Crohnova,[56][57][58] alergie a astma.[59] Mechanismus, jak helmintové modulují imunitní odpověď, není znám. Předpokládané mechanismy zahrnují re-polarizaci odpovědi Th1 / Th2[60] a modulace funkce dendritických buněk.[61][62] Hlístice dolů regulují prozánětlivé Th1 cytokiny, Interleukin-12 (IL-12), interferon-gama (IFN-y) a Faktor alfa nekrózy nádoru (TNF-ά), přičemž podporuje produkci regulačních Th2 cytokinů, jako je IL-10, IL-4, IL-5 a IL-13.[60][63]
Společná evoluce s hlístami formovala některé geny spojené s Interleukin exprese a imunologické poruchy, např Crohnova, ulcerózní kolitida a celiakie. Helminthův vztah k lidem jako hostitelům by měl být klasifikován jako vzájemný nebo symbiotický.[Citace je zapotřebí ]
Viz také
- Modifikátor biologické odezvy
- Sepsivac
- Inhibitor kontrolního bodu
- Imunoterapie interleukinem-2
- Imunostimulant
- Mikrotransplantace
- Fotoimunoterapie in vitro nebo in vivo[64][65][66][67][68][69][70]
Reference
- ^ "Imunoterapie | Cancer Center Memorial Sloan Kettering". mskcc.org. Citováno 2017-07-27.
- ^ A b C Syn NL, Teng MW, Mok TS, Soo RA (prosinec 2017). "De-novo a získaná rezistence na cílení imunitního kontrolního bodu". Lancet. Onkologie. 18 (12): e731 – e741. doi:10.1016 / s1470-2045 (17) 30607-1. PMID 29208439.
- ^ Conforti L (únor 2012). "Síť iontových kanálů v T lymfocytech, cíl imunoterapie". Klinická imunologie. 142 (2): 105–6. doi:10.1016 / j.clim.2011.11.009. PMID 22189042.
- ^ Masihi KN (červenec 2001). "Boj proti infekci pomocí imunomodulačních látek". Znalecký posudek na biologickou terapii. 1 (4): 641–53. doi:10.1517/14712598.1.4.641. PMID 11727500. S2CID 33308465.
- ^ Fuge O, Vasdev N, Allchorne P, Green JS (2015). "Imunoterapie pro rakovinu močového měchýře". Výzkum a zprávy v urologii. 7: 65–79. doi:10.2147 / RRU.S63447. PMC 4427258. PMID 26000263.
- ^ Pettenati, Caroline; Ingersoll, Molly A. (říjen 2018). „Mechanismy imunoterapie BCG a její výhled na rakovinu močového měchýře“. Recenze přírody Urologie. 15 (10): 615–625. doi:10.1038 / s41585-018-0055-4. ISSN 1759-4820. PMID 29991725. S2CID 49670901.
- ^ Salles G, Barrett M, Foà R, Maurer J, O'Brien S, Valente N a kol. (Říjen 2017). „Rituximab u hematologických malignit B-buněk: přehled 20leté klinické zkušenosti“. Pokroky v terapii. 34 (10): 2232–2273. doi:10.1007 / s12325-017-0612-x. PMC 5656728. PMID 28983798.
- ^ Hoos A (duben 2016). „Vývoj imunoonkologických léků - od CTLA4 po PD1 až po další generace“. Recenze přírody. Objev drog. 15 (4): 235–47. doi:10.1038 / nrd.2015.35. PMID 26965203. S2CID 54550859.
- ^ Pento JT (listopad 2017). „Monoklonální protilátky pro léčbu rakoviny“. Protinádorový výzkum. 37 (11): 5935–5939. doi:10.21873 / anticanres.12040. PMID 29061772.
- ^ van Seters M, van Beurden M, ten Kate FJ, Beckmann I, Ewing PC, Eijkemans MJ a kol. (Duben 2008). "Léčba vulvární intraepiteliální neoplazie topickým imikvimodem". The New England Journal of Medicine. 358 (14): 1465–73. doi:10.1056 / NEJMoa072685. PMID 18385498.
- ^ Buck HW, Guth KJ (říjen 2003). "Léčba vaginální intraepiteliální neoplázie (primárně nízkého stupně) imikvimodem 5% krém". Journal of Lower Genital Tract Disease. 7 (4): 290–3. doi:10.1097/00128360-200310000-00011. PMID 17051086. S2CID 44649376.
- ^ Järvinen R, Kaasinen E, Sankila A, Rintala E (srpen 2009). „Dlouhodobá účinnost udržovacího bacilu Calmette-Guérin versus udržovací instilační léčba mitomycinem C u často se opakujících nádorů TaT1 bez karcinomu in situ: analýza podskupiny prospektivní randomizované studie FinnBladder I s 20letým sledováním.“ Evropská urologie. 56 (2): 260–5. doi:10.1016 / j.eururo.2009.04.009. PMID 19395154.
- ^ Davidson HC, Leibowitz MS, Lopez-Albaitero A, Ferris RL (září 2009). "Imunoterapie pro rakovinu hlavy a krku". Orální onkologie. 45 (9): 747–51. doi:10.1016 / j.oraloncology.2009.02.009. PMID 19442565.
- ^ Dani T, Knobler R (leden 2009). „Extrakorporální fotoimunoterapie-fotoferéza“. Frontiers in Bioscience. 14 (14): 4769–77. doi:10.2741/3566. PMID 19273388.
- ^ Eggermont AM, Schadendorf D (červen 2009). „Melanom a imunoterapie“. Hematologické / onkologické kliniky Severní Ameriky. 23 (3): 547–64, ix – x. doi:10.1016 / j.hoc.2009.03.009. PMID 19464602.
- ^ Chuang CM, Monie A, Wu A, Hung CF (květen 2009). „Kombinace léčby apigeninem s terapeutickým očkováním proti HPV DNA generuje zvýšené terapeutické protinádorové účinky“. Journal of Biomedical Science. 16 (1): 49. doi:10.1186/1423-0127-16-49. PMC 2705346. PMID 19473507.
- ^ Pawlita M, Gissmann L (duben 2009). „[Recidivující respirační papilomatóza: indikace k očkování proti HPV?]“. Deutsche Medizinische Wochenschrift (v němčině). 134 Suppl 2: S100-2. doi:10.1055 / s-0029-1220219. PMID 19353471.
- ^ Kang N, Zhou J, Zhang T, Wang L, Lu F, Cui Y a kol. (Srpen 2009). "Adoptivní imunoterapie rakoviny plic imobilizovanými lidskými gammadeltovými T-buňkami s anti-TCRgammadelta v periferní krvi". Biologie a terapie rakoviny. 8 (16): 1540–9. doi:10,4161 / cbt. 8,16,8950. PMID 19471115.
- ^ Di Lorenzo G, Buonerba C, Kantoff PW (květen 2011). „Imunoterapie pro léčbu rakoviny prostaty“. Recenze přírody. Klinická onkologie. 8 (9): 551–61. doi:10.1038 / nrclinonc.2011.72. PMID 21606971. S2CID 5337484.
- ^ Sabado, Rachel L; Balan, Sreekumar; Bhardwaj, Nina (leden 2017). „Imunoterapie založená na dendritických buňkách“. Cell Research. 27 (1): 74–95. doi:10.1038 / cr.2016.157. ISSN 1001-0602. PMC 5223236. PMID 28025976.
- ^ A b C Rosenberg SA, Restifo NP, Yang JC, Morgan RA, Dudley ME (duben 2008). „Adoptivní přenos buněk: klinická cesta k účinné imunoterapii rakoviny“. Recenze přírody. Rakovina. 8 (4): 299–308. doi:10.1038 / nrc2355. PMC 2553205. PMID 18354418.
- ^ Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM a kol. (Říjen 2006). "Regrese rakoviny u pacientů po přenosu lymfocytů geneticky upravených". Věda. 314 (5796): 126–9. Bibcode:2006Sci ... 314..126M. doi:10.1126 / science.1129003. PMC 2267026. PMID 16946036.
- ^ Hunder NN, Wallen H, Cao J, Hendricks DW, Reilly JZ, Rodmyre R a kol. (Červen 2008). "Léčba metastatického melanomu autologními CD4 + T buňkami proti NY-ESO-1". The New England Journal of Medicine. 358 (25): 2698–703. doi:10.1056 / NEJMoa0800251. PMC 3277288. PMID 18565862.
- ^ „Program a řečníci sympozia 2008“. Cancer Research Institute. Archivovány od originál dne 15. 10. 2008.
- ^ Highfield R (18. června 2008). „Pacient s rakovinou se zotaví po injekci imunitních buněk“. The Telegraph. Archivovány od originál dne 12. září 2008. Citováno 22. prosince 2019.
- ^ Antony PA, Piccirillo CA, Akpinarli A, Finkelstein SE, Speiss PJ, Surman DR a kol. (Březen 2005). „Imunita CD8 + T buněk proti nádoru / vlastnímu antigenu je posílena pomocnými buňkami CD4 + T a bráněna přirozeně se vyskytujícími T regulačními buňkami“. Journal of Immunology. 174 (5): 2591–601. doi:10,4049 / jimmunol.174.5.2591. PMC 1403291. PMID 15728465.
- ^ Gattinoni L, Finkelstein SE, Klebanoff CA, Antony PA, Palmer DC, Spiess PJ a kol. (Říjen 2005). „Odstranění propadů homeostatických cytokinů lymfodeplecí zvyšuje účinnost adoptivně přenesených nádorově specifických CD8 + T buněk“. The Journal of Experimental Medicine. 202 (7): 907–12. doi:10.1084 / jem.20050732. PMC 1397916. PMID 16203864.
- ^ Dummer W, Niethammer AG, Baccala R, Lawson BR, Wagner N, Reisfeld RA, Theofilopoulos AN (červenec 2002). „Homeostatická proliferace T buněk vyvolává účinnou protinádorovou autoimunitu“. The Journal of Clinical Investigation. 110 (2): 185–92. doi:10,1172 / JCI15175. PMC 151053. PMID 12122110.
- ^ Dudley ME, Yang JC, Sherry R, Hughes MS, Royal R, Kammula U a kol. (Listopad 2008). „Adoptivní buněčná terapie u pacientů s metastatickým melanomem: hodnocení přípravných režimů intenzivní myeloablativní chemoradiace“. Journal of Clinical Oncology. 26 (32): 5233–9. doi:10.1200 / JCO.2008.16.5449. PMC 2652090. PMID 18809613.
- ^ Dudley ME, Wunderlich JR, Robbins PF, Yang JC, Hwu P, Schwartzentruber DJ a kol. (Říjen 2002). „Regrese rakoviny a autoimunita u pacientů po klonální repopulaci protinádorovými lymfocyty“. Věda. 298 (5594): 850–4. Bibcode:2002Sci ... 298..850D. doi:10.1126 / science.1076514. PMC 1764179. PMID 12242449.
- ^ Pilon-Thomas S, Kuhn L, Ellwanger S, Janssen W, Royster E, Marzban S a kol. (Říjen 2012). „Účinnost adoptivního buněčného přenosu lymfocytů infiltrujících nádor po indukci lymfopenie u metastatického melanomu“. Journal of Immunotherapy. 35 (8): 615–20. doi:10.1097 / CJI.0b013e31826e8f5f. PMC 4467830. PMID 22996367.
- ^ Andersen R, Borch TH, Draghi A, Gokuldass A, Rana MA, Pedersen M a kol. (Červenec 2018). „T buňky izolované od pacientů s melanomem rezistentním na inhibitor kontrolního bodu jsou funkční a mohou zprostředkovat regresi nádoru“. Annals of Oncology. 29 (7): 1575–1581. doi:10.1093 / annonc / mdy139. PMID 29688262.
- ^ Seidel, Judith A .; Otsuka, Atsushi; Kabashima, Kenji (2018-03-28). „Anti-PD-1 a Anti-CTLA-4 terapie u rakoviny: mechanismy účinku, účinnost a omezení“. Hranice v onkologii. 8: 86. doi:10.3389 / fonc.2018.00086. ISSN 2234-943X. PMC 5883082. PMID 29644214.
- ^ A b Haanen, John B. A. G .; Robert, Caroline (2015). „Imunitní inhibitory kontrolního bodu“. Imuno-onkologie. Pokrok ve výzkumu nádorů. 42: 55–66. doi:10.1159/000437178. ISBN 978-3-318-05589-4. PMID 26382943.
- ^ „Inhibitory imunitního kontrolního bodu - Národní onkologický institut“. www.cancer.gov. 2019-09-24. Citováno 2020-08-24.
- ^ Manjunath SR, Ramanan G, Dedeepiya VD, Terunuma H, Deng X, Baskar S a kol. (Leden 2012). „Autologní terapie na posílení imunity u recidivujícího karcinomu vaječníků s metastázami: kazuistika“. Kazuistiky v onkologii. 5 (1): 114–8. doi:10.1159/000337319. PMC 3364094. PMID 22666198.
- ^ Li Y, Zhang T, Ho C, Orange JS, Douglas SD, Ho WZ (prosinec 2004). "Buňky přirozeného zabíjení inhibují expresi viru hepatitidy C". Journal of Leukocyte Biology. 76 (6): 1171–9. doi:10.1189 / jlb.0604372. PMID 15339939.
- ^ Doskali M, Tanaka Y, Ohira M, Ishiyama K, Tashiro H, Chayama K, Ohdan H (březen 2011). „Možnost adoptivní imunoterapie buňkami CD3⁻CD56 + a CD3 + CD56 + pocházejícími z periferní krve k vyvolání aktivity antihepatocelulárního karcinomu a antihepatitidy C“. Journal of Immunotherapy. 34 (2): 129–38. doi:10.1097 / CJI.0b013e3182048c4e. PMID 21304407. S2CID 26385818.
- ^ Terunuma H, Deng X, Dewan Z, Fujimoto S, Yamamoto N (2008). „Potenciální role NK buněk při indukci imunitních odpovědí: důsledky pro imunoterapii založenou na NK buňkách pro rakovinu a virové infekce“. Mezinárodní recenze imunologie. 27 (3): 93–110. doi:10.1080/08830180801911743. PMID 18437601. S2CID 27557213.
- ^ Viz DM, Tilles JG (1996). „Léčba alfa-interferony u pacientů s chronickým únavovým syndromem“. Imunologická vyšetření. 25 (1–2): 153–64. doi:10.3109/08820139609059298. PMID 8675231.
- ^ Ojo-Amaize EA, Conley EJ, Peter JB (leden 1994). „Snížená aktivita přirozených zabijáckých buněk je spojena se závažností syndromu imunitní dysfunkce chronické únavy“. Klinické infekční nemoci. 18 Suppl 1: S157-9. doi:10.1093 / clinids / 18. Supplement_1.S157. PMID 8148445.
- ^ Kida K, Isozumi R, Ito M (prosinec 2000). „Zabití buněk infikovaných lidským virem Herpes 6 lymfocyty kultivovanými s interleukinem-2 nebo -12“. Pediatrics International. 42 (6): 631–6. doi:10.1046 / j.1442-200x.2000.01315.x. PMID 11192519.
- ^ Ospina-Quintero, Laura; Jaramillo, Julio C .; Tabares-Guevara, Jorge H .; Ramírez-Pineda, José R. (24. dubna 2020). „Reformulace malých molekul pro imunitní intervenci kardiovaskulárních chorob: Kombinace nízkých dávek vitaminu D / dexamethasonu podporuje produkci IL-10 a ateroprotekci u dyslipidemických myší“. Hranice v imunologii. 11: 743. doi:10,3389 / fimmu.2020.00743. PMC 7197409. PMID 32395119.
- ^ A b Rayner, Fiona; Isaacs, John D (01.12.2018). „Terapeutická tolerance u autoimunitních onemocnění“. Semináře o artritidě a revmatismu. 48 (3): 558–562. doi:10.1016 / j.semarthrit.2018.09.008. ISSN 0049-0172. PMID 30348449.
- ^ Rotrosen D, Matthews JB, Bluestone JA (červenec 2002). „Síť imunitní tolerance: nové paradigma pro vývoj terapií vyvolávajících toleranci“. The Journal of Allergy and Clinical Immunology. 110 (1): 17–23. doi:10.1067 / mai.2002.124258. PMID 12110811. S2CID 30884739.
- ^ Stolp, Jessica; Zaitsu, Masaaki; Wood, Kathryn J. (2019), Boyd, Ashleigh S. (ed.), „Imunitní tolerance a odmítnutí při transplantaci orgánů“, Imunologická tolerance, New York, NY: Springer New York, 1899, str. 159–180, doi:10.1007/978-1-4939-8938-6_12, ISBN 978-1-4939-8936-2, PMID 30649772
- ^ McMurchy, Alicia N .; Bushell, Andrew; Levings, Megan K .; Wood, Kathryn J. (01.08.2011). „Přechod k toleranci: Klinická aplikace T regulačních buněk“. Semináře z imunologie. Pokroky v transplantaci. 23 (4): 304–313. doi:10.1016 / j.smim.2011.04.001. ISSN 1044-5323. PMC 3836227. PMID 21620722.
- ^ Baker, Kenneth F; Isaacs, John D (březen 2014). „Vyhlídky na terapeutickou toleranci u lidí“. Aktuální názor na revmatologii. 26 (2): 219–227. doi:10.1097 / BOR.0000000000000029. ISSN 1040-8711. PMC 4640179. PMID 24378931.
- ^ Cooles, Faye A. H .; Isaacs, John D. (01.08.2010). „Léčba obnovením tolerance u zánětlivé artritidy - poučení z jiných nemocí“. Osvědčené postupy a výzkum Klinická revmatologie. Farmakoterapie: koncepty patogeneze a objevující se léčby. 24 (4): 497–511. doi:10.1016 / j.berh.2010.01.007. ISSN 1521-6942. PMID 20732648.
- ^ Durham SR, Walker SM, Varga EM, Jacobson MR, O'Brien F, Noble W a kol. (Srpen 1999). „Dlouhodobá klinická účinnost imunoterapie pylem trávy“. The New England Journal of Medicine. 341 (7): 468–75. doi:10.1056 / NEJM199908123410702. PMID 10441602. S2CID 14629112.
- ^ Jones, Stacie M .; Burks, A. Wesley; Dupont, Christophe (2014-02-01). „Nejmodernější imunoterapie potravinovými alergeny: orální, sublingvální a epikutánní“. Journal of Allergy and Clinical Immunology. 133 (2): 318–323. doi:10.1016 / j.jaci.2013.12.1040. ISSN 0091-6749. PMID 24636471.
- ^ MacGinnitie, Andrew J .; Rachid, Rima; Gragg, Hana; Malá, Sara V .; Lakin, Paul; Cianferoni, Antonella; Heimall, Jennifer; Makhija, Melanie; Robison, Rachel; Chinthrajah, R. Sharon; Lee, John (01.03.2017). „Omalizumab umožňuje rychlou orální desenzibilizaci při alergii na arašídy“. Journal of Allergy and Clinical Immunology. 139 (3): 873–881.e8. doi:10.1016 / j.jaci.2016.08.010. ISSN 0091-6749. PMC 5369605. PMID 27609658. S2CID 3626708.
- ^ „Výsledky hledání klinických studií - Lékařská fakulta Stanfordské univerzity“. med.stanford.edu. Citováno 2016-04-03.
- ^ Ring, J .; Gutermuth, J. (2011). „100 let hyposenzibilizace: historie alergenově specifické imunoterapie (ASIT)“. Alergie. 66 (6): 713–724. doi:10.1111 / j.1398-9995.2010.02541.x. ISSN 1398-9995. PMID 21320133. S2CID 19390006.
- ^ Correale J, Farez M (únor 2007). „Sdružení mezi infekcí parazity a imunitními odpověďmi u roztroušené sklerózy“. Annals of Neurology. 61 (2): 97–108. doi:10.1002 / ana.21067. PMID 17230481. S2CID 1033417.
- ^ Croese J, O'neil J, Masson J, Cooke S, Melrose W, Pritchard D, Speare R (leden 2006). „Doklad o koncepční studii zakládající Necator americanus u pacientů s Crohnovou chorobou a dárců rezervoáru“. Střevo. 55 (1): 136–7. doi:10.1136 / gut.2005.079129. PMC 1856386. PMID 16344586.
- ^ Reddy A, Fried B (leden 2009). „Aktualizace o používání helmintů k léčbě Crohnovy a jiné autoimunitní nemoci“. Parazitologický výzkum. 104 (2): 217–21. doi:10.1007 / s00436-008-1297-5. PMID 19050918. S2CID 19279688.
- ^ Laclotte C, Oussalah A, Rey P, Bensenane M, Pluvinage N, Chevaux JB a kol. (Prosinec 2008). "[Helminths a zánětlivá onemocnění střev]". Gastroenterologie Clinique et Biologique (francouzsky). 32 (12): 1064–74. doi:10.1016 / j.gcb.2008.04.030. PMID 18619749.
- ^ Zaccone P, Fehervari Z, Phillips JM, Dunne DW, Cooke A (říjen 2006). „Parazitární červi a zánětlivá onemocnění“. Imunologie parazitů. 28 (10): 515–23. doi:10.1111 / j.1365-3024.2006.00879.x. PMC 1618732. PMID 16965287.
- ^ A b Brooker S, Bethony J, Hotez PJ (2004). Infekce lidských měchovců v 21. století. Pokroky v parazitologii. 58. 197–288. doi:10.1016 / S0065-308X (04) 58004-1. ISBN 9780120317585. PMC 2268732. PMID 15603764.
- ^ Fujiwara RT, Cançado GG, Freitas PA, Santiago HC, Massara CL, Dos Santos Carvalho O a kol. (2009). Yazdanbakhsh M (ed.). „Infekce Necator americanus: možná příčina změněné diferenciace dendritických buněk a profilu eosinofilů u chronicky infikovaných jedinců“. PLOS opomíjené tropické nemoci. 3 (3): e399. doi:10.1371 / journal.pntd.0000399. PMC 2654967. PMID 19308259.
- ^ Carvalho L, Sun J, Kane C, Marshall F, Krawczyk C, Pearce EJ (leden 2009). „Recenze série o hlístech, imunitní modulaci a hygienické hypotéze: mechanismy, které jsou základem hlístové modulace funkce dendritických buněk“. Imunologie. 126 (1): 28–34. doi:10.1111 / j.1365-2567.2008.03008.x. PMC 2632707. PMID 19120496.
- ^ Fumagalli M, Pozzoli U, Cagliani R, Comi GP, Riva S, Clerici M a kol. (Červen 2009). „Paraziti představují hlavní selektivní sílu pro interleukinové geny a formují genetickou predispozici k autoimunitním podmínkám“. The Journal of Experimental Medicine. 206 (6): 1395–408. doi:10.1084 / jem.20082779. PMC 2715056. PMID 19468064.
- ^ Hong CH, Tang MR, Hsu SH, Yang CH, Tseng CS, Ko YC a kol. (Září 2019). „Zvýšená časná imunitní odpověď leptospirového proteinu vnější membrány LipL32 stimulovaná úzkopásmovou střední infračervenou expozicí“. Journal of Photochemistry and Photobiology. B, biologie. 198: 111560. doi:10.1016 / j.jphotobiol.2019.111560. PMID 31336216.
- ^ Chang HY, Li MH, Huang TC, Hsu CL, Tsai SR, Lee SC a kol. (Únor 2015). „Kvantitativní proteomika odhaluje sítě narušené středním infračerveným zářením v buňkách rakoviny prsu“. Journal of Proteome Research. 14 (2): 1250–62. doi:10.1021 / pr5011873. PMID 25556991.
- ^ Nagaya T, Okuyama S, Ogata F, Maruoka Y, Choyke PL, Kobayashi H (květen 2019). „Blízká infračervená fotoimunoterapie využívající difuzér z optických vláken k léčbě šíření rakoviny peritoneálního žaludku“. Rakovina žaludku. 22 (3): 463–472. doi:10.1007 / s10120-018-0871-5. PMC 7400986. PMID 30171392.
- ^ Mitsunaga M, Ogawa M, Kosaka N, Rosenblum LT, Choyke PL, Kobayashi H (listopad 2011). „Nádorové buňky selektivní in vivo v blízkosti infračervené fotoimunoterapie zaměřené na specifické membránové molekuly“. Přírodní medicína. 17 (12): 1685–91. doi:10,1038 / nm.2554. PMC 3233641. PMID 22057348.
- ^ Sato K, Sato N, Xu B, Nakamura Y, Nagaya T, Choyke PL a kol. (Srpen 2016). „Prostorově selektivní vyčerpání regulačních T buněk asociovaných s nádorem pomocí fotoimunoterapie v blízké infračervené oblasti“. Science Translational Medicine. 8 (352): 352ra110. doi:10.1126 / scitranslmed.aaf6843. PMID 27535621.
- ^ Nagaya T, Nakamura Y, Sato K, Harada T, Choyke PL, Kobayashi H (červen 2016). „Vylepšená mikro-distribuce konjugátů protilátka-foton absorbér po úvodní fotoimunoterapii blízké infračervené oblasti (NIR-PIT)“. Journal of Controlled Release. 232: 1–8. doi:10.1016 / j.jconrel.2016.04.003. PMC 4893891. PMID 27059723.
- ^ Zhen Z, Tang W, Wang M, Zhou S, Wang H, Wu Z a kol. (Únor 2017). "Protein Nanocage zprostředkovaná fibroblastová aktivace proteinem cílenou fotoimunoterapií ke zvýšení cytotoxické infiltrace T buněk a kontrole nádoru". Nano dopisy. 17 (2): 862–869. Bibcode:2017NanoL..17..862Z. doi:10,1021 / acs.nanolett.6b04150. PMID 28027646.
