CAMK - CAMK
| Ca.2+/ proteodináza závislá na kalmodulinu | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| EC číslo | 2.7.11.17 | ||||||||
| Číslo CAS | 97350-82-8 | ||||||||
| Databáze | |||||||||
| IntEnz | IntEnz pohled | ||||||||
| BRENDA | Vstup BRENDA | ||||||||
| EXPASY | Pohled NiceZyme | ||||||||
| KEGG | Vstup KEGG | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktur | RCSB PDB PDBe PDBsum | ||||||||
| Genová ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
CAMK, také psáno jako CaMK, je zkratka pro Ca.2+/ proteodináza závislá na kalmodulinu třída enzymů. CAMK se aktivují zvýšením koncentrace intracelulárních iontů vápníku (Ca2+) a klimodulin. Po aktivaci enzymy přenášejí fosfáty ATP definováno serin nebo threonin zbytky v jiných proteinech, tak jsou serin / threonin-specifické proteinové kinázy. Aktivovaný CAMK je zapojen do fosforylace transkripčních faktorů, a proto v regulaci exprese reagujících genů. CAMK také pracuje na regulaci buněčného životního cyklu (tj. Programované buněčné smrti), přeskupení buněčné cytoskeletální sítě a mechanismů zapojených do učení a paměti organismu.[1]
Typy proteinů CAM kinázy
Existují 2 běžné typy proteinů CAM kinázy: specializované a multifunkční CAM kinázy.
- CAM kinázy specifické pro substrát mají pouze jeden cíl, který mohou fosforylovat, jako jsou kinázy myosinového lehkého řetězce.[1] Tato skupina proteinů zahrnuje CAMK III. Více na CAMKIII naleznete po tomto odkazu.
- Multifunkční CAM kinázy mají více cílů, které mohou fosforylovat, a nacházejí se v procesech včetně sekrece neurotransmiterů, metabolismu glykogenu a regulace různých transkripčních faktorů.[1] CAMK II je hlavní protein v této podskupině. Více na CAMKII naleznete po tomto odkazu.
Jak CAMK fosforyluje CAM proteiny

Jakmile koncentrace vápníku v buňce vzrostou, CAM kinázy se nasytí a váží maximálně čtyři molekuly vápníku.[1] Tato saturace vápníkem aktivuje kinázu a umožňuje jí podstoupit konformační změnu, která umožňuje kináze vázat se na své fosforylační cílové místo. CAMK odstraňuje fosfátovou skupinu z ATP, nejčastěji pomocí Mg2+ iont a přidá jej do CAM proteinu, čímž se stane aktivním.[2] CAM kináza obsahuje vysoce koncentrovanou glycinovou smyčku, kde je gama fosfát z donorové molekuly ATP snadno schopen vázat se na enzym, který pak využívá iont kovu k usnadnění hladkého přenosu fosfátu do cílového proteinu.[3][4] Tento přenos fosfátů poté aktivuje cíl kinázy a dokončí fosforylační cyklus.
Obrázek 1 ukazuje, jak přítomnost vápníku nebo kalmodulinu umožňuje aktivaci CAM kináz (CAMK II).
Struktury proteinů CAMK
Všechny kinázy mají společnou strukturu katalytického jádra včetně vazebného místa pro ATP spolu s větším vazebným místem pro substrát.[5] Katalytické jádro je obvykle složeno z β-řetězců s vazebným místem pro substrát složeným z a-šroubovic.[6] Většina všech CAM kináz zahrnuje řadu domén, včetně: katalytické domény, regulační domény, asociační domény a domény vázající vápník / kalmodulin.[7]
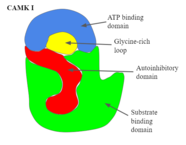
CAMK I, jak je znázorněno na obrázku 2, má dvojitou lalokovou strukturu, sestávající z katalytické domény vázající substrát a autoinhibiční domény.[1] Aby se autoinhibiční doména stala funkční, musí způsobit přizpůsobení proteinu takovým způsobem, že tato doména zcela blokuje substrátovou doménu v přijímání nových cílů. Obrázek 2 podrobně ukazuje strukturu a domény CAMK I.
CAMK II má řadu různých forem, přičemž CAMK 2A je nejběžnější, jak je znázorněno na obrázku 3. CAMK 2A má kruhovitou krystalickou strukturu složenou z menších funkčních skupin. Tyto skupiny umožňují fosforylaci cílů závislou na CaM, ale také umožňují, aby se struktura autofosforylovala sama a stala se nezávislou na CaM,[8] jak je vidět na obrázku 1. To znamená, že jakmile je protein CAMK 2A zpočátku aktivován vápníkem nebo kalmodulinem, může se zase dále aktivovat sám, takže se nestane neaktivní, i když je bez vápníku nebo kalmodulinu.

Členové rodiny CAMK
Mezi členy třídy enzymů CAMK patří mimo jiné:
- CAMKI
- CAMKII
- CAMKIII
- KAMKIV
- CAMKV CaM kináza spojená s vezikulem
- SCAMK
- Ca2 + / kalmodulin-dependentní protein kináza kináza
Pseudokinázy
Pseudokinázy jsou pseudoenzymy, proteiny, které strukturně připomínají enzymy, ale postrádají katalytickou aktivitu.
Některé z těchto pseudokináz, které souvisejí s rodinou CAMK, zahrnují:
Reference
- ^ A b C d E F Swulius, M. T .; Waxham, M. N. (září 2008). „Proteinové kinázy závislé na Ca2 + / kalmodulinu“. Buněčné a molekulární biologické vědy. 65 (17): 2637–2657. doi:10.1007 / s00018-008-8086-2. ISSN 1420-682X. PMC 3617042. PMID 18463790.
- ^ Adams JA. Kinetické a katalytické mechanismy proteinových kináz. Chem Rev. 2001; 101: 2271–2290.
- ^ Aimes RT, Hemmer W, Taylor SS. Serin-53 na špičce smyčky bohaté na glycin cAMP-dependentní protein kinázy: role v katalýze, specificita P-místa a interakce s inhibitory. Biochemie. 2000; 39: 8325–8332.
- ^ Hemmer W, McGlone M, Tsigelny I, Taylor SS. Role glycinové triády v ATP-vazebném místě cAMP-dependentní protein kinázy. J Biol Chem. 1997; 272: 16946–16954.
- ^ Hanks, Steven K (2003). „Genomická analýza nadrodiny eukaryotických proteinových kináz: perspektiva“. Genome Biology. 4 (5): 111. doi:10.1186 / gb-2003-4-5-111. PMC 156577. PMID 12734000.
- ^ Taylor, S.S .; Yang, J .; Wu, J .; Haste, N.M .; Radzio-Andzelm, E .; Anand, G. (březen 2004). „PKA: portrét dynamiky proteinových kináz“. Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1697 (1–2): 259–269. doi:10.1016 / j.bbapap.2003.11.029. ISSN 1570-9639. PMID 15023366.
- ^ Hudmon, Andy; Schulman, Howard (01.06.2002). „Neuronální Ca2 + / kalmodulin-dependentní protein kináza II: Role struktury a autoregulace v buněčné funkci“. Roční přehled biochemie. 71 (1): 473–510. doi:10.1146 / annurev.biochem.71.110601.135410. ISSN 0066-4154. PMID 12045104.
- ^ „CAMK2A vápník / kalmodulin závislá na proteinkináze II alfa [Homo sapiens (člověk)] - gen - NCBI“. www.ncbi.nlm.nih.gov. Citováno 2020-03-20.
