Syndrom necitlivosti na androgen - Androgen insensitivity syndrome
| Syndrom necitlivosti na androgen | |
|---|---|
 | |
| Výsledkem AIS je funkce androgenní receptor (AR) je narušena. Protein AR (na obrázku) zprostředkovává účinky androgenů v lidském těle. | |
| Specialita | Endokrinologie |
Syndrom necitlivosti na androgen (AIS) je intersex stav vyskytující se u 1: 20 000 jedinců až 1: 64 000, vedoucí k částečné nebo úplné neschopnosti buňka reagovat androgeny.[1]Nereagování buňky na přítomnost androgenních hormonů může narušit nebo zabránit maskulinizace mužských pohlavních orgánů u vyvíjejícího se plodu a také u zhoršování nebo prevenci vývoje u mužů sekundární sexuální charakteristiky na puberta, ale významně nezhoršuje ženský pohlavní nebo sexuální vývoj.[2][3] Necitlivost na androgeny jako taková je klinicky významná pouze tehdy, když se vyskytuje u genetických mužů (tj. Jedinců s a Y-chromozom, nebo konkrétněji an Gen SRY ).[4] Klinický fenotypy u těchto jedinců se pohybuje od typické mužský habitus s mírným spermatogenní vada nebo snížená sekundární terminální vlasy, do plna ženský habitus, navzdory přítomnosti Y-chromozomu.[5]
AIS je rozdělen do tří kategorií, které se liší stupněm genitální maskulinizace: syndrom úplné necitlivosti na androgen (CAIS) je indikován, když jsou vnější genitálie typickými ženami; mírný syndrom necitlivosti na androgen (MAIS) je indikován, když jsou vnější genitálie typického muže, a syndrom částečné androgenní necitlivosti (PAIS) je indikován, když jsou vnější genitálie částečně, ale nikoli úplně maskulinizovány.[6][7] Syndrom necitlivosti na androgen je největší samostatná entita, která vede k 46, XY undermasculinized genitalia.[8]
Správa AIS je v současné době omezena na symptomatická léčba; v současné době není k dispozici žádná metoda pro korekci nefunkčních proteinů androgenových receptorů produkovaných AR genové mutace. Mezi oblasti řízení patří přiřazení pohlaví, genitoplastika, gonadektomie ve vztahu k nádor riziko, hormonální substituční terapie, genetické poradenství, a psychologické poradenství.
Genetika

Člověk androgenní receptor (AR) je protein kódovaný a gen nachází se na proximální dlouhé rameno z X chromozom (místo Xq11-Xq12).[9] The oblast kódující protein se skládá z přibližně 2 757 nukleotidy (919 kodony ) trvající osm exony, označené 1-8 nebo A-H.[4][2] Introny se liší velikostí mezi 0,7 a 26 kb.[2] Stejně jako ostatní jaderné receptory se i AR protein skládá z několika funkční domény: transaktivace doména (nazývaná také transkripční regulační doména nebo amino / Terminál NH2 doména), Doména vázající DNA, pantová oblast a doména vázající steroidy (nazývaná také karboxylový terminál vazba ligandu doména).[4][10][2][11] Transaktivační doména je kódována exonem 1 a tvoří více než polovinu AR proteinu.[2] Exony 2 a 3 kódují doménu vázající DNA, zatímco 5' část exonu 4 kóduje oblast závěsu.[2] Zbytek exonů 4 až 8 kóduje doménu vázající ligand.[2]
Délky trinukleotidových satelitů a transkripční aktivita AR
Gen AR obsahuje dva polymorfní trinukleotid mikrosatelity v exonu 1.[10] První mikrosatelit (nejbližší k 5' konec) obsahuje 8 [12] až 60 [13][14] opakování glutamin kodon "CAG" a je tedy znám jako polyglutaminový trakt.[2] Druhý mikrosatelit obsahuje 4 [15] do 31 [16] opakování glycin kodon "GGC" a je známý jako polyglycinový trakt.[17] Průměrný počet opakování se liší podle etnického původu, přičemž běloši vykazují průměrně 21 opakování CAG a černoši 18.[18] U mužů jsou chorobné stavy spojeny s extrémy v délce polyglutaminového traktu; rakovina prostaty,[19] hepatocelulární karcinom,[20] a mentální postižení [12] jsou spojeny s příliš malým počtem opakování spinální a bulbární svalová atrofie (SBMA) je spojen s délkou opakování CAG 40 nebo více.[21] Některé studie naznačují, že délka polyglutaminového traktu je nepřímo úměrná transkripční aktivita v AR proteinu, a s tím mohou být spojeny delší polyglutaminové trakty mužská neplodnost [22][23][24] a undermasculinized genitalia u mužů.[25] Jiné studie však ukázaly, že taková korelace neexistuje.[26][27][28][29][30][31] Komplexní metaanalýza subjektu zveřejněného v roce 2007 podporuje existenci korelace a dospěl k závěru, že tyto nesrovnalosti lze vyřešit, když velikost vzorku a design studie jsou brány v úvahu.[32] Některé studie naznačují, že delší délky polyglycinového traktu jsou také spojeny s defekty maskulinizace genitálií u mužů.[33][34] Jiné studie takové spojení nenacházejí.[35]
AR mutace
Od roku 2010 více než 400 AR mutace byly hlášeny v AR databáze mutací a počet stále roste.[10] Dědictví je obvykle mateřská a následuje X-vázaný recesivní vzor;[4][36] jednotlivci s a 46, XY karyotyp vždy exprimují mutantní gen, protože mají pouze jeden X chromozom, zatímco 46, XX dopravců je ovlivněno minimálně. Asi 30% času, AR mutace je spontánní výsledek a není zděděna.[37] Takový de novo mutace jsou výsledkem a zárodečná buňka mutace nebo mozaika zárodečných buněk v pohlavní žlázy jednoho z rodičů nebo mutace v oplodněné vajíčko sám.[38] V jedné studii[39] tři z osmi de novo mutace se vyskytly v postzygotické fázi, což vedlo k odhadu až jedné třetiny de novo mutace vedou k somatickému mozaicismu.[4] Ne každá mutace AR gen vede k androgenní necitlivosti; jedna konkrétní mutace se vyskytuje u 8 až 14% genetičtí muži,[40][41][42][43] a předpokládá se, že nepříznivě ovlivňuje pouze malý počet jedinců, pokud jsou přítomny další genetické faktory.[44]
Jiné příčiny
Někteří jedinci s CAIS nebo PAIS žádné nemají AR mutace navzdory klinickým, hormonálním a histologické funkce dostatečné k zajištění diagnózy AIS; až 5% žen s CAIS nemá AR mutace,[10] stejně jako mezi 27[45][46] a 72%[47] jednotlivců s PAIS.
U jednoho pacienta byla základní příčinou předpokládaného PAIS mutant steroidogenní faktor-1 (SF-1) protein.[48] U jiného pacienta byl CAIS výsledkem deficitu přenosu a transaktivující signál z N-terminál oblast androgenního receptoru k bazální transkripční aparát buňky.[49] A koaktivátor protein interagující s aktivační funkce 1 (AF-1) transaktivace doména androgenového receptoru mohla mít u tohoto pacienta deficit.[49] Poruchu signálu nebylo možné napravit suplementací žádnými v té době známými koaktivátory, ani nebyl charakterizován nepřítomný protein koaktivátoru, což ponechalo některé v oboru nepřesvědčené, že mutantní koaktivátor vysvětlí mechanismus rezistence na androgen u pacientů s CAIS nebo PAIS s typický AR gen.[4]
XY karyotyp
V závislosti na mutaci může mít osoba s karyotypem 46, XY a AIS buď mužský (MAIS) nebo ženský (CAIS) fenotyp,[50] nebo mohou mít genitálie, které jsou pouze částečně maskulinizované (PAIS).[51] Gonády jsou varlata bez ohledu na fenotyp kvůli vlivu chromozomu Y.[52][53] Žena 46, XY tedy nemá vaječníky ani a děloha,[54] a nemůže přispět ani vejce k početí ani otěhotnět dítě.
Bylo publikováno několik případových studií plodných 46 XY mužů s AIS,[3][55][56][57][58] ačkoli tato skupina je považována za menšinu.[11] Navíc někteří neplodní muži s MAIS byli schopni počat děti po zvýšení jejich počet spermií prostřednictvím použití doplňkových testosteron.[4][59] Genetický samec počatý mužem s AIS by nedostal otcovo X chromozom, tedy ani jeden zdědit ani nést gen pro syndrom. Genetická žena koncipovaná takovým způsobem by dostala otcův chromozom X, a tak by se stala dopravce.
XX karyotyp
Genetické ženy (46, XX karyotyp) mají dva chromozomy X, tedy dva AR geny. Mutace v jednom (ale ne v obou) vede k minimálně ovlivněnému, plodnému, ženskému nosiči. U některých nosičů bylo zjištěno, že mají mírně zmenšené ochlupení, zpožděnou pubertu a / nebo vysoký vzrůst, pravděpodobně kvůli šikmé X-inaktivaci.[2][3] Ženský dopravce projde postiženým AR gen pro své děti 50% času. Pokud je postiženým dítětem genetická žena, bude také nositelkou. Dotčené 46 XY dítě bude mít AIS.
Genetická žena s mutacemi v obou AR geny mohou teoreticky vyplývat ze spojení plodného muže s AIS a ženskou nositelkou genu nebo z de novo mutace. Vzhledem k nedostatku plodných mužů AIS a nízkým výskyt z AR mutace, šance na tento výskyt jsou malé. The fenotyp takového jednotlivce je otázkou spekulace; od roku 2010 nebyl takový dokumentovaný případ zveřejněn.
Korelace genotypu a fenotypu
Jedinci s částečným AIS, na rozdíl od jedinců s úplnou nebo mírnou formou, přítomní při narození s nejednoznačné genitálie a rozhodnutí vychovávat dítě jako muže nebo ženu často není zřejmé.[4][38][60] Bohužel málo informací o fenotyp lze získat z přesných znalostí AR samotná mutace; stejný AR mutace může způsobit významné rozdíly ve stupni maskulinizace u různých jedinců, dokonce iu členů stejné rodiny.[4][36][51][61][62][63][64][65][66][67] Přesně to, co tuto variantu způsobuje, není zcela objasněno, ačkoli faktory, které k ní přispívají, by mohly zahrnovat délku polyglutamin a polyglycin plochy,[68] citlivost a odchylky v nitroděložní endokrinní prostředí,[51] účinek regulační proteiny aktivní v Sertoliho buňky,[17][69] somatický mozaismus,[4] výraz 5RD2 gen v genitální kůži fibroblasty,[61] snížena AR transkripce a překlad z jiných faktorů než mutací v oblasti kódující AR,[70] neidentifikovaný koaktivátor protein,[49] enzymové nedostatky jako např Nedostatek 21-hydroxylázy,[3] nebo jiné genetické variace, jako je mutant steroidogenní faktor-1 protein.[48] Stupeň variace se však nejeví jako konstantní napříč všemi AR mutace a v některých je mnohem extrémnější.[4][3][44][51] Missense mutace o kterých je výsledkem substituce jedné aminokyseliny, je známo, že produkují nejvíce fenotypovou rozmanitost.[10]
Patofyziologie

Androgeny a androgenní receptor
The účinky že androgeny mít na lidském těle (virilizace maskulinizace, anabolismus atd.) nejsou vyvolávány samotnými androgeny, ale jsou spíše výsledkem androgenů vázaných na androgenní receptory; androgenový receptor zprostředkovává účinky androgenů v lidském těle.[72] Podobně samotný androgenový receptor je obecně v buňce neaktivní, dokud nedojde k vazbě androgenu.[2]
Následující série kroků ilustruje, jak androgeny a androgenní receptor spolupracují na produkci androgenních účinků:[4][10][2][11][14][73][74]
- Androgen vstupuje do buňky.
- Pouze některé orgány v těle, například pohlavní žlázy a nadledviny, produkují androgen testosteron.
- Testosteron se převádí na dihydrotestosteron, chemicky podobný androgen, v buňkách obsahujících enzym 5-alfa reduktáza.
- Oba androgeny uplatňují svůj vliv prostřednictvím vazby na androgenní receptor.
- Androgen se váže na androgenní receptor.
- Androgenní receptor je všudypřítomně exprimován v tkáních lidského těla.
- Před vazbou na androgen je vázán androgenový receptor proteiny tepelného šoku.
- Tyto proteiny tepelného šoku se uvolňují po vazbě na androgen.
- Vazba androgenu indukuje stabilizující, konformační změna androgenového receptoru.
- Dva zinkové prsty z Doména vázající DNA jsou vystaveny v důsledku této nové konformace.
- Předpokládá se, že stabilitě AR pomáhá typ II koregulátory, které modulují skládání bílkovin androgenní vazbu, nebo usnadnit interakci NH2 / karboxyl-terminál.
- Hormonem aktivovaný androgenní receptor je fosforylovaný.
- Fosforylace receptoru může nastat před vazbou na androgen, ačkoli přítomnost androgenu podporuje hyperfosforylaci.
- Biologické důsledky fosforylace receptoru nejsou známy.
- Hormonem aktivovaný androgenní receptor přemístí do jádra.
- Nukleocytoplazmatický transport je částečně usnadněn pomocí aminokyselina sekvence na AR volal signál jaderné lokalizace.
- Signál jaderné lokalizace AR je primárně kódován v pantové oblasti genu AR.
- Homodimerizace dojde.
- Dimerizace je zprostředkována druhým (nejblíže 3 'konci) zinkový prst.
- Vazba DNA na regulační androgenní reakční prvky dojde.
- Cílové geny obsahují (nebo jsou ohraničeny) transkripční enhancerové nukleotidové sekvence, které interagují s prvním zinkovým prstem.
- Tyto oblasti se nazývají androgenní reakční prvky.
- Koaktivátory jsou přijímáni AR.
- Předpokládá se, že koaktivátory typu I (tj. Koregulátory) ovlivňují transkripční aktivitu AR usnadněním obsazení DNA, remodelace chromatinu nebo nábor generála transkripční faktory spojený s RNA polymeráza II holokomplex.
- cílová genová transkripce následuje.
Tímto způsobem se androgeny vázaly na androgenní receptory regulovat výraz cílových genů, a tak produkují androgenní účinky.
Teoreticky mohou určité mutantní androgenní receptory fungovat bez androgenů; in vitro studie prokázaly, že mutantní protein androgenního receptoru může indukovat transkripci v nepřítomnosti androgenu, pokud je jeho vazebná doména pro steroidy odstraněna.[75][76] Naopak doména vázající steroidy může působit k potlačování AR transaktivace doména, možná kvůli AR neligandovaný konformace.[2]

Androgeny ve vývoji plodu
Lidská embrya vyvíjejí se obdobně prvních šest týdnů bez ohledu na genetické pohlaví (46, XX nebo 46, karyotyp XY); jediný způsob, jak zjistit rozdíl mezi embryi 46, XX nebo 46, XY během tohoto časového období, je hledat Barrova těla nebo chromozom Y.[78] Gonády začínají jako boule tkáně zvané genitální hřebeny na zadní straně břišní dutina poblíž středové čáry. Pátý týden, genitální hřebeny odlišit do vnějšího kůra a vnitřní dřeň a jsou voláni lhostejné pohlavní žlázy.[78] V šestém týdnu se lhostejné pohlavní žlázy začínají rozlišovat podle genetického pohlaví. Pokud je karyotyp 46, XY, vyvíjejí se varlata vlivem Y chromozom Je SRY gen.[52][53] Tento proces nevyžaduje přítomnost androgenu ani funkční androgenní receptor.[52][53]
Až do sedmého týdne vývoje bylo embryo lhostejné sexuální příslušenství kanály, které se skládají ze dvou párů kanálů: Müllerianovy kanály a Wolffianovy kanály.[78] Sertoliho buňky ve varlatech vylučují anti-Müllerian hormon kolem této doby potlačit vývoj Müllerian potrubí, a způsobit jejich degeneraci.[78] Bez tohoto anti-Müllerova hormonu se z Müllerianových kanálků vyvine ženské vnitřní genitálie (děloha, čípek, vejcovody, a horní vaginální hlaveň ).[78] Na rozdíl od Müllerianových kanálů se Wolffianovy kanály nebudou ve výchozím nastavení nadále rozvíjet.[79] V přítomnosti testosteronu a funkčních androgenních receptorů se z Wolffianových kanálků vyvine epididymidy, vasa deferentia, a semenné váčky.[78] Pokud varlata nedokážou vylučovat testosteron nebo androgenní receptory nefungují správně, Wolffianovy kanály degenerují.[80]
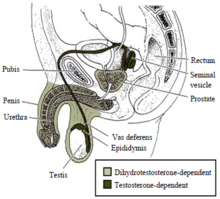
Maskulinizace mužské vnější genitálie (dále jen penis, penile močová trubice, a šourek ), stejně jako prostata, jsou závislé na androgenu dihydrotestosteron.[81][82][83][84] Testosteron se převádí na dihydrotestosteron pomocí enzymu 5-alfa reduktázy.[85] Pokud tento enzym chybí nebo je nedostatečný, nedochází k tvorbě dihydrotestosteronu a vnější mužské genitálie se nevyvíjejí správně.[81][82][83][84][85] Stejně jako v případě vnitřní mužské genitálie je potřebný funkční androgenní receptor pro dihydrotestosteron k regulaci transkripce cílových genů podílí se na vývoji.[72]
Patogeneze AIS
Mutace v genu pro androgenní receptor mohou způsobit problémy s jakýmkoli z kroků zapojených do androgenizace, od syntézy samotného proteinu androgenového receptoru, přes transkripční schopnost z dimerizovaný komplex androgen-AR.[2] AIS může být výsledkem, pokud je významně narušen i jeden z těchto kroků, protože každý krok je vyžadován pro androgeny k úspěšné aktivaci AR a regulovat genovou expresi.[2] Přesné kroky, které konkrétní mutace naruší, lze do určité míry předpovědět identifikováním oblasti AR, ve které mutace spočívá. Tato prediktivní schopnost má původ především retrospektivní; odlišný funkční domény genu AR byly objasněny analýzou účinků specifických mutací v různých oblastech AR.[2] Například je známo, že ovlivňují mutace v doméně vázající steroidy androgenní vazebná afinita nebo retence Je známo, že mutace v pantové oblasti ovlivňují jaderná translokace mutace v Doména vázající DNA je známo, že ovlivňují dimerizaci a vazbu na cílovou DNA a mutace v transaktivace Je známo, že doména ovlivňuje regulaci transkripce cílového genu.[2][79] Bohužel, i když je postižená funkční doména známa, předpovídá fenotypový důsledky konkrétní mutace (viz Korelace genotypu a fenotypu ) je obtížné.
Některé mutace mohou nepříznivě ovlivnit více než jednu funkční doménu. Například mutace v jedné funkční doméně může mít škodlivé účinky na jinou změnou způsobu interakce domén.[79] Jedna mutace může ovlivnit všechny po proudu funkční domény, pokud předčasný stop kodon nebo chyba rámování Výsledek; taková mutace může vyústit ve zcela nepoužitelný (nebo nesyntetizovatelný) protein androgenového receptoru.[2] Steroidní vazebná doména je obzvláště citlivá na účinky předčasného stop kodonu nebo chyby rámování, protože se vyskytuje na konci genu a její informace jsou tedy pravděpodobně zkráceny nebo nesprávně interpretovány než jiné funkční domény.[2]
Jiné, složitější vztahy byly pozorovány jako důsledek mutovaných AR; byly spojeny některé mutace spojené s mužskými fenotypy mužská rakovina prsu, rakovina prostaty, nebo v případě spinální a bulbární svalová atrofie nemoc nemoci centrální nervový systém.[86][19][87][88][89] Forma rakoviny prsu pozorovaná u některých mužů s PAIS je způsobena mutací v doméně AR vázající DNA.[87][89] Předpokládá se, že tato mutace způsobuje narušení interakce cílového genu AR, což jí umožňuje působit na určité další cíle, možná ve spojení s estrogenový receptor bílkoviny rakovinový růst.[2] The patogeneze spinální a bulbární svalové atrofie (SBMA) ukazuje, že i samotný mutantní protein AR může mít za následek patologie. The expanze trinukleotidů z polyglutaminový trakt genu AR, který je spojen s SBMA, vede k syntéze a špatně poskládané AR protein, který buňka nedokáže proteolyzovat a správně se rozptylovat.[90] Tyto špatně složené proteiny AR tvoří agregáty v buňce cytoplazma a jádro.[90] V průběhu 30 až 50 let se tyto agregáty hromadí a mají a cytotoxický efekt, který nakonec vyústí v neurodegenerativní příznaky spojené s SBMA.[90]
Diagnóza
Fenotypy, které jsou výsledkem necitlivosti na androgeny, nejsou pro AIS jedinečné, proto diagnóza AIS vyžaduje důkladné vyloučení jiných příčin.[8][63] Klinické nálezy svědčící pro AIS zahrnují přítomnost krátké pochvy [91] nebo podškrobené genitálie,[4][62][81] částečná nebo úplná regrese Müllerianových struktur,[92] bilaterální nondysplastic testy,[93] a narušený spermatogeneze a / nebo virilizace.[4][94][45][86] Laboratorní nálezy zahrnují 46, XY karyotyp[10] a typický nebo zvýšený postpubertální testosteron, luteinizační hormon, a estradiol úrovně.[10][8] Androgenní vazebná aktivita kůže genitálií fibroblasty je obvykle snížena,[2][95] i když byly hlášeny výjimky.[96] Může být narušena přeměna testosteronu na dihydrotestosteron.[2] Diagnóza AIS je potvrzena, pokud je androgenní receptor genové sekvenování odhaluje mutaci, i když ne všichni jedinci s AIS (zejména PAIS) budou mít AR mutace (viz Jiné příčiny ).[10][45][46][47]
Každý ze tří typů AIS (úplný, částečný a mírný) má jiný seznam diferenciální diagnózy zvážit.[4] V závislosti na formě podezření na AIS může seznam rozdílů obsahovat:[52][53][97][98][99]
- Chromozomální anomálie:
- Klinefelterův syndrom (47, XXY karyotyp)
- Turnerův syndrom (45, XO karyotyp)
- Smíšená gonadální dysgeneze (45, XO / 46, XY karyotyp)
- Tetragametický chimerismus (46, XX / 46, XY karyotyp)
- Androgen biosyntetický dysfunkce v 46, XY jednotlivců:
- Mutace receptoru luteinizačního hormonu (LH)
- Smith – Lemli – Opitzův syndrom (spojené s mentálním postižením)
- Lipoidní vrozená hyperplazie nadledvin
- Nedostatek 3β-hydroxysteroid dehydrogenázy 2
- Nedostatek 17α-hydroxylázy
- 17,20 nedostatek lyázy
- Nedostatek 17β-hydroxysteroid dehydrogenázy
- Nedostatek 5α-reduktázy
- Přebytek androgenu u 46, XX jedinců:
- Nedostatek 21-hydroxylázy
- Nedostatek 3β-hydroxysteroid dehydrogenázy 2
- Nedostatek oxidoreduktázy cytochromu P450 (porucha u matky způsobuje 46, XX fetil virilizaci)
- Nedostatek llp-hydroxylázy
- Nedostatek aromatázy
- Mutace glukokortikoidových receptorů
- Mateřský virilizující nádor (např. luteom )
- Zvýšená expozice androgenu in utero, jinak neurčená (např. androgenní léky )
- Vývojový
- Mayer – Rokitansky – Küster – Hauserův syndrom (46, XX karyotyp)
- Swyerův syndrom (46, XY karyotyp)
- XX gonadální dysgeneze (46, XX karyotyp)
- Leydigova buňka ageneze nebo hypoplázie, není uvedeno jinak (46, XY karyotyp)
- Syndrom nepřítomných (mizejících) varlat
- Ovotestikulární DSD
- Testikulární DSD (tj. 46, XX obrácení pohlaví )
- Teratogenní příčiny (např. estrogeny, antiestrogeny )
- Jiné příčiny:
- Frasierův syndrom (spojené s progresivní glomerulopatií)
- Denys – Drashův syndrom (spojené s nefropatií a Wilmsovým nádorem)
- WAGR syndrom (spojené s Wilmsovým nádorem a aniridiemi)
- McKusick – Kaufmanov syndrom (spojené s postaxiální polydaktylií)
- Robinowův syndrom (spojené s nanismem)
- Aarskog-Scottův syndrom (spojené s anomáliemi obličeje)
- Syndrom ruka-noha-genitálie (spojené s malformacemi končetin)
- Syndrom popliteálního pterygia (spojené s rozsáhlým popruhem za koleny)
- Kallmannův syndrom (často spojená s anosmií)
- Hypospadias není uvedeno jinak
- Kryptorchismus není uvedeno jinak
- vaginální atrézie není uvedeno jinak
Klasifikace
AIS je rozdělen do tří tříd podle fenotyp: syndrom úplné necitlivosti na androgen (CAIS), syndrom částečné necitlivosti na androgen (PAIS) a syndrom mírné androgenní necitlivosti (MAIS).[4][10][94][45][100][37][32][101][11] Pediatrický navrhl doplňkový systém fenotypového hodnocení, který používá sedm tříd místo tradičních tří endokrinolog Charmian A. Quigley a kol. v roce 1995.[2] Prvních šest stupňů stupnice, stupně 1 až 6, se liší stupněm genitální maskulinizace; stupeň 1 je indikován, když jsou vnější genitálie plně maskulinizovány, stupeň 6 je indikován, pokud jsou vnější genitálie plně feminizovány, a stupně 2 až 5 kvantifikují čtyři stupně klesající maskulinizace genitálií, které leží v mezidobí.[2] Stupeň 7 je k nerozeznání od stupně 6 do puberty a poté se rozlišuje podle přítomnosti sekundární terminální vlasy; stupeň 6 je indikován, pokud jsou přítomny sekundární koncové vlasy, zatímco stupeň 7 je indikován, pokud chybí.[2] The Quigleyova stupnice lze použít ve spojení s tradičními třemi třídami AIS k poskytnutí dalších informací o stupni maskulinizace genitálií a je zvláště užitečný, když je diagnóza PAIS.[10][102]
Kompletní AIS
Částečný AIS
Mírný AIS
Řízení
Správa AIS je v současné době omezena na symptomatická léčba; v současné době není k dispozici žádná metoda pro korekci nefunkčních proteinů androgenových receptorů produkovaných AR genové mutace. Mezi oblasti řízení patří přiřazení pohlaví, genitoplastika, gonadektomie ve vztahu k nádor riziko, hormonální substituční terapie, genetické poradenství, a psychologické poradenství.
CAIS
PAIS
MAIS
Epidemiologie
Odhady pro výskyt syndromu necitlivosti na androgen jsou založeny na relativně malém populace velikosti, a proto je známo, že jsou nepřesné.[4] Odhaduje se, že CAIS se vyskytuje u každého z 20 400 46 XY porodů.[103] Celostátní průzkum v Nizozemsku založený na pacientech s genetické potvrzení diagnózy odhaduje, že minimální výskyt CAIS je jeden z 99 000.[61] Výskyt PAIS se odhaduje na jeden ze 130 000.[104] Díky své jemné prezentaci není MAIS obvykle vyšetřován, s výjimkou případu mužská neplodnost,[81] jeho skutečná prevalence tedy není známa.[10]
Kontroverze
Preimplantační genetická diagnostika
Preimplantační genetická diagnostika (PGD nebo PIGD) označuje genetické profilování embryí před implantací (jako forma profilování embryí) a někdy i oocytů před oplodněním. Pokud se používá k screeningu specifické genetické sekvence, jeho hlavní výhodou je, že se vyhne selektivnímu ukončení těhotenství, protože metoda vysoce pravděpodobné, že vybrané embryo bude bez uvažovaného stavu. [105]
Ve Velké Británii se AIS objevuje na seznamu závažných genetických onemocnění, která mohou být vyšetřována pomocí PGD.[106] Někteří etici, lékaři a obhájci intersexu argumentovali tím, že screening embryí, aby konkrétně vyloučily intersexuální rysy, jsou založeny na sociálních a kulturních normách na rozdíl od lékařské nutnosti.[107][108][109][110][111][Citace je zapotřebí ]
Dějiny
Zaznamenané popisy účinků AIS sahají stovky let zpět, i když je důležité porozumět jeho základům histopatologie došlo až v padesátých letech minulého století.[4] The taxonomie a nomenklatura spojený s necitlivostí na androgeny prošel významným vývojem, který se vyrovnal tomuto porozumění.
Časová osa hlavních milníků
- 1950: Lawson Wilkins spravuje denně methyltestosteron na karyotyp | 46, XY pacientka, která nevykazuje žádné známky virilizace. Jeho experiment je první dokumentovanou demonstrací patofyziologie AIS.[63][112]
- 1970: Mary F. Lyon a Susan Hawkes uvedli, že gen na chromozomu X způsobil u myší úplnou necitlivost na androgeny.[113][114]
- 1981: Barbara Migeon et al. zúžil lokus lidského genu pro androgenní receptor (nebo faktor kontrolující gen pro androgenní receptor) na někde mezi Xq11 a Xq13.[115][116]
- 1988: Gen lidského androgenního receptoru je první naklonovaný a částečně analyzovány více stranami.[117][118] Terry Brown et al. uvedli první mutace, u nichž bylo prokázáno, že způsobují AIS.[10][116]
- 1989: Terry Brown et al. uvádí přesný lokus AR genu (Xq11-Xq12),[9] a Dennis Lubahn et al. zveřejnil svůj intron -exon hranice.[119]
- 1994: Byla vytvořena databáze mutací genů androgenních receptorů, aby poskytla komplexní seznam mutací publikovaných v lékařských časopisech a konferenčních sbornících.[120]
Časná terminologie
První popisy účinků AIS se v lékařské literatuře objevily jako individuální kazuistiky nebo jako součást komplexního popisu intersex tělesnosti. V roce 1839 skotský porodník pane James Young Simpson zveřejnil jeden takový popis[121] ve vyčerpávající studii intersexuality, která byla připočítána k prohloubení porozumění lékařské komunity tomuto předmětu.[122] Simpsonův systém taxonomie však nebyl zdaleka první; taxonomie nebo popisy pro klasifikaci intersexuality byly vyvinuty italským lékařem a fyzikem Fortuné Affaitati v roce 1549,[123][124] Francouzský chirurg Ambroise Paré v roce 1573,[122][125] Francouzský lékař a průkopník sexuologie Nicolas Venette v roce 1687 (pod pseudonymem Vénitien Salocini),[126][127] a francouzský zoolog Isidore Geoffroy Saint-Hilaire v roce 1832.[128] Všech pět těchto autorů používalo hovorový výraz „hermafrodit „jako základ jejich taxonomií, i když sám Simpson ve své publikaci zpochybnil vhodnost slova.[121] Používání slova „hermafrodit“ v lékařské literatuře přetrvávalo dodnes,[129][130] ačkoli jeho slušnost je stále pochybná. Nedávno byl navržen alternativní systém nomenklatury,[131] ale téma toho, které slovo nebo slova by měla být použita na jeho místo, je stále předmětem mnoha debat.[98][132][133][134][135]

Pseudohermafroditismus
"Pseudohermafroditismus „až donedávna[131] byl termín používaný v lékařské literatuře k popisu stavu jedince, jehož pohlavní žlázy a karyotyp se neshodují s vnějšími genitáliemi v pohlaví binární smysl. Například 46 jedinců s XY, kteří mají ženský fenotyp, ale místo vaječníků mají také varlata - skupina, která zahrnuje všechny jedince s CAIS i některé jedince s PAIS - je klasifikováno jako „mužský pseudohermafroditismus“, zatímco jedinci s jak vaječník, tak varle (nebo alespoň jeden ovotestis) jsou klasifikovány jakoskutečný hermafroditismus ".[130][131] Použití tohoto slova v lékařské literatuře antedatovalo objev chromozomu, takže jeho definice ne vždy zohledňovala karyotyp při určování pohlaví jedince. Předchozí definice „pseudohermafroditismu“ se opíraly o vnímané nesrovnalosti mezi vnitřními a vnějšími orgány; „pravé“ pohlaví jedince bylo určeno vnitřními orgány a vnější orgány určovaly „vnímané“ pohlaví jedince.[121][128]
Německo-švýcarský patolog Edwin Klebs je někdy známý pro použití slova "pseudohermaphroditism" v jeho taxonomii intersexualita v roce 1876,[137] ačkoli toto slovo zjevně není jeho vynálezem, jak se někdy uvádí; historie slova "pseudohermafrodit „a odpovídající touha oddělit se „opravdoví“ hermafroditi z „falešných“, „falešných“ nebo „pseudo“ hermafroditů sahá nejméně do roku 1709, kdy holandský anatom Frederik Ruysch použil ji v publikaci popisující subjekt se varlaty a převážně ženským fenotypem.[136] „Pseudohermafrodit“ se také objevil v Acta Eruditorum Později téhož roku při revizi Ruyschovy práce.[138] Některé důkazy také naznačují, že toto slovo už německá a francouzská lékařská komunita používala dlouho předtím, než jej Klebs použil; Němec fyziolog Johannes Peter Müller „publikaci z roku 1834 označil„ pseudohermafroditismus “s podtřídou hermafroditismu ze Saint-Hilaireovy taxonomie[139] a ve 40. letech 19. století se „pseudohermafroditismus“ objevil v několika francouzských a německých publikacích, včetně slovníků.[140][141][142][143]
Feminizace varlat
V roce 1953 americký gynekolog John Morris podal první úplný popis toho, co nazval „syndromem testikulární feminizace“, na základě 82 případů sestavených z lékařské literatury, včetně dvou jeho vlastních pacientů.[4][2][144] Termín „testikulární feminizace“ byl vytvořen, aby odrážel Morrisovo pozorování, že varlata u těchto pacientů produkovala hormon, který měl feminizující účinek na tělo, což je jev, o kterém se nyní chápe jako důsledek nečinnosti androgenů a aromatizace testosteronu na estrogen.[4] Několik let předtím, než Morris vydal svůj mezník, Lawson Wilkins ukázal experimentem, že nereagování cílové buňky na působení androgenních hormonů bylo příčinou „mužského pseudohermafroditismu“.[63][112] Wilkinsova práce, která jasně prokázala nedostatek terapeutického účinku, když 46, XY Pacienti byli léčeni androgeny, což způsobilo postupný posun v nomenklatuře od „testikulární feminizace“ k „androgenové rezistenci“.[81]
Ostatní jména
Mnoho různých prezentací AIS dostalo zřetelné jméno, jako je Reifensteinův syndrom (1947),[145] Goldberg-Maxwellův syndrom (1948),[146] Morrisův syndrom (1953),[144] Gilbert-Dreyfusův syndrom (1957),[147] Lubův syndrom (1959),[148] „neúplná testikulární feminizace“ (1963),[149] Syndrom růžové vody (1965),[150] a Aimanův syndrom (1979).[151] Protože nebylo pochopeno, že všechny tyto různé prezentace byly způsobeny stejnou sadou mutací v genu pro androgenní receptor, každé nové kombinaci symptomů bylo dáno jedinečné jméno, což vedlo ke komplikované stratifikaci zdánlivě nesourodých poruch.[63][152]
Za posledních 60 let se objevovaly zprávy o nápadně odlišných fenotypech dokonce iu členů stejné rodiny a stálý pokrok byl učiněn směrem k pochopení základních molekulárních patogeneze AIS bylo shledáno, že tyto poruchy jsou odlišnými fenotypovými expresemi jednoho syndromu způsobeného molekulárními defekty v genu pro androgenní receptor.[4][11][63][152]
AIS je nyní přijímanou terminologií pro syndromy vyplývající z nereagování cílové buňky na působení androgenních hormonů.[4] CAIS zahrnuje fenotypy dříve popsané „testikulární feminizací“, Morrisovým syndromem a Goldberg-Maxwellovým syndromem;[4][153] PAIS zahrnuje Reifensteinův syndrom, Gilbert-Dreyfusův syndrom, Lubův syndrom, „neúplnou testikulární feminizaci“ a Rosewaterův syndrom;[152][154][155] a MAIS zahrnuje Aimanův syndrom.[156]
Virilizovanější fenotypy AIS byly někdy popsány jako „syndrom undervirilizovaného muže“, „syndrom neplodného muže“, „syndrom undervirilizovaného plodného muže“ atd., Než se objevily důkazy, že tyto stavy byly způsobeny mutacemi AR gen.[57] Tyto diagnózy byly použity k popisu různých mírných defektů virilizace; výsledkem je, že PAIS lépe popisuje fenotypy některých mužů, kteří byli diagnostikováni jako takové (např. mikropenis, hypospadias, a nesestouplá varlata ), zatímco jiné lépe popisuje MAIS (např. izolovaná mužská neplodnost nebo gynekomastie).[4][57][58][155][157][158]
Společnost a kultura
Ve filmu Orchideje, moje intersexuální dobrodružství, Phoebe Hart a její sestra Bonnie Hart, obě ženy s CAIS, zdokumentovaly své zkoumání AIS a dalších intersexuálních problémů.[159]
Nahrávací umělkyně Dalea je hispánsko-americká aktivistka, která je veřejně informována o svém CAIS. Poskytla rozhovory o svém stavu[160][161] a založili společnost Girl Comet, neziskovou iniciativu zaměřenou na rozmanitost a inspiraci.[162]
V roce 2017 modelka Hanne Gaby Odiele odhalili, že se narodili se syndromem necitlivosti na intersexuální rys a androgenní necitlivost. Jako dítě podstoupili lékařské postupy týkající se jejího stavu,[163] které podle nich proběhly bez informovaného souhlasu jejich rodičů.[164] Bylo jim řečeno o jejich intersexuálním stavu týdny před zahájením jejich modelářské kariéry.[164]
V japonském hororovém románu z roku 1991 Prsten tím, že Koji Suzuki (později adaptovaný do japonských, korejských a amerických filmů), hlavní protivník Sadako má tento syndrom.[Citace je zapotřebí ]
v série 2, epizoda 13 ("Skin Deep") Televizní seriál Dům, hlavní pacient rakovinné varle je mylně považován za vaječník kvůli neobjevenému pacientovi CAIS.[Citace je zapotřebí ]
V sezóně 2 MTV série Předstírat, postava má CAIS. Postava Lauren Cooper, kterou hraje Bailey De Young, byla první intersexuální seriál pravidelný v americké televizi.[165][166]
v sezóna 8, epizoda 11 ("Delko pro obranu") Televizní seriál CSI: Miami, primární podezřelý má AIS, který ho zbaví znásilnění.[Citace je zapotřebí ]
V sérii 8, epizoda 5 z Zavolejte porodní asistentku, žena zjistí, že má AIS. Navštěvuje a cervikální stěr a vychovává, že nikdy neměla menstruaci, a je znepokojena tím, že bude mít děti, protože se bude vdávat. Poté je diagnostikován "syndrom testikulární feminizace", starý termín pro AIS.[167]
Viz také
Reference
- ^ Hughes IA, Deeb A (prosinec 2006). "Androgenní rezistence". Nejlepší praxe. Res. Clin. Endokrinol. Metab. 20 (4): 577–98. doi:10.1016 / j.beem.2006.11.003. PMID 17161333.Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A (2008). „Syndrom necitlivosti na androgen: klinické rysy a molekulární vady“. Hormony (Atény). 7 (3): 217–29. doi:10.14310 / horm.2002.1201. PMID 18694860.Quigley CA, De Bellis A, Marschke KB, el-Awady MK, Wilson EM, francouzský FS (červen 1995). "Defekty androgenového receptoru: historické, klinické a molekulární perspektivy". Endocr. Rev. 16 (3): 271–321. doi:10.1210 / edrv-16-3-271. PMID 7671849.
- ^ A b C d E F G h i j k l m n Ó str q r s t u proti w X y z aa Quigley CA, De Bellis A, Marschke KB, el-Awady MK, Wilson EM, francouzský FS (červen 1995). "Defekty androgenového receptoru: historické, klinické a molekulární perspektivy". Endocr. Rev. 16 (3): 271–321. doi:10.1210 / edrv-16-3-271. PMID 7671849.
- ^ A b C d E Giwercman YL, Nordenskjöld A, Ritzén EM, Nilsson KO, Ivarsson SA, Grandell U, Wedell A (červen 2002). „Mutace genu pro androgenní receptor (E653K) v rodině s vrozenou hyperplázií nadledvin způsobenou nedostatkem steroidů 21-hydroxylázy i částečnou necitlivostí na androgeny“. J. Clin. Endokrinol. Metab. 87 (6): 2623–8. doi:10.1210 / jc.87.6.2623. PMID 12050225.
- ^ A b C d E F G h i j k l m n Ó str q r s t u proti w X Hughes IA, Deeb A (prosinec 2006). "Androgenní rezistence". Nejlepší praxe. Res. Clin. Endokrinol. Metab. 20 (4): 577–98. doi:10.1016 / j.beem.2006.11.003. PMID 17161333.
- ^
- Hughes IA, Deeb A (prosinec 2006). "Androgenní rezistence". Nejlepší praxe. Res. Clin. Endokrinol. Metab. 20 (4): 577–98. doi:10.1016 / j.beem.2006.11.003. PMID 17161333.
- Zuccarello D, Ferlin A, Vinanzi C, Prana E, Garolla A, Callewaert L, Claessens F, Brinkmann AO, Foresta C (duben 2008). „Podrobné funkční studie mírných mutací androgenového receptoru prokazují jejich souvislost s mužskou neplodností“. Clin. Endokrinol. 68 (4): 580–8. doi:10.1111 / j.1365-2265.2007.03069.x. PMID 17970778. S2CID 2783902.
- Ferlin A, Vinanzi C, Garolla A, Selice R, Zuccarello D, Cazzadore C, Foresta C (listopad 2006). „Mužská neplodnost a mutace genu pro androgenní receptor: klinické rysy a identifikace sedmi nových mutací“. Clin. Endokrinol. 65 (5): 606–10. doi:10.1111 / j.1365-2265.2006.02635.x. PMID 17054461. S2CID 33713391.
- Stouffs K, Tournaye H, Liebaers I, Lissens W (2009). „Mužská neplodnost a postižení chromozomu X“. Hučení. Reprod. Aktualizace. 15 (6): 623–37. doi:10.1093 / humupd / dmp023. PMID 19515807.
- Giwercman YL, Nikoshkov A, Byström B, Pousette A, Arver S, Wedell A (červen 2001). „Nová mutace (N233K) v transaktivační doméně a mutace N756S v doméně vázající ligand genu pro androgenní receptor jsou spojeny s mužskou neplodností.“ Clin. Endokrinol. 54 (6): 827–34. doi:10.1046 / j.1365-2265.2001.01308.x. PMID 11422119. S2CID 23554058.
- Lund A, Juvonen V, Lähdetie J, Aittomäki K, Tapanainen JS, Savontaus ML (červen 2003). "Nová variabilita sekvence v doméně regulující transaktivaci androgenového receptoru u dvou neplodných finských mužů". Plod Sterilní. 79. Suppl 3: 1647–8. doi:10.1016 / s0015-0282 (03) 00256-5. PMID 12801573.
- ^
- Hughes IA, Deeb A (prosinec 2006). "Androgenní rezistence". Nejlepší praxe. Res. Clin. Endokrinol. Metab. 20 (4): 577–98. doi:10.1016 / j.beem.2006.11.003. PMID 17161333.
- Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A (2008). „Syndrom necitlivosti na androgen: klinické rysy a molekulární vady“. Hormony (Atény). 7 (3): 217–29. doi:10.14310 / horm.2002.1201. PMID 18694860.
- Zuccarello D, Ferlin A, Vinanzi C, Prana E, Garolla A, Callewaert L, Claessens F, Brinkmann AO, Foresta C (duben 2008). „Podrobné funkční studie mírných mutací androgenového receptoru prokazují jejich souvislost s mužskou neplodností“. Clin. Endokrinol. 68 (4): 580–8. doi:10.1111 / j.1365-2265.2007.03069.x. PMID 17970778. S2CID 2783902.
- Ferlin A, Vinanzi C, Garolla A, Selice R, Zuccarello D, Cazzadore C, Foresta C (listopad 2006). „Mužská neplodnost a mutace genu pro androgenní receptor: klinické rysy a identifikace sedmi nových mutací“. Clin. Endokrinol. 65 (5): 606–10. doi:10.1111 / j.1365-2265.2006.02635.x. PMID 17054461. S2CID 33713391.
- ^
- Stouffs K, Tournaye H, Liebaers I, Lissens W (2009). „Mužská neplodnost a postižení chromozomu X“. Hučení. Reprod. Aktualizace. 15 (6): 623–37. doi:10.1093 / humupd / dmp023. PMID 19515807.
- Ozülker T, Ozpaçaci T, Ozülker F, Ozekici U, Bilgiç R, Mert M (leden 2010). „Náhodná detekce tumoru Sertoli-Leydigových buněk zobrazením FDG PET / CT u pacienta se syndromem necitlivosti na androgeny“. Ann Nucl Med. 24 (1): 35–9. doi:10.1007 / s12149-009-0321-x. PMID 19957213. S2CID 10450803.
- Davis-Dao CA, Tuazon ED, Sokol RZ, Cortessis VK (listopad 2007). „Mužská neplodnost a variace v délce opakování CAG v genu pro androgenní receptor: metaanalýza“. J. Clin. Endokrinol. Metab. 92 (11): 4319–26. doi:10.1210 / jc.2007-1110. PMID 17684052.
- Kawate H, Wu Y, Ohnaka K, Tao RH, Nakamura K, Okabe T, Yanase T, Nawata H, Takayanagi R (listopad 2005). „Narušená nukleární translokace, cílení na nukleární matrici a intranukleární mobilita mutantních androgenních receptorů nesoucích aminokyselinové substituce v doméně vázající deoxyribonukleovou kyselinu odvozenou od pacientů se syndromem necitlivosti na androgen“. J. Clin. Endokrinol. Metab. 90 (11): 6162–9. doi:10.1210 / jc.2005-0179. PMID 16118342.
- Gottlieb B, Lombroso R, Beitel LK, Trifiro MA (leden 2005). "Molekulární patologie androgenového receptoru u mužské (ne) plodnosti". Reprod. Biomed. Online. 10 (1): 42–8. doi:10.1016 / S1472-6483 (10) 60802-4. PMID 15705293.
- ^ A b C Ahmed SF, Cheng A, Hughes IA (duben 1999). "Hodnocení osy gonadotropin-gonadal u syndromu necitlivosti na androgen". Oblouk. Dis. Dítě. 80 (4): 324–9. doi:10.1136 / příd. 80.4.324. PMC 1717906. PMID 10086936.
- ^ A b Brown CJ, Goss SJ, Lubahn DB, Joseph DR, Wilson EM, French FS, Willard HF (únor 1989). „Lokus androgenového receptoru na lidském chromozomu X: regionální lokalizace na Xq11-12 a popis polymorfismu DNA“. American Journal of Human Genetics. 44 (2): 264–9. PMC 1715398. PMID 2563196.
- ^ A b C d E F G h i j k l m Galani A, Kitsiou-Tzeli S, Sofokleous C, Kanavakis E, Kalpini-Mavrou A (2008). „Syndrom necitlivosti na androgen: klinické rysy a molekulární vady“. Hormony (Atény). 7 (3): 217–29. doi:10.14310 / horm.2002.1201. PMID 18694860.
- ^ A b C d E F Gottlieb B, Lombroso R, Beitel LK, Trifiro MA (leden 2005). "Molekulární patologie androgenového receptoru u mužské (ne) plodnosti". Reprod. Biomed. Online. 10 (1): 42–8. doi:10.1016 / S1472-6483 (10) 60802-4. PMID 15705293.
- ^ A b Kooy RF, Reyniers E, Storm K, Vits L, van Velzen D, de Ruiter PE, Brinkmann AO, de Paepe A, Willems PJ (červenec 1999). "CAG opakovaná kontrakce v genu pro androgenní receptor u tří bratrů s mentální retardací". American Journal of Medical Genetics. 85 (3): 209–13. doi:10.1002 / (SICI) 1096-8628 (19990730) 85: 3 <209 :: AID-AJMG4> 3.0.CO; 2-2. PMID 10398229.
- ^ Dejager S, Bry-Gauillard H, Bruckert E, Eymard B, Salachas F, LeGuern E, Tardieu S, Chadarevian R, Giral P, Turpin G (srpen 2002). "Komplexní endokrinní popis Kennedyho choroby odhalující androgenní necitlivost související s délkou opakování CAG". J. Clin. Endokrinol. Metab. 87 (8): 3893–901. doi:10.1210 / jc.87.8.3893. PMID 12161529.
- ^ A b C Choong CS, Wilson EM (prosinec 1998). „Trinukleotid se opakuje v lidském androgenním receptoru: molekulární základ onemocnění“. J. Mol. Endokrinol. 21 (3): 235–57. doi:10.1677 / jme.0.0210235. PMID 9845666.
- ^ Audi L, Fernández-Cancio M, Carrascosa A a kol. (Duben 2010). „Nové (60%) a rekurentní (40%) genové mutace androgenového receptoru u série 59 pacientů s poruchou sexuálního vývoje 46, XY“. J. Clin. Endokrinol. Metab. 95 (4): 1876–88. doi:10.1210 / jc.2009-2146. PMID 20150575.
- ^ Lumbroso R, Beitel LK, Vasiliou DM, Trifiro MA, Pinsky L (listopad 1997). „Varianty využití kodonu v polymorfní (GGN) n trinukleotidové repetici lidského genu pro androgenní receptor“. Hučení. Genet. 101 (1): 43–6. doi:10,1007 / s004390050583. PMID 9385367. S2CID 24753862.
- ^ A b Gottlieb B, Pinsky L, Beitel LK, Trifiro M (prosinec 1999). "Androgenní necitlivost". American Journal of Medical Genetics. 89 (4): 210–7. doi:10.1002 / (SICI) 1096-8628 (19991229) 89: 4 <210 :: AID-AJMG5> 3.0.CO; 2-P. PMID 10727996.
- ^ Edwards A, Hammond HA, Jin L, Caskey CT, Chakraborty R (únor 1992). "Genetická variace na pěti trimerních a tetramerních tandemových lokusech opakování ve čtyřech skupinách lidské populace". Genomika. 12 (2): 241–53. doi:10.1016 / 0888-7543 (92) 90371-X. PMID 1740333.
- ^ A b Casella R, Maduro MR, Lipshultz LI, Lamb DJ (listopad 2001). "Význam polymorfismu polyglutaminového traktu v androgenním receptoru". Urologie. 58 (5): 651–6. doi:10.1016 / S0090-4295 (01) 01401-7. PMID 11711330.
- ^ Yeh SH, Chiu CM, Chen CL, Lu SF, Hsu HC, Chen DS, Chen PJ (duben 2007). „Somatické mutace na trinukleotidových repeticích genu pro androgenní receptor u mužského hepatocelulárního karcinomu“. Int. J. Cancer. 120 (8): 1610–7. doi:10.1002 / ijc.22479. PMID 17230529. S2CID 22184439.
- ^ La Spada AR, Wilson EM, Lubahn DB, Harding AE, Fischbeck KH (červenec 1991). "Mutace genu pro androgenní receptor v X-vázané spinální a bulbární svalové atrofii". Příroda. 352 (6330): 77–9. Bibcode:1991Natur.352 ... 77S. doi:10.1038 / 352077a0. PMID 2062380. S2CID 1678351.
- ^ Casella R, Maduro MR, Misfud A, Lipshultz LI, Yong EL, Lamb DJ (leden 2003). „Délka polyglutaminu pro gen androgenního receptoru je spojena s histologií varlat u neplodných pacientů.“ J. Urol. 169 (1): 224–7. doi:10.1016 / s0022-5347 (05) 64073-6. PMID 12478141.
- ^ Dowsing AT, Yong EL, Clark M, McLachlan RI, de Kretser DM, Trounson AO (srpen 1999). „Propojení mezi mužskou neplodností a expanzí trinukleotidů v genu pro androgenní receptor“. Lanceta. 354 (9179): 640–3. doi:10.1016 / S0140-6736 (98) 08413-X. PMID 10466666. S2CID 1868372.
- ^ Tut TG, Ghadessy FJ, Trifiro MA, Pinsky L, Yong EL (listopad 1997). „Dlouhé polyglutaminové trakty v androgenním receptoru jsou spojeny se sníženou transaktivací, sníženou produkcí spermií a mužskou neplodností“. J. Clin. Endokrinol. Metab. 82 (11): 3777–82. doi:10.1210 / jc.82.11.3777. PMID 9360540.
- ^ Lim HN, Chen H, McBride S, Dunning AM, Nixon RM, Hughes IA, Hawkins JR (březen 2000). „Delší polyglutaminové trakty v androgenním receptoru jsou spojeny se středně těžkými až těžkými undermasculinized genitalia u mužů XY“. Hučení. Mol. Genet. 9 (5): 829–34. doi:10,1093 / hmg / 9,5,829. PMID 10749991.
- ^ Hiort O, Holterhus PM, Horter T, Schulze W, Kremke B, Bals-Pratsch M, Sinnecker GH, Kruse K (srpen 2000). "Význam mutací v genu pro androgenní receptor u mužů s idiopatickou neplodností". J. Clin. Endokrinol. Metab. 85 (8): 2810–5. doi:10.1210 / jc.85.8.2810. PMID 10946887.
- ^ Kukuvitis A, Georgiou I, Bouba I, Tsirka A, Giannouli CH, Yapijakis C, Tarlatzis B, Bontis J, Lolis D, Sofikitis N, Papadimas J (červen 2002). „Sdružení polymorfismů estrogenových receptorů alfa a trinukleotidů androgenních receptorů CAG s mužskou neplodností: studie u 109 řeckých neplodných mužů“. Int. J. Androl. 25 (3): 149–52. doi:10.1046 / j.1365-2605.2002.00339.x. PMID 12031042.
- ^ von Eckardstein S, Syska A, Gromoll J, Kamischke A, Simoni M, Nieschlag E (červen 2001). „Inverzní korelace mezi koncentrací spermií a počtem opakování CAG androgenního receptoru u normálních mužů“. J. Clin. Endokrinol. Metab. 86 (6): 2585–90. doi:10.1210 / jc.86.6.2585. hdl:11380/607795. PMID 11397858.
- ^ Rajpert-De Meyts E, Leffers H, Petersen JH, Andersen AG, Carlsen E, Jørgensen N, Skakkebaek NE (leden 2002). „Délka CAG opakování v genu pro androgenní receptor a reprodukční proměnné u plodných a neplodných mužů“. Lanceta. 359 (9300): 44–6. doi:10.1016 / S0140-6736 (02) 07280-X. PMID 11809188. S2CID 24126374.
- ^ Hiort O, Horter T, Schulze W, Kremke B, Sinnecker GH (listopad 1999). „Mužská neplodnost a zvýšené riziko nemocí v budoucích generacích“. Lanceta. 354 (9193): 1907–8. doi:10.1016 / S0140-6736 (05) 76874-4. PMID 10584751. S2CID 44272921.
- ^ Muroya K, Sasagawa I, Suzuki Y, Nakada T, Ishii T, Ogata T (květen 2001). „Hypospadie a gen androgenního receptoru: screening mutací a analýza délky opakování CAG“. Mol. Hučení. Reprod. 7 (5): 409–13. doi:10,1093 / mol / 7,5,409. PMID 11331662.
- ^ A b Davis-Dao CA, Tuazon ED, Sokol RZ, Cortessis VK (listopad 2007). „Mužská neplodnost a variace v délce opakování CAG v genu pro androgenní receptor: metaanalýza“. J. Clin. Endokrinol. Metab. 92 (11): 4319–26. doi:10.1210 / jc.2007-1110. PMID 17684052.
- ^ Radpour R, Rezaee M, Tavasoly A, Solati S, Saleki A (2007). „Sdružení dlouhých polyglycinových traktů (opakování GGN) v exonu 1 genu pro androgenní receptor s kryptorchismem a penilní hypospadií u íránských pacientů“. J. Androl. 28 (1): 164–9. doi:10.2164 / jandrol.106.000927. PMID 16957138.
- ^ Aschim EL, Nordenskjöld A, Giwercman A, Lundin KB, Ruhayel Y, Haugen TB, Grotmol T, Giwercman YL (říjen 2004). „Spojení mezi kryptorchismem, hypospadiemi a délkou opakování GGN v genu pro androgenní receptor“. J. Clin. Endokrinol. Metab. 89 (10): 5105–9. doi:10.1210 / jc.2004-0293. PMID 15472213.
- ^ Rajender S, Rajani V, Gupta NJ, Chakravarty B, Singh L, Thangaraj K (2006). "Žádná asociace androgenního receptoru GGN s opakováním délky polymorfismu s neplodností u indických mužů". J. Androl. 27 (6): 785–9. doi:10,2164 / jandrol.106,000166. PMID 16809273.
- ^ A b Gottlieb B, Beitel LK, Trifiro MA (květen 2001). "Variabilní databáze expresivity a mutací: databáze mutací genů androgenového receptoru". Hučení. Mutat. 17 (5): 382–8. doi:10,1002 / humu.1113. PMID 11317353. S2CID 2933566.
- ^ A b Ozülker T, Ozpaçaci T, Ozülker F, Ozekici U, Bilgiç R, Mert M (leden 2010). „Náhodná detekce tumoru Sertoli-Leydigových buněk zobrazením FDG PET / CT u pacienta se syndromem necitlivosti na androgeny“. Ann Nucl Med. 24 (1): 35–9. doi:10.1007 / s12149-009-0321-x. PMID 19957213. S2CID 10450803.
- ^ A b Köhler B, Lumbroso S, Leger J, Audran F, Grau ES, Kurtz F, Pinto G, Salerno M, Semitcheva T, Czernichow P, Sultan C (leden 2005). „Syndrom necitlivosti na androgeny: somatický mozaicismus androgenního receptoru v sedmi rodinách a důsledky pro přiřazení pohlaví a genetické poradenství“. J. Clin. Endokrinol. Metab. 90 (1): 106–11. doi:10.1210 / jc.2004-0462. PMID 15522944.
- ^ Hiort O, Sinnecker GH, Holterhus PM, Nitsche EM, Kruse K (červen 1998). „Zděděné a de novo genové mutace receptoru pro androgen: vyšetřování rodin s jedním případem“. J. Pediatr. 132 (6): 939–43. doi:10.1016 / S0022-3476 (98) 70387-7. PMID 9627582.
- ^ Batch JA, Williams DM, Davies HR, Brown BD, Evans BA, Hughes IA, Patterson MN (říjen 1992). "Genové mutace receptoru pro androgen identifikované SSCP u čtrnácti subjektů se syndromem necitlivosti na androgen". Hučení. Mol. Genet. 1 (7): 497–503. doi:10,1093 / hmg / 1,7,497. PMID 1307250.
- ^ Hiort O, Klauber G, Cendron M, Sinnecker GH, Keim L, Schwinger E, Wolfe HJ, Yandell DW (květen 1994). "Molekulární charakterizace genu pro androgenní receptor u chlapců s hypospadiemi". Eur. J. Pediatr. 153 (5): 317–21. doi:10.1007 / BF01956409. PMID 8033918. S2CID 12862106.
- ^ Lu J, Danielsen M (červen 1996). "A Stu I polymorphism in the human androgen receptor gene (AR)". Clin. Genet. 49 (6): 323–4. doi:10.1111/j.1399-0004.1996.tb03800.x. PMID 8884086. S2CID 33645516.
- ^ Macke JP, Hu N, Hu S, Bailey M, King VL, Brown T, Hamer D, Nathans J (October 1993). "Sequence variation in the androgen receptor gene is not a common determinant of male sexual orientation". American Journal of Human Genetics. 53 (4): 844–52. PMC 1682384. PMID 8213813.
- ^ A b Gottlieb B, Vasiliou DM, Lumbroso R, Beitel LK, Pinsky L, Trifiro MA (1999). "Analysis of exon 1 mutations in the androgen receptor gene". Hučení. Mutat. 14 (6): 527–39. doi:10.1002/(SICI)1098-1004(199912)14:6<527::AID-HUMU12>3.0.CO;2-X. PMID 10571951.
- ^ A b C d Ferlin A, Vinanzi C, Garolla A, Selice R, Zuccarello D, Cazzadore C, Foresta C (listopad 2006). „Mužská neplodnost a mutace genu pro androgenní receptor: klinické rysy a identifikace sedmi nových mutací“. Clin. Endokrinol. 65 (5): 606–10. doi:10.1111 / j.1365-2265.2006.02635.x. PMID 17054461. S2CID 33713391.
- ^ A b Melo KF, Mendonca BB, Billerbeck AE, Costa EM, Inácio M, Silva FA, Leal AM, Latronico AC, Arnhold IJ (July 2003). "Clinical, hormonal, behavioral, and genetic characteristics of androgen insensitivity syndrome in a Brazilian cohort: five novel mutations in the androgen receptor gene". J. Clin. Endokrinol. Metab. 88 (7): 3241–50. doi:10.1210/jc.2002-021658. PMID 12843171.
- ^ A b Ahmed SF, Cheng A, Dovey L, Hawkins JR, Martin H, Rowland J, Shimura N, Tait AD, Hughes IA (February 2000). "Phenotypic features, androgen receptor binding, and mutational analysis in 278 clinical cases reported as androgen insensitivity syndrome". J. Clin. Endokrinol. Metab. 85 (2): 658–65. doi:10.1210/jc.85.2.658. PMID 10690872.
- ^ A b Coutant R, Mallet D, Lahlou N, Bouhours-Nouet N, Guichet A, Coupris L, Croué A, Morel Y (August 2007). "Heterozygous mutation of steroidogenic factor-1 in 46,XY subjects may mimic partial androgen insensitivity syndrome". J. Clin. Endokrinol. Metab. 92 (8): 2868–73. doi:10.1210/jc.2007-0024. PMID 17488792.
- ^ A b C Adachi M, Takayanagi R, Tomura A, Imasaki K, Kato S, Goto K, Yanase T, Ikuyama S, Nawata H (September 2000). "Androgen-insensitivity syndrome as a possible coactivator disease". N. Engl. J. Med. 343 (12): 856–62. doi:10.1056/NEJM200009213431205. PMID 10995865.
- ^ Ghadessy FJ, Lim J, Abdullah AA, Panet-Raymond V, Choo CK, Lumbroso R, Tut TG, Gottlieb B, Pinsky L, Trifiro MA, Yong EL (June 1999). "Oligospermic infertility associated with an androgen receptor mutation that disrupts interdomain and coactivator (TIF2) interactions". J. Clin. Investovat. 103 (11): 1517–25. doi:10.1172/JCI4289. PMC 408364. PMID 10359561.
- ^ A b C d Giwercman YL, Ivarsson SA, Richthoff J, Lundin KB, Giwercman A (2004). "A novel mutation in the D-box of the androgen receptor gene (S597R) in two unrelated individuals Is associated with both normal phenotype and severe PAIS". Horm. Res. 61 (2): 58–62. doi:10.1159/000075240. PMID 14646391. S2CID 39208502.
- ^ A b C d Achermann JC, Jameson JL (2006). "Disorders of sexual differentiation". In Hauser SL, Kasper DL, Fauci AS, Braunwald E, Longo DL (eds.). Harrison's endocrinology. New York: McGraw-Hill Medical Pub. Divize. p. 161172. ISBN 978-0-07-145744-6.
- ^ A b C d Simpson JL, Rebar RW (2002). Hung, Wellington, Becker, Kenneth L., Bilezikian, John P., William J Bremner (eds.). Principy a praxe endokrinologie a metabolismu. Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 852–85. ISBN 978-0-7817-4245-0.
- ^ Brinkmann A, Jenster G, Ris-Stalpers C, van der Korput H, Brüggenwirth H, Boehmer A, Trapman J (April 1996). "Molecular basis of androgen insensitivity". Steroidy. 61 (4): 172–5. doi:10.1016/0039-128X(96)00008-6. hdl:2066/22511. PMID 8732995. S2CID 34941122.
- ^ Pinsky L, Kaufman M, Killinger DW (leden 1989). „Zhoršená spermatogeneze není povinným vyjádřením receptorově defektní androgenní rezistence“. American Journal of Medical Genetics. 32 (1): 100–4. doi:10,1002 / ajmg.1320320121. PMID 2705470.
- ^ Grino PB, Griffin JE, Cushard WG, Wilson JD (duben 1988). "Mutace androgenového receptoru spojená s částečnou androgenní rezistencí, familiární gynekomastií a plodností". J. Clin. Endokrinol. Metab. 66 (4): 754–61. doi:10.1210 / jcem-66-4-754. PMID 3346354.
- ^ A b C Tsukada T, Inoue M, Tachibana S, Nakai Y, Takebe H (říjen 1994). "Mutace androgenového receptoru způsobující androgenní rezistenci u nedervirilizovaného mužského syndromu". J. Clin. Endokrinol. Metab. 79 (4): 1202–7. doi:10.1210 / jc.79.4.1202. PMID 7962294.
- ^ A b Giwercman A, Kledal T, Schwartz M, Giwercman YL, Leffers H, Zazzi H, Wedell A, Skakkebaek NE (červen 2000). "Zachována mužská plodnost navzdory snížené citlivosti na androgeny způsobené mutací v doméně vázající ligand genu pro androgenní receptor". J. Clin. Endokrinol. Metab. 85 (6): 2253–9. doi:10.1210 / jc.85.6.2253. PMID 10852459.
- ^ Yong EL, Ng SC, Roy AC, Yun G, Ratnam SS (září 1994). "Těhotenství po hormonální korekci závažného spermatogenního defektu způsobeného mutací genu pro androgenní receptor". Lanceta. 344 (8925): 826–7. doi:10.1016 / S0140-6736 (94) 92385-X. PMID 7993455. S2CID 34571405.
- ^ Bouvattier C, Mignot B, Lefèvre H, Morel Y, Bougnères P (September 2006). "Impaired sexual activity in male adults with partial androgen insensitivity". J. Clin. Endokrinol. Metab. 91 (9): 3310–5. doi:10.1210/jc.2006-0218. PMID 16757528.
- ^ A b C Boehmer AL, Brinkmann O, Brüggenwirth H, van Assendelft C, Otten BJ, Verleun-Mooijman MC, Niermeijer MF, Brunner HG, Rouwé CW, Waelkens JJ, Oostdijk W, Kleijer WJ, van der Kwast TH, de Vroede MA, Drop SL (September 2001). "Genotype versus phenotype in families with androgen insensitivity syndrome". J. Clin. Endokrinol. Metab. 86 (9): 4151–60. doi:10.1210/jcem.86.9.7825. PMID 11549642.
- ^ A b Evans BA, Hughes IA, Bevan CL, Patterson MN, Gregory JW (June 1997). "Phenotypic diversity in siblings with partial androgen insensitivity syndrome". Oblouk. Dis. Dítě. 76 (6): 529–31. doi:10.1136/adc.76.6.529. PMC 1717223. PMID 9245853.
- ^ A b C d E F Pérez-Palacios G, Chávez B, Méndez JP, McGinley JI, Ulloa-Aguirre A (1987). "The syndromes of androgen resistance revisited". J. Steroid Biochem. 27 (4–6): 1101–8. doi:10.1016/0022-4731(87)90196-8. PMID 3320547.
- ^ Radmayr C, Culig Z, Glatzl J, Neuschmid-Kaspar F, Bartsch G, Klocker H (October 1997). "Androgen receptor point mutations as the underlying molecular defect in 2 patients with androgen insensitivity syndrome". J. Urol. 158 (4): 1553–6. doi:10.1016/S0022-5347(01)64279-4. PMID 9302173.
- ^ Deeb A, Mason C, Lee YS, Hughes IA (July 2005). "Correlation between genotype, phenotype and sex of rearing in 111 patients with partial androgen insensitivity syndrome". Clin. Endokrinol. 63 (1): 56–62. doi:10.1111/j.1365-2265.2005.02298.x. PMID 15963062. S2CID 19608750.
- ^ Rodien P, Mebarki F, Mowszowicz I, Chaussain JL, Young J, Morel Y, Schaison G (August 1996). "Different phenotypes in a family with androgen insensitivity caused by the same M780I point mutation in the androgen receptor gene". J. Clin. Endokrinol. Metab. 81 (8): 2994–8. doi:10.1210/jc.81.8.2994. PMID 8768864.
- ^ Nordenskjöld A, Söderhäll S (1998). "An androgen receptor gene mutation (A645D) in a boy with a normal phenotype". Hučení. Mutat. 11 (4): 339. PMID 9554755.
- ^ Werner R, Holterhus PM, Binder G, Schwarz HP, Morlot M, Struve D, Marschke C, Hiort O (September 2006). "The A645D mutation in the hinge region of the human androgen receptor (AR) gene modulates AR activity, depending on the context of the polymorphic glutamine and glycine repeats". J. Clin. Endokrinol. Metab. 91 (9): 3515–20. doi:10.1210/jc.2006-0372. PMID 16804045.
- ^ Zenteno JC, Chávez B, Vilchis F, Kofman-Alfaro S (2002). "Fenotypová heterogenita spojená se stejnými mutacemi ve zbytku 870 androgenového receptoru". Horm. Res. 57 (3–4): 90–3. doi:10.1159/000057958. PMID 12006704. S2CID 23484493.
- ^ Holterhus PM, Werner R, Hoppe U, Bassler J, Korsch E, Ranke MB, Dörr HG, Hiort O (2005). "Molecular features and clinical phenotypes in androgen insensitivity syndrome in the absence and presence of androgen receptor gene mutations". J Mol Med. 83 (12): 1005–1113. doi:10.1007/s00109-005-0704-y. PMID 16283146. S2CID 7725163.
- ^ Meehan KL, Sadar MD (May 2003). "Androgens and androgen receptor in prostate and ovarian malignancies". Přední. Biosci. 8 (1–3): d780–800. doi:10.2741/1063. PMID 12700055.
- ^ A b Wang Q, Ghadessy FJ, Trounson A, de Kretser D, McLachlan R, Ng SC, Yong EL (prosinec 1998). „Azoospermie spojená s mutací v doméně vázající ligand androgenového receptoru vykazující normální vazbu ligandu, ale vadnou transaktivaci“. J. Clin. Endokrinol. Metab. 83 (12): 4303–9. doi:10.1210 / jc.83.12.4303. PMID 9851768.
- ^ Taneja SS, Ha S, Swenson NK, Huang HY, Lee P, Melamed J, Shapiro E, Garabedian MJ, Logan SK (December 2005). "Cell-specific regulation of androgen receptor phosphorylation in vivo". J. Biol. Chem. 280 (49): 40916–24. doi:10.1074/jbc.M508442200. PMID 16210317.
- ^ Heinlein CA, Chang C (April 2002). "Androgen receptor (AR) coregulators: an overview". Endocr. Rev. 23 (2): 175–200. doi:10.1210/er.23.2.175. PMID 11943742.
- ^ Jenster G, van der Korput HA, van Vroonhoven C, van der Kwast TH, Trapman J, Brinkmann AO (October 1991). "Domains of the human androgen receptor involved in steroid binding, transcriptional activation, and subcellular localization". Mol. Endokrinol. 5 (10): 1396–404. doi:10.1210/mend-5-10-1396. PMID 1775129.
- ^ Simental JA, Sar M, Lane MV, French FS, Wilson EM (January 1991). "Transcriptional activation and nuclear targeting signals of the human androgen receptor". J. Biol. Chem. 266 (1): 510–8. PMID 1985913.
- ^ A b Gilbert SF (2000). Vývojová biologie. Sunderland, Massachusetts: Sinauer Associates. ISBN 978-0-87893-243-6.
- ^ A b C d E F Jones RE, Lopez KH (2006). "Chapter 5: Sexual differentiation". Human reproductive biology. Amsterdam: Elsevier Academic Press. str.127–48. ISBN 978-0-12-088465-0.
- ^ A b C Yong EL, Loy CJ, Sim KS (2003). "Gen androgenového receptoru a mužská neplodnost". Hučení. Reprod. Aktualizace. 9 (1): 1–7. doi:10.1093 / humupd / dmg003. PMID 12638777.
- ^ Hannema SE, Scott IS, Hodapp J, Martin H, Coleman N, Schwabe JW, Hughes IA (November 2004). "Residual activity of mutant androgen receptors explains wolffian duct development in the complete androgen insensitivity syndrome". J. Clin. Endokrinol. Metab. 89 (11): 5815–22. doi:10.1210/jc.2004-0709. PMID 15531547.
- ^ A b C d E Oakes MB, Eyvazzadeh AD, Quint E, Smith YR (prosinec 2008). "Úplný syndrom necitlivosti na androgen - přehled". J Pediatr Adolesc Gynecol. 21 (6): 305–10. doi:10.1016 / j.jpag.2007.09.006. PMID 19064222.
- ^ A b Roy AK, Lavrovsky Y, Song CS, Chen S, Jung MH, Velu NK, Bi BY, Chatterjee B (1999). Regulation of androgen action. Vitam. Horm. Vitamíny a hormony. 55. pp. 309–52. doi:10.1016/S0083-6729(08)60938-3. ISBN 978-0-12-709855-5. PMID 9949684.
- ^ A b Kokontis JM, Liao S (1999). Molecular action of androgen in the normal and neoplastic prostate. Vitam. Horm. Vitamíny a hormony. 55. pp. 219–307. doi:10.1016/s0083-6729(08)60937-1. ISBN 978-0127098555. PMID 9949683.
- ^ A b Rajender S, Gupta NJ, Chakrabarty B, Singh L, Thangaraj K (March 2009). "Ala 586 Asp mutation in androgen receptor disrupts transactivation function without affecting androgen binding". Plod Sterilní. 91 (3): 933.e23–8. doi:10.1016/j.fertnstert.2008.10.041. PMID 19062009.
- ^ A b Sobel V, Schwartz B, Zhu YS, Cordero JJ, Imperato-McGinley J (August 2006). "Bone mineral density in the complete androgen insensitivity and 5alpha-reductase-2 deficiency syndromes". J. Clin. Endokrinol. Metab. 91 (8): 3017–23. doi:10.1210/jc.2005-2809. PMID 16735493.
- ^ A b Lund A, Juvonen V, Lähdetie J, Aittomäki K, Tapanainen JS, Savontaus ML (červen 2003). "Nová variabilita sekvence v doméně regulující transaktivaci androgenového receptoru u dvou neplodných finských mužů". Plod Sterilní. 79. Suppl 3: 1647–8. doi:10.1016 / s0015-0282 (03) 00256-5. PMID 12801573.
- ^ A b Wooster R, Mangion J, Eeles R, Smith S, Dowsett M, Averill D, Barrett-Lee P, Easton DF, Ponder BA, Stratton MR (October 1992). "A germline mutation in the androgen receptor gene in two brothers with breast cancer and Reifenstein syndrome". Nat. Genet. 2 (2): 132–4. doi:10.1038/ng1092-132. PMID 1303262. S2CID 19780651.
- ^ Evans BA, Harper ME, Daniells CE, Watts CE, Matenhelia S, Green J, Griffiths K (March 1996). "Low incidence of androgen receptor gene mutations in human prostatic tumors using single strand conformation polymorphism analysis". Prostata. 28 (3): 162–71. doi:10.1002/(SICI)1097-0045(199603)28:3<162::AID-PROS3>3.0.CO;2-H. PMID 8628719.
- ^ A b Lobaccaro JM, Lumbroso S, Belon C, Galtier-Dereure F, Bringer J, Lesimple T, Namer M, Cutuli BF, Pujol H, Sultan C (November 1993). "Androgen receptor gene mutation in male breast cancer". Hučení. Mol. Genet. 2 (11): 1799–802. doi:10.1093/hmg/2.11.1799. PMID 8281139.
- ^ A b C Stenoien DL, Cummings CJ, Adams HP, Mancini MG, Patel K, DeMartino GN, Marcelli M, Weigel NL, Mancini MA (May 1999). "Polyglutamine-expanded androgen receptors form aggregates that sequester heat shock proteins, proteasome components and SRC-1, and are suppressed by the HDJ-2 chaperone". Hučení. Mol. Genet. 8 (5): 731–41. doi:10.1093/hmg/8.5.731. PMID 10196362.
- ^ Ismail-Pratt IS, Bikoo M, Liao LM, Conway GS, Creighton SM (July 2007). "Normalization of the vagina by dilator treatment alone in Complete Androgen Insensitivity Syndrome and Mayer-Rokitansky-Kuster-Hauser Syndrome". Hučení. Reprod. 22 (7): 2020–4. doi:10.1093/humrep/dem074. PMID 17449508.
- ^ Nichols JL, Bieber EJ, Gell JS (březen 2009). „Případ sester s úplným syndromem necitlivosti na androgeny a nesouhlasnými Müllerianovými zbytky“. Plodnost a sterilita. 91 (3): 932.e15–8. doi:10.1016 / j.fertnstert.2008.09.027. PMID 18930210.
- ^ Hannema SE, Scott IS, Rajpert-De Meyts E, Skakkebaek NE, Coleman N, Hughes IA (March 2006). "Testicular development in the complete androgen insensitivity syndrome". J. Pathol. 208 (4): 518–27. doi:10.1002/path.1890. PMID 16400621. S2CID 20730666.
- ^ A b Zuccarello D, Ferlin A, Vinanzi C, Prana E, Garolla A, Callewaert L, Claessens F, Brinkmann AO, Foresta C (duben 2008). „Podrobné funkční studie mírných mutací androgenového receptoru prokazují jejich souvislost s mužskou neplodností“. Clin. Endokrinol. 68 (4): 580–8. doi:10.1111 / j.1365-2265.2007.03069.x. PMID 17970778. S2CID 2783902.
- ^ Weidemann W, Linck B, Haupt H, Mentrup B, Romalo G, Stockklauser K, Brinkmann AO, Schweikert HU, Spindler KD (December 1996). "Clinical and biochemical investigations and molecular analysis of subjects with mutations in the androgen receptor gene". Clin. Endokrinol. 45 (6): 733–9. doi:10.1046/j.1365-2265.1996.8600869.x. PMID 9039340. S2CID 28176593.
- ^ Deeb A, Jääskeläinen J, Dattani M, Whitaker HC, Costigan C, Hughes IA (October 2008). "A novel mutation in the human androgen receptor suggests a regulatory role for the hinge region in amino-terminal and carboxy-terminal interactions". J. Clin. Endokrinol. Metab. 93 (10): 3691–6. doi:10.1210/jc.2008-0737. PMID 18697867.
- ^ Quint EH, McCarthy JD, Smith YR (March 2010). "Vaginal surgery for congenital anomalies". Clin Obstet Gynecol. 53 (1): 115–24. doi:10.1097/GRF.0b013e3181cd4128. PMID 20142648. S2CID 41259739.
- ^ A b Hughes IA (February 2008). "Disorders of sex development: a new definition and classification". Nejlepší praxe. Res. Clin. Endokrinol. Metab. 22 (1): 119–34. doi:10.1016/j.beem.2007.11.001. PMID 18279784.
- ^ Kim KR, Kwon Y, Joung JY, Kim KS, Ayala AG, Ro JY (October 2002). "True hermaphroditism and mixed gonadal dysgenesis in young children: a clinicopathologic study of 10 cases". Mod. Pathol. 15 (10): 1013–9. doi:10.1097 / 01.MP.0000027623.23885.0D. PMID 12379746.
- ^ Stouffs K, Tournaye H, Liebaers I, Lissens W (2009). „Mužská neplodnost a postižení chromozomu X“. Hučení. Reprod. Aktualizace. 15 (6): 623–37. doi:10.1093 / humupd / dmp023. PMID 19515807.
- ^ Kawate H, Wu Y, Ohnaka K, Tao RH, Nakamura K, Okabe T, Yanase T, Nawata H, Takayanagi R (listopad 2005). „Narušená nukleární translokace, cílení na nukleární matrici a intranukleární mobilita mutantních androgenních receptorů nesoucích aminokyselinové substituce v doméně vázající deoxyribonukleovou kyselinu odvozenou od pacientů se syndromem necitlivosti na androgen“. J. Clin. Endokrinol. Metab. 90 (11): 6162–9. doi:10.1210 / jc.2005-0179. PMID 16118342.
- ^ Sultan C, Paris F, Terouanne B, Balaguer P, Georget V, Poujol N, Jeandel C, Lumbroso S, Nicolas JC (2001). "Disorders linked to insufficient androgen action in male children". Hučení. Reprod. Aktualizace. 7 (3): 314–22. doi:10.1093/humupd/7.3.314. PMID 11392378.
- ^ Bangsbøll S, Qvist I, Lebech PE, Lewinsky M (January 1992). "Testicular feminization syndrome and associated gonadal tumors in Denmark". Acta Obstet Gynecol Scand. 71 (1): 63–6. doi:10.3109/00016349209007950. PMID 1315102. S2CID 39727062.
- ^ Mazen I, El-Ruby M, Kamal R, El-Nekhely I, El-Ghandour M, Tantawy S, El-Gammal M (2010). "Screening of genital anomalies in newborns and infants in two egyptian governorates". Horm Res Pediatr. 73 (6): 438–42. doi:10.1159/000313588. PMID 20407231. S2CID 22171345.
- ^ https://americanpregnancy.org/getting-pregnant/infertility/preimplantation-genetic-diagnosis-70971
- ^ PGD conditions licensed by the HFEA Archivováno 6. října 2014 na adrese Wayback Machine, Human Fertilization and Embryology Authority, 1 October 2014. Retrieved on October 1, 2014.
- ^ Davis G (2013). "The social costs of preempting intersex traits". Jsem J. Bioeth. 13 (10): 51–3. doi:10.1080/15265161.2013.828119. PMID 24024811. S2CID 7331095.
- ^ Sparrow R (2013). "Gender eugenics? The ethics of PGD for intersex conditions". Jsem J. Bioeth. 13 (10): 29–38. doi:10.1080/15265161.2013.828115. PMID 24024804. S2CID 41857961.
- ^ Behrmann J, Ravitsky V (2013). "Queer liberation, not elimination: why selecting against intersex is not "straight" forward". Jsem J. Bioeth. 13 (10): 39–41. doi:10.1080/15265161.2013.828131. PMID 24024805. S2CID 27065247.
- ^ Nisker J (2013). "Informed choice and PGD to prevent "intersex conditions"". Jsem J. Bioeth. 13 (10): 47–9. doi:10.1080/15265161.2013.828125. PMID 24024809. S2CID 6085229.
- ^ "Submission on the ethics of genetic selection against intersex traits". Organizace Intersex International Australia. 2014-04-29. Archivovány od originál dne 6. října 2014. Citováno 28. září 2014.
- ^ A b Wilkins L. (1950). "Heterosexual development". V: The diagnosis and treatment of endocrine disorders in childhood and adolescence. Springfield, IL: Charles C Thomas, pp. 256–79.[ISBN chybí ]
- ^ Lyon MF, Hawkes SG (September 1970). "X-linked gene for testicular feminization in the mouse". Příroda. 227 (5264): 1217–9. Bibcode:1970Natur.227.1217L. doi:10.1038/2271217a0. PMID 5452809. S2CID 4285996.
- ^ Ohno S, Lyon MF (July 1970). "X-Linked testicular feminization in the mouse as a non-inducible regulatory mutation of the Jacob-Monod type". Klinická genetika. 1 (3–4): 121–7. doi:10.1111/j.1399-0004.1970.tb01627.x. S2CID 85180199.
- ^ Migeon BR, Brown TR, Axelman J, Migeon CJ (October 1981). "Studies of the locus for androgen receptor: localization on the human X chromosome and evidence for homology with the Tfm locus in the mouse". Sborník Národní akademie věd Spojených států amerických. 78 (10): 6339–43. Bibcode:1981PNAS...78.6339M. doi:10.1073/pnas.78.10.6339. PMC 349034. PMID 6947233.
- ^ A b Brown TR, Lubahn DB, Wilson EM, Joseph DR, French FS, Migeon CJ (November 1988). "Deletion of the steroid-binding domain of the human androgen receptor gene in one family with complete androgen insensitivity syndrome: evidence for further genetic heterogeneity in this syndrome". Sborník Národní akademie věd Spojených států amerických. 85 (21): 8151–5. Bibcode:1988PNAS...85.8151B. doi:10.1073/pnas.85.21.8151. PMC 282385. PMID 3186717.
- ^ Lubahn DB, Joseph DR, Sullivan PM, Willard HF, French FS, Wilson EM (April 1988). "Cloning of human androgen receptor complementary DNA and localization to the X chromosome". Věda. 240 (4850): 327–30. Bibcode:1988Sci...240..327L. doi:10.1126/science.3353727. PMID 3353727.
- ^ Chang CS, Kokontis J, Liao ST (April 1988). "Molecular cloning of human and rat complementary DNA encoding androgen receptors". Věda. 240 (4850): 324–6. Bibcode:1988Sci...240..324C. doi:10.1126/science.3353726. PMID 3353726.
- ^ Lubahn DB, Brown TR, Simental JA, Higgs HN, Migeon CJ, Wilson EM, French FS (December 1989). "Sequence of the intron/exon junctions of the coding region of the human androgen receptor gene and identification of a point mutation in a family with complete androgen insensitivity". Sborník Národní akademie věd Spojených států amerických. 86 (23): 9534–8. Bibcode:1989PNAS...86.9534L. doi:10.1073/pnas.86.23.9534. PMC 298531. PMID 2594783.
- ^ Patterson MN, Hughes IA, Gottlieb B, Pinsky L (September 1994). "The androgen receptor gene mutations database". Nucleic Acids Res. 22 (17): 3560–2. PMC 308319. PMID 7937057.
- ^ A b C Simpson JY. (1839). "Hermaphroditism". In: Todd RB, ed. Cyclopaedia of Anatomy and Physiology, Vol II. London: Longman, Brown, Green, Longmans, & Roberts; 2: 684–738.
- ^ A b King H (2007). Midwifery, obstetrics and the rise of gynaecology: the uses of a sixteenth-century compendium. Aldershot, Hants, England: Ashgate Pub. ISBN 978-0-7546-5396-7.
- ^ Affaitati F [Affaitat]. De hermaphroditis. Venet. 1549.
- ^ Panckoucke CL, ed. (1820). Dictionnaire des sciences médicales – biographie médicale. 1 (1. vyd.). Paris: Panckoucke. p. 59.
- ^ Paré A (1573). Des monstres et prodiges. Paris: Dupuys.
- ^ Venette N [Vénitien Salocini]. Tableau de l'amour humain considéré dans l'état du mariage. Parme: Chez Franc d'Amour 1687.
- ^ Jacob G. Tractatus de hermaphroditis. London: E. Curll 1718.
- ^ A b Svatý Hilaire IG (1832–1836). Histoire générale et particulière des anomalies de l'organisation. Paříž: J.-B. Baillière.
- ^ Dorsey FY, Hsieh MH, Roth DR (březen 2009). „46, XX SRY-negativní skuteční hermafroditní sourozenci“. Urologie. 73 (3): 529–31. doi:10.1016 / j.urology.2008.09.050. PMID 19038427.
- ^ A b Verkauskas G, Jaubert F, Lortat-Jacob S, Malan V, Thibaud E, Nihoul-Fékété C (únor 2007). „Dlouhodobé sledování 33 případů skutečného hermafroditismu: 40letá zkušenost s konzervativní operací gonád“. J. Urol. 177 (2): 726–31, diskuse 731. doi:10.1016 / j.juro.2006.10.003. PMID 17222668.
- ^ A b C Hughes IA, Houk C, Ahmed SF, Lee PA (červenec 2006). „Prohlášení o shodě o léčbě intersexuálních poruch“. Oblouk. Dis. Dítě. 91 (7): 554–63. doi:10.1136 / adc.2006.098319. PMC 2082839. PMID 16624884.
- ^ Simmonds M (leden 2007). „Uvažovalo se o„ variacích reprodukčního vývoje “?“. Oblouk. Dis. Dítě. 92 (1): 89. doi:10.1136 / adc.2006.107797. PMC 2083124. PMID 17185456.
- ^ Zannoni GF, Vellone VG, Cordisco EL, Sangiorgi E, Grimaldi ME, Neri C, Nanni L, Neri G (leden 2010). "Morfologie a imunofenotypizace monolaterální ovotestidy u mozaiky jedince 46, XderY / 45, X s nejednoznačnými genitáliemi". Int. J. Gynecol. Pathol. 29 (1): 33–8. doi:10.1097 / PGP.0b013e3181b52e75. PMID 19952940.
- ^ Feder EK, Karkazis K (2008). „Co se jmenuje? Spor o„ poruchy pohlavního vývoje"". Hastings Cent Rep. 38 (5): 33–6. doi:10,1353 / hcr.0,0062. PMID 18947138. S2CID 39697912.
- ^ Reis E (2007). „Divergence nebo nepořádek ?: politika pojmenování intersexu“. Perspektiva. Biol. Med. 50 (4): 535–43. doi:10.1353 / pbm.2007.0054. PMID 17951887. S2CID 17398380.
- ^ A b Ruysch F (1709). Thesaurus anatomicus octavus. Amsterdam: Joannem Wolters. 33, deska II.
- ^ Klebs E. Handbuch der patologischen anatomie. Berlín: A. Hirschwald 1876; 1: 718.
- ^ Mencke JB, ed. Acta eruditorum anno mdccix. Lipsko: Joh. Grossii Haeredes, Joh. Frid. Gleditsch & Frid. Groschuf. 1709; 28: 272–4.
- ^ Müller JP, vyd. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin. Berlín: G. Eichler 1834, s. 171.
- ^ Académie française. Complément du dictionnaire de l'Académie française. Paříž: Chez Firmin Didot Fréres 1843, s. 997.
- ^ Ritter von Raiman JN, Edlen von Rosas A, Fischer SC, Wisgrill J, eds. Medicinische Jahrbücher des kaiserlich-königlichen österreichischen Staates (svazek 22). Vídeň: Carl Gerold 1840; 22: 380–4.
- ^ Bertuch FJ, Schütz CG, eds. Allgemeine Literatur-Zeitung, čísla 1–97. Lipsko 1815, s. 257–60.
- ^ Peschier A, Mozin DJ, eds. Dodatečný au dictionnaire complet des langues française et allemande de l'abbe Mozin. Paříž: Stuttgart et Augsbourg 1859, s. 333.
- ^ A b Morris JM (červen 1953). "Syndrom feminizace varlat u mužských pseudohermafroditů". Dopoledne. J. Obstet. Gynecol. 65 (6): 1192–1211. doi:10.1016/0002-9378(53)90359-7. PMID 13057950.
- ^ Reifenstein EC Jr. (1947). „Dědičný familiární hypogonadismus“. Proc Am Fed Clin Res. 3: 86. PMID 18909356.
- ^ Goldberg MB, Maxwell A (květen 1948). „Mužský pseudohermafroditismus prokázán chirurgickým průzkumem a mikroskopickým vyšetřením; kazuistika se spekulacemi týkajícími se patogeneze“. J. Clin. Endokrinol. Metab. 8 (5): 367–79. doi:10.1210 / jcem-8-5-367. PMID 18863968.
- ^ Gilbert-Dreyfus S, Sabaoun CI, Belausch J (1957). „Etude d'un cas familial d'androgynoidisme avec hypospadias grave, gynecomastie et hyperoestrogenie“. Ann. Endokrinol. 18: 93–101.
- ^ Lubs HA Jr, Vilar O, Bergenstal DM (září 1959). "Rodinný mužský pseudohermafrodismus s labiálními varlaty a částečnou feminizací: endokrinní studie a genetické aspekty". J. Clin. Endokrinol. Metab. 19 (9): 1110–20. doi:10.1210 / jcem-19-9-1110. PMID 14418653.
- ^ Morris JM, Mahesh VB (listopad 1963). „Další pozorování syndromu,“ testikulární feminizace."". Dopoledne. J. Obstet. Gynecol. 87: 731–48. PMID 14085776.
- ^ Rosewater S, Gwinup G, Hamwi JG (září 1965). „Familiární gynekomastie“. Annals of Internal Medicine. 63 (3): 377–85. doi:10.7326/0003-4819-63-3-377. PMID 14327504.
- ^ Aiman J, Griffin JE, Gazak JM, Wilson JD, MacDonald PC (únor 1979). "Androgenní necitlivost jako příčina neplodnosti u jinak normálních mužů". N. Engl. J. Med. 300 (5): 223–7. doi:10.1056 / NEJM197902013000503. PMID 759869.
- ^ A b C Simpson JL (2008). „Mužský pseudohermafroditismus způsobený necitlivostí na androgen nebo nedostatkem 5α-reduktázy“. Glob. Libr. Dámské Med. Globální knihovna ženského lékařství. doi:10.3843 / GLOWM.10349.
- ^ Hester JD (2004). „Intersex (e) und alternative Heilungsstrategien - Medizin, soziale Imperative und identitatsstiftende Gegengemeinschaften“. Ethik Med. 16: 48–67. doi:10.1007 / s00481-004-0284-3. S2CID 5933432.
- ^ McPhaul MJ (1999). "Molekulární defekty androgenového receptoru". J. Steroid Biochem. Mol. Biol. 69 (1–6): 315–22. doi:10.1016 / S0960-0760 (99) 00050-3. PMID 10419008. S2CID 1485903.
- ^ A b Hoff TA, Fuqua SA (2000). „Varianty polymorfismu steroidů a jaderných receptorů v hormonální rezistenci a hormonální nezávislosti“. V Miller MS, Cronin MT (eds.). Genetické polymorfismy a náchylnost k nemocem. Washington, DC: Taylor & Francis. p. 111. ISBN 978-0-7484-0822-1.
- ^ Sultan C, Lumbroso S, Paris F, Jeandel C, Terouanne B, Belon C, Audran F, Poujol N, Georget V, Gobinet J, Jalaguier S, Auzou G, Nicolas JC (srpen 2002). "Poruchy působení androgenů". Semin. Reprod. Med. 20 (3): 217–28. doi:10.1055 / s-2002-35386. PMID 12428202.
- ^ Chu J, Zhang R, Zhao Z, Zou W, Han Y, Qi Q, Zhang H, Wang JC, Tao S, Liu X, Luo Z (leden 2002). „Mužská plodnost je kompatibilní se substitucí Arg (840) Cys v AR u velké čínské rodiny postižené odlišnými fenotypy syndromu necitlivosti na AR“. J. Clin. Endokrinol. Metab. 87 (1): 347–51. doi:10.1210 / jc.87.1.347. PMID 11788673.
- ^ Meschede D, Horst J (květen 1997). „Molekulární genetika mužské neplodnosti“. Mol. Hučení. Reprod. 3 (5): 419–30. doi:10,1093 / mol / 3,5,419. PMID 9239727.
- ^ Hart P. „Orchids: My Intersex Adventure“. hartflicker Pohyblivé obrázky. Archivovány od originál dne 2017-12-11.
- ^ Carter S (31. května 2014). „Náročné perspektivy: Rozhovor s Dalea“. Časopis Vada. Citováno 23. ledna 2017.
- ^ Peikoff K (22. srpna 2014). „Jaké to je být opravdu intersex“. Kosmopolitní. Citováno 23. ledna 2017.
- ^ „Vše o‚ dívčí kometě ''". Dalea Music. Archivovány od originál dne 2016-12-25. Citováno 2017-01-24.
- ^ „Mezinárodní modelka Hanne Gaby Odiele odhaluje, že je Intersex; oznamuje partnerství s advokáty společnosti InterACT pro Intersex Youth, aby zvýšila povědomí o důležitosti ochrany lidských práv pro intersexuální lidi po celém světě“ (PDF). interACT. 23. ledna 2017.
- ^ A b Faye S, Balzary C, Wyman E, Jawara, Sobol S, Shelley N (2017). „Hanne Gaby Odiele“. Omámený (250). Archivovány od originál dne 07.09.2018. Citováno 2017-05-30.
- ^ "'Faking It 'zrušeno; Carter Covington rozhovor - Hollywood Reporter ". 2016-05-16. Archivovány od originál dne 2016-05-16. Citováno 2019-02-11.
To, o čem bude show skutečně známá, je Lauren, která vyjde jako intersex a bude první pravidelnou sérií, která je intersex v televizi
- ^ Kay A. "'Díky jeho předstírání se historie LGBT stane v sezóně 2 ". Shon. Citováno 2019-02-11.
- ^ „Zavolej porodní asistentce: Co je to testikulární feminizační syndrom?“. Radio Times. Citováno 2019-02-11.
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |
Informace
- Syndrom necitlivosti na androgen na NIH /UW Genové testy
- Online Mendelian Inheritance in Man (OMIM): Syndrom necitlivosti na androgeny - 300068, 313700

