Kináza receptoru tropomyosinu A - Tropomyosin receptor kinase A
Kináza receptoru tropomyosinu A (TrkA),[5] také známý jako receptor s vysokou afinitou nervového růstového faktoru, neurotrofní tyrosinkinázový receptor typu 1nebo TRK1 transformující protein tyrosinkinázy je protein že u lidí je kódován NTRK1 gen.[6]
Tento gen kóduje člena rodina neurotrofních tyrosinkinázových receptorů (NTKR). Tato kináza je membránově vázaný receptor, který po něm neurotrophin vazba, sama se fosforyluje (autofosforylace ) a členové Cesta MAPK. Přítomnost této kinázy vede k diferenciaci buněk a může hrát roli při specifikaci subtypů senzorických neuronů. Mutace v tomto genu byly spojeny s vrozená necitlivost na bolest s anhidrózou, sebepoškozující chování, mentální postižení a / nebo kognitivní poruchy a jisté rakoviny. Byly nalezeny alternativní transkripční sestřihové varianty tohoto genu, ale dosud byly charakterizovány pouze tři.[7]
Funkce
TrkA je vysoká afinita katalytický receptor pro neurotrophin, Nervový růstový faktor, nebo „NGF“. Jako takový zprostředkovává mnohočetné účinky NGF, mezi něž patří neuronální diferenciace a vyhýbání se programovaná buněčná smrt.
Členové rodiny
TrkA je součástí podskupiny proteinových kináz, které zahrnuje TrkB a TrkC. Existují také další neurotrofní faktory strukturálně související s NGF: BDNF (pro neurotrofický faktor odvozený od mozku), NT-3 (pro neurotropin-3) a NT-4 (pro neurotropin-4). Zatímco TrkA zprostředkovává účinky NGF, TrkB je vázán a aktivován BDNF, NT-4 a NT-3. Dále, TrkC váže a je aktivován NT-3.[8]
Kromě TrkA existuje ještě jeden další NGF receptor, nazývaný „LNGFR " (pro "Receptor nervového růstového faktoru s nízkou afinitou "). Na rozdíl od TrkA hraje LNGFR v biologii NGF poněkud méně jasnou roli. Někteří vědci prokázali, že se LNGFR váže a slouží jako„ záchytný bod "pro neurotrofiny. Buňky, které exprimují jak LNGFR, tak Trk receptory, proto mohou mít větší aktivita - protože mají vyšší „mikrokoncentraci" neurotrofinu. Ukázalo se však také, že při nepřítomnosti společně exprimovaného TrkA může LNGFR signalizovat buňce smrt prostřednictvím apoptózy - tedy buňky exprimující LNGFR v nepřítomnosti Trk receptorů může spíše zemřít, než žít v přítomnosti neurotropinu.
Role v nemoci
TrkA byl původně klonován z nádoru tlustého střeva; rakovina nastala translokací, která vedla k aktivaci TrkA kinázové domény. Samotný TrkA se však nejeví jako onkogen.[Citace je zapotřebí ]
V jedné studii byla zjištěna úplná absence TrkA receptoru keratokonus - ovlivněné rohovky, spolu se zvýšenou úrovní izoformy represoru Transkripční faktor Sp3.[9]
Ukázalo se, že genové fúze zahrnující NTRK1 jsou onkogenní, což vede ke konstitutivní aktivaci TrkA.[10] Ve výzkumné studii Vaishnavi A. a kol. Se odhaduje, že fúze NTRK1 se vyskytují u 3,3% rakoviny plic, jak bylo hodnoceno prostřednictvím sekvenování nové generace nebo fluorescence in situ hybridizace.[10]
Nařízení
Hladiny odlišných proteinů lze regulovat pomocí „ubikvitin /proteazom „systém. V tomto systému je malý (7–8 kd) protein nazývaný„ubikvitin "je připevněn k cílovému proteinu, a je tedy zaměřen na destrukci strukturou zvanou"proteazom ". TrkA je zaměřen na ničení zprostředkované proteazomy pomocí" E3. " ubikvitin ligáza " volala NEDD4-2.[11] Tento mechanismus může představovat odlišný způsob řízení přežití neuronu. Rozsah a možná typ ubikvitinace TrkA lze regulovat druhým, nepříbuzným receptorem pro NGF, p75NTR.
Interakce
TrkA bylo prokázáno komunikovat s:
Ligandy
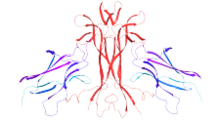
Malé molekuly jako např amitriptylin a kyselina gambogová deriváty aktivují TrkA. Amitriptylin aktivuje TrkA a usnadňuje heterodimerizaci TrkA a TrkB v nepřítomnosti NGF. Vazba amitriptylinu na TrkA nastává na oblast bohatou na leucin (LRR) extracelulární domény receptoru, která je odlišná od vazebného místa NGF. Amitryptilin má obě neurotrofní aktivitu in-vitro a in-vivo (model myši).[29] Gambogický amid, derivát kyseliny gambogové, selektivně aktivuje TrkA (ale ne TrkB a TrkC ) oba in-vitro a in-vivo interakcí s cytoplazmatickou juxtamembránovou doménou TrkA.[30]
Role v rakovině
Ačkoli byl původně identifikován jako onkogenní fúze v roce 1982,[31] teprve nedávno došlo k obnovenému zájmu o rodinu Trk, protože se týká její role v lidských rakovinách kvůli identifikaci fúzí genů NTRK1 (TrkA), NTRK2 (TrkB) a NTRK3 (TrkC) a dalších onkogenních alterací u řady typy nádorů. Počet Inhibitory Trk jsou (v roce 2015) v klinických studiích a prokázaly časný příslib zmenšování lidských nádorů.[32]
Inhibitory ve vývoji
Entrektinib (dříve RXDX-101) je hodnocený lék vyvinutý společností Ignyta, Inc., který má potenciální protinádorovou aktivitu. Je to selektivní pan-trk receptor inhibitor tyrosinkinázy (TKI) cílení genových fúzí v trkA, trkB, a trkC (kódováno NTRK1, NTRK2, a NTRK3 genů), která je v současné době ve fázi 2 klinického testování.[33]
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000198400 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000028072 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). „Kapitola 8: Atypické neurotransmitery“. In Sydor A, Brown RY (eds.). Molekulární neurofarmakologie: Nadace pro klinickou neurovědu (2. vyd.). New York: McGraw-Hill Medical. ISBN 9780071481274.
Dalším společným rysem neurotrofinů je to, že produkují své fyziologické účinky pomocí rodiny receptorů kinázy receptoru tropomyosinu (Trk) (také známé jako rodina kináz tyrosinových receptorů). ...
Trk receptory
Všechny neurotrofiny se vážou na třídu vysoce homologních receptorových tyrosinkináz známých jako Trk receptory, z nichž jsou známé tři typy: TrkA, TrkB a TrkC. Těmito transmembránovými receptory jsou glykoproteiny, jejichž molekulové hmotnosti se pohybují od 140 do 145 kDa. Každý typ receptoru Trk má tendenci vázat specifické neurotrofiny: TrkA je receptor pro NGF, TrkB receptor pro BDNF a NT-4 a TrkC receptor pro NT-3. Byla však zaznamenána určitá překrývání ve specifičnosti těchto receptorů . - ^ Martin-Zanca D, Hughes SH, Barbacid M (duben 1986). „Lidský onkogen vzniklý fúzí zkrácených sekvencí tropomyosinu a proteinové tyrosinkinázy“. Příroda. 319 (6056): 743–8. doi:10.1038 / 319743a0. PMID 2869410.
- ^ „Entrez Gene: NTRK1 neurotrofní tyrosinkináza, receptor, typ 1“.
- ^ Benito-Gutiérrez E, Garcia-Fernàndez J, Comella JX (únor 2006). "Původ a vývoj rodiny Trk neurotrofních receptorů". Mol. Buňka. Neurosci. 31 (2): 179–92. doi:10.1016 / j.mcn.2005.09.007. PMID 16253518.
- ^ Lambiase A, Merlo D, Mollinari C, Bonini P, Rinaldi AM, D 'Amato M, Micera A, Coassin M, Rama P, Bonini S, Garaci E (listopad 2005). „Molekulární základ pro keratokonus: nedostatek exprese TrkA a jeho transkripční represe pomocí Sp3“. Proc. Natl. Acad. Sci. USA 102 (46): 16795–800. doi:10.1073 / pnas.0508516102. PMC 1283852. PMID 16275928.
- ^ A b Vaishnavi, Aria; Capelletti, Marzia; Le, Anh T .; Kako, Severine; Butaney, Mohit; Ercan, Dalia; Mahale, Sakshi; Davies, Kurtis D .; Aisner, Dara L. (01.11.2013). „Onkogenní a na léky citlivé NTRK1 přesmyky u rakoviny plic“. Přírodní medicína. 19 (11): 1469–1472. doi:10,1038 / nm. 3352. ISSN 1546-170X. PMC 3823836. PMID 24162815.
- ^ Yu T, Calvo L, Anta B, López-Benito S, Southon E, Chao MV, Tessarollo L, Arévalo JC (duben 2011). „Regulace obchodování s aktivovaným TrkA je zásadní pro funkce zprostředkované NGF“. Provoz. 12 (4): 521–34. doi:10.1111 / j.1600-0854.2010.01156.x. PMC 3547592. PMID 21199218.
- ^ A b C d Koch A, Mancini A, Stefan M, Niedenthal R, Niemann H, Tamura T (březen 2000). „Přímá interakce receptoru nervového růstového faktoru, TrkA, s nereceptorovou tyrosinkinázou, c-Abl, prostřednictvím aktivační smyčky“. FEBS Lett. 469 (1): 72–6. doi:10.1016 / S0014-5793 (00) 01242-4. PMID 10708759.
- ^ Yano H, Cong F, Birge RB, Goff SP, Chao MV (únor 2000). "Sdružení Abl tyrosinkinázy s receptorem nervového růstového faktoru Trk". J. Neurosci. Res. 59 (3): 356–64. doi:10.1002 / (SICI) 1097-4547 (20000201) 59: 3 <356 :: AID-JNR9> 3.0.CO; 2-G. PMID 10679771.
- ^ A b C Meakin SO, MacDonald JI, Gryz EA, Kubu CJ, Verdi JM (duben 1999). „Signální adaptér FRS-2 soutěží s Shc o vazbu na receptor nervového růstového faktoru TrkA. Model pro diskriminaci proliferace a diferenciace“. J. Biol. Chem. 274 (14): 9861–70. doi:10.1074 / jbc.274.14.9861. PMID 10092678.
- ^ Song C, Perides G, Liu YF (únor 2002). „Exprese Huntingtinu s plnou délkou polyglutaminu expandovaného narušuje signalizaci receptoru růstového faktoru v buňkách feochromocytomu potkana (PC12)“. J. Biol. Chem. 277 (8): 6703–7. doi:10,1074 / jbc.M110338200. PMID 11733534.
- ^ MacDonald JI, Gryz EA, Kubu CJ, Verdi JM, Meakin SO (červen 2000). „Přímá vazba signálního adaptéru proteinu Grb2 na aktivační smyčkové tyrosiny na receptoru tyrosinkinázy nervového růstového faktoru, TrkA“. J. Biol. Chem. 275 (24): 18225–33. doi:10,1074 / jbc.M001862200. PMID 10748052.
- ^ Yamashita H, Avraham S, Jiang S, Dikic I, Avraham H (květen 1999). „Homologní kináza Csk se asociuje s receptory TrkA a podílí se na růstu neuritů buněk PC12“. J. Biol. Chem. 274 (21): 15059–65. doi:10.1074 / jbc.274.21.15059. PMID 10329710.
- ^ Nykjaer A, Lee R, Teng KK, Jansen P, Madsen P, Nielsen MS, Jacobsen C, Kliemannel M, Schwarz E, Willnow TE, Hempstead BL, Petersen CM (únor 2004). „Sortilin je nezbytný pro smrt neuronových buněk indukovanou proNGF“. Příroda. 427 (6977): 843–8. doi:10.1038 / nature02319. PMID 14985763.
- ^ Lee R, Kermani P, Teng KK, Hempstead BL (listopad 2001). "Regulace přežití buněk vylučovanými proneurotrofiny". Věda. 294 (5548): 1945–8. doi:10.1126 / science.1065057. PMID 11729324.
- ^ Wiesmann C, Ultsch MH, Bass SH, de Vos AM (září 1999). "Krystalová struktura nervového růstového faktoru v komplexu s ligandovou vazebnou doménou receptoru TrkA". Příroda. 401 (6749): 184–8. doi:10.1038/43705. PMID 10490030.
- ^ Ohmichi M, Decker SJ, Pang L, Saltiel AR (srpen 1991). „Nervový růstový faktor se váže na proto-onkogenní produkt trk 140 kd a stimuluje jeho asociaci s homologní doménou src fosfolipázy C gamma 1“ (PDF). Biochem. Biophys. Res. Commun. 179 (1): 217–23. doi:10.1016 / 0006-291X (91) 91357-I. hdl:2027.42/29169. PMID 1715690.
- ^ A b C d Qian X, Riccio A, Zhang Y, Ginty DD (listopad 1998). "Identifikace a charakterizace nových substrátů Trk receptorů ve vývoji neuronů". Neuron. 21 (5): 1017–29. doi:10.1016 / S0896-6273 (00) 80620-0. PMID 9856458.
- ^ A b Nakamura T, Komiya M, Sone K, Hirose E, Gotoh N, Morii H, Ohta Y, Mori N (prosinec 2002). „Grit, protein aktivující GTPázu pro rodinu Rho, reguluje extenzi neuritů prostřednictvím asociace s receptorem TrkA a molekulami adaptéru N-Shc a CrkL / Crk“. Mol. Buňka. Biol. 22 (24): 8721–34. doi:10.1128 / MCB.22.24.8721-8734.2002. PMC 139861. PMID 12446789.
- ^ Wooten MW, Seibenhener ML, Mamidipudi V, Diaz-Meco MT, Barker PA, Moscat J (březen 2001). „Atypický protein p62 interagující s proteinkinázou C je strukturou aktivace NF-kappaB nervovým růstovým faktorem.“. J. Biol. Chem. 276 (11): 7709–12. doi:10.1074 / jbc.C000869200. PMID 11244088.
- ^ Geetha T, Wooten MW (únor 2003). "Sdružení atypického proteinu kinázy C-interagujícího proteinu p62 / ZIP s receptorem nervového růstového faktoru TrkA reguluje přenos receptorů a signalizaci Erk5". J. Biol. Chem. 278 (7): 4730–9. doi:10,1074 / jbc.M208468200. PMID 12471037.
- ^ Jadhav T, Geetha T, Jiang J, Wooten MW (červenec 2008). „Identifikace konsensuálního místa pro polyubikvitinaci TRAF6 / p62“. Biochem. Biophys. Res. Commun. 371 (3): 521–4. doi:10.1016 / j.bbrc.2008.04.138. PMC 2474794. PMID 18457658.
- ^ Wooten MW, Geetha T, Babu JR, Seibenhener ML, Peng J, Cox N, Diaz-Meco MT, Moscat J (březen 2008). „Zásadní role sekvestosomu 1 / p62 při regulaci akumulace Lys63-ubikvitinovaných proteinů“. J. Biol. Chem. 283 (11): 6783–9. doi:10,1074 / jbc.M709496200. PMID 18174161.
- ^ Borrello MG, Pelicci G, Arighi E, De Filippis L, Greco A, Bongarzone I, Rizzetti M, Pelicci PG, Pierotti MA (červen 1994). „Onkogenní verze tyrosinkináz Ret a Trk váží adaptorové proteiny Shc a Grb2“. Onkogen. 9 (6): 1661–8. PMID 8183561.
- ^ Jang SW, Liu X, Chan CB, Weinshenker D, Hall RA, Xiao G, Ye K (červen 2009). „Amitriptylin je agonista receptoru TrkA a TrkB, který podporuje heterodimerizaci TrkA / TrkB a má silnou neurotrofickou aktivitu.“. Chem. Biol. 16 (6): 644–656. doi:10.1016 / j.chembiol.2009.05.010. PMC 2844702. PMID 19549602.
- ^ Jang SW, Okada M, Sayeed I, Xiao G, Stein D, Jin P, Ye K (říjen 2007). „Gambogický amid, selektivní agonista pro receptor TrkA, který má silnou neurotrofickou aktivitu, zabraňuje smrti neuronových buněk“. Proc Natl Acad Sci U S A. 104 (41): 16329–16334. doi:10.1073 / pnas.0706662104. PMC 2042206. PMID 17911251.
- ^ Pulciani S, Santos E, Lauver AV, Long LK, Aaronson SA, Barbacid M (prosinec 1982). "Onkogeny v pevných lidských nádorech". Příroda. 300 (5892): 539–42. doi:10.1038 / 300539a0. PMID 7144906.
- ^ Doebele RC, Davis LE, Vaishnavi A, Le AT, Estrada-Bernal A, Keysar S, Jimeno A, Varella-Garcia M, Aisner DL, Li Y, Stephens PJ, Morosini D, Tuch BB, Fernandes M, Nanda N, nízká JA (říjen 2015). „Onkogenní fúze NTRK u pacienta se sarkomem měkkých tkání s odpovědí na inhibitor kinázy související s tropomyosinem LOXO-101“. Objev rakoviny. 5 (10): 1049–57. doi:10.1158 / 2159-8290.CD-15-0443. PMC 4635026. PMID 26216294.
- ^ „Slibné údaje z klinických hodnocení entrektinibu“. ScienceDaily. 18. dubna 2016.
externí odkazy
Další čtení
- Indo Y (2002). „Genetika vrozené necitlivosti na bolest s anhidrózou (CIPA) nebo dědičnou senzorickou a autonomní neuropatií typu IV. Klinické, biologické a molekulární aspekty mutací genu TRKA (NTRK1) kódujícího receptorovou tyrosinkinázu pro nervový růstový faktor“. Clin. Auton. Res. 12 (Suppl 1): I20–32. doi:10,1007 / s102860200016. PMID 12102460.
- Micera A, Lambiase A, Stampachiacchiere B, Bonini S, Bonini S, Levi-Schaffer F (2007). "Nervový růstový faktor a remodelace opravy tkání: trkA (NGFR) a p75 (NTR), dva receptory jeden osud". Cytokinový růstový faktor Rev. 18 (3–4): 245–56. doi:10.1016 / j.cytogfr.2007.04.004. PMID 17531524.