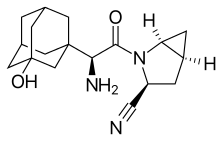
Saxagliptin - Saxagliptin
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Onglyza |
| Ostatní jména | BMS-477118 |
| AHFS /Drugs.com | Informace o drogách pro spotřebitele |
| MedlinePlus | a610003 |
| Licenční údaje |
|
| Trasy z správa | Pusou (tablety ) |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické data | |
| Biologická dostupnost | ~ 75% (T.max = 2 h) |
| Vazba na bílkoviny | zanedbatelný |
| Metabolismus | Jaterní (CYP3A4 a CYP3A5 ) |
| Odstranění poločas rozpadu | 2,5 h (saxagliptin), 3,1 h (hlavní metabolit) |
| Vylučování | 22% (Žluč ), 75% (Moč ) |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEMBL | |
| Řídicí panel CompTox (EPA) | |
| Chemické a fyzikální údaje | |
| Vzorec | C18H25N3Ó2 |
| Molární hmotnost | 315.417 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Saxagliptin, prodávané pod značkou Onglyza, je orální hypoglykemikum (antidiabetikum ) z inhibitor dipeptidyl peptidázy-4 (DPP-4) třída.[1][2] Počáteční vývoj byl pouze u Bristol-Myers Squibb; v roce 2007 AstraZeneca se spojil s Bristol-Myers Squibb, aby společně vyvinuli finální sloučeninu a spolupracovali na marketingu této drogy.
V dubnu 2016 americký FDA přidal varování před zvýšeným rizikem srdeční selhání.[3] Toto bylo založeno na datech v článku, který dospěl k závěru, že „inhibice DPP-4 se saxagliptinem nezvyšovala ani nesnižovala rychlost ischemických příhod, ačkoli byla zvýšena míra hospitalizace pro srdeční selhání. snížit kardiovaskulární riziko u pacientů s cukrovkou. “[4]
Lékařské použití
Saxagliptin se používá v monoterapii nebo v kombinaci s jinými léky k léčbě diabetu 2. typu. Nezdá se, že by snižovalo riziko infarkty nebo tahy.[4] Zvyšuje riziko hospitalizace pro srdeční selhání přibližně o 27%. Stejně jako ostatní inhibitory DPP-4 má relativně mírnou schopnost snižovat HbA1c, je spojen s relativně nízkým rizikem hypoglykémie a nezpůsobuje přírůstek hmotnosti.[4][5]
Saxagliptin zlepšil průměr HbA1c hladiny (ve srovnání s placebem) ve 24týdenní studii u lidí s diabetem 2. typu.[6] Kombinovaná léčba saxagliptinem a metforminem byla účinnější než monoterapie saxagliptinem nebo metforminem.[6] Když relativní výhody zvýšení dávky a sulfonylmočovina nebo přidání saxagliptinu bylo hodnoceno ve studii se 768 pacienty, ukázalo se, že kombinovaná léčba má významně větší dopad na hladinu glukózy v krvi nalačno, než samotné zvýšení testované dávky glibenklamidu.[7]
Nepříznivé účinky
V těch, kteří berou sulfonylmočoviny existuje zvýšené riziko nízká hladina cukru v krvi.[8]
3 nežádoucí účinky byly pozorovány vyšší u saxagliptinu oproti placebu. Tabulka 1: Nežádoucí účinky (bez ohledu na hodnocení kauzality zkoušejícím) v placebem kontrolovaných studiích * hlášeny u ≥ 5% pacientů léčených přípravkem ONGLYZA (tablety saxagliptinu) 5 mg a častěji než u pacientů léčených placebem.[9]
| ONGLYZA 5 mg N = 882 | Placebo N = 799 | |
|---|---|---|
| Infekce horních cest dýchacích | 68 (7.7) | 61 (7.6) |
| Infekce močových cest | 60 (6.8) | 49 (6.1) |
| Bolest hlavy | 57 (6.5) | 47 (5.9)[9] |
- 5 placebem kontrolovaných studií zahrnuje dvě studie monoterapie a jednu studii doplňkové kombinované léčby s každou z následujících: metforminem, thiazolidindionem nebo glyburidem. Tabulka ukazuje data za 24 týdnů bez ohledu na glykemickou záchranu.[9]
V únoru 2012 distribuovala společnost Bristol-Myers / Astra Zeneca další bezpečnostní informace o užívání saxagliptinu v Jižní Africe. Příbalový leták je třeba upravit pro Jižní Afriku. Kontraindikace nyní budou zahrnovat historii citlivosti na saxagliptin (nebo jiný inhibitor DPP4) i pankreatitidu. Spontánně hlášené nežádoucí účinky v Jižní Africe zahrnovaly anafylaxi, angioedém a akutní pankreatitidu.
Ve studii o kardiovaskulárních výsledcích léčba saxagliptinem umožnila malé zvýšení rizika hospitalizace pro srdeční selhání.[4] Saxagliptin může způsobit bolesti kloubů, které mohou být závažné a invalidizující.[10] Saxagliptin může zvyšovat riziko srdečního selhání.[11]
Snášenlivost
Monoterapie i kombinovaná léčba jinými látkami byly v klinických studiích obecně dobře tolerovány.[6]
Pankreatitida a rakovina pankreatu
Bylo navrženo spojení třídy inhibitorů DPP-IV s pankreatickými problémy, zejména na základě kazuistik spojených s inhibitorem DPP-IV sitagliptinem a několika mimetiky inkretinu včetně exenatid. Studie z roku 2013 týkající se inhibitoru DPP-4 sitagliptinu uvádí „znepokojující změny v pankreatu potkanů, které by mohly vést k rakovině pankreatu“.[12] Druhý dokument od stejných autorů uvádí nárůst prekancerózních lézí v pankreatu dárců orgánů, kteří užívali inhibitory GLP-1.[13] V reakci na tyto zprávy provedly americké FDA a Evropská agentura pro léčivé přípravky nezávislé kontroly všech klinických a předklinických údajů týkajících se možného spojení inhibitorů DPP-IV s rakovinou pankreatu. Ve společném dopise časopisu New England Journal of Medicines agentury uvedly, že „obě agentury souhlasí s tím, že tvrzení týkající se příčinné souvislosti mezi léky na bázi inkretinu a pankreatitidou nebo rakovinou pankreatu, jak jsou nedávno vyjádřena ve vědecké literatuře a v médiích, jsou v rozporu s aktuálními údaji. FDA a EMA v této době nedospěly ke konečnému závěru, pokud jde o takový kauzální vztah. Přestože souhrn údajů, které byly přezkoumány, poskytuje jistotu, pankreatitida bude i nadále považována za riziko spojené s těmito léky, dokud nebude k dispozici více údajů; obě agentury pokračují ve vyšetřování tohoto bezpečnostního signálu. “[14]
Byly podány žaloby, ve kterých žalobci, u kterých se vyvinula rakovina pankreatu, tvrdí, že inhibitory DPP-IV nebo inkretiny měly příčinnou roli ve vývoji jejich rakoviny.[15][16]
Výroba
Syntéza saxagliptinu Bristol-Myers Squibb amidovou kopulací N-Boc-3-hydroxyadamantylglycinu (2) a methanoprolinamid (3) s EDC. První je komerčně dostupný, zatímco druhý je dostupný jako N-Boc analog. Prolineamidová část se následně dehydratuje anhydrid kyseliny trifluoroctové čímž se získá kyanid ve formě trifluoracetátového esteru, který se hydrolyzuje. Odstranění Boc chránící skupina, následovaná neutralizací poskytne požadovaný produkt (1):[17]
Farmakologie
Saxagliptin je součástí třídy léků na diabetes nazývaných dipeptidyl peptidáza-4 Inhibitory (DPP-4). DPP-4 je enzym, který se štěpí inkretin hormony. Jako Inhibitor DPP-4 saxagliptin zpomaluje odbourávání inkretinových hormonů a zvyšuje hladinu těchto hormonů v těle. Je to právě toto zvýšení inkretinových hormonů, které je odpovědné za prospěšné účinky saxagliptinu, včetně zvýšení produkce inzulínu v reakci na jídlo a snížení rychlosti glukoneogeneze v játrech.[18]
Role dipeptidyl peptidázy-4 v glukóza v krvi regulace je považována za degradaci GIP[19] a degradace GLP-1.[19][20]
Vzhledem k tomu, že inkretinové hormony jsou aktivnější v reakci na vyšší hladinu cukru v krvi (a jsou méně aktivní v reakci na nízkou hladinu cukru v krvi), je riziko nebezpečně nízké hladiny cukru v krvi (hypoglykémie) nízké při monoterapii saxagliptinem.
Licencování
V červnu 2008 byla FDA předložena nová žádost o léčbu saxagliptinu v léčbě diabetu 2. typu. Byla založena na programu vývoje léčiv s 8 randomizovanými studiemi: 1 studie fáze 2 s dávkováním (2,5–100 mg / d) ; 6 kontrolovaných studií fáze 3, 24 týdnů s dalšími kontrolovanými kontrolami od 12 do 42 měsíců, dvojitě zaslepené; a jednu 12týdenní studii mechanismu účinku s dvouletým obdobím sledování.[21] FDA schválila saxagliptin se značkou Onglyza dne 31. července 2009.[22]Saxagliptin byl schválen pro použití v celé Evropské unii Evropskou agenturou pro léčivé přípravky 1. prosince 2009.[23]Společnost Bristol-Myers Squibb to dne 27. prosince 2006 oznámila Otsuka Pharmaceutical Co. bylo uděleno výhradní právo na vývoj a komercializaci sloučeniny v Japonsku. Podle licenční smlouvy bude Otsuka odpovědný za veškeré náklady na vývoj, ale Bristol-Myers Squibb si ponechává práva na společnou propagaci saxagliptinu s Otsuka v Japonsku.[24] Dále bylo dne 11. ledna 2007 oznámeno, že Bristol-Myers Squibb a AstraZeneca budou spolupracovat na dokončení vývoje léku a následném marketingu.[25]
Viz také
Reference
- ^ Augeri D; et al. (2005). „Objev a předklinický profil saxagliptinu (BMS-477118): vysoce účinný, dlouhodobě působící, orálně aktivní inhibitor dipeptidyl peptidázy IV pro léčbu cukrovky typu 2“. Journal of Medicinal Chemistry. 48 (15): 5025–5037. doi:10.1021 / jm050261p. PMID 16033281.
- ^ „Bristol, Takeda Drugs Offer Alternatives to Januvia (Update2)“. Bloomberg. 2008-06-07.
- ^ „Bezpečnostní upozornění na humánní léčivé přípravky - léky na cukrovku obsahující saxagliptin a alogliptin: sdělení o bezpečnosti léčiv - riziko srdečního selhání“. www.fda.gov. Citováno 7. dubna 2016.
- ^ A b C d Scirica, BM; Bhatt, DL; Braunwald, E; Steg, PG; Davidson, J; Hirshberg, B; Ohman, P; Frederich, R; Wiviott, SD; Hoffman, EB; Cavender, MA; Udell, JA; Desai, NR; Mosenzon, O; McGuire, DK; Ray, KK; Leiter, LA; Raz, I (3. října 2013). „Saxagliptin a kardiovaskulární výsledky u pacientů s diabetes mellitus 2. typu“ (PDF). The New England Journal of Medicine. 369 (14): 1317–1326. doi:10.1056 / nejmoa1307684. hdl:10044/1/40070. PMID 23992601.
- ^ Ali S; Fonseca V (leden 2013). „Přehled saxagliptinu: zvláštní zaměření na bezpečnost a nepříznivé účinky“. Expert Opin Drug Saf. 12 (1): 103–9. doi:10.1517/14740338.2013.741584. PMID 23137182.
- ^ A b C Dhillon, S; Weber, J. (2009). "Saxagliptin". Drogy. 69 (15): 2103–2114. doi:10.2165/11201170-000000000-00000. PMID 19791828.
- ^ „Nové léky: saxagliptin“. Australský předepisovatel (34): 89–91. Červen 2011.
- ^ Salvo, Francesco; Moore, Nicholas; Arnaud, Mickael; Robinson, Philip; Raschi, Emanuel; De Ponti, Fabrizio; Bégaud, Bernard; Pariente, Antoine (3. května 2016). „Přidání inhibitorů dipeptidyl peptidázy-4 k sulfonylmočovinám a riziko hypoglykémie: systematický přehled a metaanalýza“. BMJ. 353: i2231. doi:10.1136 / bmj.i2231. PMC 4854021. PMID 27142267.
- ^ A b C "Onglyza". RxList. Citováno 2012-01-31.
- ^ „Inhibitory DPP-4 pro cukrovku typu 2: komunikace o bezpečnosti léčiv - může způsobit silnou bolest kloubů“. US Food and Drug Administration (FDA). 2015-08-28. Citováno 1. září 2015.
- ^ „Sdělení FDA o bezpečnosti léčiv: FDA přidává varování o riziku srdečního selhání na štítky léků na diabetes typu 2 obsahujících saxagliptin a alogliptin“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA). 12. ledna 2017. Citováno 11. srpna 2020.
- ^ Matveyenko AV, Dry S, Cox HI a kol. (Červenec 2009). „Přínosné endokrinní, ale nepříznivé exokrinní účinky sitagliptinu v modelu transgenního krysího transgenního krysího typu lidského ostrůvku s diabetem typu 2: interakce s metforminem. Cukrovka. 58 (7): 1604–15. doi:10.2337 / db09-0058. PMC 2699878. PMID 19403868.
- ^ Butler AE, Campbell-Thompson M, Gurlo T, Dawson DW, Atkinson M, Butler PC (červenec 2013). „Značná expanze exokrinních a endokrinních pankreasů s inkretinovou terapií u lidí se zvýšenou dysplazií exokrinních pankreatů a potenciálem neuroendokrinních nádorů produkujících glukagon“. Cukrovka. 62 (7): 2595–604. doi:10 2337 / db12-1686. PMC 3712065. PMID 23524641.
- ^ Egan, Amy G .; Slepý, Eberhard; Dunder, Kristina; De Graeff, Pieter A .; Hummer, B. Timothy; Bourcier, Todd; Rosebraugh, Curtis (2014). „Pankreatická bezpečnost léčiv na bázi inkretinu - hodnocení FDA a EMA - NEJM“ (PDF). New England Journal of Medicine. 370 (9): 794–7. doi:10.1056 / NEJMp1314078. PMID 24571751.
- ^ „Poslední soudní spory o Januvii vycházející z rakoviny slinivky břišní Nápověda: Resource4thePeople hlásí, že případy jsou i nadále podávány ve federálních sporech s více obvody“. DG. DigitalJournal.com. 14. října 2013. Citováno 2013-10-14.
- ^ „RE RE: INCRETIN MIMETICS PRODUKTY ODPOVĚDNOSTI ZA ZODPOVĚDNOST“ (PDF). USJP. Soudní panel Spojených států pro multidistrické spory. 26. srpna 2013. Citováno 2013-08-26.
- ^ Scott AS, Gregory SJ, Sergei K, Shelly AR, Truc V, Robert EW (2009). „Příprava saxagliptinu, nového inhibitoru DPP-IV“. Org. Process Res. Dev. 13 (6): 1169–1176. doi:10.1021 / op900226j.
- ^ [1] Informace o cukrovce
- ^ A b Mentlein, R; Gallwitz, B; Schmidt, WE (15. června 1993). „Dipeptidyl-peptidáza IV hydrolyzuje žaludeční inhibiční polypeptid, glukagonový peptid-1 (7-36) amid, peptidový histidin methionin a je odpovědný za jejich degradaci v lidském séru“. European Journal of Biochemistry. 214 (3): 829–835. doi:10.1111 / j.1432-1033.1993.tb17986.x. PMID 8100523.
- ^ Ahrén, Bo; Landin-Olsson, Mona; Jansson, Per-Anders; Svensson, Maria; Holmes, David; Schweizer, Anja (květen 2004). „Inhibice dipeptidyl peptidázy-4 snižuje glykemii, udržuje hladinu inzulínu a snižuje hladinu glukagonu u diabetu 2. typu“. Journal of Clinical Endocrinology & Metabolism. 89 (5): 2078–2084. doi:10.1210 / jc.2003-031907. PMID 15126524. Citováno 2007-01-11.
- ^ Robert Frederich, MD; et al. (Květen 2010). „Systematické hodnocení kardiovaskulárních výsledků v programu vývoje léků na saxagliptin pro diabetes 2. typu“. Postgraduální medicína. 122 (3): 16–27. doi:10.3810 / pgm.2010.05.2138. PMID 20463410.
- ^ Telegram (2. srpna 2009). „FDA schvaluje lék na cukrovku od dvou místních výrobců“. Worcester Telegram & Gazette Corp. Citováno 2009-08-02.
- ^ Publikace EMA | www.ema.europa.eu/docs/en_GB/document.../WC500044316.pdf
- ^ „Bristol-Myers Squibb a Otsuka Pharmaceutical Co., Ltd. oznamují exkluzivní licenční smlouvu pro diabetickou sloučeninu saxagliptinu v Japonsku“ (Tisková zpráva). Bristol-Myers Squibb. 27. prosince 2006. Citováno 2006-12-27.
- ^ „Týmy AstraZeneca s Bristol-Myers na léčbě cukrovky“. Delaware News-Journal. Associated Press. 11. ledna 2007. Archivovány od originál dne 30. září 2007. Citováno 2007-01-11.
externí odkazy
- "Saxagliptin". Informační portál o drogách. Americká národní lékařská knihovna.
- Banting and Best Diabetes Center at UT dpp4

