Orbitální hybridizace - Orbital hybridisation - Wikipedia
v chemie, orbitální hybridizace (nebo hybridizace) je koncept míchání atomové orbitaly do nového hybridní orbitaly (s různými energiemi, tvary atd., než jsou složené atomové orbitaly) vhodné pro vznik párování elektronů chemické vazby v teorie valenčních vazeb. Například v atomu uhlíku, který tvoří čtyři jednoduché vazby, se orbitál valence-shell s kombinuje se třemi orbitály valence-shell p za vzniku čtyř ekvivalentních sp3 směsi, které jsou uspořádány do a čtyřboká uspořádání kolem uhlíku k vazbě na čtyři různé atomy. Hybridní orbitaly jsou užitečné při vysvětlení molekulární geometrie a atomové vazebné vlastnosti a jsou symetricky rozmístěny v prostoru. Hybridní orbitaly obvykle vznikají smícháním atomových orbitalů srovnatelných energií.[1]
Historie a použití
Chemik Linus Pauling poprvé vyvinul teorii hybridizace v roce 1931, aby vysvětlil strukturu jednoduchých molekuly jako metan (CH4) použitím atomové orbitaly.[2] Pauling poukázal na to, že atom uhlíku tvoří čtyři vazby pomocí jednoho s a tří p orbitalů, takže „lze odvodit“, že atom uhlíku vytvoří tři vazby v pravém úhlu (pomocí p orbitalů) a čtvrtou slabší vazbu pomocí orbitální v libovolném směru. Ve skutečnosti má metan čtyři C-H vazby stejné síly. Úhel mezi libovolnými dvěma vazbami je čtyřboký úhel vazby 109 ° 28 ' [3] (přibližně 109,5 °). Pauling předpokládal, že v přítomnosti čtyř atomů vodíku tvoří orbitaly s a p čtyři ekvivalentní kombinace, které nazval hybridní orbitaly. Každý hybrid je označen sp3 označuje jeho složení a je směrován podél jedné ze čtyř C-H vazeb.[4] Tento koncept byl vyvinut pro takové jednoduché chemické systémy, ale tento přístup byl později aplikován v širším měřítku a dnes je považován za efektivní heuristický pro racionalizaci struktur organické sloučeniny. Poskytuje jednoduchý orbitální obraz ekvivalentní formátu Lewisovy struktury.
Teorie hybridizace je nedílnou součástí organická chemie, jeden z nejpřesvědčivějších příkladů Baldwinova pravidla. Pro kreslení reakčních mechanismů je někdy nutný klasický vazebný obraz se dvěma atomy sdílejícími dva elektrony.[5] Teorie hybridizace vysvětluje vazbu v alkenech[6] a metan.[7] Množství p znaku nebo s znaku, o kterém rozhoduje hlavně orbitální hybridizace, lze použít ke spolehlivé předpovědi molekulárních vlastností, jako je kyselost nebo zásaditost.[8]
Přehled
Orbitály jsou modelovou reprezentací chování elektronů v molekulách. V případě jednoduché hybridizace je tato aproximace založena na atomové orbitaly, podobné těm, které byly získány pro atom vodíku, jediný neutrální atom, pro který Schrödingerova rovnice lze přesně vyřešit. V těžších atomech, jako je uhlík, dusík a kyslík, jsou použitými atomovými orbitaly orbitaly 2s a 2p, podobné orbitálům ve vodíku v excitovaném stavu.
Hybridní orbitaly se považují za směsi atomových orbitalů, které jsou navzájem superponovány v různých poměrech. Například v metan, hybridní orbitál C, který tvoří každý uhlík –vodík vazba se skládá z 25% s znaku a 75% p znaku a je tedy popsána jako sp3 (číst jako s-p-tři) hybridizováno. Kvantová mechanika popisuje tento hybrid jako sp3 vlnová funkce formy N (s + √3pσ), kde N je a normalizační konstanta (zde 1/2) a pσ je p orbitál směřující podél osy CH k vytvoření a sigma vazba. Poměr koeficientů (obecně označovaných λ) je √3 v tomto příkladu. Protože elektronová hustota spojený s orbitálem je úměrný druhé mocnině vlnové funkce, poměr p-znaku k s-znaku je λ2 = 3. Znak p nebo váha složky p je N2λ2 = 3/4.
Druhy hybridizace
sp3

Hybridizace popisuje vazbu atomů z hlediska atomu. Pro čtyřboká koordinovaný uhlík (např. metan CH4), uhlík by měl mít 4 orbitaly se správnou symetrií, aby se mohl vázat na 4 atomy vodíku.
Uhlík základní stav konfigurace je 1 s2 2 s2 2 s2 nebo snadněji čitelné:
| C | ↑↓ | ↑↓ | ↑ | ↑ | |
| 1 s | 2 s | 2 s | 2 s | 2 s |
Atom uhlíku může použít své dva samostatně obsazené orbitaly typu p k vytvoření dvou kovalentní vazby se dvěma atomy vodíku, čímž se získá singlet methylen CH2, nejjednodušší karben. Atom uhlíku se může také vázat na čtyři atomy vodíku excitací (nebo podporou) elektronu z dvojnásobně obsazeného orbitálu 2 s na prázdný orbitál 2 p, čímž vzniknou čtyři jednotlivě obsazené orbitaly.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | 2 s | 2 s | 2 s | 2 s |
Energie uvolněná tvorbou dvou dalších vazeb více než kompenzuje požadovanou excitační energii, což energeticky upřednostňuje tvorbu čtyř vazeb CH.
Kvantově mechanicky se získá nejnižší energie, pokud jsou čtyři vazby ekvivalentní, což vyžaduje, aby byly vytvořeny z ekvivalentních orbitalů na uhlíku. Lze získat sadu čtyř ekvivalentních orbitalů, které jsou lineárními kombinacemi valenčního pláště (jádrové orbitaly se téměř nikdy nepodílejí na vazbě) a vlnových funkcí,[9] což jsou čtyři sp3 hybridy.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | sp3 | sp3 | sp3 | sp3 |
V CH4, čtyři sp3 hybridní orbitaly jsou překryty vodík 1 s orbitaly, čímž se získá čtyři vazby σ (sigma) (tj. čtyři jednoduché kovalentní vazby) stejné délky a síly.
 překládá do
překládá do 
sp2


Další sloučeniny uhlíku a další molekuly lze vysvětlit podobným způsobem. Například, eten (C2H4) má dvojnou vazbu mezi uhlíky.
U této molekuly uhlík sp2 hybridizuje, protože jeden π (pi) vazba je vyžadován pro dvojná vazba mezi uhlíky a na atom uhlíku se tvoří pouze tři vazby σ. Ve sp2 hybridizace 2s orbital je smíchán pouze se dvěma ze tří dostupných 2p orbitalů, obvykle označovaných 2pX a 2py. Třetí 2p orbitální (2pz) zůstává nehybridizovaný.
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | sp2 | sp2 | sp2 | 2 s |
tvoří celkem tři sp2 orbitaly s jedním zbývajícím orbitálem. V ethylenu (eten ) dva atomy uhlíku tvoří vazbu σ překrytím jedné sp2 orbitální z každého atomu uhlíku. Vazba π mezi atomy uhlíku kolmo na molekulární rovinu je tvořena překrytím 2p – 2p. Každý atom uhlíku tvoří kovalentní vazby C – H se dvěma vodíky pomocí s – sp2 překrytí, vše s 120 ° spojovacími úhly. Vazby vodík-uhlík mají stejnou sílu a délku, v souladu s experimentálními údaji.
sp

Chemická vazba ve sloučeninách, jako jsou alkyny s trojné vazby se vysvětluje sp hybridizací. V tomto modelu je orbitál 2 s smíchán pouze s jedním ze tří p orbitalů,
| C* | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 s | sp | sp | 2 s | 2 s |
což má za následek dva orbitaly sp a dva zbývající p orbitaly. Chemická vazba v acetylén (ethyn) (C.2H2) sestává z překrytí sp – sp mezi dvěma atomy uhlíku tvořící vazbu σ a dvěma dalšími π vazby tvořený p – p překrytím. Každý uhlík se také váže na vodík v překrytí σ s – sp v úhlech 180 °.
Hybridizace a tvar molekuly

Hybridizace pomáhá vysvětlit tvar molekuly, protože úhly mezi vazbami jsou přibližně stejné jako úhly mezi hybridními orbitály. To je v rozporu s teorie odpuzování valenčních elektronových párů (VSEPR), které lze použít k předpovědi molekulární geometrie spíše na základě empirických pravidel než na základě valenčních vazeb nebo orbitálních teorií.[10]
spX hybridizace
Jako valenční orbitaly prvky hlavní skupiny jsou jeden s a tři p orbitaly s odpovídajícími oktetové pravidlo, spX hybridizace se používá k modelování tvaru těchto molekul.
| Koordinační číslo | Tvar | Hybridizace | Příklady |
|---|---|---|---|
| 2 | Lineární | sp hybridizace (180 °) | CO2 |
| 3 | Trigonální rovinná | sp2 hybridizace (120 °) | BCl3 |
| 4 | Čtyřboká | sp3 hybridizace (109,5 °) | CCl4 |
| Interorbitální úhly[11] | |||
spXdy hybridizace
Jako valenční orbitaly přechodné kovy jsou pět d, jedna sa tři p orbitaly s odpovídajícími 18-elektronové pravidlo, spXdy hybridizace se používá k modelování tvaru těchto molekul. Tyto molekuly mají tendenci mít více tvarů odpovídajících stejné hybridizaci kvůli různým zúčastněným d-orbitalům. Čtvercový rovinný komplex má jeden neobsazený p-orbitál, a proto má 16 valenčních elektronů.[12]
| Koordinační číslo | Tvar | Hybridizace | Příklady |
|---|---|---|---|
| 4 | Čtvercový rovinný | sp2d hybridizace | PtCl42− |
| 5 | Trigonální bipyramidální | sp3d hybridizace | Fe (CO)5 |
| Čtvercový pyramidální | MnCl52− | ||
| 6 | Osmistěn | sp3d2 hybridizace | Mo (CO)6 |
| 7 | Pětiboká bipyramidová | sp3d3 hybridizace | ZrF73− |
| Uzavřená oktaedrická | MF7− | ||
| Omezené trigonální hranolové | TaF72− | ||
| 8 | Čtvercový antiprismatický | sp3d4 hybridizace | Odkaz8− |
| Dodecahedral | Mo (CN)84− | ||
| Trvalý prizmatický prizmatik | ZrF84− | ||
| 9 | Trikovaný trigonální hranolový | sp3d5 hybridizace | ReH92− |
| Čtvercový antiprismatický |
sdX hybridizace
V některých přechodový kov komplexy s nízkou d počet elektronů, p-orbitaly jsou neobsazené a sdX hybridizace se používá k modelování tvaru těchto molekul.[11][13][12]
| Koordinační číslo | Tvar | Hybridizace | Příklady |
|---|---|---|---|
| 3 | Trigonální pyramidální | sd2 hybridizace (90 °) | CrO3 |
| 4 | Čtyřboká | sd3 hybridizace (70,5 °, 109,5 °) | TiCl4 |
| 5 | Čtvercový pyramidální | sd4 hybridizace (65,9 °, 114,1 °) | Ta (CH3)5 |
| 6 | C3v Trigonální hranolové | sd5 hybridizace (63,4 °, 116,6 °) | W (CH3)6 |
| Interorbitální úhly[11] | |||
Hybridizace hypervalentních molekul
Octet expanze
V některých učebnicích obecné chemie je hybridizace prezentována pro koordinaci hlavní skupiny číslo 5 a vyšší pomocí schématu „rozšířeného oktetu“ s d-orbitaly, které poprvé navrhl Pauling. Takové schéma je však nyní považováno za nesprávné ve světle výpočtů výpočetní chemie.
| Koordinační číslo | Tvar | Hybridizace | Příklady |
|---|---|---|---|
| 5 | Trigonální bipyramidální | sp3d hybridizace | PF5 |
| 6 | Osmistěn | sp3d2 hybridizace | SF6 |
| 7 | Pětiboká bipyramidová | sp3d3 hybridizace | LI7 |
V roce 1990 Eric Alfred Magnusson z University of New South Wales publikoval dokument definitivně vylučující roli d-orbitální hybridizace ve vazbě v hypervalentních sloučeninách druhé řady (období 3 ) prvky, končící bod sporu a zmatku. Část zmatku pochází ze skutečnosti, že d-funkce jsou nezbytné v základních sadách používaných k popisu těchto sloučenin (nebo jinak vznikají nepřiměřeně vysoké energie a zkreslené geometrie). Také příspěvek d-funkce k funkci molekulárních vln je velký. Tyto skutečnosti byly nesprávně interpretovány v tom smyslu, že d-orbitaly musí být zapojeny do lepení.[14][15]
Rezonance
Ve světle výpočetní chemie, lepší léčba by byla vyvolat sigma vazba rezonance kromě hybridizace, což znamená, že každá rezonanční struktura má své vlastní hybridizační schéma. Všechny rezonanční struktury se musí řídit oktetové pravidlo.[16]
| Koordinační číslo | Rezonanční struktury |
|---|---|
| 5 | Trigonální bipyramidální |
 | |
| 6 | Osmistěn |
 | |
| 7 | Pětiboká bipyramidová |
 |
Isovalentní hybridizace
I když mohou být užitečné hybridní orbitaly, ve skutečnosti většina vazeb vyžaduje orbitaly středního charakteru. To vyžaduje rozšíření, aby zahrnovalo flexibilní vážení atomových orbitalů každého typu (s, p, d) a umožňuje kvantitativní zobrazení tvorby vazby, když se molekulární geometrie odchyluje od ideálních úhlů vazby. Množství p-znaku není omezeno na celočíselné hodnoty; tj. hybridizace jako sp2.5 jsou také snadno popsány.
Hybridizace vazebných orbitalů je určena Bentovo pravidlo: "Atomový charakter se koncentruje na orbitálech zaměřených na elektropozitivní substituenty".
Molekuly s osamělými páry
Pro molekuly s osamělými páry jsou vazebné orbitaly isovalentní spX hybridy. Například dva hybridní orbitaly kyslíku ve vodě tvořící vazbu lze popsat jako sp4.0 dát interorbital úhel 104,5 °.[17] To znamená, že mají 20% s a 80% p charakter a mají ne znamenat, že hybridní orbitál je vytvořen z jednoho sa čtyř p orbitálů na kyslík, protože 2p subshell kyslíku obsahuje pouze tři p orbitaly. Tvary molekul s osamělými páry jsou:
- Trigonální pyramidální
- Tři isovalentní hybridní vazby (> 90 °)
- Např. NH3
- Ohnutý
- Dva isovalentní hybridní vazby (> 90 °)
- Např. SO2, H2Ó
V takových případech existují dva matematicky ekvivalentní způsoby reprezentace osamělých párů. Mohou být reprezentovány orbitaly symetrie sigma a pí podobné molekulové orbitální teorii nebo ekvivalentními orbitaly podobné teorii VSEPR.
Hypervalentní molekuly
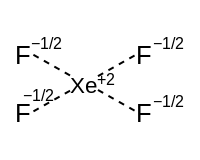
U hypervalentních molekul s osamělými páry lze schéma vazby rozdělit na hypervalentní složku a složku skládající se z isovalentní spX hybridní dluhopisy. Hypervalentní složka se skládá z rezonančních vazeb pomocí p orbitalů. Níže uvedená tabulka ukazuje, jak každý tvar souvisí se dvěma komponentami a jejich příslušné popisy.
| Počet isovalentních hybridů dluhopisů (označeno červeně) | ||||
|---|---|---|---|---|
| Dva | Jeden | – | ||
| Hypervalentní složka[16] | Lineární osa (jeden orbitální) | Houpačka | Ve tvaru písmene T. | Lineární |
 |  |  | ||
| Čtvercový rovinný rovník (dva p orbitaly) | Čtvercový pyramidální | Čtvercový rovinný | ||
 |  | |||
| Pětiúhelníkový rovník (dva p orbitaly) | Pětiúhelníkový pyramidový | Pětiúhelníkový rovinný | ||
 |  | |||
Hybridizační vady
Hybridizace orbitálů s a p za účelem vytvoření efektivní spX hybridy vyžadují, aby měly srovnatelný radiální rozsah. Zatímco 2p orbitaly jsou v průměru o méně než 10% větší než 2 s, částečně je to způsobeno nedostatkem radiálního uzlu na 2p orbitálech, 3p orbitaly, které mají jeden radiální uzel, přesahují 3s orbitaly o 20–33%.[18] Rozdíl v rozsahu orbitálů s a p se ve skupině dále zvyšuje. Hybridizaci atomů v chemických vazbách lze analyzovat zvážením lokalizovaných molekulárních orbitalů, například použitím přírodních lokalizovaných molekulárních orbitalů v přírodní vazba orbitální (NBO) schéma. v metan, CH4, vypočtený poměr p / s je přibližně 3 v souladu s „ideálním“ sp3 hybridizace, zatímco pro silan, SiH4, poměr p / s je blíže k 2. Podobný trend lze pozorovat iu ostatních 2p prvků. Substituce fluoru za vodík dále snižuje poměr p / s.[19] 2p prvky vykazují téměř ideální hybridizaci s ortogonálními hybridními orbitaly. U těžších prvků bloku p nelze tento předpoklad ortogonality odůvodnit. Tyto odchylky od ideální hybridizace byly označeny jako hybridizační defekty Kutzelnigg.[20]
Fotoelektronová spektra
Jedna mylná představa týkající se orbitální hybridizace je, že nesprávně předpovídá ultrafialová fotoelektronová spektra mnoha molekul. I když je to pravda, pokud Koopmanova věta se aplikuje na lokalizované hybridy, kvantová mechanika vyžaduje, aby (v tomto případě ionizovaná) vlnová funkce vyhovovala symetrii molekuly, což znamená rezonance v teorii valenčních vazeb. Například v metanu jsou ionizované stavy (CH4+) lze zkonstruovat ze čtyř rezonančních struktur, které přiřazují vysunutý elektron každé ze čtyř sp3 orbitaly. Lineární kombinace těchto čtyř struktur, zachování počtu struktur, vede k trojnásobnému degenerovanému T2 stát a A.1 Stát.[21][22] Rozdíl v energii mezi každým ionizovaným stavem a základním stavem by byl ionizační energie, která poskytuje dvě hodnoty v souladu s experimentem.
Lokalizované vs kanonické molekulární orbitaly
Vazebné orbitaly vytvořené z hybridních atomových orbitalů lze považovat za lokalizované molekulární orbitaly, které lze vytvořit z delokalizovaných orbitalů molekulární orbitální teorie vhodnou matematickou transformací. U molekul v základním stavu tato transformace orbitalů ponechává celkovou funkci mnoha elektronových vln beze změny. Hybridní orbitální popis základního stavu tedy je ekvivalent k delokalizovanému orbitálnímu popisu celkové energie základního stavu a hustoty elektronů, jakož i molekulární geometrie, která odpovídá minimální hodnotě celkové energie.
Dvě lokalizovaná reprezentace
Molekuly s více vazbami nebo více osamělými páry mohou mít orbitaly představované symetrií sigma a pí nebo ekvivalentní orbitaly. Různé metody valenční vazby používají jednu ze dvou reprezentací, které mají matematicky ekvivalentní celkový mnoho-elektron vlnové funkce a jsou příbuzní a unitární transformace sady obsazených molekulárních orbitalů.
U více vazeb je reprezentace sigma-pi převládající ve srovnání s ekvivalentní okružní (ohnuté pouto ) zastoupení. Naproti tomu pro více osamělých párů používá většina učebnic ekvivalentní orbitální zobrazení. Zastoupení sigma-pi se však také používá, například Weinhold a Landis v kontextu přírodní vazebné orbitaly, lokalizovaná orbitální teorie obsahující modernizované analogy klasických (valenční vazba / Lewisova struktura) vazebných párů a osamělých párů.[23] Například pro molekulu fluorovodíku jsou dva volné páry F v podstatě nehybridizované p orbitaly, zatímco druhý je spX hybridní orbitální. Obdobně platí pro vodu (jeden O osamělý pár je v čistém orbitálu, druhý v spX hybridní orbitální).
Viz také
- Teorie krystalového pole
- Isovalentní hybridizace
- Teorie ligandového pole
- Lineární kombinace atomových orbitalů
- MO diagramy
Reference
- ^ Housecroft, Catherine E .; Sharpe, Alan G. (2005). Anorganická chemie (2. vyd.). Pearson Prentice-Hal. str. 100. ISBN 0130-39913-2.
- ^ Pauling, L. (1931), "Povaha chemické vazby. Aplikace výsledků získaných z kvantové mechaniky a z teorie paramagnetické náchylnosti ke struktuře molekul", Journal of the American Chemical Society, 53 (4): 1367–1400, doi:10.1021 / ja01355a027
- ^ Brittin, W. E. (1945). "Valenční úhel čtyřboký atom uhlíku". J. Chem. Educ. 22 (3): 145. Bibcode:1945JChEd..22..145B. doi:10.1021 / ed022p145.
- ^ L. Pauling Povaha chemické vazby (3. vydání, Oxford University Press 1960) s. 111–120.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Bratře, Petere (2001). Organická chemie (1. vyd.). Oxford University Press. str. 105. ISBN 978-0-19-850346-0.
- ^ Organická chemie, Třetí vydání Marye Anne Fox James K. Whitesell 2003 ISBN 978-0-7637-3586-9
- ^ Organická chemie 3. vyd. 2001 Paula Yurkanis Bruice ISBN 978-0-130-17858-9
- ^ „Kyseliny a zásady“. Orgo je jednoduché. Citováno 23. června 2015.
- ^ McMurray, J. (1995). Vydání Chemistry Annotated Instructors Edition (4. vydání). Prentice Hall. str. 272. ISBN 978-0-131-40221-8
- ^ Gillespie, R.J. (2004), „Výuka molekulární geometrie pomocí modelu VSEPR“, Journal of Chemical Education, 81 (3): 298–304, Bibcode:2004JChEd..81..298G, doi:10.1021 / ed081p298
- ^ A b C Weinhold, Frank; Landis, Clark R. (2005). Valence a vazba: Perspektiva přirozeného vazebného orbitálního dárce-akceptoru. Cambridge: Cambridge University Press. s. 367, 374–376, 381–383. ISBN 978-0-521-83128-4.
- ^ A b Bayse, Craig; Hall, Michael (1999). „Predikce geometrií komplexů kovových polyhydridů s přechodem pomocí analýzy symetrie“. J. Am. Chem. Soc. 121 (6): 1348–1358. doi:10.1021 / ja981965 +.
- ^ Kaupp, Martin (2001). ""Non-VSEPR "Struktury a lepení v systémech d (0)". Angew Chem Int Ed Engl. 40 (1): 3534–3565. doi:10.1002 / 1521-3773 (20011001) 40:19 <3534 :: AID-ANIE3534> 3.0.CO; 2- #. PMID 11592184.
- ^ Magnusson, E. (1990). „Hyperkoordinační molekuly prvků druhé řady: funkce d nebo d orbitaly?“. J. Am. Chem. Soc. 112 (22): 7940–7951. doi:10.1021 / ja00178a014.
- ^ David L. Cooper; Terry P. Cunningham; Joseph Gerratt; Peter B. Karadakov; Mario Raimondi (1994). „Chemické vazby na hyperkoordinované atomy druhé řady: d Orbitální účast versus demokracie“. Journal of the American Chemical Society. 116 (10): 4414–4426. doi:10.1021 / ja00089a033.
- ^ A b Richard D. Harcourt; Thomas M. Klapötke (2003). „Zvýšené valenční (kvalitativní valenční vazby) popisy elektronických struktur molekul obsahujících fluór bohatých na elektrony“. Journal of Fluorine Chemistry. 123 (1): 5–20. doi:10.1016 / S0022-1139 (03) 00012-5.
- ^ Frenking, Gernot; Shaik, Sason, eds. (2014). „Kapitola 3: Pohled NBO na chemické vazby“. Chemická vazba: Základní aspekty chemických vazeb. John Wiley & Sons. ISBN 978-3-527-66471-9.
- ^ Kaupp, Martin (2007). "Role radiálních uzlů atomových orbitalů pro chemickou vazbu a periodická tabulka". Journal of Computational Chemistry. 28 (1): 320–325. doi:10.1002 / jcc.20522. ISSN 0192-8651. PMID 17143872. S2CID 12677737.
- ^ Kaupp, Martin (2014) [1. Hospoda. 2014]. „Kapitola 1: Chemická vazba prvků hlavní skupiny“. Frenking, Gernod & Shaik, Sason (eds.). Chemická vazba: Chemická vazba napříč periodickou tabulkou. Wiley-VCH. ISBN 978-1-234-56789-7.
- ^ Kutzelnigg, W. (srpen 1988). "Ortogonální a neortogonální hybridy". Journal of Molecular Structure: THEOCHEM. 169: 403–419. doi:10.1016/0166-1280(88)80273-2.
- ^ Andrei M. Tokmachev; Andrei L. Tchougreeff; Igor A. Misurkin (2001). "Ionizační potenciály v semiempirickém antisymetrizovaném produktu striktně lokalizovaného geminálního přístupu". International Journal of Quantum Chemistry. 85 (3): 109–117. doi:10,1002 / qua.1060.
- ^ Sason S. Shaik; Phillipe C. Hiberty (2008). Průvodce chemiků po teorii Valence Bond. New Jersey: Wiley-Interscience. str. 104–106. ISBN 978-0-470-03735-5.
- ^ Weinhold, Frank; Landis, Clark R. (2012). Objevování chemie pomocí orbitálů s přírodními vazbami. Hoboken, N.J .: Wiley. str. 67–68. ISBN 978-1-118-11996-9.


